Журнал неорганической химии, 2022, T. 67, № 7, стр. 908-915
Синтез и исследование фаз со структурой типа голландита, кристаллизующихся в системах Cs2O–M2O3(MO)–TiO2 (M = Al, Fe, Сu, Ni, Mg)
О. Ю. Синельщикова a, *, Н. В. Беспрозванных a, Д. А. Рогова a, С. К. Кучаева a, О. Л. Галанкина a, b
a Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
b Институт геологии и геохронологии докембрия РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
* E-mail: sinelshikova@mail.ru
Поступила в редакцию 28.10.2021
После доработки 06.12.2021
Принята к публикации 13.12.2021
- EDN: SGAYHB
- DOI: 10.31857/S0044457X22060228
Аннотация
Известно, что керамика на основе голландитов в основном производится традиционным твердофазным методом. Однако использование различных золь-гель методов в некоторых случаях позволяет изменить температурно-временные параметры ее синтеза, морфологические характеристики, пористость, а также электрофизические свойства. В настоящей работе керамические материалы на основе ряда цезий-титанатных голландитовых фаз синтезированы сжиганием цитратно-нитратных композиций. Структура полученных материалов изучена с помощью рентгенофазового анализа и сканирующей электронной микроскопии. При изучении электрофизических свойств обнаружено, что в потоке водорода электропроводность голландитов с алюминием и никелем значительно (на 2.5–3 порядка) увеличивается во всем исследованном диапазоне температур. Таким образом, керамику на основе этих голландитов можно рассматривать как перспективную для создания сенсоров водорода и топливных элементов.
ВВЕДЕНИЕ
Как показали проведенные ранее исследования, в богатой титаном области систем Cs2O–(MO)M2O3–TiO2 (M = Al, Fe, Cu, Ni, Mg) возможно образование тройных соединений, кристаллизующихся в структурных типах голландита и лепидокрокита, а также двойных слоистых титанатов с общей формулой Cs2TinO2n+ 1 (n = 2, 5, 6) [1–9]. Благодаря широкому спектру свойств наиболее интересными объектами для исследования в указанных системах являются соединения со структурой голландита. Эти сложные оксиды имеют общую формулу ${\text{M}}_{x}^{k}{\text{A}}_{{{{(4n--kh)} \mathord{\left/ {\vphantom {{(4n--kh)} z}} \right. \kern-0em} z}}}^{z}{{{\text{O}}}_{{2n}}},$ где Mk – вакансия, одно- и двухвалентные элементы; Аz – различные комбинации поливалентных элементов с суммарной степенью окисления 3.75–4. Родоначальник ряда – голландит – имеет химический состав ${\text{BaM}}{{{\text{n}}}^{{{\text{II}}}}}{\text{Mn}}_{{\text{7}}}^{{{\text{IV}}}}{{{\text{O}}}_{{{\text{16}}}}}{\text{,}}$ поэтому большинство авторов записывают химические формулы соединений, кристаллизующихся в данном структурном типе, таким образом, чтобы n = 8 [2].
Сложные титансодержащие оксиды типа голландита могут быть использованы как ионные проводники, катализаторы, матрицы для захоронения радиоактивных отходов [3, 5, 10–15]. Поэтому их исследование носит как научный, так и практический интерес.
Основным методом получения сложных оксидов типа голландита в цезий-титанатных системах является классический метод твердофазных реакций между терморазлагаемыми карбонатами или нитратами и оксидами металлов [1–3, 5, 13, 15, 16]. Он осуществляется методом холодного прессования и спекания [1–3, 5, 13], горячего прессования [17], а также плавлением механически измельченной смеси на воздухе или в вакууме [14]. Однако перечисленные методы требуют высоких температур (~1300°C, во время плавления – 1450–1550°С) и длительной изотермической выдержки (15–92 ч), что может приводить к потере цезия благодаря его высокой летучести. Помимо этого, метод горячего прессования (направленного или изостатического) требует сложного технологического сопровождения. Указанных недостатков частично удается избежать при использовании метода соосаждения исходных смесей, в том числе с дошихтовкой соединениями цезия. Проведенное в [18, 19] изучение процессов формирования голландитов Ba2 –x/2CsxFe2Ti6O16 и Ba0.7Cs0.6Al2Ti6O16 при использовании такого подхода подтвердило формирование голландитовых фаз непосредственно из исходных компонентов без образования промежуточных соединений при более низких температурах, чем при использовании механического измельчения и смешения компонентов.
Помимо снижения температурно-временных параметров получения плотной керамики для голландитовых фаз актуален подбор методик формирования пористых газопроницаемых материалов для использования в качестве электродов топливных элементов, катализаторов и газовых сенсоров [20]. В связи с этим вызывает интерес исследование процесса синтеза данных сложных оксидов с использованием подходов, альтернативных классическому твердофазному спеканию.
Одним из активно исследуемых в настоящее время методов получения материалов на основе простых и сложных оксидов является синтез в реакциях горения органо-солевых композиций. Его главные преимущества: снижение температурно-временных режимов, простое аппаратурное исполнение и использование недорогих доступных реактивов [21–28]. При правильном подборе параметров окислительно-восстановительный процесс сопровождается значительным локальным нагревом, который позволяет получать порошки на основе высокотемпературных соединений [26–33], а кратковременность данного процесса часто способствует ограничению роста кристаллов продуктов реакции, что существенно влияет на их физико-химические свойства [34–40].
В настоящей работе представлены результаты исследования фаз со структурой голландита, кристаллизующихся в системах Cs2O–(MO)M2O3–TiO2 (M = Al, Fe, Cr, Cu, Ni, Mg), с применением цитратно-нитратного метода, а также изучения их электрофизических свойств в атмосфере воздуха и аргон-водородной смеси (5% H2).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реактивов для синтеза голландитовых фаз использовали особо чистые TiCl4, HNO3, C6H8O7 · H2O, Al(NO3)3 · 9H2O, MgO, а также Cs2CO3, Fe(NO3)3 · 10H2O, Ni3(OH)4CO3 · · 4H2O, CuO марки “ч. д. а.”.
Предварительно получали раствор цитрата никеля реакцией основного карбоната никеля с лимонной кислотой. Из остальных солей и оксидов металлов готовили водные растворы нитратов. Для этого проводили реакцию Сs2CO3, MgO и CuO с разбавленной HNO3, а состав, содержащий TiO(NO3)2, синтезировали аналогично методике, изложенной в [38]. Указанные растворы смешивали, соблюдая желаемую стехиометрию. Необходимое количество лимонной кислоты, рассчитанное исходя из количества нитратов, входящих в состав композиции, составляло Cs2(M,Ti)8O16 : 4.3–5.0 C6H8O7. Таким образом, условное соотношение восстановителя и окислителя (φ) было равно ~0.8–0.9, т.е. все рассмотренные составы соответствовали режиму объемного горения [31, 38].
После смешения всех компонентов сильно разбавленным водным раствором аммиака доводили pH раствора до 6.5, что приводило к образованию золя, который в процессе выпаривания при 80°С превращался в ксерогель.
Термическую обработку проводили в фарфоровых тиглях. Исходные смеси сжигали при 650°С с последующей выдержкой при этой температуре в течение 2 ч, после чего прессовали в таблетки и подвергали дополнительному обжигу при температуре 1050°С от 6 до 27 ч. Набор времени выдержки при данной температуре осуществляли постепенно, интервалами от 4 до 6 ч, длительность для каждого состава была подобрана экспериментально.
На всех стадиях термообработки проводили рентгенофазовый анализ (РФА) (дифрактометр ДРОН-3М, CuKα-излучение). На основании рентгенограмм образцов после конечного обжига, снятых с использованием внутреннего стандарта – Ge, с помощью программ Unicell и PDWin были рассчитаны параметры элементарной ячейки полученных голландитовых фаз.
Для уточнения конечного химического состава и подтверждения однофазности синтезированных керамических материалов проводили анализ шлифованных образцов с помощью сканирующего электронного микроскопа JSM-6510LA с энергодисперсионным спектрометром JED-2200 (JEOL, Япония). Изображения были получены в режиме отраженных (композиционный контраст BEC) электронов. Элементный состав определяли на электронно-зондовом микроанализаторе (EPMA) Jeol JXA-8230, оснащенном тремя спектрометрами с дисперсией по длине волны. Рабочие условия: 20 кВ, ток зонда 20 нА, сфокусированный пучок. Для всех элементов были измерены линии Kα1. В расчетах применяли программу коррекции ZAF. Анализ химического состава проводили без использования стандартов.
Для изучения электрофизических характеристик синтезированных образцов использовали цилиндрические таблетки высотой 2–3 мм и диаметром 9.5–10 мм. Перед измерением электропроводности на торцевые грани образцов наносили Pt-содержащую проводниковую пасту (ООО “Элма-пасты”). После ее вжигания (850°С, 1 ч) определяли электропроводность каждого образца на воздухе и в аргон-водородной смеси (5 об. % Н2) на переменном токе частотой 1 кГц; напряжение, подаваемое на контакты измерительной ячейки, составляло 0.12 В (LCR-метр Fluke 6063). Для образцов, проявивших наибольшую разницу проводимости на воздухе и в присутствии водорода, дополнительно с помощью импедансметра Z-2000 (Elins) проводили опыты по исследованию динамических откликов в реальном времени при циклах ввода/вывода аргон-водородной смеси при температурах 700 и 800°С, а также при 550°С для CNTO (температуры были выбраны исходя из данных температурной зависимости и границ измерения используемого прибора: Z ≤ 100 кОм). Измерительную ячейку с образцом термостатировали на воздухе при выбранной температуре в течение 20 мин, после чего в автоматическом режиме каждые 30 с фиксировали годограф импеданса в диапазоне частот от 3 Гц до 2 МГц, амплитуда переменного сигнала составляла 0.127 В, при этом в печь поочередно подавали воздух и смесь 95% Ar/5% H2. Графики, отражающие реакцию на смену атмосферы, нормировали на размер образца и строили в зависимости от времени исходя из аппроксимации полученных кривых до пересечения с осью действительных значений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для каждого полученного состава в табл. 1 указана исходная стехиометрия и время выдержки при 1050°С, после которого фазовый состав образцов оставался неизменным. Там же приведены условные обозначения образцов, используемые далее в статье.
Таблица 1.
Состав синтезированных образцов
| Условное обозначение | Номинальный состав по шихте | Выдержка при 1050°С, ч | Состав по МРСА |
|---|---|---|---|
| CCTO | Сs2CuTi7O16 | 6 | Сs1.72Cu0.72Ti7.21O16 + примесь CuO |
| CMTO | Сs2MgTi7O16 | 6 | Сs1.78Mg0.61Ti7.25O16 |
| CNTO | Сs2Ni0.8Ti7.1O16 | 8 | Сs1.72Ni0.78Ti7.17O16 + примесь TiO2 |
| СFTO | Сs2Fe1.75Ti6.8175O16 | 27 | Сs1.75Fe1.47Ti6.53O16 + примесь Fe2TiO5 |
| САТО | Сs2Al2Ti6O16 | 15 | Сs1.65Al1.17Ti6.71O16 + примесь TiO2 |
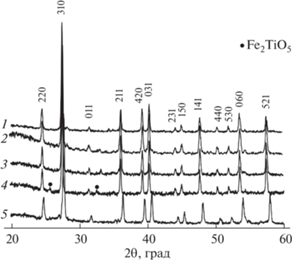
По данным РФА, основной фазой во всех синтезированных керамических материалах являются соединения со структурой типа голландита (рис. 1).
Электронные микрофотографии, полученные на шлифах синтезированных образцов, с использованием МРСА отдельных точек и участков (рис. 2), также указывают на преобладание в образцах голландитовых фаз. Однофазным, по результатам сканирующей электронной микроскопии (СЭМ), является CMTO. Составы, содержащие никель и алюминий, имеют небольшую примесь оксида титана (отдельные зерна, меньше порога обнаружения согласно РФА). В образце CCTO остаются небольшие непрореагировавшие включения CuO, присутствуют также более светло-серые, чем основная фаза, области, это связано с перераспределением концентрации цезия на две голландитовые фазы, различающиеся по составу на ~5 мас. % (в таблице указан усредненный химический состав).
Рис. 2.
Микрофотографии синтезированных образцов: CCTO (а), CMTO (б), CNTO (в), СFTO (г), САТО (д). На рисунке отмечены примесные фазы.
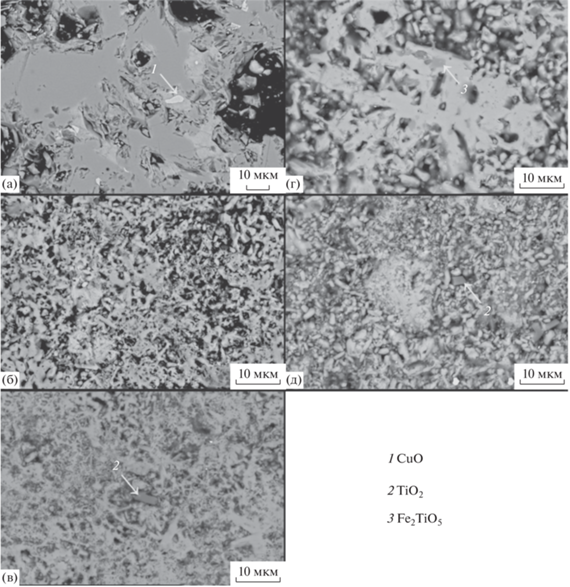
Согласно данным СЭМ, в железосодержащей керамике (СFTO) присутствует титанат железа – Fe2TiO5. Во всех случаях содержание цезия меньше номинального по шихте (табл. 1), что может быть связано как с преимущественным формированием упорядоченных голландитов, сопровождающимся его испарением при обжиге, так и с завышением количества титана при синтезе (за счет относительно высокой ошибки определения его концентрации в растворе).
Анализ микрофотографий показал, что все полученные образцы могут быть отнесены к керамическим материалам с высокой пористостью. Наиболее плотно-спеченным является образец ССТО, его пористость составляет ~18%. У CMTO и CATO этот показатель равен ~25%, а у СNTO и CFTO он составляет ~28%.
Рассчитанные для полученных голландитов параметры элементарной ячейки (табл. 2) находятся в хорошем соответствии с изменением среднего эффективного радиуса ионов, занимающих октаэдрические позиции в кристаллической решетке.
Таблица 2.
Параметры элементарной ячейки и фактор толерантности голландитовых фаз
| Образец | Параметры элементарной ячейки голландитовой фазы, тетрагональная сингония, пр. гр. I4/m |
Ri(M) [40] | Ri(M,Ti)* | $t_{i}^{*}$ [41] |
||
|---|---|---|---|---|---|---|
| a = b, Å | c, Å | V, Å3 | КЧ = 6 | |||
| CCTO | 10.2815(10) | 2.9622(7) | 313.12(7) | 0.73 | 0.612 | 1.05 |
| CMTO | 10.2628(13) | 2.9687(9) | 312.68(10) | 0.72 | 0.614 | 1.07 |
| CNTO | 10.2690(11) | 2.9634(8) | 312.50(8) | 0.69 | 0.609 | 1.05 |
| СFTO | 10.2631(6) | 2.9699(4) | 312.82(5) | 0.78 | 0.633 | 1.05 |
| САТО | 10.1757(12) | 2.9364(8) | 304.05(8) | 0.53 | 0.589 | 1.03 |
Фактор толерантности (ti), позволяющий на основании геометрических соотношений между атомами в кристаллической ячейке оценить стабильность соединений типа голландита, рассчитан с учетом химического состава, который был определен по данным микрозондового анализа и степени заполнения туннельных позиций атомами цезия. Значения ti находятся в диапазоне от 1.03 до 1.07, что соотносится с границами соединений данного типа, относительно легко синтезируемых без применения высокого давления и восстановительной атмосферы [42].
Температурные зависимости электропроводности представлены на рис. 3. Наибольшая проводимость на воздухе наблюдается для образца СCTO, тогда как для остальных составов эти значения на 2–3 порядка меньше. Такое повышение электропроводности при включении меди в состав голландита отмечается исследователями и в ряду твердых растворов K1.6(Mg1 –yCuy)0.8Ti7.2O16 [43]. Как показали авторы проведенных с помощью модифицированного метода поляризации Вагнера исследований, оно обусловлено не только уменьшением пористости керамики и увеличением размера зерен, но и ростом электронной составляющей проводимости. В ССТО, вероятно, причины те же.
Рис. 3.
Температурные зависимости электропроводности синтезированных образцов: (а) 1 – CCTO; 2 – CMTO; 3 – CFTO, для сравнения двойными линиями приведена электропроводность голландитов: 4 – Cs1.33Ga2.66Ti5.34O16 [43], 5 – Cs1.36Mg0.76Ti7.28O16 [13]; (б) 1 – CATO; 2 – CNTO. Графики, соответствующие измерению на воздухе, – сплошные, в присутствии Н2 – пунктирные.
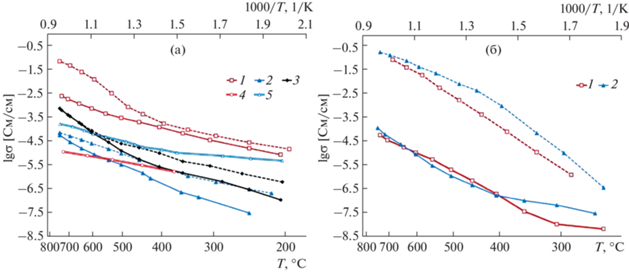
Полученные данные для других образцов достаточно хорошо согласуются с результатами исследований электрофизических свойств керамики на основе цезиевых голландитовых фаз (рис. 3а, график 4, 5). Более высокая энергия активации электропроводности у большинства полученных составов (табл. 3) по сравнению с цезий-галлиевыми (0.78 эВ) [44] и цезий-магниевыми твердыми растворами [13], синтезированными традиционным керамическим методом, связана, вероятно, с различиями в составе, а также со значительным влиянием высокой пористости и сопротивления границ зерен.
Таблица 3.
Энергия активации электропроводности синтезированных образцов
| Образец | CCTO | CMTO | CNTO | CFTO | CATO | |
|---|---|---|---|---|---|---|
| Ea, эВ, t ≥ 550°С | на воздухе | 0.70 | 0.86 | 1.40 | 1.24 | 0.93 |
| в присутствии Н2 | 1.10 | 0.60 | 0.83 | 1.10 | 1.17 | |
Электропроводность в присутствии водорода для всех представленных составов возрастает, поэтому все синтезированные образцы, согласно результатам проведенного исследования, можно отнести к хеморезистивным материалам, различная чувствительность которых в значительной степени зависит от площади удельной поверхности, концентрации поверхностных активных центров на ней для поглощения газа и способности к переносу электронов [45]. Наиболее интересными среди рассмотренных материалов являются голландитовые керамические материалы, содержащие никель и алюминий (рис. 3б). Значения электропроводности для CNTO и САТО в исследуемых атмосферах различаются примерно на 2.5–3 порядка. Для этих двух образцов дополнительно были выполнены динамические опыты по изучению стабильности и скорости отклика в режиме смены атмосферы (рис. 4) при различной температуре. Их чувствительность (соотношение сопротивления в различных атмосферах) составила ~650–700 при рассмотренных температурах. При этом оба образца характеризуются малым временем отклика (1.5–2 мин) на водород и достаточно быстро (за 4.5–5 мин) окисляются до первоначального состояния с подачей к ячейке воздуха при температурах выше 550°С. Никелевый голландит, в отличие от содержащего алюминий, при температурах 600 и 700°С проявляет существенное изменение электропроводности в условиях восстановительной атмосферы, которое отражается на росте проводимости в зависимости от времени воздействия (рис. 4а).
Рис. 4.
Результаты изучения электропроводности образцов CNTO (а) и САТО (б) при цикличной смене атмосферы воздух–95% Ar/5% H2–воздух. Температура: 550 (1), 700 (2) и 800°С (3).
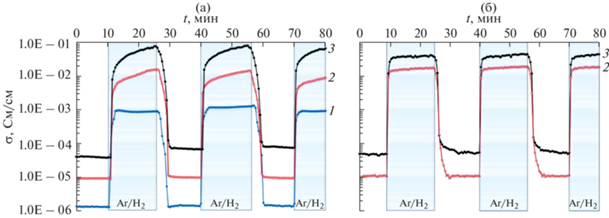
Также при 700°С для этого состава заметен гистерезис значений проводимости на воздухе между первоначально синтезированным образцом и образцом, подвергшимся восстановлению в течение 15 мин, поэтому данный состав имеет меньшую температуру стабильности, чем САТО, для которого гистерезис при данной температуре не наблюдается. Гистерезис характерен в циклах нагрева и охлаждения в присутствии водорода только при температуре выше 600°C, при более низких значениях для всех рассмотренных составов он не обнаружен.
Несмотря на то, что для ряда калиевых голландитов преимущественно ионный характер проводимости был доказан проведением дополнительных исследований, например с помощью метода Гитторфа [13], для соединений, содержащих цезий, такие работы не проводились. В общем случае для титанатов щелочных металлов характерно наличие не только ионного переноса заряда с участием щелочных катионов, но и некоторая доля электронной составляющей, обусловленной изоморфным замещением и дефектами упаковки на границах зерен материала [13, 43, 45]. На основании этого можно предположить наличие ионно-электронного типа переноса заряда в полученных фазах, однако достоверное определение различного типа электропроводности требует дополнительных исследований и запланировано нами в дальнейшем.
ЗАКЛЮЧЕНИЕ
В ходе работы впервые цитратно-нитратным методом были синтезированы керамические образцы на основе голландитовых фаз следующих составов: Сs1.72Cu0.72Ti7.21O16 (ССТО), Сs1.78Mg0.61Ti7.25O16 (СМТО), Сs1.72Ni0.78Ti7.17O16 (CNTO), Сs1.75Fe1.47Ti6.53O16 (CFTO), Сs1.65Al1.17Ti6.71O16 (CATO). По результатам СЭМ и РФА, однофазные либо близкие к однофазным (содержащие небольшие включения зерен оксида титана или меди) образцы получены во всех случаях, кроме состава, содержащего железо. Полученная керамика является высокопористой. Для синтезированных образцов изучена электропроводность в среде воздуха и аргон-водородной смеси в интервале температур 200–800°С. Образец ССТО имеет лучшую проводимость на воздухе, а СNTO и CATO проявляют высокую чувствительность к присутствию водорода. Проводимость на воздухе и в смеси 95% Ar/5% H2 отличается для них примерно на 2.5–3 порядка, что делает их интересными объектами для дальнейшего изучения в качестве сенсорных материалов и электродов водородных топливных элементов.
Список литературы
Knyazev A.V., Mączka M., Ladenkov I.V. et al. // J. Solid State Chem. 2012. V. 196. P. 110. https://doi.org/10.1016/j.jssc.2012.05.043
Князев А.В., Черноруков Н.Г., Ладенков И.В. и др. // Журн. неорган. химии. 2011. Т. 56. № 11. С. 1785. [Knyazev A.V., Chernorukov N.G., Ladenkov I.V. et al. Russ. J. Inorg. Chem. 2011. V. 56. № 11. P. 1702.] https://doi.org/10.1134/S0036023611110131
Furusawa S., Suemoto T., Ishigame M. // Phys. Rev. B. 1988. V. 38. № 17. P. 12600. https://doi.org/10.1103/PhysRevB.38.12600
Grey I.E., Madsen I.C., Watts J.A. et al. // J. Solid State Chem. 1985. V. 58. № 3. P. 350. https://doi.org/10.1016/0022-4596(85)90217-8
Zhao M., Russell P., Amoroso J. et al. // J. Mater. Sci. 2020. V. 55. P. 6401. https://doi.org/10.1007/s10853-020-04447-3
Pilarski M., Marschall R., Gross S. et al. // Appl. Catal. B. 2018. V. 227. P. 349. https://doi.org/10.1016/j.apcatb.2018.01.039
Gatehouse B.M. // Acta Crystallogr., Sect. C. 1989. V. 45. P. 1674. https://doi.org/10.1107/S010827018900418X
Ohashi M. // Solid State Ionics. 2004. V. 172. № 1–4. P. 31. https://doi.org/10.1016/j.ssi.2004.01.035
Kudo A., Kondo T. // J. Mater. Chem. 1997. V. 7. P. 777. https://doi.org/10.1039/A606297K
Горшков Н.В., Михайлова Д.А., Викулова М.А. и др. // Журн. неорган. химии. 2021. Т. 66. № 8. С. 1009. [Gorshkov N.V., Mikhailova D.A., Vikulova M.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1121.] https://doi.org/10.1134/S0036023621080076
Gorshkov N., Vikulova M., Gorbunov M. et al. // Ceram. Int. 2021. V. 47. № 4. P. 5721. https://doi.org/10.1016/j.ceramint.2020.10.158
Беспрозванных Н.В., Синельщикова О.Ю., Морозов Н.А. и др. // Журн. прикл. химии. 2020. Т. 93. № 8. С. 1098. [Besprozvannykh N.V., Sinel’shchikova O.Yu., Morozov N.A. et al. // Russ. J. Appl. Chem. 2020. V. 93. № 8. P. 1132.] https://doi.org/10.1134/S1070427220080042
Петров С.А., Григорьева Л.Ф., Сазеев И.Ю. и др. // Неорган. материалы. 1994. Т. 30. № 7. С. 963.
Tumurugoti P., Clark B.M., Edwards D.J. et al. // J. Solid State Chem. 2017. V. 246. P. 107. https://doi.org/10.1016/j.jssc.2016.11.007
Leinekugel-le-Cocq A.Y., Deniard P., Jobic S. et al. // J. Solid State Chem. 2006. V. 179. № 10. P. 3196. https://doi.org/10.1016/j.jssc.2006.05.047
Grote R., Zhao M., Shuller-Nickles L. et al. // J. Mater. Sci. 2019. V. 54. P. 1112. https://doi.org/10.1007/s10853-018-2904-1
Ringwood A.E., Kesson S.E., Ware N.G. et al. // Geochem. J. 1979. V. 13. № 4. P. 141.
Shabalin B., Titov Y., Zlobenko B. et al. // Mineralogical J. (Ukraine). 2013. V. 35. № 4. P. 12.
Григорьева Л.Ф., Петров С.А., Синельщикова О.Ю. и др. // Физика и химия стекла. 2007. Т. 33. № 6. С. 842. [Grigor’eva L.F., Petrov S.A., Sinel’shchikova O.Yu. et al. // Glass Phys. Chem. 2007. V. 33. № 6. P. 613.] https://doi.org/10.1134/S1087659607060132
Cao C., Singh K., Hay Kan W. et al. // Inorg. Chem. 2019. V. 58. № 8. P. 4782. https://doi.org/10.1021/acs.inorgchem.8b03152
Mastoroudes B.C., Markgraaff J., Wagener J.B. et al. // Chem. Phys. 2020. V. 537. P. 110816. https://doi.org/10.1016/j.chemphys.2020.110816
Muthuraman M., Arul Dhas N., Patil K.C. // Bull. Mater. Sci. 1994. V. 17. № 6. P. 977. https://doi.org/10.1007/BF02757574
Беспрозванных Н.В., Синельщикова О.Ю., Кучаева С.К. и др. // Журн. прикл. химии. 2015. Т. 88. № 2. С. 169. [Besprozvannykh N.V., Sinel’shchikova O.Y., Kuchaeva S.K. et al. // Russ. J. Appl. Chem. 2015. V. 88. № 2. P. 192.] https://doi.org/10.1134/S1070427215020020
Морозов Н.А., Синельщикова О.Ю., Беспрозванных Н.В. и др. // Физика и химия стекла. 2021. Т. 47. № 5. С. 561. [Morozov N.A., Sinelshchikova O.Yu., Besprozvannykh N.V. et al. // Glass Phys. Chem. 2021. V. 47. № 5. P. 481. https://doi.org/10.1134/S1087659621050114]
Ломанова Н.А., Томкович М.В., Соколов В.В. и др. // Журн. общ. химии. 2016. Т. 86. № 10. С. 1605. [Lomanova N.A., Tomkovich M.V., Sokolov V.V. et al. // Russ. J. Gen. Chem. 2016. V. 86. № 10. P. 2256.] https://doi.org/10.1134/S1070363216100030
Комлев А.А., Гусаров В.В. // Неорган. материалы. 2014. Т. 50. № 12. С. 1346. [Komlev A.A., Gusarov V.V. // Inorg. Mater. 2014. Т. 50. № 12. P. 1247.] https://doi.org/10.1134/S0020168514120103
Попков В.И., Альмяшева О.В., Шмидт М.П. и др. // Журн. неорган. химии. 2015. Т. 60. № 10. С. 1308. [Popkov V.I., Izotova S.G., Almjasheva O.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 10. P. 1193.] https://doi.org/10.1134/S0036023615100162
Popkov V.I., Almjasheva O.V., Nevedomskiy V.N. et al. // Nanosystems: Phys. Chem. Math. 2015. V. 6. № 6. P. 866. https://doi.org/10.17586/2220-8054-2015-6-6-866-874
Gilabert J., Palacios M.D., Sanz V., Mestre S. // Boletín de la Sociedad Española de Cerámica y Vidrio. 2017. V. 56. № 5. P. 215. https://doi.org/10.1016/j.bsecv.2017.03.003
Deshpande K., Mukasyan A., Varma A. // J. Am. Ceram. Soc. 2003. V. 86. № 7. P. 1149. https://doi.org/10.1111/j.1151-2916.2003.tb03439.x
Mukasyan A.S., Costello C., Sherlock K.P. et al. // Sep. Purif. Technol. 2001. V. 25. P. 117. https://doi.org/10.1016/S1383-5866(01)00096-X
Ostroushko A.A., Russkikh O.V. // Nanosystems: Phys. Chem. Math. 2017. V. 8. № 4. P. 476. https://doi.org/10.17586/2220-8054-2017-8-4-476-502
Khaliullin Sh.M., Zhuravlev V.D., Bamburov V.G. // I Int. J. Self-Propag. High-Temp Synth. 2017. V. 26. № 2. P. 93. https://doi.org/10.3103/S1061386217020078
Phuruangrat A., Kuntalue B., Thongtem S., Thongtem T. // Russ. J. Inorg. Chem. 2021. V. 66. P. 332. https://doi.org/10.1134/S0036023621030128
Ketsko V.A., Smirnova M.N., Kop’eva M.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1287. https://doi.org/10.1134/S0036023620090065
Khaliullin Sh.M., Koshkina A.A. // Ceram. Int. 2021. V. 47. № 9. P. 11942. https://doi.org/10.1016/j.ceramint.2021.01.035
Ершов Д.С., Беспрозванных Н.В., Синельщикова О.Ю. // Физика и химия стекла. 2020. Т. 46. № 4. С. 416. [Ershov D.S., Besprozvannykh N.V., Sinel’shchikova O.Yu. // Glass Phys. Chem. 2020. V. 46. № 4. P. 329.] https://doi.org/10.1134/S1087659620040057
Морозов Н.А., Синельщикова О.Ю., Беспрозванных Н.В., Масленникова Т.П. // Журн. неорган. химии. 2020. Т. 65. № 8. С. 1019. [Morozov N.A., Sinelshchikova O.Yu., Besprozvannykh N.V., Maslennikova T.P. // Russ. J. Inorg. Chem. 2020. V. 65. № 8. P. 1127.] https://doi.org/10.1134/S0036023620080124
Ломанова Н.А., Томкович М.В., Осипов А.В. и др. // Физика твердого тела. 2019. Т. 61. № 12. P. 2503. [Lomanova N.A., Tomkovich M.V., Osipov A.V. et al. // Phys. Solid State. 2019. V. 61. P. 2535.] https://doi.org/10.1134/S1063783419120278
Lomanova N.A., Tomkovich M.V., Sokolov V.V. et al. // J. Nanopart. Res. 2018. V. 20. P. 17. https://doi.org/10.1007/s11051-018-4125-6
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. A32. P. 751. https://doi.org/10.1107/S0567739476001551
Kesson E.S., White T.Y. // J. Solid State Chem. 1986. V. 63. P. 122. https://doi.org/10.1016/0022-4596(86)90160-X
Yoon K.H., Han S., Kang D.H., Kim T.H. // J. Mater. Sci. 1998. V. 33. P. 417. https://doi.org/10.1023/A:1004380015500
Xu Y., Wen Y., Grote R. et al. // Sci. Rep. 2016. V. 6. P. 27412. https://doi.org/10.1038/srep27412
Galstyan V. // Sensors. 2017. V. 17. № 12. P. 2947. https://doi.org/10.3390/s17122947
Gorshkov N.V., Goffman V.G., Vikulova M.A. et al. // J. Electroceram. 2018. V. 40. P. 306. https://doi.org/10.1007/s10832-018-0131-4
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии