Журнал неорганической химии, 2022, T. 67, № 6, стр. 717-726
Особенности синтеза оксида меди(II) в реакциях горения с глицином и лимонной кислотой
В. Д. Журавлев a, *, Л. В. Ермакова a, Ш. М. Халиуллин a, В. Г. Бамбуров a, Т. А. Патрушева a, Н. М. Поротникова a
a Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: zhvd@ihim.uran.ru
Поступила в редакцию 08.09.2021
После доработки 15.10.2021
Принята к публикации 24.10.2021
- EDN: CIORZP
- DOI: 10.31857/S0044457X22060265
Аннотация
Рассмотрено влияние соотношения лимонной кислоты (φ = 0.5–1.3) и глицина (φ = 0.5; 0.7–0.9) на скорость реакций горения, фазовый состав и размерность порошка CuOx, получаемого из раствора нитрата меди, в условиях открытого и “закрытого” реакторов. Моделирование реакций горения при синтезе CuOx показало, что расчеты Tmax по уравнению, выведенному для синтеза в реакциях горения, возможны и для реакций термолиза или пиролиза. Методами рентгеновской дифракции и электронной микроскопии изучены формирование, морфология и дисперсность образцов после окончания реакции горения и термообработки при 500°C. Характеристики профилей горения демонстрируют переход от режима объемного горения к самораспространяющемуся высокотемпературному синтезу и далее к термолизу ксерогелей при увеличении содержания лимонной кислоты. Установлено, что замедление скорости окислительно-восстановительных реакций не снижает потери CuO за счет уноса меди в составе органических летучих компонентов.
ВВЕДЕНИЕ
Керамика на основе оксида меди(II) относится к материалам с гигантской диэлектрической проницаемостью и хорошей термической стабильностью [1, 2]. Кроме того, CuO – потенциальный материал для фотоники, газовых катализаторов, биосенсоров, суперпроводников и суперконденсаторов [3–6]. Для получения нано- и тонкодисперсных порошков CuO используют различные методы. Так, авторы [7] использовали низкотемпературный гидротермальный метод для синтеза наноструктурного оксида меди из ацетата меди с 2-пиперидилметанолом. Синтез выполнен в автоклаве при температурах 100–200°С. В работе [1] CuO получали полимеризацией нитрата меди с акриловой кислотой с последующим прокаливанием при 500°С в течение 6 ч на воздухе. В работе [8] синтез вели в реакции горения из раствора нитрата меди и глицина (мочевины) в условиях стехиометрического содержания топлива и окислителя. Растворы упаривали и переносили в муфельную печь, нагретую до 450°С, выдерживали в ней в течение 1.5 ч и получали чистый моноклинный оксид меди. Синтез CuO, Cu и CuNi в реакциях горения нитрата меди и карбогидразида при отношении топливо/окислитель от 0.5 до 2.0 описан в работе [9]. Сжигание раствора проводили в печи, нагретой до 350°С.
Реакции горения из растворов (Solution Combustion Synthesis (SCS)) [10–21] активно используют в качестве быстрого и с минимальной экологической нагрузкой метода получения простых и сложных оксидов, композитов на их основе, подложек для катализаторов. Однако большинство авторов, как правило, делают акцент на свойствах получаемых материалов, не изучая возможности метода. Обычно синтез ведут в малых, можно сказать в микроколичествах (менее 2–3 г), а финальную часть окислительно-восстановительного процесса – горение получаемого ксерогеля – проводят в закрытых муфельных печах [8, 9]. Это может быть оправдано при синтезе оксидов с участием активных восстановителей, например, из растворов нитрата меди с глицином, когда реакция протекает достаточно бурно с выносом прекурсора из реактора [22]. Отличительной особенностью топлива, имеющего в своем составе аминогруппы, является разложение или деструкция с выделением аммиака (NH3) при нагревании. При одновременном выделении диоксида азота (NO2) от распада нитратных групп образуется гипергольная смесь двух газов, которая самовоспламеняется и горит очень бурно, вовлекая в реакцию остальную часть ксерогеля [23]. Увеличение массы получаемого оксида при постоянной открытой площади реактора также приводит к увеличению температуры горения [24] и, как следствие, к возрастанию скорости выхода отходящих газов и выносу материала. Для снятия ограничений по интенсивности реакции и массе получаемого материала можно использовать его избыток по сравнению со стехиометрическим отношением топливо/окислитель [25, 26] или менее энергичный восстановитель в топливо, например, карбоновые кислоты [20, 27, 28]. Также в реакционном растворе заменяют часть активного восстановителя на менее активный, имеющий более длинную цепочку углеродных атомов [29].
В настоящей работе исследовано влияние состава двойного топлива, состоящего из глицина и лимонной кислоты, на фазовый состав прекурсоров при синтезе оксида меди(II), размерность и морфологию порошков оксидов меди. Измерены температуры реакций горения и рассчитаны теоретические температуры горения с учетом фазового состава полученных прекурсоров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали нитрат меди (ч. д. а.), глицин (х. ч.) и лимонную кислоту 1-водную (ч.) Для проведения эксперимента в 150 мл раствора нитрата меди, содержащего 135.78 г/л Cu(NO3)2, вносили навески глицина и лимонной кислоты в расчете на синтез 8.64 г CuO и в соответствии с выбранными значениями φ, после чего исходный раствор приобретал рН 2.
Синтез вели в открытом цилиндрическом алюминиевом реакторе объемом 2 л с площадью открытой поверхности 346 см2. Количество глицина и лимонной кислоты для условий стехиометрии (φ = 1) рассчитывали по уравнениям:
(1)
$\begin{gathered} {\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{\text{ + 1}}{\text{.11N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH }} \to \\ \to \,\,{\text{ CuO + 1}}{\text{.555}}{{{\text{N}}}_{{\text{2}}}} + {\text{2}}{\text{.7775}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 2}}{\text{.22C}}{{{\text{O}}}_{{\text{2}}}}{\text{.}} \\ \end{gathered} $(2)
$\begin{gathered} {\text{Cu(N}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}} + {\text{0}}{\text{.555}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{7}}}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to \,\,{\text{CuO}} + {{{\text{N}}}_{{\text{2}}}} + {\text{2}}{\text{.775}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{3}}{\text{.33C}}{{{\text{O}}}_{{\text{2}}}}{\text{.}} \\ \end{gathered} $В первой серии экспериментов (открытый реактор) количество глицина составляло 50, 70, 80 и 90% от стехиометрического значения (φгл = 0.5, 0.7, 0.8, 0.9). В каждом опыте с определенным содержанием глицина количество лимонной кислоты изменялось от φлим = 0.5 до φлим = 1.3.
Вторую серию опытов (φгл = 0.5, 0.7 и φлим = = 0.5, 0.7, 0.9, 1.1, 1.3) выполняли в “закрытом” реакторе, т.е. в реакторе, закрытом сверху алюминиевой крышкой с отверстием посередине для помещения термопар и выхода газообразных продуктов реакции. Раствор упаривали на электрическом нагревателе мощностью 1 кВт до формирования ксерогеля и инициации реакции горения.
РФА образцов выполняли на дифрактометре Shimadzu XRD-7000 (CuKα-излучение, 2θ = 25°–65°). Обработку данных и анализ фазового состава образцов проводили с помощью картотеки PDF4 (ICDD, USA, Release 2009) и программы Powder Cell for Windows 2.4, описание профилей отражений – с использованием функции псевдо-Войта. Доля фаз приведена в мас. %.
Структурно-морфологические характеристики исследовали на сканирующем электронном микроскопе Jeol JSM 6390 LA с приставкой JED 2300. Удельную поверхность порошков оксида меди(II) определяли методом Брунауэра–Эммета–Теллера (БЭТ) на установке Micromeritics Gemini VII Surface Area and Porosity по тепловой десорбции азота. Для определения дисперсности (размеров) частиц методом лазерного рассеяния использовали лазерный измеритель частиц Horiba LA-950V2.
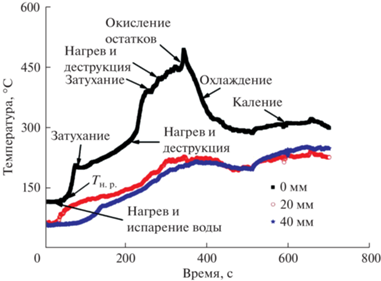
Измерение температур горения выполняли с помощью трех термопар типа ТПП, помещенных в реактор на высоте +0, 20 и 40 мм от его дна [30]. Все термопары расположены на одной линии, нижняя термопара – вдоль оси реактора, две другие – параллельно ей и на расстоянии 20 мм в разные стороны от осевой линии. Регистрацию температур осуществляли с помощью видеографического регистратора Ш932.9А-015/1 (НПФ “Сенсорика”, Екатеринбург) с периодом 0.3 с.
Расчеты максимальных температур горения выполнены с помощью программы SCSTempCal (http://www.ihim.uran.ru/razr/newmath/razr_88.html) [24].
Количество и массовую долю углерода и углеродсодержащих остатков в полученном продукте определяли из данных количественного РФА соединений меди в прекурсоре и потерь при прокаливании выше 500°С (когда прекурсор переходит в CuO, углеродсодержащие компоненты окисляются и улетают).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследования показали, что максимальная интенсивность в реакциях горения наблюдается при стехиометрическом соотношении топливо/окислитель (φ = 1.0) [10]. Как следствие, отклонение значений φ от стехиометрических и использование менее энергичного восстановителя, например лимонной кислоты, приводит к снижению интенсивности реакции горения. Наши контрольные эксперименты с лимонной кислотой и нитратом меди в условиях стехиометрии показали, что процесс протекает без выброса порошка за пределы реактора, но сопровождается невысоким открытым пламенем, и в отходящих газах видна примесь желто-коричневого цвета, свидетельствующая о наличии диоксида азота. Образец после синтеза содержит смесь фаз CuO : Cu2O ≈ ≈ 2.6 : 1, а также примесь меди (табл. 1). Синтез с глицином без выброса прекурсора возможен лишь при φ = 0.5 [22], полученный образец содержит CuO в качестве доминантной фазы с заметным количеством примеси Cu2O (табл. 1).
Таблица 1.
Фазовый состав образцов после синтеза с глицином или лимонной кислотой
| φ | Фазы, мас. % | ||
|---|---|---|---|
| Cu | Cu2O | CuO | |
| φлим = 1 | 1.6 | 27.6 | 70.8 |
| φгл = 0.5 | – | 9.4 | 90.6 |
Использование двойного восстановителя в указанных в табл. 2 количествах позволяет провести процесс получения материалов без выбросов и без образования диоксида азота. Однако в экспериментах после начала реакции появлялось зеленое пламя умеренной интенсивности. Цвет пламени явно связан с присутствием в нем катионов меди. Процесс завершался формированием массы черного или желто-коричневого цвета (в зависимости от относительного содержания Cu и/или Cu2O) в виде крупных “каракулевых” завитков. Учитывая идентификацию нескольких оксидов меди в составе прекурсора, в дальнейшем его формульное написание условно примем как CuOx. После охлаждения материал для разрушения крупных агрегатов частиц и получения нормального распределения по размерам проходил помол мелющими телами из диоксида циркония при нагрузке 5 : 1 и скорости вращения 500–600 об/мин в нестандартной мельнице типа “пьяная бочка”, у которой ось вращения пересекает ось цилиндра под определенным углом.
Таблица 2.
Содержание* Cu, Cu2O и CuO в прекурсорах после синтеза с лимонной кислотой и глицином в открытом реакторе
| φлим | Фазы, мас. % | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| φгл = 0.5 | φгл = 0.7 | φгл = 0.8 | φгл = 0.9 | |||||||||
| Cu | Cu2O | CuO | Cu | Cu2O | CuO | Cu | Cu2O | CuO | Cu | Cu2O | CuO | |
| 0.8 | 42.6 | 46.1 | 11.3 | 6.7 | 46.5 | 46.8 | 2.7 | 38.0 | 59.2 | 56.7 | 43.3 | 0 |
| 0.9 | 17.9 | 47.1 | 35.0 | 2.8 | 35.7 | 61.4 | 2.8 | 23.8 | 73.4 | 25.4 | 59.3 | 15.3 |
| 1.1 | 6.9 | 42.4 | 50.8 | 1.3 | 12.6 | 86.1 | 3.6 | 14.8 | 81.7 | 9.0 | 38.5 | 52.4 |
| 1.3 | 2.5 | 34.9 | 62.6 | 8.9 | 16.3 | 74.9 | 4.0 | 22.2 | 73.8 | 5.2 | 17.0 | 77.8 |
Изменение фазового состава образцов, полученных в открытом реакторе, в зависимости от соотношения глицина и лимонной кислоты в исходных растворах представлено в табл. 2 и на рис. 1а–1в, рис. S1 . Наблюдается тенденция увеличения массовой доли CuO с ростом содержания лимонной кислоты и глицина, т.е. с увеличением Σ(φгл + φлим). Хотя все эксперименты выполнены в восстановительном режиме реакций горения, фаза Cu в заметном количестве присутствует лишь в двух образцах: при φгл = 0.5 с φлим = 0.8 и φгл = 0.9 с φлим = 0.8 (табл. 2). В остальных образцах ее доля постепенно снижается (рис. 1а, 1г) или остается в пределах 2.7–8.9 мас. % (рис. 1б, 1в). Содержание Cu2O с увеличением доли лимонной кислоты также уменьшается, но Cu2O присутствует в прекурсорах в существенно больших, чем медь, количествах (от 17.0 до 47.1 мас. %). Наблюдаемые экстремумы на графиках (рис. 1б, 1в) связаны, скорее всего, с нестабильностью реакций горения и взаимодействием продуктов горения, чем с определенным взаимодействием топлива и нитрата меди в реакционном ксерогеле.
Рис. 1.
Зависимости изменения массовой доли фаз Cu, Cu2O и CuO в прекурсорах от содержания лимонной кислоты (φлим) в образцах при синтезе в открытом (φгл = 0.5 (а), 0.7 (б), 0.9 (в) и “закрытом” (φгл = 0.5 (г)) реакторах.
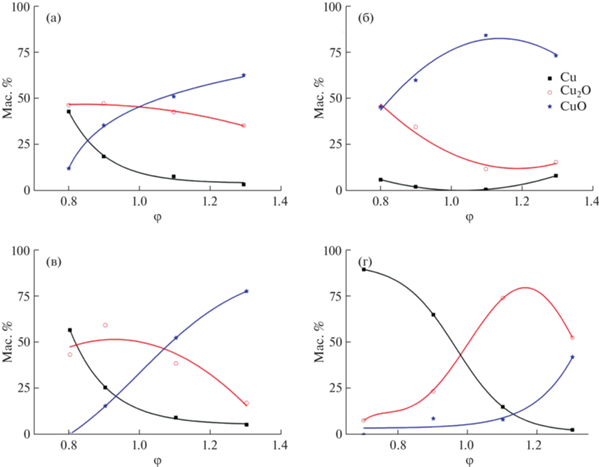
При проведении синтеза в “закрытом” реакторе в диапазоне 0.7 ≤ φлим < 1 в фазовом составе доминирует медь (рис. 1б, 1г, табл. 3). Дальнейшее увеличение φлим приводит к возрастанию массовых долей Cu2O и CuO. Этот эффект является несколько неожиданным, поскольку реакция горения протекает в восстановительной области в закрытом реакторе. С возрастанием φлим и, соответственно, суммарного φ недостаток кислорода также увеличивается, что должно приводить к снижению массовых долей Cu2O и CuO.
Таблица 3.
Фазовый состав образцов CuOx, синтезированных в “закрытом” реакторе
| φгл | φлим | Фазы, мас. % | |||
|---|---|---|---|---|---|
| Cu* | Cu2O* | CuO* | “С” | ||
| 0.5 | 0.5 | 31.2 | 61.4 | 7.4 | 4.6 |
| 0.5 | 0.7 | 91.6 | 8.1 | 0.3 | 0.3 |
| 0.5 | 0.9 | 66.6 | 24.2 | 9.2 | 0.0 |
| 0.5 | 1.1 | 15.6 | 75.8 | 8.6 | 3.9 |
| 0.5 | 1.3 | 2.9 | 53.9 | 43.2 | 2.8 |
| 0.7 | 0.9 | 1.8 | 35.4 | 62.9 | 4.6 |
Согласно литературным данным [23], первоначально в ходе реакции горения формируется CuO. Под воздействием восстановительной среды, образовавшейся в реакторе, происходит восстановление оксидов меди вплоть до металла [23]. В работах [31, 32] представлен механизм восстановления NiO до никеля водородом, который образуется при разложении глицина под действием каталитических свойств никеля и его оксида при добавлении аммиака. Причем фаза чистого металла образуется преимущественно в восстановительной области. И чем больше отклонение от стехиометрии, тем выше доля металлической фазы. Однако в наших экспериментах в закрытом реакторе не прослеживается однозначная корреляция между φгл + φлим и массовыми долями Cu и CuOx, что не позволяет достоверно объяснить в соответствии с приведенными в литературе механизмами особенности фазообразования в образцах, полученных авторами в реакциях горения из нитратных растворов меди с глицином и лимонной кислотой.
Для определения “порогового” содержания лимонной кислоты в качестве добавки к глицину, позволяющей снизить скорость реакции, были измерены профили горения при φгл = 0.5, но с изменяющимся содержанием лимонной кислоты: φлим = 0.5, 0.7, 0.9, 1.1, 1.3 (рис. 2). Измерения проводили в “закрытом” реакторе, в крышке которого располагалось отверстие диаметром 4.5 см для помещения термопар и отвода исходящих газов.
Рис. 2.
Температурные профили получения CuO при φгл = 0.5 и φлим = 0.5 (1), 0.7 (2), 0.9 (3), 1.1 (4), 1.3 (5).
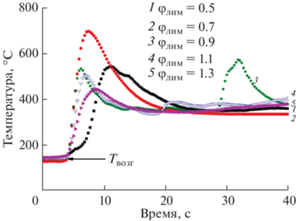
Профили 1 и 2 относятся к режиму объемного горения [25, 33], при котором фиксируется высокое пламя, достигающее отверстия в крышке реактора. Начиная с температурного профиля 3 (суммарное φ ≥ 1.4) реакция протекает по типу самораспространяющегося высокотемпературного синтеза (СВС), температурные профили 3 и 4 искривляются и становятся многопиковыми. Для данного режима синтеза разложение ксерогеля происходит в виде распространяющейся волны и сопровождается пламенем небольшой интенсивности. Направление движения носит вероятностный характер, что и приводит к разнообразию видов температурных профилей. Температурный профиль 5, соответствующий суммарному φ = 1.8, иллюстрирует изменение температуры в реакторе при движении беспламенной волны горения (незначительное искрение по фронту волны). Температурные и временные характеристики процессов горения в закрытом реакторе приведены в табл. 4.
Таблица 4.
Характеристики реакций горения (“закрытый” реактор)
| φгл | φлим | Твозг, °C | Тmax(изм.), °C | Тmax(расч.), °C | Время горения (tгор), c |
|---|---|---|---|---|---|
| 0.5 | 0.5 | 151 | 545 | 563 | 7.2 |
| 0.5 | 0.7 | 135 | 699 | 694 | 3.7 |
| 0.5 | 0.9 | 143 | 574 | 537 | 2.4 |
| 0.5 | 1.1 | 148 | 505 | 539 | 3.0 |
| 0.5 | 1.3 | 153 | 445 | 429 | 4.8 |
| 0.7 | 0.9 | 140 | 495 | 483 | ~280 |
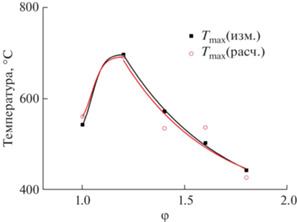
Время горения tгор (от момента возгорания до момента достижения Тmax) не превышает 7.2 с и, видимо, связано с горением глицин-нитратных комплексов, поджигающих цитрат-нитратные комплексы, реакции которых идут по типу СВС и с дальнейшим увеличением φлим. Усредненная температура возгорания в экспериментах с двойным топливом для опытов с φгл = 0.5 равна 146°C, а максимальная температура горения, пройдя через максимум (699°C) для суммарного φ = 1.2, плавно снижается (рис. 3) с увеличением доли лимонной кислоты в составе топлива. Особенностью, явно вызванной использованием двух типов комплексонов-восстановителей, является максимум температуры горения не для стехиометрического соотношения (Σφ = 1), а для смещенного к составу с Σφ = 1.2. Вероятно, это следствие побочных процессов окисления-восстановления при взаимодействии образующегося прекурсора с непрореагировавшей частью ксерогеля и влиянием разной природы теплопереноса между образующимися в прекурсоре фазами (табл. 4).
Рис. 3.
Зависимости изменения максимальных температур горения Tmax(изм.) и Tmax(расч.) от суммарного значения φ в закрытом реакторе.
Знание фазового состава прекурсора и продуктов реакции позволяет теоретически рассчитать Tmax по смоделированным реакциям горения (3)–(8):
(3)
$\begin{gathered} {\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{{\cdot 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.556N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.278}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{7}}}} \to {\text{0}}{\text{.340Cu + 0}}{\text{.298C}}{{{\text{u}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.0644CuO + 1}}{\text{.278}}{{{\text{N}}}_{{\text{2}}}} + {\text{2}}{\text{.495C}}{{{\text{O}}}_{{\text{2}}}} + \\ {\text{ + }}\,\,{\text{5}}{\text{.5}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.283C + 0}}{\text{.602}}{{{\text{O}}}_{{\text{2}}}}{\text{.}} \\ \end{gathered} $(4)
$\begin{gathered} {\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{{\cdot 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.556N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.389}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{7}}}} \to {\text{0}}{\text{.925Cu + 0}}{\text{.0362C}}{{{\text{u}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + }}\,\,{\text{ 0}}{\text{.0024CuO + 1}}{\text{.278}}{{{\text{N}}}_{{\text{2}}}}{\text{ + 3}}{\text{.252C}}{{{\text{O}}}_{{\text{2}}}}{\text{ + }} \\ {\text{ + }}\,\,{\text{5}}{\text{.944}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.192C + 0}}{\text{.173}}{{{\text{O}}}_{{\text{2}}}}{\text{.\;\;}} \\ \end{gathered} $(5)
$\begin{gathered} {\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{{\cdot 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.556N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.5}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{7}}}} \to {\text{0}}{\text{.698Cu + 0}}{\text{.113C}}{{{\text{u}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.077CuO + 1}}{\text{.278}}{{{\text{N}}}_{{\text{2}}}}{\text{ + 2}}{\text{.922C}}{{{\text{O}}}_{{\text{2}}}} + \\ + \,\,{\text{6}}{\text{.389}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.0C + 1}}{\text{.190CO}}{\text{.}} \\ \end{gathered} $(6)
$\begin{gathered} {\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{{\cdot 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.556N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.611}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{7}}}} \to {\text{0}}{\text{.077Cu + 0}}{\text{.375C}}{{{\text{u}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.174CuO + 1}}{\text{.278}}{{{\text{N}}}_{{\text{2}}}}{\text{ + 2}}{\text{.468C}}{{{\text{O}}}_{{\text{2}}}} + \\ {\text{ + }}\,\,{\text{6}}{\text{.833}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.239C + 2}}{\text{.071CO}}{\text{.\;\;\;}} \\ \end{gathered} $(7)
$\begin{gathered} {\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{{\cdot 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.556N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.722}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{7}}}} \to {\text{0}}{\text{.034Cu + 0}}{\text{.281C}}{{{\text{u}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.405CuO + 1}}{\text{.278}}{{{\text{N}}}_{{\text{2}}}}{\text{ + 1}}{\text{.939C}}{{{\text{O}}}_{{\text{2}}}} + \\ {\text{ + }}\,\,{\text{7}}{\text{.278}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.180C + 3}}{\text{.326CO}}{\text{.\;\;\;}} \\ \end{gathered} $(8)
$\begin{gathered} {\text{Cu}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{{\cdot 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.778N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{COOH + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.5}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{7}}}} \to {\text{0}}{\text{.0216Cu + 0}}{\text{.188C}}{{{\text{u}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.602CuO + 1}}{\text{.389}}{{{\text{N}}}_{{\text{2}}}} + {\text{1}}{\text{.907C}}{{{\text{O}}}_{{\text{2}}}} + \\ {\text{ + }}\,\,{\text{6}}{\text{.944}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 0}}{\text{.142C + 2}}{\text{.507CO}}{\text{.}} \\ \end{gathered} $Следует отметить, что в ксерогеле к моменту возгорания остается до 3 молей воды на 1 моль нитрата меди [34], что было учтено в расчетах [35]. Важным моментом является тот факт, что синтез проводили в “закрытом” реакторе, ограничивающем вынос продукта потоком исходящих газов и потери тепловой энергии на излучение [35], а также попадание в реактор кислорода из атмосферы. Вследствие этого и проведения синтеза в области восстановительного горения в газовых продуктах реакции появляется CO.
Из табл. 4 и рис. 3 видно, что максимальная температура горения достигается при суммарном φ = 1.2. При дальнейшем возрастании φ снижаются Tmax(изм.) и Tmax(расч.). Аппроксимации нисходящих ветвей зависимостей изменения максимальных температур описываются кривыми экспоненциального затухания с коэффициентами детерминации R2, равными 0.99 и 0.90 соответственно.
Исходя из полученных данных (табл. 4, рис. 3) можно предположить, что увеличение содержания двойного топлива (Σφ = φгл + φлим) выше 1.8 нецелесообразно, так как выводит реакцию синтеза за рамки режима по типу СВС. Можно также предположить, что при других комбинациях топлива в рамках суммарного φ = 1.3–1.8 реакция горения будет достаточно спокойной и близкой по типу к режиму СВС. Это подтверждает температурный профиль для синтеза CuOx с φгл = 0.7 и φлим = 0.9 (рис. 4).
В процессе возрастания температуры до ~140°С в реакторе образуется ксерогель, в котором в некоторый момент времени начинается окислительно-восстановительная реакция, а скорость подъема температуры (от Tн. р. – температуры начала реакции) начинает возрастать по всему объему ксерогеля, что зафиксировано на температурных профилях. Деструкция ксерогеля начинается в нижнем слое и сопровождается повышением температуры до ~495°C только через 280 с после начала реакции при непрерывном подводе тепла от нагревателя, что не позволяет отнести процесс к синтезу в реакциях Solution Combustion Synthesis (SCS) вследствие не самоподдерживающегося характера горения. Образующийся нижний слой прекурсора CuOx создает теплоизолирующий слой, в результате чего в верхних слоях ксерогеля (20–40 мм от дна реактора) температура стабилизируется на ~200–230°C, но непрерывный подвод тепла от нагревателя поддерживает рост объема реакционной массы. Она становится менее плотной, и процессы деструкции ксерогеля продолжаются. Окислительно-восстановительная реакция уже не является самораспространяющейся, ее следует квалифицировать как окислительный пиролиз. Тем не менее близость значений расчетной температуры (Tmax(расч.) = 483°C) и экспериментально зафиксированной (495°С) свидетельствует о применимости уравнений программы SCSTempCal [24, 35] для моделирования подобных реакций в “закрытом” реакторе.
Несмотря на то, что в экспериментах с открытым реактором не происходит выноса порошка прекурсора, экспериментальная масса прекурсора в пересчете на оксид меди(II) с учетом РФА образцов оказывается меньше теоретической. В опытах, проводимых в открытом реакторе, процесс сопровождается появлением пламени зеленого цвета. Возможно, окрашивание пламени указывает на потерю части меди, присутствующей в пламени в виде летучих органических компонентов. Количество углеродсодержащих компонентов в образцах после синтеза в “закрытом” реакторе не превышало 4.6 мас. %. Данные о потерях CuO приведены в табл. 5. Из нее следует, что увеличение доли глицина в составе топлива способствует росту потерь CuO.
Таблица 5.
Потери целевого продукта в расчете на CuO при получении в реакциях горения
| Условия синтеза | Открытый реактор* | “Закрытый” реактор | ||
|---|---|---|---|---|
| φлим | φгл = 0.5 | φгл = 0.7 | φгл = 0.5 | φгл = 0.7 |
| Δm, мас. % | ||||
| 0.5 | – | – | 52.8 | – |
| 0.7 | – | – | 4.2 | – |
| 0.8 | 17.1 | 24.9 | – | – |
| 0.9 | 10.3 | 26.5 | 3.7 | 37.8 |
| 1.1 | 24.8 | 28.9 | 3.7 | – |
| 1.3 | 19.8 | 20.11 | 1.9 | – |
В закрытом реакторе при φгл = 0.5 и φлим = 0.5 зафиксирован аномально высокий вынос продукта из реактора. Такие большие потери массы вызваны морфологией синтезируемого оксида CuOx (рис. 5а). Полученный порошок состоит из просвечивающих рыхлых агломератов размерами 50–100 мкм с многочисленными пустотами, формирующимися в условиях объемного горения. Вследствие малой насыпной плотности [22] они легко увлекаются потоком исходящих газов и через отверстие и незначительные щели в крышке реактора выносятся за его пределы. При увеличении количества лимонной кислоты в составе реакционного раствора агломераты синтезируемого оксида укрупняются, уплотняются и скрепляются друг с другом, образуя мелкоячеистую сетку (рис. 5б, 5в). Вследствие этого сила потока исходящих газов становится недостаточной для увлечения частиц порошка. При дальнейшем увеличении φлим агломераты образуют кристаллоподобную структуру, соединенную между собой мостиками (рис. 5г, 5д). Свободные пространства между частицами создают условия для беспрепятственного выхода газов, вследствие чего потери синтезируемого продукта снижаются до 1.9 мас. % (табл. 5).
Рис. 5.
СЭМ-изображения порошков CuOx после синтеза в “закрытом” реакторе: (а) φгл = 0.5, φлим = 0.5, (б) φгл = 0.5, φлим = 0.7, (в) φгл = 0.5, φлим = 0.9, (г) φгл = 0.5, φлим = 1.1, (д) φгл = 0.5, φлим = 1.3 и CuOx, полученного в открытом реакторе после отжига при 500°C: (е) φгл = 0.7, φлим = 0.9.

Потери массы при синтезе в открытом реакторе существенно выше, чем в “закрытом” реакторе. Значительная потеря массы целевого продукта, видимо, связана как с более продолжительным временем открытого горения, сопровождающего окислительно-восстановительную реакцию, так и с образованием в составе прекурсора большей доли менее плотного по сравнению с Cu (Cu2O) порошка CuO. Кроме того, играют роль и более интенсивные конвекционные газовые потоки между открытым реактором и атмосферой.
Микроструктура порошков CuOx представлена на вставках к рис. 5а–5д в масштабе 2 мкм. Отчетливо выделяются конгломераты с размерами от сотен нм до 2 мкм. С увеличением φлим прослеживается тенденция к упорядочиванию поверхностей, образованных сросшимися конгломератами.
РФА образцов, отожженных при 500°C, указывает на их монофазность, параметры кристаллической ячейки CuO: a = 4.685 ± 0.003, b = 3.427 ± ± 0.001, c = 5.133 ± 0.019 Å; β = 99.33° ± 0.02°. По данным седиментационного анализа, порошки после помола имеют нормальное распределение со средним диаметром частиц от 20.3 до 45 мкм. Традиционно считается, что в реакциях горения получают нано- и субмикронные порошки, и не упоминается об их агрегации. Особенностью данной схемы получения оксида меди является формирование плотных и крупных агрегатов микрочастиц за счет окисления Cu и Cu2O (рис. 5е). Получаемые порошки имеют невысокую площадь удельной поверхности (от 0.73 до 4.29 м2/г).
Агрегаты CuO представляют собой частицы неправильной формы (рис. 5е) с изменяющейся от условий синтеза пористостью, плохо поддающиеся измельчению при помоле. Последнее косвенно свидетельствует об их повышенной твердости.
ЗАКЛЮЧЕНИЕ
В результате исследования условий получения порошков CuO в реакциях горения с двойным топливом (глицин и лимонная кислота) установлено, что увеличение содержания лимонной кислоты при постоянном количестве глицина снижает скорость и интенсивность синтеза. Большее количество глицина при постоянном суммарном φ также способствует подавлению реакции горения.
В условиях восстановительного горения потери материала минимальны в “закрытом” реакторе и не превышают 1.9–4.2 мас. % при доминировании в составе топлива лимонной кислоты и φгл = 0.5. Потери в открытом реакторе выше и составляют 10–29 мас. % от теоретического выхода по CuO из-за беспрепятственного истечения газов и доминирования в составе прекурсора фазы CuO.
Наблюдаемый аномальный вынос продукта через технологическое отверстие крышки “закрытого” реактора при Σφ = 1.0 обусловлен увлечением рыхлых и относительно легких частиц потоком исходящих газов в условиях объемного горения.
Фазовый состав прекурсоров после окончания реакций горения представляет собой смесь CuO, Cu2O и Cu. Присутствие в топливе лимонной кислоты (φ = 0.8–1.3) подавляет формирование медного порошка и увеличивает выход CuO, вероятно, за счет снижения температуры в зоне реакции гипергольных газов и СО. Образование меди и ее оксидов, способных выступать в качестве катализаторов глубокого окисления углеводородов, приводит к аномально малому содержанию углеродных фрагментов топлива в полученных порошках (0–4.6 мас. %).
Изучение температурных профилей горения ксерогелей нитрата меди с лимонной кислотой и глицином показало, что к реакциям SCS в открытом реакторе можно отнести только синтез, выполненный с φлим < 0.9 и φгл = 0.7–0.9. Повышение содержания лимонной кислоты в реакционной смеси увеличивает время окислительно-восстановительных реакций в связи с переходом к пиролизу и/или термолизу от внешнего источника тепла. Однако расчеты Tmax по термодинамическому уравнению, выведенному для реакций SCS [35], применимы и для такого типа реакций при наличии данных по фазовому составу полученных материалов.
Список литературы
Putjuso T., Manyum P., Yimnirun R. et al. // Solid State Sciences. 2011. V. 13. № 1. P. 158. https://doi.org/10.1016/j.solidstatesciences.2010.11.006
Sarkar S., Jana P.K., Chaudhuri B.K. // Appl. Phys. Lett. 2006. V. 89. № 21. P. 212905. https://doi.org/10.1063/1.2393001
Qiu G., Dharmarathna S., Zhang Y. et al. // J. Phys. Chem. C. 2012. V. 116. P. 468. https://doi.org/10.1021/jp209911k
Brege J.J., Hamilton C. E., Crouse C. A. et al. // Nano Lett. 2009. V. 9. P. 2239. https://doi.org/10.1021/nl900080f
Cao Y., Fan J., Bai L. et al. // Cryst. Growth. Des. 2010. V. 10. P. 232. https://doi.org/10.1021/cg9008637
Basu M., Sinha A.K., Pradhan M. et al. // Chem. Commun. 2010. V. 6. P. 8785. https://doi.org/10.1039/C0CC03137B
Gacia P.D., Shrestha L.K., Bairi P. et al. // Ceram. Int. 2015. V. 41. P. 9426. https://doi.org/10.1016/j.ceramint.2015.03.323
Sadabadi H., Aftabtalab A., Zafarian S. et al. // Adv. Mater. Res. 2014. V. 829. P. 152. https://doi.org/10.4028/www.scientific.net/AMR.829.152
Rao G.R., Mishra B.G., Sahu H.R. // Mater. Lett. 2004. V. 58. P. 3523. https://doi.org/10.1016/j.matlet.2004.05.082
Mukasyan A.S., Epstein P., Dinka P. // Proceedings of the Combustion Institute. 2007. V. 31. P. 1789. https://doi.org/10.1016/j.proci.2006.07.052
Dinka P., Mukasyan A.S. // J. Phys. Chem. B. 2005. V. 109. P. 21627. https://doi.org/10.1021/jp054486n
Ermakova L.V., Zhuravlev V.D., Khaliullin Sh.M., Vovkotrub E.G. // Thermochim. Acta. 2021. V. 695. P. 178809. https://doi.org/10.1016/j.tca.2020.178809
Deganello F., Tyagi A.K. // Prog. Cryst. Growth Charact. Mater. 2018. V. 64. P. 23. https://doi.org/10.1016/j.pcrysgrow.2018.03.001
Комлев А.А., Гусаров В.В. // Неорган. материалы. 2014. Т. 50. № 12. С. 1346. [Komlev A.A., Gusarov V.V. // Inorg. Mater. 2014. V. 50. № 12. P. 1247.] https://doi.org/10.1134/S0020168514120103
Ломанова Н.А., Томкович М.В., Соколов В.В. и др. // Журн. общей химии. 2016. Т. 86. № 10. С. 1605. [Lomanova N.A., Tomkovich M.V., Sokolov V.V. et al. // Russ. J. Gen. Chem. 2016. V. 86. № 10. P. 2256.] https://doi.org/10.1134/S1070363216100030
Lomanova N.A., Tomkovich M.V., Osipov A.V. et al. // Phys. Solid State. 2019. V. 61. № 12. P. 2503. https://doi.org/10.1134/S1063783419120278
Lomanova N.A., Tomkovich M.V., Danilovich D.P. et al. // Inorg. Mater. 2020. V. 56. № 12. P. 1271. https://doi.org/10.1134/S0020168520120110
Pleshakov I.V., Volkov M.P., Lomanova N.A. et al. // Techn. Phys. Lett. 2020. V. 46. № 11. P. 1072. https://doi.org/10.1134/S1063785020110115
Cama T.S., Petrova A.E., Ugolkov V.L. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 5. P. 725. https://doi.org/10.1134/S0036023620050046
Surisa Sa-nguanprang, Anukorn Phuruangrat, Titipun Thongtem et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 7. P. 1102. https://doi.org/10.1134/S0036023620070189
Ketsko V.A., Smirnova M.N., Kop’eva M.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1287. https://doi.org/10.1134/S0036023620090065
Журавлев В.Д., Нефедова К.В., Резницких О.Г. // Int. Scientific J. Alternative Energy and Ecology. 2007. V. 8. № 52. P. 22.
Podbolotov K.B., Khort A.A., Tarasov A.B. et al. // Combustion Science and Technology. 2017. V. 189. № 11. P. 1878. https://doi.org/10.1080/00102202.2017.1334646
Khaliullin Sh.M., Popov I.S., Zhuravlev V.D. // Int. J. Self-Propag. High-Temp. Synth. 2020. V. 29. № 2. P. 87. https://doi.org/10.3103/S1061386220020077
Mukasyan A.S., Costello C., Sherlock K.P. et al. // Sep. Purif. Technol. 2001. V. 25. P. 117.
Deganello F., Marcì G., Deganello G. // J. Eur. Ceram. Soc. 2009. V. 29. P. 439. https://doi.org/10.1016/j.jeurceramsoc.2008.06.012
Morozov N.A., Sinelshchikova O.Yu., Besprozvan-nykh N.V. et al. // Glass Phys. Chem. 2021. V. 47. № 5. P. 481. https://doi.org/10.1134/S1087659621050114
Phuruangrat A., Kuntalue B., Thongtem S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 3. P. 332. https://doi.org/10.1134/S0036023621030128
Khaliullin Sh.M., Zhuravlev V.D., Ermakova L.V. et al. // Int. J. Self-Propag. High-Temp. Synth. 2019. V. 28. № 4. P. 226. https://doi.org/10.3103/S1061386219040058
Khaliullin Sh.M., Koshkina A.A. // Ceram. Int. 2021. V. 47. № 9. P. 11942. https://doi.org/10.1016/j.ceramint.2021.01.035
Kumar A., Wolf E.E., Mukasyan A.S. // AlChE J. 2011. V. 57. № 8. P. 2207. https://doi.org/10.1002/aic.12416
Росляков С.И., Ковалев Д.Ю., Рогачев А.С. и др. // Докл. АН. 2013. Т. 449. № 3. С. 313. https://doi.org/10.7868/S086956521309017X
Халиуллин Ш.М., Бамбуров В.Г., Русских О.В. и др.// Докл. АН. 2015. Т. 461. № 4. С. 418. [Khaliullin Sh.M., Bamburov V.G., Russkikh O.V. et al. // Dokl. Chem. 2015. V. 461. № 2. P. 93. https://doi.org/10.1134/S0012500815040011]
Małecka B., Łącz A., Drożdż E. et al. // J. Therm. Anal. Calorim. V. 119. № 2. P. 1053. https://doi.org/10.1007/s10973-014-4262-9
Khaliullin Sh.M., Zhuravlev V.D., Bamburov V.G. et al. // J. Sol-Gel Sci. Technol. 2020. V. 93. P. 251. https://doi.org/10.1007/s10971-019-05189-8
Дополнительные материалы
- скачать ESM.docx
- Рис. S1. Дифрактограммы прекурсоров, полученных а) в открытом реакторе и б) в “закрытом” реакторе.
Инструменты
Журнал неорганической химии