Журнал неорганической химии, 2022, T. 67, № 6, стр. 852-861
Химическое осаждение и свойства пленок β-Ni(OH)2, полученных в аммиачных растворах
Е. В. Поляков a, *, Р. Р. Цуканов a, Л. Ю. Булдакова a, Ю. В. Кузнецова a, И. В. Волков a, В. П. Жуков a, М. А. Максимова a, А. В. Дмитриев a, И. В. Бакланова a, О. А. Липина a, А. П. Тютюнник a
a Институт химии твердого тела УрО РАН
620219 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: polyakov@ihim.uran.ru
Поступила в редакцию 06.10.2021
После доработки 01.11.2021
Принята к публикации 25.11.2021
- EDN: UEIZZD
- DOI: 10.31857/S0044457X22060204
Аннотация
Методами кинетики и химической термодинамики исследованы коллоидно-химические превращения, сопровождающие термический распад гомогенного водного раствора аммиачных комплексов Ni(II). Установлен конкурентный механизм роста нано- и микрокристаллов гидроксида β-Ni(OH)2 в объеме раствора и на поверхности раздела раствор–твердое. Скорости роста массовой концентрации гидроксида по каждому из маршрутов определяются кинетикой гомогенной реакции первого порядка разрушения комплекса ${\text{Ni}}\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)_{6}^{{2 + }}.$ Причина конкурентного роста массы золя и пленки β-Ni(OH)2 состоит в разной энергии активации реакций превращения ${\text{Ni}}\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)_{6}^{{2 + }}$ в микрокристаллы золя (131.0 ± 27.0 кДж/моль) и пленки (94.0 ± 24.0 кДж/моль). Это дает две температурные области преимущественного роста массы золя или пленки. В области температур 70–75°C скорости роста массы золя и пленки одинаковы. Предложена интерпретация коллоидного механизма роста микрокристаллов гидроксида в зависимости от температуры. Установлено влияние морфологии и толщины пленок β-Ni(OH)2 на их ширину оптической щели, фотокаталитическую и электрическую активность.
ВВЕДЕНИЕ
Интерес к использованию методов химического осаждения из растворов для синтеза неорганических соединений в виде пленок, в частности гидроксида и оксида никеля, связан с возможностью создания на их основе малозатратных технологий применения в составе органических светодиодов, электрохромных материалов, химических сенсоров, электродов с (n–p)-переходом в солнечных батареях, дисплеях, устройствах фотовольтаики [1–7]. Быстро развиваются технологические приемы создания пленочных электрохимических устройств высокой емкости [8–13]. Гидроксид и оксид никеля являются полупроводниками с прямой оптической шириной щели 3.0–3.5 эВ, активными в УФ- и видимой областях спектра [14] при фотокаталитическом разложении молекул воды, органических и неорганических соединений [15–18]. Пленочные формы этих катализаторов, в отличие от порошков, могут использоваться в проточных фотокаталитических реакторах [19–21].
Методы синтеза пленок и покрытий α-, β-Ni(OH)2 на подложках в растворах за счет механизмов химического и коллоидно-химического формирования твердой фазы весьма разнообразны [14, 22, 23]. Общим для них является термическое воздействие на реакционный раствор солей никеля, содержащих свободный аммиак, аммиачные комплексы ионов Ni(II) и/или поверхностно-активные вещества, органические амины как дополнительный источник ионов аммония и регулятор морфологии и скорости роста пленок. Нагрев гомогенного раствора соли никеля приводит к распаду комплексов никеля, формированию золя, а затем геля α-, β-Ni(OH)2 и пленок гидроксида на поверхностях раздела фаз [1, 8, 24–30]. Основными факторами механизма роста пленок являются гетерогенная нуклеация [14] в результате пересыщения раствора относительно гидроксида, температура, длительность контакта раствора с подложкой, концентрация аммиака в реакционном растворе, величина рН [28]. Толщина растущей пленки, ее морфология, размер кристаллитов и их взаимная ориентация зависят от природы подложки, концентрации аммиака и поверхностно-активных веществ, времени контакта, скорости испарения аммиака, температуры. Для объяснения стадийности роста пленок исходят из представлений о двух основных механизмах формирования твердой фазы на подложке [14]. В первом случае формирование пленки начинается с гомогенного зарождения и нуклеации коллоидных частиц в объеме раствора, их последующей гетерокоагуляции и прикрепления к подложке. Необходимым условием прохождения реакции по этому маршруту служит различие в знаке или отсутствие поверхностного заряда (ζ-потенциала) частиц коллоида и элементов поверхности подложки. Другой механизм состоит в гетерогенном зарождении твердой фазы гидроксида/оксида на поверхности подложки с последующим ионно-молекулярным ростом пленки по нормали к поверхности подложки. Возможна комбинация этих двух механизмов с начальным гетерогенным зародышеобразованием на поверхности подложки и дальнейшим ростом нанокристаллов за счет ориентированного прикрепления их части из объема золя к готовой поверхности ранее возникших зародышей. Отмечается, что морфология растущих пленок связана с температурой системы [8, 14]. При относительно низких температурах формируются одномерные структуры, объединяющиеся в соты. При высоких температурах увеличение скорости гетерогенной нуклеации ведет к росту зерен Ni(OH)2 с образованием чешуйчатой морфологии в виде пучков микрохлопьев [8, 14, 23–30].
Таким образом, кинетика формирования поликристаллической пленки гидроксида никеля с позиций механизма конкурентной гетерогенной нуклеации в объеме раствора и на поверхности раздела фаз является ключевым фактором формирования ее фазового состава, толщины и морфологии. Однако в найденной нами литературе этот вопрос не обсуждается.
Цель исследования – установление методами термодинамического, кинетического и инструментального физико-химического анализа элементов механизма термически стимулированного распада аммиачных комплексов Ni(II) по маршрутам образования золя Ni(OH)2 в объеме реакционного раствора (гомогенная нуклеация) и пленки Ni(OH)2 на поверхности раздела фаз раствор–стенка сосуда (гетерогенная нуклеация) в зависимости от концентрации аммиака, рН и температуры раствора. Полученные кинетические результаты использовали для установления связи между условиями синтеза, физико-химическими характеристиками и функциональными свойствами (фотокаталитическая активность при УФ-облучении, обратимость при электрохимической циклической перезарядке пленочного электрода) тонких пленок β-Ni(OH)2 на диэлектрической (стекло) и проводящей (нержавеющая сталь) подложках.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выбор условий формирования Ni(OH)2 в объеме равновесного при данной температуре раствора электролита, первоначально содержащего гомогенные аммиачные и гидроксокомплексы никеля(II), установление влияния температуры и рН на устойчивость комплексов проводили методом термодинамического моделирования. Анализ изменения с температурой полей преобладания фаз и комплексных соединений никеля в координатах pH–Eh–температура для всех участвующих в реакциях (1)–(3) химических форм Ni(0, II, III) выполняли с помощью программы HSC Chemistry v.8:
(1)
${\text{N}}{{{\text{i}}}^{{2 + }}} + n{\text{N}}{{{\text{H}}}_{4}}{\text{OH}} \rightleftarrows {\text{Ni}}({\text{N}}{{{\text{H}}}_{3}})_{n}^{{2 + n{{{\text{H}}}_{2}}{\text{O}}}},\,\,\,\,n = 3--6,$(2)
$\begin{gathered} {\text{Ni}}({\text{N}}{{{\text{H}}}_{3}})_{6}^{{2 + }} + 2{\text{O}}{{{\text{H}}}^{ - }} \rightleftarrows \\ \rightleftarrows {\text{Ni}}{{({\text{OH}})}_{2}}\left( {{\text{раствор}}} \right) + 6{\text{N}}{{{\text{H}}}_{3}}_{{({\text{aq}})}}, \\ \end{gathered} $(3)
${\text{Ni}}({\text{N}}{{{\text{H}}}_{3}})_{6}^{{2 + }} + 2{\text{O}}{{{\text{H}}}^{ - }} \rightleftarrows {\text{Ni}}{{({\text{OH}})}_{2}}{\text{||Si}}{{{\text{O}}}_{2}} + 6{\text{N}}{{{\text{H}}}_{3}}_{{({\text{aq}})}}.$В уравнениях (1)–(3) знак “||SiO2” является символом поверхности раздела раствор–твердое (стекло). Моделирование учитывало возможность образования 29 твердых, жидких и газообразных компонентов, включая твердые фазы NiH0.68, Ni, NiO, α-, β-Ni(OH)2, акваионы Ni(II), их гидроксо-, аммиачные моно- и димерные комплексы, акватированные молекулы аммиака NH3(aq), ионы ${\text{NH}}_{4}^{ + },$ газообразные NH3, O2 и Ar (термостатирующий газ) при общем давлении 1 атм. Была выбрана область температур 25–95°C и значений рН (1.0–14.0). Эти параметры охватывали условия синтеза гидроксида никеля в объеме раствора и на поверхности раздела раствор||твердое, известные из литературы [8, 24–30], рис. 1, S1.
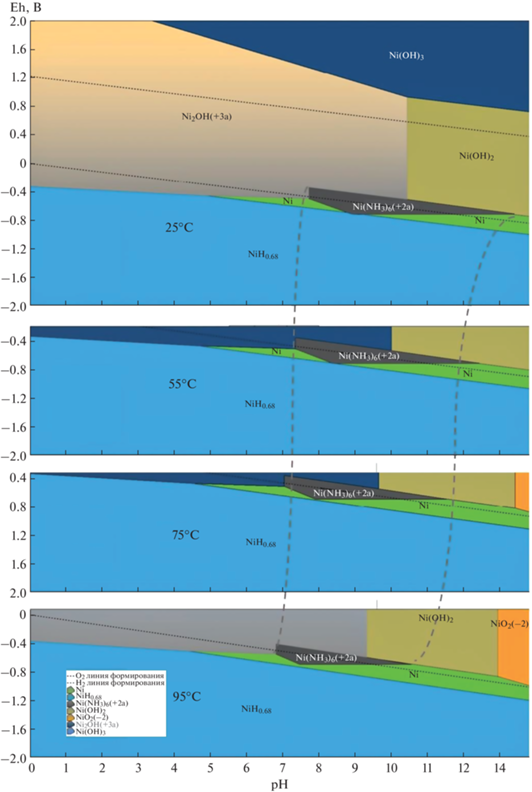
Рис. 1.
Диаграммы эволюции поля преобладания аммиачного комплекса никеля ${\text{Ni(N}}{{{\text{H}}}_{{\text{3}}}}{\text{)}}_{6}^{{2 + }}$ (черный многогранник) на фоне фаз Ni(OH)2–Ni–NiH0.68. Концентрация Ni – 0.37 ммоль/кг, NH3 – 5.88 моль/кг. Ось абсцисс – рН, ось ординат – Eh, В (относительно H2/Н+-электрода).
Проверку выбранных условий синтеза золя β-Ni(OH)2 и пленки β-Ni(OH)2||SiO2 на внутренней поверхности стенок реактора (SiO2) по реакциям (2), (3) проводили при постоянной температуре в пробирках из термостойкого стекла емкостью 5 мл, заполненных 2.5 мл 0.6–1.0 ммоль/л раствора аммиаката Ni(II) c концентрацией свободного аммиака в пределах 0.1–6.0 моль/л. Экспериментально установлено, что раствор приобретал температуру термостата за 10–15 с [23].
Изменение размера и заряда поверхности частиц золя (ξ-потенциал) анализировали методом динамического светорассеяния на анализаторе частиц Zetasizer Nano ZS (Malvern Instruments Ltd.). Особенность примененной нами методики измерения состояла в исследовании процесса при заданной температуре непосредственно в кварцевом реакторе анализатора с температурной поправкой сигнала от потока обратнорассеянных фотонов на уменьшение интенсивности входного светового потока через стенку реактора за счет поглощения в растущей пленке гидроксида [23].
Морфологию осадков и пленок, их качественный элементный состав определяли методом сканирующей электронной микроскопии на приборе JSM JEOL 6390LA. Исследовали также фрагменты стенки реактора с пленкой в условиях равновесия (рис. 2). Фазовый анализ осадков и пленок гидроксида проводили при комнатной температуре на дифрактометре STADI-P (STOE), используя CuKα1-излучение. Расшифровку рентгенограмм выполняли с помощью библиотеки PDF-2 (ICDD Release 2009), табл. S1 , рис. S2 .
Рис. 2.
Морфология типичной пленки β-Ni(OH)2||SiO2 при различных увеличениях, полученная методом сканирующей электронной микроскопии на приборе JSM JEOL 6390LA через 20 мин после начала синтеза; цветом отмечен фрагмент стопки гексагональных кристаллов с линейными размерами ~600 нм и толщиной 180 нм.

КР-спектры образцов осадков и пленок на стекле записывали при комнатной температуре на спектрометре RENISHAW-1000 (длина волны лазера λ = 532 нм, мощность Р = 25 мВт), рис. S3 .
Электронные спектры пропускания пленок гидроксида никеля на стеклянных подложках в видимом и УФ-диапазоне спектра записывали на спектрофотометре Shimadzu UV-3101PC UV/Vis/Near-IR. Спектры диффузного рассеяния пленок гидроксида никеля записывали в интервале длин волн 220–800 нм на спектрофотометре Shimadzu UV-3600 UV-vis-NIR с использованием в качестве стандарта порошка сульфата бария BaSO4.
Кинетику изменения массовой концентрации никеля в реакционном растворе в зависимости от времени контакта фаз по уравнениям (2), (3) исследовали в реакторах с идентичным раствором, помещенных в термостат. В момент времени (τ) от начала нагрева вынимали реактор из термостата и анализировали на содержание Ni отдельно раствор (I), золь гидроксида в объеме раствора (II) и пленку гидроксида на поверхности стенки реактора (III) методом масс-спектрометрии (Elan 9000). Образцы I отделяли фильтрованием реакционного раствора через бумажный фильтр “синяя лента”. Перед измерением раствор I подкисляли концентрированной соляной кислотой. Образцы III получали после удаления содержимого стеклянного реактора и однократной промывки поверхности стенок дистиллированной водой путем растворения пленки гидроксида в 25 мл концентрированной соляной кислоты. Образцы осадка II после его отделения на фильтре переносили вместе с фильтром в стеклянный стакан, растворяли в 25 мл концентрированной соляной кислоты, отделяли фильтрат на фильтре “синяя лента”. Содержание никеля в растворах после отбора образцов I–III измеряли методом масс-спектрометрии в количественном режиме [23]. По результатам анализа вычисляли общее массовое содержание Ni в реакторе и мольную долю никеля в образцах I–III. На рис. S5 приведена типичная изотерма кинетики распределения никеля в объектах I–III от времени (τ) в серии экспериментов c постоянными значениями температуры и рН.
Фотокаталитическую активность образцов пленок гидроксида никеля(II) исследовали в виде покрытий, нанесенных на внутреннюю поверхность стенки реактора в стаканах из кварцевого стекла. Реакторы с пленкой гидроксида заполняли исследуемым раствором субстрата бензохинон–гидрохинон (BQ–HQ) объемом 25 мл с концентрацией 0.10 ммоль/л. Перед облучением растворы субстрата приводили в сорбционное равновесие с фотокатализатором в течение 10 мин и далее без перемешивания облучали потоком УФ-света, направленным по нормали к поверхности раствора, при pH 6.8 и температуре 22°C. Источником света служила УФ-лампа с длиной волны λmax = 253 нм. Концентрацию субстрата в растворе измеряли вольт-амперометрическим методом, подробно описанным ранее [31]. На рис. S6 показано изменение относительной концентрации субстрата со временем облучения раствора пленками фотокатализатора различной толщины.
Исследование электрохимических свойств пленок гидроксида никеля выполняли в щелочном растворе электролита на многоканальном потенциостате-гальваностате Р-2Х (компания Electrochemical Instruments, Черноголовка, РФ) по трехэлектродной схеме с AgCl-электродом сравнения и Pt-поляризационным электродом. Электролитом служили растворы КОН с концентрацией 3.0 моль/л, электроактивным материалом – пленка, полученная осаждением β-Ni(OH)2 на поверхность фольги из нержавеющей стали площадью 0.12 см2. Поляризацию электрода проводили в диапазоне от 100 до 800 мВ со скоростью развертки (v) от 5 до 10 000 мВ/с. Вид полученных кривых поляризации в координатах ток (I)–потенциал (E) при различных скоростях развертки потенциала представлен на рис. S7 .
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гетерогенный механизм роста пленок
Результаты термодинамического анализа устойчивости аммиачных комплексов никеля в зависимости от температуры раствора показали, что основной ионной формой состояния Ni(II) в растворе в области рН 8–13 при выбранной общей концентрации аммиака 5.88 моль/кг и стандартной температуре является гексааммиачный комплекс ${\text{Ni(N}}{{{\text{H}}}_{{\text{3}}}})_{6}^{{2 + }}.$ Область его устойчивости определяется абсолютной величиной и соотношением концентрации Ni(II), рН и концентрации аммиака в растворе. По мере роста температуры она сужается, перемещаясь в область более низких значений рН (рис. 1, пунктирные линии). Из диаграммы устойчивости видно, что если при 25°C в аммиачном растворе с рН 13 основной формой является комплекс ${\text{Ni(N}}{{{\text{H}}}_{{\text{3}}}}{\text{)}}_{6}^{{2 + }},$ то при 55°C и том же значении рН устойчивой формой Ni(II) становится гидроксид Ni(OH)2. Для начального рН 11 потеря устойчивости ионного комплекса наступит при 95°C. Изменение полей преобладания аммиачных комплексов никеля (символ а в формуле) и гидроксидных соединений Ni(II, III) в зависимости от концентрации свободных OH–-ионов и температуры иллюстрирует рис. S1 : при [OH–] = 0.01 моль/л (рН 12) гидроксид никеля не образуется до 80°C (рис. S1a ), при [OH–] = 0.1 моль/л (рН 13) фаза гидроксида устойчива выше 63°C (рис. S1b ). Результаты моделирования подтверждают ведущую роль пересыщения в формировании поликристаллических пленок гидроксида никеля на поверхности стекла [28].
Морфология пленок гидроксида во всем диапазоне температур представляет собой сотовую сетку гексагональных микрокристаллов, описанную ранее [14, 25, 29] (рис. 2). По данным рентгенофазового анализа, пленка обладает набором рефлексов, характерным для брукитa β-Ni(OH)2$(P\bar {3}m1),$ рис. S2 [32]. В табл. S1 приведены структурные параметры типичной пленки гидроксида никеля, осажденной на поверхности стекла, при температурах от 25 до 95°C; звездочкой отмечены рефлексы, уширение которых вызвано дефектом упаковки плоскостей ab [14]. Особенностью микрокристаллов, составляющих первичные частицы пленки β-Ni(OH)2, является усиление рефлексов от плоскостей [001] по сравнению с изотропными кристаллами золя [32]. С увеличением толщины пленки гидроксида в ней появляется фаза смешанного оксигидроксида никеля(II, III) состава (Ni(OH)2(NiOOH)0.167)0.857, наиболее интенсивный пик которой соответствует брегговскому углу 2θ ~ 11.2° (№ 01-089-7111 по PDF-2, ICDD 2009). Ее относительное содержание не превышает 0.1–0.2 мас. %, тем не менее появление фазы NiOOH совместно с Ni(OH)2 выше 60°C согласуется с результатами термодинамического анализа рассматриваемой системы, рис. S1 . Подтверждением того, что пленки гидроксида никеля не содержат примеси α-Ni(OH)2, служат данные КР-спектроскопии (рис. S3 ); на вставке – фрагмент того же спектра в области валентных колебаний связи Ni–O. Интенсивные полосы с частотами 310, 446 и 3600 см–1 соответствуют решеточной моде Eg, решеточной моде А1g и деформационным колебаниям A1g O−H молекул связанной воды в β-Ni(OH)2 [14].
Установленные из термодинамического анализа области высокотемпературной неустойчивости комплекса ${\text{Ni(N}}{{{\text{H}}}_{{\text{3}}}})_{6}^{{2 + }}$ стали основой кинетического исследования роста пленок β-Ni(OH)2. Пример изменения концентрации никеля со временем, показывающий конкурентный характер гетерогенного роста микрочастиц золя и пленки согласно уравнениям (1)–(3), приведен на рис. S5 . Рост массовой концентрации частиц золя и пленки происходит без индукционного периода. Скорость изменения концентрации на начальном этапе процессов с близкой к экспериментальной точностью соответствует кинетической модели необратимой реакции 1-го порядка распада ионов ${\text{Ni(N}}{{{\text{H}}}_{{\text{3}}}}{\text{)}}_{6}^{{2 + }}$ и накопления гидроксида Ni(OH)2 в виде золя (индекс p) и пленки (индекс f):
(4)
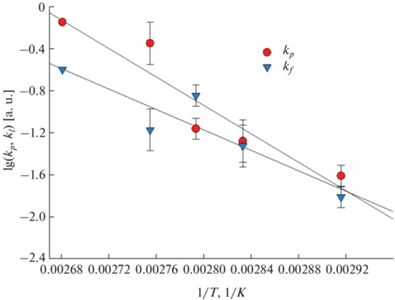
$\begin{gathered} \frac{{d\left[ {{\text{Ni(N}}{{{\text{H}}}_{{\text{3}}}})_{6}^{{2 + }}} \right]}}{{dt}} = - {{k}_{{aq}}}\left[ {{\text{Ni(N}}{{{\text{H}}}_{3}})_{6}^{{2 + }}} \right], \\ \frac{{d{{{[{\text{Ni(OH}}{{)}_{2}}]}}_{{p,f}}}}}{{dt}} = {{k}_{{p,f}}}{{[{\text{Ni(OH}}{{{\text{)}}}_{2}}]}_{{p,f}}}, \\ \end{gathered} $Рис. 3.
Температурная зависимость коэффициентов скорости реакции образования осадка (kp, 1/мин) и пленки (kf, 1/мин) гидроксида никеля в аммиачном растворе при рН 11.3. Вычисленные энергии активации (ΔE, кДж/моль): ΔEp = 130.7 ± ± 27.0 для образования осадка и ΔEf = 94.4 ± 23.8 для пленки.
Эволюция размеров микрокристаллов β-Ni(OH)2 в объеме раствора представляет собой многостадийный процесс (рис. 4). Средний размер частиц золя изменяется со временем синтеза немонотонно, что видно из изменения со временем формы распределения частиц по размерам (полной ширины распределения по размерам на полувысоте, ПШПВ), рис. S10 . Характер роста размера частиц β-Ni(OH)2 зависит от температуры (рис. 4). При 70°C средний размер частиц золя изменяется монотонно от 0 до 10 ОКР (~600 нм), при 75°C наблюдаются две стадии роста размеров частиц золя: первые 20 мин формируются частицы размером 2 ОКР (~120 нм), после 25 мин частицы золя начинают укрупняться, достигая 10 ОКР. Согласно данным [34, 35], по габитусу частицы представляют собой стопки сросшихся плоских кристаллов почти гексагональной формы. На рис. 2 приведен фрагмент пленки β-Ni(OH)2, на котором видны гексагональные микрокристаллы (показано цветом) с линейными размерами 600 × 600 × 180 нм, которые на поздних стадиях кристаллизации принимают форму дисков округлой формы с близкими размерами граней и толщиной. Микрокристалл состоит из трех сросшихся пластин шириной 1 ОКР (~60 нм) и диаметром 10 ОКР, что согласуется с данными [36]. Кратность размеров элементов микрокристалла размерам ОКР позволяет следующим образом детализировать схему формирования микрокристаллов золя, предложенную в [25]. Постоянная и почти нулевая величина ξ-потенциала гидроксидных частиц (–9.0 мВ) на всем протяжении формирования золя говорит об отсутствии электростатических затруднений для агрегационного взаимодействия поверхностей растущих микрокристаллов. Формирование на начальном этапе зародышей с размерами 1 ОКР происходит мгновенно в масштабах времени реакции (t). Далее микрокристаллы растут преимущественно за счет объединения боковых граней зародышей (наиболее интенсивный рефлекс с индексом (001), рис. S1 , рис. 4 [35]) с образованием пластин размерами 10 × 10 × 1 ОКР и срастания их в стопки. Формирование стопок пластин в микрокристалл происходит в растворе электролита, а сростки микрокристаллов образуются на поверхности раздела фаз электролит– стекло со сдвигом плоскостей срастания с индексом (001) из-за дефекта вращательного смещения кристаллографических плоскостей аb вокруг оси с и сдвигового смещения по плоскостям аb [14]. По мере роста линейных размеров одиночных пластин у микрокристаллов нарастает, а при последующем формировании их в стопки уменьшается ширина распределения частиц по размерам, вызванная различием средних размеров микрокристаллов вдоль кристаллографической оси с и вдоль плоскостей аb стопок растущих микрокристаллов. Согласно теории диффузного рассеяния света, увеличение различий в линейных размерах растущих микрокристаллов вызывает увеличение ПШПВ [37]. Как видно из рис. S10 (вставка), величина ПШПВ со временем кристаллизации возрастает, проходя через максимум. При низких температурах (≤40°C) скорость роста невелика, что ведет к сотовой структуре c тонкими стенками. При высоких температурах (≥60°C) увеличивается скорость объемного роста микрокристаллов и параллельно с этим идет рост плотноупакованных гексагональных стопок микрокристаллов в пленке. Описанный конкурентный механизм роста качественно объясняет различия в морфологии пленки гидроксида никеля, связанные с температурой синтеза [25].
Рис. 4.
Динамика изменения размера (Dh) коллоидных частиц β-Ni(OH)2 в ячейке спектрометра при 70 и 75°C. ОКР – область когерентного рассеяния (63 нм) по данным рентгеновской дифракции, рис. S2 . На вставке показан участок поверхности пленки β-Ni(OH)2 через 20 мин после начала синтеза, цветом выделен фрагмент стопки микрокристаллов с линейными размерами ~600 нм и толщиной ~180 нм.
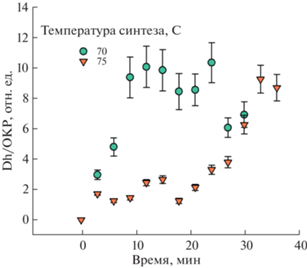
Особенности коллоидно-химического процесса, представленного на рис. 4, относятся к геометрии и морфологии растущих микрокристаллов золя. Они отличаются от концентрационных характеристик процесса массовой кристаллизации и дополняют их (рис. S5 ). Данные рис. 4 показывают, как изменяется со временем протекания реакций (1)–(3) средний размер растущих микрокристаллов золя гидроксида в объеме реакционного раствора в масштабе размера первичных частиц растущих микрокристаллов. При 7°C увеличение среднего размера частиц золя в растворе происходит более интенсивно, чем при 75°C. Экспериментальные трудности не позволяют сопоставить скорость изменения средних размеров микрокристаллов золя со скоростями роста размеров отдельных фракций микрокристаллов в объеме золя и на поверхности раздела фаз жидкость–твердое.
Электрохимическая активность пленок
Кристаллическая структура и ячеистая морфология получаемых пленок, их развитая поверхность делают композиты на основе гидроксида и оксида никеля перспективными материалами для элементов со сверхвысокой емкостью [8, 10, 11, 13, 14, 26, 30, 32, 38]. Изотермы катодно-анодной поляризации показывают (рис. S7A ), что при скорости развертки потенциала v от 5 до 30 мВ/с расстояние между анодным (0.47 В) и катодным (0.61 В) пиками составляет 131 мВ (>59 мВ), а высота пика анодного тока практически в 2 раза больше катодного тока. Это характерно для необратимых электрохимических процессов. Увеличение интенсивности тока с ростом v представляет суперпозицию фарадеевского (когда ток I ~ v1/2) и емкостного вклада (ток I ~ v). На рис. S7 Б представлена эмпирическая зависимость slope $b = \frac{{d\lg (I)}}{{dv}}$ от потенциала E. В области E = 0.4–0.5 В значение производной slope b ~ 1. Оценка емкостной части вклада в ток обмена для этой области дает ${I \mathord{\left/ {\vphantom {I {(vS)}}} \right. \kern-0em} {(vS)}} = - 0.001154\,\,\frac{{\text{Ф}}}{{{\text{с}}{{{\text{м}}}^{2}}}} = 3100~\,\,{{\text{Ф}} \mathord{\left/ {\vphantom {{\text{Ф}} {\text{г}}}} \right. \kern-0em} {\text{г}}}{\text{,}}$ где S – рабочая площадь электрода. В области потенциалов 0.55–0.65 В slope b ~ 0.5 и ток определяются главным образом фарадеевским вкладом, связанным с протеканием гетерогенной редокс-реакции с участием NiOOH:
(6)
$\begin{gathered} {\text{Ni(OH}}{{{\text{)}}}_{{\text{2}}}}{\text{||Si}}{{{\text{O}}}_{2}} + {\text{OH}}_{{(aq)}}^{ - } \rightleftarrows \\ \rightleftarrows \,\,{\text{NiOOH||Si}}{{{\text{O}}}_{{\text{2}}}} + 2{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{(aq)}}} + {{e}^{ - }}. \\ \end{gathered} $Прямым свидетельством возможности самопроизвольного протекания редокс-реакции (6) при контакте пленки β-Ni(OH)2 с кислородом воздуха служит появление на рентгенограммах пленок гидроксида никеля фазы твердого раствора (Ni(OH)2(NiOOH)0.167)0.857 по данным библиотеки PDF-2 (рис. S2 ). При скорости v ≤ 10 В/с пленка успевает накопить полный заряд, что является преимуществом полученных композитов как полупроводников со сверхвысокой емкостью.
Фотокаталитическая активность пленок
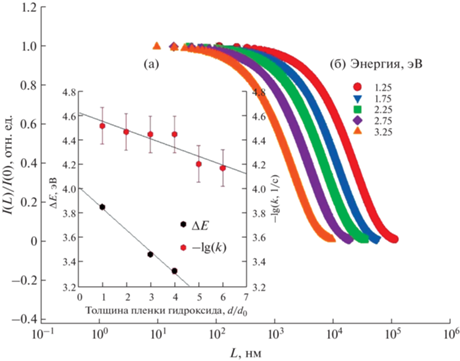
Эксперименты по кинетике фотоокисления субстрата на пленках гидроксида никеля, осажденных на внутреннюю поверхность стеклянного реактора, показали, что изменение концентрации субстрата С(t) описывается на начальной стадии уравнением необратимой реакции первого порядка относительно концентрации субстрата $\partial С\left( t \right){\kern 1pt} /{\kern 1pt} \partial t = - kC\left( t \right)$ (рис. S6 ). Найденный порядок величины константы скорости k соответствует данным [39], и скорость фотоокисления k увеличивается с толщиной пленки катализатора (рис. 5а). Согласно результатам квантово-химического моделирования взаимодействия УФ-излучения с монокристаллом β-Ni(OH)2, выполненного с помощью программы VASP [16], поглощение фотонов в слое гидроксида толщиной <100 нм при энергии фотонов <4 эВ (длина волны <300 нм) пренебрежимо мало, I(L)/I(0) ~ 1 (рис. 5б). Монотонное уменьшение ширины оптической щели ΔE с ростом толщины слоя катализатора эквивалентно увеличению длины свободного пробега фотонов в материале (L), росту концентрации электронно-дырочных пар и, как следствие, увеличению скорости фотоокисления субстрата (рис. 5). Таким образом, изменяя толщину пленки β-Ni(OH)2, можно регулировать скорость фотоокисления субстрата УФ-излучением.
Рис. 5.
Изменение интенсивности света I(L) с глубиной проникновения (L) в монокристалл β-Ni(OH)2 по данным расчета методом VASP [21]. На вставке приведено изменение оптической щели ΔE и коэффициента скорости фотоокисления –lg(k) с толщиной пленки d, d0 – толщина одного слоя ~600 нм.
ЗАКЛЮЧЕНИЕ
С помощью методов термодинамического и кинетического исследования динамики изменения коллоидно-химического состояния растущих частиц β-Ni(OH)2 в работе установлен конкурентный характер роста микрокристаллов гидроксида в виде золя и пленки. Скорость роста массовой концентрации фазы в объеме и в виде пленки на поверхности раздела раствор–твердое контролируется химической стадией распада преобладающего в условиях синтеза комплекса ${\text{Ni(N}}{{{\text{H}}}_{{\text{3}}}})_{6}^{{2 + }}.$ Поскольку энергия активации различна для кинетических маршрутов роста микрокристаллов в объеме раствора и на поверхности раздела раствор–стенка, это приводит к предпочтительному росту концентрации золя гидроксида в объеме раствора и размера микрокристаллов при повышенных температурах и к росту массовой концентрации гидроксида в пленке при пониженных температурах системы. Впервые экспериментально установлена стадийность кристаллизационного роста со временем и предложена интерпретация изменения размеров и морфологии микрокристаллов β-Ni(OH)2 в золе и пленке, зависящая от энергии активации роста и температуры в системе. Охарактеризованы электрохимическая и фотокаталитическая активность синтезированных пленок β-Ni(OH)2, предложена квантово-химическая интерпретация полученных данных.
Список литературы
Мокрушин С.Г. // Журн. физ. химии. 1934. Т. 5. № 8. С. 1082.
Mokrushin S.G. // Dokl. Akad. Nauk SSSR. 1945. V. 47. P. 113.
Chan I.-M., Hong F.C. // Thin Solid Films. 2004. V. 450. № 2. P. 304. https://doi.org/10.1016/j.tsf.2003.10.022
Moulki H., Faure C., Mihelcic M. et al. // Thin Solid Films. 2014. V. 533. P. 63. https://doi.org/10.1016/j.tsf.2013.10.154
Hotovy I., Spiess L., Predanocy M. et al. // Vacuum. 2014. V. 107. P. 129. https://doi.org/10.1016/j.vacuum.2014.04.012
Bandara J., Divarathne C.M., Nanayakkara S.D. // Solar Energy Materials and Solar Cells. 2004. V. 81. № 4. P. 429. https://doi.org/10.1016/j.solmat.2003.11.027
Wager J.F. // Science. 2003. V. 300. P. 1245. https://doi.org/10.1126/science.1085276
Lan W., Tang G., Sun Y. et al. // J. Mater. Sci.: Mater. Electron. 2016. V. 27. P. 2741. https://doi.org/10.1007/s10854-015-4085-x
Ling-kuan M., Wei-ping Y. // Cailiao Rechuli Xuebao. 2006. V. 17. № 5. P. 17. (in Chinese)
Zhen-zhen Zh., Wen-bin N., Neng-yue G. et al. // Dianhuaxue. 2011. V. 17. № 3. P. 292. (in Chinese)
Tao L., Fei W., Shao-hui X. et al. // Huadong Shifan Daxue Xuebao, Ziran Kexueban 2012. V. 5. P. 1. (in Chinese)
Meng-qi G., Jie Zh., Jing X. et al. // Biaomian Jishu. 2015. V. 44. № 1. P. 47. (in Chinese)
Zhiguo Zh., Hua H., Liguang W. et al. // Chem. Eng. J. 2021. V. 412. № 128617. https://doi.org/10.1016/j.cej.2021.128617
Hall D.S., Lockwood D.J., Bock C. et al. // Proc. R. Soc. 2015. V. 471. Art. 20140792. https://doi.org/10.1098/rspa.2014.0792
Hayat Kh., Gondal M.A., Khaled M.M. et al. // J. Mol. Catal. A: Chem. 2011. V. 336. № 1–2. P. 64. https://doi.org/10.1016/j.molcata.2010.12.011
Davoud Y., Akbar Z. A., Mohammad J. // Water Environ. J. 2019. V. 33. № 2. P. 167. https://doi.org/10.1111/wej.12387
Qamar M., Gondal M.A., Yamani Z.H. et al. // J. Mol. Catal. A: Chem. 2011. V. 341. № 1-2. P. 83. https://doi.org/10.1016/j.molcata.2011.03.029
Quan G., Jianni L., Ziwei G. et al. // Faming Zhuanli Shenqing. 2017. CN 106694015. A 20170524. (in Chinese)
Ochiai T., Fujishima A.J. // Photochem. Photobiol. C: Photochem. Rev. 2012. V. 13. P. 247. https://doi.org/10.1016/j.jphotochemrev.2012.07.001
Varshney G., Kanel S.R., Kempisty D.M. et al. // Coord. Chem. Rev. 2016. V. 306. P. 43. https://doi.org/10.1016/j.ccr.2015.06.011
Lai C.W., Lee K.M., Juan J.C. // Nanocomposites for Visible Light-induced Photocatalysis. Springer Series on Polymer and Composite Materials. Spr. / Eds. Pradhan D. et al. Cham: Springer, 2017. https://doi.org/10.1007/978-3-319-62446-4_7
Kozhevnikova N.S., Markov V.F., Maskaeva L.N. // Russ. J. Phys. Chem. A. 2020. V. 94. № 12. P. 2399. [Кожевникова Н.С., Марков В.Ф., Маскаева Л.Н. // Журн. физ. химии. 2020. Т. 94. № 12. С. 1752.]https://doi.org/10.1134/S0036024420120134
Polyakov E.V., Tzukanov R.R., Volkov I.V. et al. // Nanosystems: Physics, Chemistry, Mathematics. 2020. V. 11. № 5. P. 601. https://doi.org/10.17586/2220-8054-2020-11-5-601-607
Черемухин Ю.Г. Дис. … канд. хим. наук. Свердловск, 1977. 138 с.
Patil U.M., Gurav K.V., Hkim J. et al. // Bull. Mater. Sci. 2014. V. 37. № 1. P. 2. https://doi.org/10.1007/s12034-014-0617-x
Avena M.J., Vazquez M.V., Carbonio R.E. et al. // J. Appl. Electrochem. 1994. V. 24. P. 256. https://doi.org/10.4028/www.scientific.net/MSF.498-499.612
Guire M.R.D., Bauermann L.P., Parikh H. et al. Chemical Bath Deposition. Chemical Solution Deposition of Functional Oxide Thin Films / Eds. Waser R. et al. Vienna: Springer, 2013. P. 319. https://doi.org/10.1007/978-3-211-99311-8_14
Presto S., Giraudb D., Testino A. et al. // Thin Solid Films. 2014. V. 552. P. 1. https://doi.org/10.1016/j.tsf.2013.12.008
Gomaa M.M., Boshta M., Farag B.S. et al. // J. Mater. Sci. - Mater. Electron. 2016. V. 27. P. 711. https://doi.org/10.1007/s10854-015-3807-4
Patil U.M., Gurava K.V., Fulari V.J. et al. // J. Power Sources. 2009. V. 188. P. 338. https://doi.org/10.1016/j.jpowsour.2008.11.136
Polyakov E.V., Krasilnikov V.N., Gyrdasova O.I. et al. // Nanosystems: Physics, Chemistry, Mathematics. 2014. V. 5. № 4. P. 553.
Khemiy O.M., Yablon L.S., Budzulyak I.M. et al. // J. Vasyl Stefanyk Precarpathian National University. 2016. V. 3. № 1. P. 23. https://doi.org/10.15330/jpnu.3.1.23-28
Shveikin G.P., Polyakov E.V., Denisova T.A. et al. // Int. J. Nanotechnology. 2006. V. 3. № 1. P. 39. https://doi.org/10.1504/IJNT.2006.008736
Yuxi Xu, Xiaoqing Huang, Zhaoyang Lin et al. // Nano Res. 2013. V. 61. № 1. P. 65. https://doi.org/10.1007/s12274-012-0284-4
Yajun Qi, Hongyan Qi, Jinhua Li et al. // J. Cryst. Growth. 2008. V. 310. P. 4221. https://doi.org/10.1016/j.jcrysgro.2008.06.047
Yua J.-H., Nama S.-H., Gila Y.E. et al. // Appl. Surf. Sci. 2020. V. 532. P. 147441.
Куликов К.Г., Кошлан Т.В. // Журн. тех. физики. 2015. Т. 85. № 127. С. 26. [Kulikov K.G., Koshlan T.V. // Technical Physics. 2015. V. 60. № 12. P. 1758.]
Simonenko T.L., Bocharova V.A., Gorobtsov P.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1292. https://doi.org/10.1134/S0036023620090193
Martínez Sánchez C., Regmi C., Lee S.W. et al. // Topics in Catalysis. 2021. V. 64. P. 73. https://doi.org/10.1007/s11244-020-01295-y
Дополнительные материалы
- скачать ESM.docx
- Рис.S1. - Рис.S10.
Таблица 1.
Инструменты
Журнал неорганической химии


