Журнал неорганической химии, 2022, T. 67, № 6, стр. 739-749
Роль процесса смешения растворов реагентов в формировании морфологических особенностей нанокристаллических частиц гидроксида и оксида магния
Т. П. Масленникова a, b, *, М. Е. Котова a, b, М. С. Ломакин b, c, В. Л. Уголков a
a Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
b Санкт-Петербургский государственный электротехнический университет “ЛЭТИ” им. В.И. Ульянова
197022 Санкт-Петербург, ул. Профессора Попова, 5, Россия
c Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
* E-mail: maslennikova.tp@iscras.ru
Поступила в редакцию 29.10.2021
После доработки 23.12.2021
Принята к публикации 30.12.2021
- EDN: GKDQTW
- DOI: 10.31857/S0044457X22060162
Аннотация
Работа направлена на определение влияния способа смешения жидкофазных реагентов на размерные параметры кристаллитов и частиц нанокристаллического гидроксида магния, образующегося при осаждении из раствора хлорида магния раствором гидроксида натрия, а также на морфологию и дисперсный состав оксида магния, формирующегося при дегидратации Mg(OH)2. Гидроксид магния получали методом обратного осаждения и путем смешения реагентов в микрореакторе со свободно сталкивающимися струями. В зависимости от способа смешения реагентов образуются кристаллиты гидроксида магния с разной склонностью к агрегированию и агломерированию с образованием частиц пластинчатой формы. При формировании частиц оксида магния в случае термообработки нанокристаллического гидроксида магния при 500°С происходит дробление пластинчатых кристаллитов Mg(OH)2 с образованием наночастиц MgO, размер кристаллитов которых сопоставим с толщиной кристаллитов и частиц исходного гидроксида магния. После высокотемпературной (1000°С) обработки частиц Mg(OH)2 образуются кристаллиты MgO, размер которых сопоставим с размером агломератов частиц исходного гидроксида магния.
ВВЕДЕНИЕ
Как показано в многочисленных работах [1–9], форма и размеры нанокристаллического гидроксида магния, получаемого методами мягкой химии, зависят от конкретного способа и условий синтеза. При формировании Mg(OH)2 путем его осаждения из растворов солей важной составляющей процесса синтеза является смешение растворов реагентов. В работах [10–15] было показано, что смешение жидких реагентов в микрореакторах, в том числе в микрореакторах со свободно сталкивающимися струями (МРСС), приводит к повышению степени однородности распределения компонентов в реакционном пространстве. Применение МРСС позволило синтезировать ряд соединений [6, 16–21] с нанометровыми размерами частиц, приближающимися к их предельно возможным минимальным значениям [22].
Наночастицы гидроксида магния с определенными морфологическими параметрами могут представлять интерес как для прямого их практического применения, например, в качестве антипиренов, сорбентов тяжелых металлов из водных сред, нейтрализатора кислых сред (жидких, газообразных), составляющих компонентов в солнечных элементах нового поколения [2, 6, 7, 23], так и для использования в качестве прекурсоров с целью получения других фаз [24]. Последнее важно в связи с тем, что скорость синтеза, структура, морфологические характеристики и свойства синтезируемых веществ и материалов в большой степени могут зависеть от размера частиц реагентов и степени пространственного сопряжения на границах их контакта [25–29]. В частности, представляет интерес выявление роли морфологии, размерных параметров и других характеристик нанокристаллических частиц гидроксида магния, зависящих в том числе от способа и условий смешения растворов реагентов, на строение образующихся при их дегидратации наночастиц оксида магния.
Наночастицы MgO получают разными методами [30–36]. Предыстория реагентов и способы получения оксида магния могут в значительной степени определять морфологию, размерные и другие характеристики частиц и, как следствие, свойства содержащих их материалов. Распространенным и наиболее экономичным способом получения оксида магния является термическое разложение гидроксида магния. При этом управлять дисперсным состоянием продукта дегидратации в широком диапазоне размерных параметров наночастиц оксида магния можно путем использования гидроксида магния с заданной морфологией и размерными параметрами нанокристаллических частиц. С практической точки зрения нанокристаллический MgO может применяться в качестве сорбентов, катализаторов, материалов электрохимических сенсоров, изоляционных материалов в керамике, электронике и электрохимической промышленности и т.п. [23, 36].
Цель настоящей работы – определение влияния способа смешения жидкофазных реагентов на формирование размерных параметров кристаллитов и частиц нанокристаллического гидроксида магния при его синтезе методом осаждения из раствора хлорида магния, а также на морфологию, строение и дисперсный состав образующихся при их дегидратации наночастиц оксида магния.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных компонентов для синтеза гидроксида магния использовали хлорид магния в виде кристаллогидрата MgCl2 · 6H2O (ч. д. а.), гидроксид натрия (ч. д. а.) и дистиллированную воду. Концентрация раствора хлорида магния составляла 0.25 моль/л, раствора NaOH – 0.51 моль/л. Осаждение гидроксида магния проводили двумя способами: методом обратного осаждения и с использованием МРСС. Схематически осаждение данными способами показано на рис. 1. Реагенты были взяты в расчете на стехиометрию гидроксида магния с 5%-ным избытком гидроксида натрия для обеспечения полноты осаждения продукта реакции.
Рис. 1.
Схема осаждения гидроксида магния: а – обратное осаждение; 1 ‒ химический стакан; 2 ‒ магнитный якорь; 3 ‒ магнитная мешалка; б – МРСС; 1 ‒ корпус реактора; 2 ‒ патрубок для отвода продуктов; 3 ‒ сопла; 4 ‒ патрубок для подачи продувочного газа; 5 ‒ емкость для растворов реагентов; 6 ‒ химический стакан для продуктов.
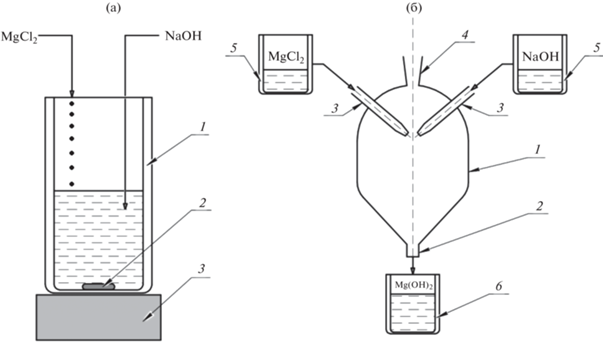
При синтезе гидроксида магния методом обратного осаждения в раствор гидроксида натрия при перемешивании магнитной мешалкой добавляли тонкой струйкой раствор хлорида магния (рис. 1а). Образовавшуюся суспензию перемешивали в течение 1 ч.
Синтез гидроксида магния в МРСС (рис. 1б) проводили по методике, описанной в [18, 37]. Расход растворов гидроксида натрия и хлорида магния составлял 150 мл/мин, что соответствовало расчетной скорости струй при столкновении растворов 12.4 м/с.
Полученные указанными способами осадки промывали до отрицательной реакции на ионы Na+ и Cl–, высушивали при температуре 100°С и определяли их химический и дисперсный состав.
В дальнейшем образцы обозначены как образец 1 – гидроксид магния, полученный методом обратного осаждения, и образец 2 – гидроксид магния, полученный осаждением в МРСС.
Оксид магния получали термообработкой на воздухе гидроксида магния (образцы 1 и 2) в режиме изотермический обжиг–закалка при температуре 500°С и продолжительности изотермической выдержки в печи в течение 10 мин. Температурный режим обжига был выбран на основе данных синхронного термического анализа образцов 1 и 2.
Фазовое состояние, параметры кристаллической структуры и размер кристаллитов образцов определяли по данным рентгеновской порошковой дифрактометрии. Исследования проводили на рентгеновском дифрактометре Rigaku SmartLab 3. Измерения выполняли в режиме на отражение (геометрия Брэгга–Брентано) с использованием CuKα-излучения (никелевый β-фильтр). Обработку полученных данных и идентификацию пиков осуществляли с использованием пакета программ DFWin и базы данных ICDD PDF-2. Размерные параметры кристаллитов определяли на основании анализа распределения кристаллитов по размерам, построенного с использованием программного пакета SmartLab Studio II (Rigaku).
Состояние образцов исследовали также методом ИК-спектроскопии (ИК-фурье-спектрометр ФСМ-1201). Диапазон длин волн составлял 450‒4000 см–1, измерения проводили на воздухе в режиме пропускания, разрешение составляло 4 см–1. Обработку спектров осуществляли с помощью базового программного обеспечения Fspec.
Форму и размеры наночастиц определяли методом просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе JEM 2100-F с ускоряющим напряжением (Uуск) до 200 кВ с приставкой Oxford Instruments INCA для рентгеноспектрального микроанализа. Для определения удельной поверхности образцов применяли метод низкотемпературной адсорбции азота (метод Брунауэра–Эммета–Теллера, газовый анализатор Quantochrome, Nova-1200e). Прогрев образца проводили при температуре 200°С в течение 2 ч. Выбор температуры прогрева образца перед анализом определяли на основе результатов дифференциальной сканирующей калориметрии (ДСК)/термогравиметрии (ТГ).
Синхронный термический анализ выполняли на анализаторе STA 429 CD Netzsch с использованием платина-родиевого держателя образцов типа TГ + ДСК в интервале температур от 50 до 900°С при нагревании со скоростью 20 град/мин в потоке воздуха 50 см3/мин. При анализе регистрировали изменения массы с точностью ±0.005 мг (кривые ТГ в процентах от исходной массы) и изменения энтальпии образца (кривые ДСК в мВт/мг).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Элементный анализ показал отсутствие примесей ионов натрия и хлора в образцах 1 и 2 в пределах чувствительности метода энергодисперсионного рентгеноспектрального микроанализа. Анализ данных рентгеновской дифрактометрии образцов 1 и 2 (рис. 2) показал, что единственной кристаллической фазой в них является гидроксид магния со структурой брусита. Отличие рентгеновских дифрактограмм образцов состоит в том, что у гидроксида магния, полученного методом МРСС, наблюдается большее уширение рентгеновских пиков в направлении оси c, что может быть связано с меньшим размером кристаллитов, по крайней мере их толщины, по сравнению с частицами, полученными методом обратного осаждения. Для образцов 1 и 2 было рассчитано распределение кристаллитов по размерам во взаимно перпендикулярных направлениях по рентгеновским рефлексам 001 и 110 (рис. 3). Параметры распределения приведены в табл. 1.
Рис. 2.
Рентгеновские дифрактограммы образцов Mg(OH)2, полученных разными способами смешения реагентов: 1 – обратное осаждение; 2 – МРСС (индексация по данным PDF-2 # 0044-1482).
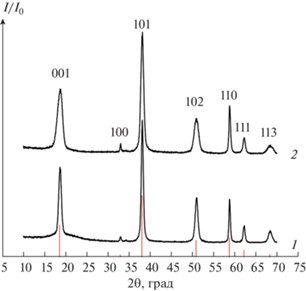
Рис. 3.
Распределение кристаллитов по размеру: а – по рефлексу 001 (hcr), б – по рефлексу 110 (dcr) для образцов Mg(OH)2, полученных при различных способах смешения реагентов: 1 – обратное осаждение, 2 – МРСС.
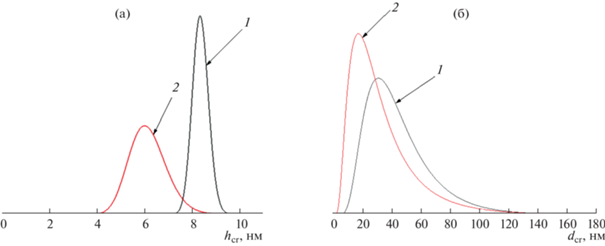
Таблица 1.
Размерные параметры кристаллитов и частиц гидроксида магния
| Взвешенное среднее значение размера кристаллитов hcr ± δ, нм (по рефлексу 001) | Взвешенное среднее значение размера кристаллитов dcr ± δ, нм (по рефлексу 110) | Среднее значение толщины частиц h ± δ, нм | Среднее значение ширины частиц D ± δ, нм |
Число кристаллитов в частице |
|---|---|---|---|---|
| Образец 1 | ||||
| 8.4 ± 0.3 | 45 ± 21 | 7 ± 1 | 55 ± 9 | ~1 |
| Образец 2 | ||||
| 6.1 ± 0.8 | 30 ± 19 | 6 ± 1 | 58 ± 18 | ~1–4 |
Полученные данные показывают, что средние размеры кристаллитов образца 2 меньше на ~30% по толщине и на ~40% по ширине по сравнению с размерами кристаллитов образца 1.
Данные ПЭМ образцов гидроксида магния показывают, что независимо от способа синтеза частицы гидроксида магния представлены тонкими пластинами с основанием, близким по форме к кругу или шестиугольнику с закругленными углами (для частиц бóльших размеров) (рис. 4). Анализ распределения частиц по размерам свидетельствует о незначительных различиях в средних значениях ширины и толщины частиц образцов 1 и 2: в образце, полученном методом обратного осаждения, частицы имеют средний диаметр пластины D(1) = 55 ± 9 нм и толщину h(1) = 7 ± 1 нм, а у образца, полученного методом МРСС, D(2) = = 58 ± 18 нм, h(2) = 6 ± 1 нм (табл. 1). Вместе с тем наночастицы в образце 2 отличаются более широким распределением значений ширины частиц, чем в образце 1 (рис. 4в, 4е).
Рис. 4.
ПЭМ-фотографии образцов Mg(OH)2 и гистограммы распределения частиц по ширине (D) и толщине (h): а–в – образец 1; г–е – образец 2. Овалами на изображениях ПЭМ выделены агломераты частиц.
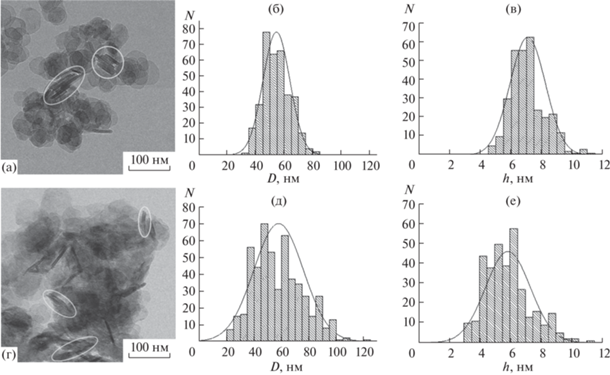
Сравнение данных по размерам кристаллитов и частиц Mg(OH)2 в указанных выше взаимно перпендикулярных направлениях в образцах 1 и 2 показывает, что в обоих случаях частицы представлены в среднем пластинами толщиной в размер одного кристаллита. Если на основании сопоставления размеров кристаллитов в плоскости (110) и ширины наночастиц частицы образца 1 можно считать в основном монокристаллическими, то в образце 2 средние размеры ширины частиц в пределах вариации размерных параметров могут в ~2 раза превышать размеры кристаллитов в плоскости (110) (табл. 1). Этот факт позволяет говорить о том, что кристаллиты образца 2 агрегированы в наночастицы таким образом, что сформировали пластинчатые сростки толщиной в один кристаллит и шириной до нескольких кристаллитов, сросшихся по граням, параллельным направлению [001]. По-видимому, поликристаллический характер пластинчатых наночастиц гидроксида магния в образце 2 является причиной более широкого распределения этих частиц по их ширине (рис. 4).
Другим существенным различием между наночастицами образцов 1 и 2 является характер и степень их агломерирования. Если у образца 1 наблюдается незначительное число агломератов в виде наложенных друг на друга пластинчатых частиц (рис. 4а), то в образце 2 имеется большое число агломератов, состоящих из разноориентированных пластинчатых частиц разного размера. Агломераты частиц на электронно-микроскопических снимках выделены кружками (рис. 4а, 4г).
Наличие агломератов частиц может значительно сказаться на результатах определения средних размеров частиц по данным низкотемпературной адсорбции газов. Так, вследствие агломерирования наночастиц пластинчатой формы внутренние поверхности частиц в агломератах могут стать недоступными для адсорбции газа. В этом случае при определении размерных параметров частиц по данным о значениях удельной площади поверхности образцов, полученным методом низкотемпературной адсорбции газов, фиксируются частицы-агломераты, состоящие из нескольких сложенных друг с другом отдельных частиц пластинчатой формы (рис. 4а, 4г).
Для образцов гидроксида магния, полученных различными способами синтеза, методом низкотемпературной адсорбции азота были определены следующие значения удельной площади поверхности: для образца 1 – $S_{{{\text{exp}}}}^{{\left( {\mathbf{1}} \right)}}$ = 72 ± 2 м2/г, для образца 2 – $S_{{{\text{exp}}}}^{{\left( {\mathbf{2}} \right)}}$ = 111 ± 4 м2/г.
Сравнение экспериментальных значений удельной площади поверхности образцов $S_{{{\text{exp}}}}^{{\left( {{\mathbf{1}},{\mathbf{2}}} \right)}}$ со значениями удельной площади поверхности частиц, рассчитанных в предположении образования плотных сростков частиц – $S_{{{\text{part}}}}^{{\left( {{\mathbf{1}},{\mathbf{2}}} \right)}}$(n, m), где n и m – число частиц, сросшихся по толщине и ширине соответственно, показывает, что агломераты можно считать состоящими в среднем из 2–3 наночастиц пластинчатой формы. При этом для образца 2 характерна меньшая агломерированность частиц по толщине, чем для образца 1, что подтверждает качественные результаты, полученные методом ПЭМ (сравнение рис. 4г и 4а). Наблюдаемое, по данным ПЭМ (рис. 4), большое число частиц в разориентированных агломератах образца 2 не подтверждается результатами анализа данных об удельной площади поверхности (табл. 2). Это, по-видимому, связано с тем, что поверхность у разориентированных частиц-агломератов образца 2 (рис. 4г) более доступна для адсорбирующихся молекул газа, чем у плотных агломератов образца 1 (рис. 4а).
Таблица 2.
Расчетные значения удельной площади поверхности частиц образцов 1 и 2, полученные в предположении образования плотных сростков частиц – $S_{{{\text{part}}}}^{{\left( {{\mathbf{1}},{\mathbf{2}}} \right)}}$(n, m) гидроксида магния (n и m – число сросшихся частиц по толщине и ширине соответственно)
| Число частиц в агломерате (n) | Удельная площадь поверхности, м2/г | |||||
|---|---|---|---|---|---|---|
| образец 1 | образец 2 | |||||
| m | ||||||
| 1 | 2 | 3 | 1 | 2 | 3 | |
| 1 | 151 | 142 | 138 | 170 | 161 | 158 |
| 2 | 91 | 82 | 78 | (100) | 91 | 87 |
| 3 | (71) | 62 | 58 | 76 | 68 | 64 |
Примечание. При расчетах средние значения размерных параметров частиц образцов 1 и 2 были взяты из табл. 1; в расчетах использовали значения рентгеновской плотности гидроксида магния со структурой брусита ρ = 2.368 г/см3 (PDF-2 # 0044-1482); скобками в таблице выделены значения $S_{{{\text{part}}}}^{{\left( {{\mathbf{1}},{\mathbf{2}}} \right)}}$(n, m), наиболее близкие к экспериментальным.
Сравнение данных по размерам кристаллитов, пластинчатых частиц и частиц-агломератов позволяет заключить, что в зависимости от способа смешения реагентов образуются кристаллиты Mg(OH)2 с разной склонностью к агрегированию в частицы пластинчатой формы, которые, в свою очередь, также по-разному агломерируют. Так, частицы, образующиеся при синтезе Mg(OH)2 методом обратного осаждения, можно рассматривать как монокристаллические. Частицы, образующиеся при смешении реагентов в микрореакторе, являются в основном агрегатами, так как состоят, как правило, из 1–4 кристаллитов (табл. 1). Кристаллиты в агрегатах срастаются по граням, параллельным направлению [001].
При образовании агломератов частиц более активная коагуляция их по направлению [001] наблюдается в случае метода обратного осаждения (рис. 4а), чем при микрореакторном смешении реагентов (рис. 4г). В первом случае (образец 1) средняя толщина агломератов частиц составляет около 7 × 3 = 21 нм, а во втором – около 6 × 2 = = 12 нм. Последнее обстоятельство и обеспечивает почти в два раза более высокое значение удельной площади поверхности наночастиц Mg(OH)2, полученных методом МРСС.
Результаты исследования термического поведения гидроксида магния, полученного различными способами, приведены на рис. 5. Для кривых ДСК образцов характерно наличие двух эндотермических максимумов. Первый эндоэффект (I) в температурном интервале ~60–350°С связан с удалением из образца сорбированной воды. На данном этапе образец 1 теряет 2.85% массы $\left( {m_{{\text{I}}}^{{\left( {\mathbf{1}} \right)}}} \right),$ а образец 2 – 3.96% $\left( {m_{{\text{I}}}^{{\left( {\mathbf{2}} \right)}}} \right).$ Второй эндоэффект (II) при T > > 350°С с максимумом при ~420°С связан с процессом разложения гидроксида магния. В данном интервале температур образец 1 теряет 27.63% массы, а образец 2 – 27.69% массы. На протяжении всего температурного интервала исследования образцы теряют 34.35% (образец 1) и 34.32% (образец 2) массы соответственно. Полученные данные о количестве сорбированной воды в образцах хорошо коррелируют с данными о соотношении значений их удельной площади поверхности: ${{S_{{{\text{exp}}}}^{{\left( {\mathbf{2}} \right)}}} \mathord{\left/ {\vphantom {{S_{{{\text{exp}}}}^{{\left( {\mathbf{2}} \right)}}} {S_{{{\text{exp}}}}^{{\left( {\mathbf{1}} \right)}}}}} \right. \kern-0em} {S_{{{\text{exp}}}}^{{\left( {\mathbf{1}} \right)}}}}$ ~ 1.5, ${{m_{{\text{I}}}^{{\left( {\mathbf{2}} \right)}}} \mathord{\left/ {\vphantom {{m_{{\text{I}}}^{{\left( {\mathbf{2}} \right)}}} {m_{{\text{I}}}^{{\left( {\mathbf{1}} \right)}}}}} \right. \kern-0em} {m_{{\text{I}}}^{{\left( {\mathbf{1}} \right)}}}}$ = 3.96/2.85 ~ 1.4. Потери массы образцами 1 и 2 на этапе II приблизительно одинаковы и коррелируют с процентным значением содержания воды в гидроксиде магния ~30.9%. Некоторые различия в расчетных значениях и экспериментальных данных, по-видимому, могут быть связаны со сложностью разделения этапов I и II из-за их наложения друг на друга. Другой причиной некоторого несоответствия расчетных и экспериментальных значений содержания воды в гидроксиде магния может быть тот факт, что при температуре ~900°С потеря воды из образцов продолжается несмотря на то, что кристаллическая фаза Mg(OH)2 на дифрактограммах уже не наблюдается (рис. 6). Некоторое количество воды при этом может находиться в рентгеноаморфной фазе.
Рис. 5.
Кривые ТГ и ДСК образцов Mg(OH)2: а – образец 1, б – образец 2. На вставке представлена рентгеновская дифрактограмма образцов после термического анализа: на дифракционных максимумах указаны кристаллографические индексы, отвечающие MgO со структурой периклаза.
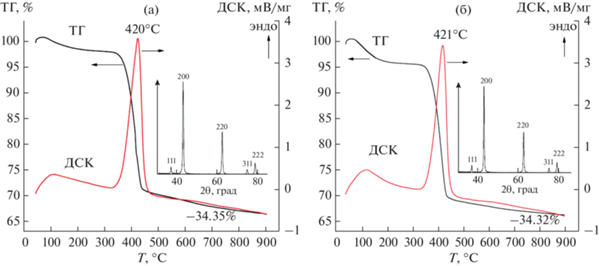
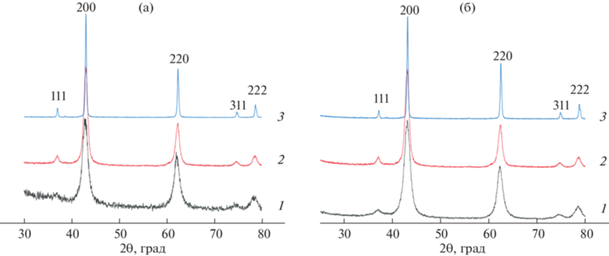
Рис. 6.
Рентгеновские дифрактограммы образцов Mg(OH)2 (1 и 2) после их термообработки при 500°С (10 мин и 24 ч) и 1000°С (24 ч): а – образцы 1'(500/10 мин) (1), 1'(500/24 ч) (2), 1'(1000/24 ч) (3); б – образцы 2'(500/10 мин) (1), 2'(500/24 ч) (2), 2'(1000/24 ч) (3). Кристаллографические индексы MgO указаны по данным PDF-2 # 0045-0946.
Данные рентгеновской дифракции образцов (вставка на рис. 5) после термического анализа свидетельствуют об отсутствии кристаллического гидроксида магния и образовании оксида магния со структурой периклаза (PDF-2 # 0045-0946). Результаты термического анализа (рис. 5) позволяют заключить, что даже кратковременная термообработка образцов 1 и 2 при температуре ~500°С приводит к образованию оксида магния.
Для определения влияния способа получения гидроксида магния на особенности строения, морфологию и размерные параметры кристаллитов и частиц оксида магния проведен анализ данных рентгеновской дифракции (рис. 6), ИК-спектроскопии (рис. 7) и ПЭМ (рис. 8) серий образцов оксида магния, полученных термообработкой при 500°С (10 мин и 24 ч) и 1000°С (24 ч) образцов гидроксида магния 1 и 2, обозначенных в дальнейшем как: 1'(500/10 мин), 1'(500/24 ч), 1'(1000/24 ч), 2'(500/10 мин), 2'(500/24 ч) и 2'(1000/24 ч).
Рис. 7.
ИК-спектры образцов: 1 – 1; 2 – 1'(500/10 мин); 3 – 1'(500/24 ч) (а); 1 – 2; 2 – 2'(500/10 мин), 3 – 2'(500/24 ч) (б).
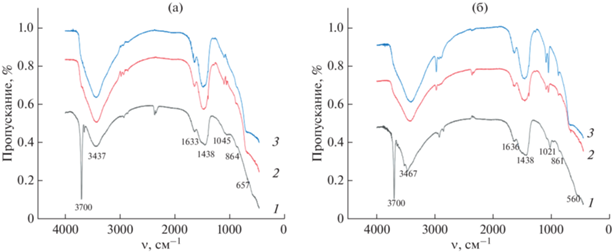
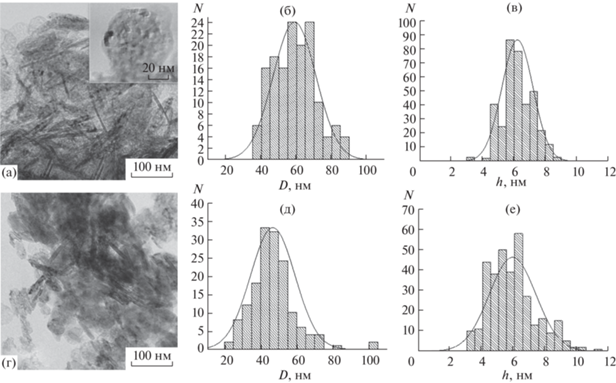
Рис. 8.
ПЭМ-фотографии образцов MgO и гистограммы распределения частиц по ширине (D) и толщине (h): а–в – образец 1'(500/10 мин); г–е – образец 2'(500/10 мин).
Как следует из данных рентгеновской дифрактометрии (рис. 6), уже десятиминутная термообработка образцов 1 и 2 гидроксида магния при 500°С приводит к разрушению фазы брусита с образованием нанокристаллического оксида магния (табл. 3). Однако после обжига при этой температуре даже в течение 24 ч наблюдается значительное содержание в системе аморфной фазы, которая полностью переходит в нанокристаллический MgO только после термообработки при 1000°С (табл. 3). При этом заметного влияния способа получения гидроксида магния на образование оксида магния при дегидратации Mg(OH)2 не наблюдается ни по данным рентгеновской дифракции, ни по данным ИК-спектроскопии (рис. 7).
Таблица 3.
Параметры образцов оксида магния, полученных термообработкой гидроксида магния с разной синтетической предысторией (образцы серий 1' и 2')
| Условия термообработки: температура; продолжительность | Доля кристал-лической фазы, % | Размер кристал-литов, нм (расчет по рефлексу 111) | Размер кристал-литов, нм (расчет по рефлексу 200) | Размер кристаллитов, нм (данные ПЭМ) | Средний размер частиц, нм | |
|---|---|---|---|---|---|---|
| толщина | ширина | |||||
| Образцы серии 1' | ||||||
| 500°С; 10 мин | 15 | 8 ± 1 | 8 ± 1 | 7 ± 2 | 6 ± 1 | 59 ± 12 |
| 500°С; 24 ч | 20 | 9 ± 1 | 9 ± 1 | – | – | – |
| 1000°С; 24 ч | 100 | 57 ± 2 | 56 ± 1 | – | – | – |
| Образцы серии 2' | ||||||
| 500°С; 10 мин | 14 | 6 ± 1 | 7 ± 1 | 4 ± 2 (толщина) 8 ± 2 (длина) |
6 ± 1 | 47 ± 12 |
| 500°С; 24 ч | 21 | 9 ± 1 | 9 ± 1 | – | – | – |
| 1000°С; 24 ч | 100 | 67 ± 3 | 65 ± 1 | – | – | – |
В ИК-спектрах образцов гидроксидов 1 и 2 (кривые 1 на рис. 7а и 7б) присутствует острый интенсивный пик при 3700 см–1, отвечающий валентным колебаниям OH-группы. В образцах серий 1' и 2' после термообработки при 500°С этот пик отсутствует. Вместе с тем в образцах 1'(500/10 мин), 1'(500/24 ч) и 2'(500/10 мин), 2'(500/24 ч), так же как и в образцах 1 и 2, наблюдаются полосы при 3700–3100, 1633 и 1438 см–1, которые можно отнести к валентным и деформационным (две последние полосы) колебаниям H2O. Полосы, наблюдаемые в диапазоне 1484–1099 см–1, также могут быть отнесены к связям C–O и C–O–C [7, 38–41]. Наличие указанных полос в образцах после термообработки гидроксида магния при 500°С, по-видимому, определяется большим количеством в системе аморфной фазы, содержащей воду (табл. 3), следует отметить, что и данные термогравиметрии (рис. 5) показывают потерю воды при термообработке образцов выше 500°С. Полосы поглощения при 864, 657 и 560 см–1, относящиеся к валентным колебаниям Mg–O, характерны для всех исследуемых образцов (рис. 7).
Анализ результатов ДСК/ТГ образцов 1 и 2, рентгеновской дифракции, ИК-спектроскопии и ПЭМ образцов оксида магния, полученных термообработкой образцов гидроксида магния при 500°С, показывает, что если на процесс дегидратации и на средние размеры кристаллитов MgO способ смешения реагентов при образовании Mg(OH)2 заметного влияния не оказывает, то форма образующихся кристаллитов MgO, распределение по размерам и средние размеры частиц оксида магния чувствительны к синтетической предыстории гидроксида магния (рис. 8, табл. 3). Меньшие размеры частиц MgO, состоящих из кристаллитов овальной формы, наблюдаются в случае дегидратации частиц Mg(OH)2, полученных смешением реагентов в МРСС.
Следует отметить, что после термообработки при 500°С частицы образующегося оксида магния практически сохраняют форму и размеры исходного гидроксида магния (табл. 1, 3). Вместе с тем при дегидратации Mg(OH)2 происходит дробление их кристаллитов с образованием кристаллитов MgO, размер которых сопоставим по величине с толщиной кристаллитов гидроксида магния. При этом сами частицы MgO приобретают мозаичное строение (рис. 8а).
После термообработки гидроксида магния при 1000°С размер кристаллитов MgO становится сопоставимым с размером агломератов частиц исходного гидроксида магния. Этот факт позволяет заключить, что именно агломераты частиц Mg(OH)2 являются источниками вещества для перекристаллизационного роста кристаллов оксида магния, протекающего при повышенных температурах.
ЗАКЛЮЧЕНИЕ
В зависимости от способа смешения реагентов – растворов хлоридов магния и гидроксида натрия (методом обратного осаждения или в МРСС) образуются кристаллиты гидроксида магния с разной склонностью к агрегированию и агломерированию в частицы пластинчатой формы. Частицы Mg(OH)2, синтезированные методом обратного осаждения, можно рассматривать как монокристаллические. При смешении реагентов в микрореакторе образуются агрегаты, состоящие, как правило, из нескольких кристаллитов (1–4), сросшихся по граням, параллельным кристаллографическому направлению [001].
После термообработки гидроксида магния с образованием частиц оксида магния нивелируются в значительной степени различия в морфологии исходных частиц. При этом при низкотемпературной обработке (500°С) происходит дробление кристаллитов Mg(OH)2 с образованием частиц MgO, размер кристаллитов которых сопоставим с толщиной кристаллитов исходного гидроксида магния. После высокотемпературной обработки частиц Mg(OH)2 размеры кристаллитов MgO сопоставимы с размерами агломератов частиц исходного гидроксида магния.
Список литературы
Baird T., Braterman P.S., Cochrane H.D. et al. // J. Cryst. Growth. 1988. V. 91. № 4. P. 610. https://doi.org/10.1016/0022-0248(88)90129-7
Henrist C., Mathieu J.-P., Vogels C. et al. // J. Cryst. Growth. 2003. V. 249. № 1–2. P. 321. https://doi.org/10.1016/S0022-0248(02)02068-7
Giorgi R., Bozzi C., Dei L. et al. // Langmuir. 2005. V. 21. № 18. P. 8495. https://doi.org/10.1021/la050564m
Kumari L., Li W.Z., Vannoy C.H. et al. // Ceram. Int. 2009. V. 35. № 8. P. 3355. https://doi.org/10.1016/j.ceramint.2009.05.035
Alavi M.A., Morsali A. // Ultrason. Sonochem. 2010. V. 17. № 2. P. 441. https://doi.org/10.1016/j.ultsonch.2009.08.013
Kumar D.V.R., Prasad B.L.V., Kulkarni A.A. // Ind. Eng. Chem. Res. 2013. V. 52. № 49. P. 17376. https://doi.org/10.1021/ie402012x
Taglieri G., Felice B., Daniele V. et al. // J. Nanoparticle Res. 2015. V. 17. № 10. P. 411. https://doi.org/10.1007/s11051-015-3212-1
Мацукевич И.В., Ручец А.Н., Крутько Н.П. и др. // Журн. прикл. химии. 2017. Т. 90. № 1. С. 3. [Matsukevich I.V., Ruchets A.N., Krut’ko N.P. et al. // Russ. J. Appl. Chem. 2017. V. 90. № 1. P. 1.] https://doi.org/10.1134/S1070427217010013
Zahran H.Y., Shneouda S.S., Yahia I.S. et al. // J. Sol-Gel Sci. Technol. 2018. V. 86. № 1. P. 104. https://doi.org/10.1007/s10971-018-4613-2
Johnson B.K., Prud’homme R.K. // AIChE J. 2003. V. 49. № 9. P. 2264. https://doi.org/10.1002/aic.690490905
Erkoç E., Fonte C.P., Dias M.M. et al. // Chem. Eng. Res. Des. 2016. V. 106. P. 74. https://doi.org/10.1016/j.cherd.2015.12.002
Проскурина О.В., Ноговицин И.В., Ильина Т.С. и др. // Журн. общ. химии. 2018. Т. 88. № 10. С. 1699. [Proskurina O.V., Nogovitsin I.V., Il’ina T.S. et al. // Russ. J. Gen. Chem. 2018. V. 88. № 10. P. 2139.] https://doi.org/10.1134/S1070363218100183
Proskurina O.V., Sivtsov E.V., Enikeeva M.O. et al. // Nanosyst. Physics, Chem. Math. 2019. V. 10. № 2. P. 206. https://doi.org/10.17586/2220-8054-2019-10-2-206-214
Проскурина О.В., Соколова А.Н., Сироткин А.А. и др. // Журн. неорган. химии. 2021. Т. 66. № 2. С. 160. [Proskurina O.V., Sokolova A.N., Sirotkin A.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 163.] https://doi.org/10.1134/S0036023621020157
Albadi Y., Abiev R.S., Sirotkin A.A. et al. // Chem. Eng. Process. – Process Intensif. 2021. V. 166. P. 108473. https://doi.org/10.1016/j.cep.2021.108473
Albadi Y., Sirotkin A.A., Semenov V.G. et al. // Russ. Chem. Bull. 2020. V. 69. № 7. P. 1290. https://doi.org/10.1007/s11172-020-2900-x
Abiev R.S., Almyasheva O.V., Izotova S.G. et al. // J. Chem. Technol. Appl. 2017. V. 1. № 1. https://doi.org/10.35841/chemical-technology.1.1.7-13
Proskurina O.V., Abiev R.S., Danilovich D.P. et al. // Chem. Eng. Process. – Process Intensif. 2019. V. 143. P. 107598. https://doi.org/10.1016/j.cep.2019.107598
Кудряшова Ю.С., Здравков А.В., Уголков В.Л. и др. // Физика и химия стекла. 2020. Т. 46. № 4. С. 427. [Kudryashova Y.S., Zdravkov A.V., Ugolkov V.L. et al. // Glass. Phys. Chem. 2020. V. 46. № 4. P. 335.] https://doi.org/10.1134/S1087659620040082
Кудряшова Ю.С., Здравков А.В., Абиев Р.Ш. // Физика и химия стекла. 2021. Т. 47. № 3. С. 330. [Kudryashova Y.S., Zdravkov A.V., Abiev R.S. // Glass. Phys. Chem. 2021. V. 47. № 3. P. 260.] https://doi.org/10.1134/S108765962103007X
Albadi Y., Ivanova M.S., Grunin L.Y. et al. // Inorganics. 2021. V. 9. № 5. P. 39. https://doi.org/10.3390/inorganics9050039
Almjasheva O.V., Lomanova N.A., Popkov V.I. et al. // Nanosyst. Physics, Chem. Math. 2019. V. 10. № 4. P. 428. https://doi.org/10.17586/2220-8054-2019-10-4-428-437
Pilarska A. A., Klapiszewski Ł., Jesionowski T. // Powder Technology. 2017. V. 319. P. 373. https://doi.org/10.1016/j.powtec.2017.07.009
Корыткова Э.Н., Пивоварова Л.Н. // Физика и химия стекла. 2010. Т. 36. № 1. С. 69. [Korytkova E.N., Pivovarova L.N. // Glass Phys. Chem. 2010. V. 36. № 1. P. 53. https://doi.org/10.1134/S1087659610010104]
Schmalzried H. // Chemical Kinetics of Solids. Weinheim: Wiley-VCH, 1995. https://doi.org/10.1002/9783527615537
Гусаров В.В. // Журн. общ. химии. 1997. Т. 67. № 12. С. 1959. [Gusarov V.V. // Russ. J. Gen. Chem. 1997. V. 67. № 12. P. 1846.]
Гусаров В.В., Ишутина Ж.Н., Малков А.А. и др. // Докл. АН. 1997. Т. 357. № 2. С. 203. [Gusarov V.V., Ishutina Z.N., Malkov A.A. et al. // Dokl. Akad. Nauk. 1997. V. 357. № 2. P. 203.]
Barantchikov A.E., Ivanov V.K., Oleynikov N.N. et al. // Mendeleev Commun. 2004. V. 14. № 4. P. 143. https://doi.org/10.1070/MC2004v014n04ABEH001954
Альмяшева О.В., Гусаров В.В. // Физика и химия стекла. 2006. Т. 32. № 2. С. 224. [Almjasheva O.V., Gusarov V.V. // Glass. Phys. Chem. 2006. V. 32. № 2. P. 162.] https://doi.org/10.1134/S1087659606020064
Федоров П.П., Ткаченко Е.А., Кузнецов С.В. и др. // Неорган. материалы. 2007. Т. 43. № 5. С. 574. [Fedorov P.P., Tkachenko E.A., Kuznetsov S.V. et al. // Inorg. Mater. 2007. V. 43. № 5. P. 502.] https://doi.org/10.1134/S0020168507050111
Veldurthi S., Shin C.-H., Joo O.-S. et al. // Microporous Mesoporous Mater. 2012. V. 152. P. 31. https://doi.org/10.1016/j.micromeso.2011.11.044
Лановецкий С.В., Тихонов В.А., Пойлов В.З. // Неорган. материалы. 2013. Т. 49. № 12. С. 1304. [Lanovetskiy S.V., Tikhonov V.A., Poilov V.Z. // Inorg. Mater. 2013. V. 49. № 12. P. 1203.] https://doi.org/10.1134/S0020168513120091
Manikandan S., Rajan K.S. // RSC Adv. 2014. V. 4. № 93. P. 51830. https://doi.org/10.1039/C4RA09173F
Moorthy S.K., Ashok C., Rao K.V. et al. // Mater. Today Proc. 2015. V. 2. № 9. P. 4360. https://doi.org/10.1016/j.matpr.2015.10.027
Chebanenko M.I., Martinson K.D., Matsukevich I.V. et al. // Nanosyst. Physics, Chem. Math. 2020. V. 11. № 4. P. 474. https://doi.org/10.17586/2220-8054-2020-11-4-474-479
Abinaya S., Kavitha H.P., Prakash M. et al. // Sustain. Chem. Pharm. 2021. V. 19. P. 100368. https://doi.org/10.1016/j.scp.2020.100368
Абиев Р.Ш., Альмяшева О.В., Гусаров В.В., Изотова С.Г. Способ получения нанопорошков феррита кобальта и микрореактор для его реализации // Пат. РФ № 2625981. Приоритет 16.09.2016. Дата публикации 20.07.2017.
Chanda D.K., Samanta A., Dey A. et al. // J. Mater. Sci. 2017. V. 52. № 9. P. 4910. https://doi.org/10.1007/s10853-016-0728-4
Ansari A., Ali A., Asif M., Shamsuzzaman S. // New J. Chem. 2018. V. 42. № 1. P. 184. https://doi.org/10.1039/c7nj03742b
Imani M.M., Safaei M. // J. Nanotechnology. 2019. V. 2019. P. 6063832. https://doi.org/10.1155/2019/6063832
Piperopoulos E., Fazio M., Mastronardo E. et al. // Materials. 2021. V. 14. № 5. P. 1091. https://doi.org/10.3390/ma14051091
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


