Журнал неорганической химии, 2022, T. 67, № 6, стр. 794-801
Синтез твердого раствора Ba1 – xLaxF2 + x из нитратного расплава
П. П. Федоров a, *, А. А. Александров a, b, А. Г. Брагина a, c, М. Н. Маякова a, В. В. Воронов a, М. В. Цыганкова c, А. Н. Дьяченко c, В. К. Иванов b
a Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
c МИРЭА – Российский технологический университет, Институт тонких химических технологий
им. М.В. Ломоносова
119571 Москва, пр-т Вернадского, 86, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 11.11.2021
После доработки 02.12.2021
Принята к публикации 06.12.2021
- EDN: YDZWYK
- DOI: 10.31857/S0044457X22060071
Аннотация
Методом синтеза из раствора в расплаве изучено фазообразование в системе фторид бария–фторид лантана (BaF2–LaF3) при 350–450°С. В качестве исходных веществ использовали нитраты бария и лантана, в качестве фторирующего агента – фторид натрия, растворителем служил нитрат натрия. Образцы исследованы методами рентгенофазового анализа и растровой электронной микроскопии (РЭМ). Выявлено образование флюоритового твердого раствора Ba1 –xLaxF2 +x, где х = 0.3–0.5 (30–50 мол. % LaF3). По данным РЭМ, частицы твердого раствора имеют субмикронные размеры и характеризуются кубической морфологией. Твердый раствор на основе фторида лантана в условиях синтеза не образуется, а формирующиеся частицы LaF3 представляют собой тонкие гексагональные пластинки.
ВВЕДЕНИЕ
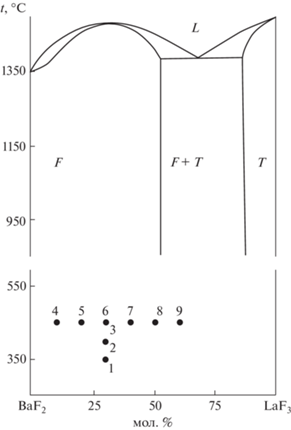
В системе BaF2–LaF3 образуются широкие области твердых растворов на основе Ba1 –xLaxF2 +x со структурой флюорита и La1 –yBayF3 –y (y = 1 – x) с тригональный структурой тисонита [1, 2]. Равновесная предельная концентрация LaF3 при температуре эвтектики (1390°С) составляет 52 мол. % (х ≤ 0.52) и практически не меняется при понижении температуры до 900°С [1, 3], рис. 1. Система представляет классический случай стабилизации кристаллической структуры типа флюорита гетеровалентными изоморфными замещениями: на кривых плавления твердого раствора Ba1 –xLaxF2 +x имеет место максимум при x = 0.31 с температурой плавления 1485°С. Низкотемпературная область этой фазовой диаграммы практически не изучена, поскольку время, необходимое для достижения равновесия, с понижением температуры увеличивается по экспоненциальному закону [4–6]. Возможность исследования низкотемпературной области открывается при использовании расплава нитрата натрия в качестве среды проведения процессов синтеза [7, 8].
Твердые растворы в системе BaF2–LaF3 известны в качестве электролитов с высокой фтор-ионной проводимостью [7–22]. Твердый раствор на основе фторида лантана со структурой тисонита La0.95Ba0.05F2.95 имеет наивысшую электропроводность (σ = 6 × 10–5 Ом–1 см–1 при 300 K) и используется в твердотельных химических источниках тока, работающих при повышенной температуре [17]. Электропроводность флюоритового твердого раствора Ba1 –xLaxF2 +x также достаточно высока. Она возрастает с увеличением концентрации фторида лантана и при x = 0.4 достигает для нанопорошков величины σ = 5 × 10–5 Ом–1 см–1 при 300 K [11, 13, 15]. Высокая ионная проводимость связана с особенностями кластерного строения гетеровалентных твердых растворов [23–37].
Созданы и исследованы сцинтилляторы на основе Ba1 –xLaxF2 +x с концентрацией La до 5% [38]. Фторид бария – эффективный катализатор фторирования 2-хлорпиридина [39]. Использование твердого раствора Ba1 –xLaxF2 +x, где x = 0.5, позволяет уменьшить гидратацию чистого фторида бария и, как следствие, избежать агломерации наночастиц и падения каталитической активности за счет уменьшения эффективной площади поверхности катализатора [40].
Типичным способом получения твердых растворов Ba1 –xLaxF2 +x долгое время было выращивание монокристаллов [41]. Однако помимо сложности аппаратурного оформления и высоких энергозатрат на рост кристаллов существует проблема потери устойчивости фронта кристаллизации за счет переохлаждения. Рост однородных кристаллов высокого оптического качества возможен только из окрестности точки максимума на кривой ликвидуса [42]. Более удобной и дешевой является порошкообразная форма материала [43].
Разработано много методик синтеза порошков фторида бария с различными ионами-активаторами. Часть из них основана на использовании водных растворов в качестве среды проведения синтеза [44–49]. Синтез проводят осаждением из раствора соли щелочноземельного или редкоземельного элемента путем добавления раствора фторирующего агента с последующим удалением маточного раствора. Такой метод синтеза характеризуется простотой исполнения, однако имеет ряд недостатков, среди которых высокая степень гидратированности образцов и агломерации наночастиц и протекание пирогидролиза в процессе сушки образцов.
Другой активно применяемый метод – механохимический синтез [50–52]. Его достоинство заключается в универсальности и использовании для синтеза лишь одной емкости планетарной мельницы, в которую загружают реагенты, чаще всего чистые фториды и мелющие тела. Очевидно, что конечные продукты загрязнены частицами мелющих тел. Кроме того, при проведении помола на воздухе ввиду высокой энергии процесса может протекать гидролиз.
Альтернативным методом синтеза является синтез из раствора в расплаве нитратов щелочных элементов [7, 8]. Он имеет ряд преимуществ перед другими методами: экспрессность, низкая степень гидратированности образцов, экологичность. В качестве исходных реагентов используют нитраты щелочных, щелочноземельных и редкоземельных элементов, фторирующим агентом служит фторид щелочного элемента, а в качестве среды синтеза применяют нитраты щелочных металлов. Реакция проходит под слоем расплава, без доступа влаги и кислорода воздуха.
Цель настоящей работы – исследование низкотемпературного фазообразования в системе BaF2–LaF3 методом синтеза из нитратного расплава, синтез микро- и нанопорошков Ba1 –xLaxF2 +x.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов проводили методом спонтанной кристаллизации из раствора в расплаве. В качестве исходных реагентов использовали нитрат бария Ba(NO3)2 (ос. ч. 10-2, Реахим, или х. ч., Вектон) и гексагидрат нитрата лантана La(NO3)3 · ⋅ 6H2O (99.99 мас. %, ООО “Ланхит”), в качестве фторирующего агента – фторид натрия NaF (х. ч., Химмед), в качестве растворителя – нитрат натрия NaNO3 (х. ч., Химмед, или ч. д. а., МХК “Леверна”). Для синтеза использовали пятикратный мольный избыток фторирующего агента и десятикратный мольный избыток растворителя.
Исходную гомогенизированную реакционную смесь в фарфоровом глазурованном тигле помещали в муфельную печь для проведения синтеза при температурах 350–450°С. Время выдержки образцов при максимальной температуре (τ, мин) составляло 120 и 360 мин.
Протекающая реакция может быть записана уравнением:
(1)
$\begin{gathered} \left( {{\text{1}}--x} \right){\text{Ba}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}} + x{\text{La}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}}{{\cdot 6}}{{{\text{H}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + }}\,\,\left( {{\text{2}} + x} \right){\text{NaF}} \to {\text{B}}{{{\text{a}}}_{{{\text{1 --}}x}}}{\text{L}}{{{\text{a}}}_{x}}{{{\text{F}}}_{{2 + x}}}{\kern 1pt} \downarrow + \\ + \,\,\left( {{\text{2}} + x} \right){\text{NaN}}{{{\text{O}}}_{{\text{3}}}} + {\text{6}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow {\text{.}} \\ \end{gathered} $После проведения синтеза спек извлекали из тигля и несколько раз промывали бидистиллированной водой от растворителя и непрореагировавшего фторирующего агента, при этом частично растворялся и фторид бария. Контроль качества промывок осуществляли с помощью теста на качественную реакцию дифениламина на нитрат-ионы. Затем осадок высушивали при температуре ~40°С на воздухе под лампой.
Полученные образцы исследовали методами рентгенофазового анализа (РФА) на дифрактометре Bruker D8 Advance (CuKα-излучение) и растровой электронной микроскопии (РЭМ) на микроскопе Carl Zeiss NVision 40. Для расчета параметров решетки использовали программное обеспечение TOPAS, Difwin и Powder 2.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
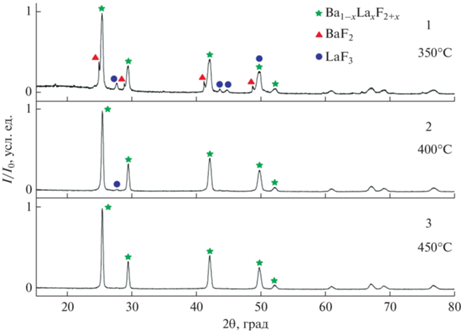
В ходе работы были получены образцы, синтезированные при температурах 350–450°C со временем выдержки 120 мин с шагом 50°C, из расчета на получение твердого раствора с номинальным составом Ba0.7La0.3F2.3. Рентгенограммы образцов приведены на рис. 2.
При температуре 350°C в образце были проиндицированы три фазы: фторид бария, твердый раствор на основе фторида бария со структурой флюорита и фторид лантана. При повышении температуры на 50°C остаются только фаза твердого раствора и фторид лантана. Образец, синтезированный при температуре 450°C, по данным РФА, однофазный. Параметры решетки твердого раствора и содержание фторида лантана (x) рассчитаны по уравнению зависимости параметра решетки от содержания LaF3 в твердом растворе [3]:
где a – рассчитанный параметр решетки, a0 = = 6.200 Å – параметр решетки чистого фторида бария, k = – 0.3033. Результаты расчета приведены в табл. 1.Таблица 1.
Результаты расчета параметров решетки и содержания фторида лантана в образцах 1–3
| Номер образца | Условия синтеза | Параметр решетки Ba1–xLaxF2+x | x, мол. д. LaF3 |
|---|---|---|---|
| t, °С | a, Å | ||
| 1 | 350 | 6.0843(5) | 0.381 |
| 2 | 400 | 6.0742(5) | 0.415 |
| 3 | 450 | 6.0765(5) | 0.407 |
На основании данных РФА образца 1 можно сделать вывод, что сначала в системе отдельно протекают реакции между фторидом натрия и нитратом бария, фторидом натрия и нитратом лантана:
(3)
${\text{Ba}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}} + {\text{2NaF}} \to {\text{Ba}}{{{\text{F}}}_{2}}{\kern 1pt} \downarrow + 2{\text{NaN}}{{{\text{O}}}_{3}},$(4)
$\begin{gathered} {\text{La}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}}\cdot{\text{ }}6{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 3{\text{NaF}} \to \\ \to \,\,{\text{La}}{{{\text{F}}}_{3}}{\kern 1pt} \downarrow + 3{\text{NaN}}{{{\text{O}}}_{3}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow , \\ \end{gathered} $(5)
$(1--x){\text{Ba}}{{{\text{F}}}_{2}} + x{\text{La}}{{{\text{F}}}_{3}} \to {\text{B}}{{{\text{a}}}_{{1--x}}}{\text{L}}{{{\text{a}}}_{x}}{{{\text{F}}}_{{2 + x}}}.$Следует отметить, что при температуре синтеза 350°C 2-часовой выдержки недостаточно для полного протекания реакции (5) в системе. Подобное поведение наблюдалось и в системе CaF2–SrF2 [7]. Данные РФА о фазообразовании в зависимости от температуры показывают, что для получения однофазного твердого раствора следует повышать температуру процесса.
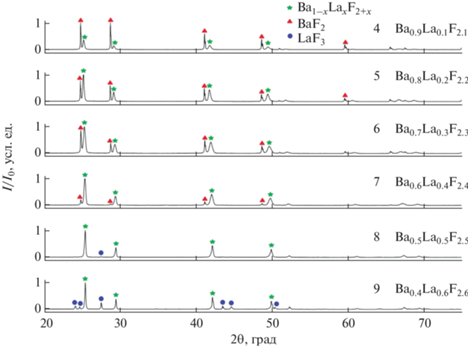
Была синтезирована серия образцов при температуре 450°C с временем выдержки 360 мин из расчета на получение твердого раствора с номинальным составом Ba1 –xLaxF2 +x, где x варьировали от 0.1 до 0.6 с шагом 0.1. Рентгенограммы образцов приведены на рис. 3.
При номинальном содержании фторида лантана от 10 до 40 мол. % индицированы две фазы: практически чистый фторид бария и твердый раствор на основе фторида бария со структурой флюорита. При номинальном содержании фторида лантана 50% в продукте реакции проиндицирована рентгенограмма твердого раствора Ba1 –xLaxF2 +x со структурой флюорита с небольшой примесью фторида лантана. При повышении номинального содержания фторида лантана до 60 мол. % увеличивается интенсивность пиков фторида лантана. Параметры решетки всех образцов приведены в табл. 2.
Таблица 2.
Результаты расчета параметров решетки и содержания фторида лантана в образцах 4–9
| Номер образца | Номинальное содержание LaF3, ат. % | Параметры решетки | x, мол. д. LaF3 | |||
|---|---|---|---|---|---|---|
| LaF3 | Ba1–xLaxF2 +x | BaF2 | ||||
| a, Å | c, Å | a, Å | a, Å | |||
| 4 | 10 | – | – | 6.1003(4) | 6.1953(3) | 0.329 |
| 5 | 20 | – | – | 6.1037(3) | 6.1974(1) | 0.317 |
| 6 | 30 | – | – | 6.082(1) | 6.191(1) | 0.389 |
| 7 | 40 | – | – | 6.066(1) | 6.1927(7) | 0.442 |
| 8 | 50 | 7.186(1) | 7.350(1) | 6.0513(3) | – | 0.490 |
| 9 | 60 | 7.1889(3) | 7.353(1) | 6.0470(2) | – | 0.504 |
Согласно данным расчета параметров решетки фторида лантана, твердый раствор на основе фторида лантана со структурой тисонита La1 –yBayF3 –y, где y = 1 – x, не образуется [53, 54]. Образцы 3 и 6 отличаются временем выдержки (2 и 6 ч соответственно), в образце 3 чистый фторид бария, по данным РФА, не обнаружен. Такое наблюдение может быть связано с тем, что при увеличении времени выдержки частицы укрупняются, снижается их растворимость в воде при промывках образца после стадии синтеза в расплаве.
На рис. 4 приведены СЭМ-микрофотографии образцов, синтезированных при температуре 450°C и выдержке в течение 360 мин.
Рис. 4.
Микрофотографии СЭМ: а, б – образца 4, в – образца 8, г – образца 8 с использованием детектора отраженных электронов, д, е – образца 9.

Микрофотографии образца 8 получены с использованием разных детекторов. При использовании детектора отраженных электронов (рис. 4г) видно, что микрофотография по яркости однородна, следовательно, в образце отсутствуют фазы с более легкими элементами, которые экранируют меньше электронов из-за низкого количества электронов в атоме. Вследствие этого на микрофотографии они были бы гораздо темнее.
В образце 9 на микрофотографиях видны частицы двух видов: гексагональные призмы с большим соотношением стороны к высоте призмы, относящиеся к фториду лантана, и кубические субмикронные частицы твердого раствора на основе фторида бария. Для образца 9 съемку с использованием детектора отраженных электронов не проводили, поскольку барий и лантан, входящие в состав фаз, имеют идущие подряд порядковые номера, поэтому отличие в общем количестве электронов незначительно для определения разных фаз на микрофотографии.
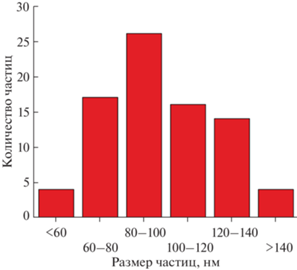
На микрофотографии образца 4 (рис. 4б) видно наличие частиц, сильно различающихся по размерам. Крупные микронные частицы с кубической огранкой относятся к фазе чистого фторида бария. Наличие каверн в крупных частицах может быть связано с протеканием реакции (5) или началом их растворения при проведении отмывок. Из данных РФА следует, что частицы меньших, субмикронных размеров относятся к фазе твердого раствора, поскольку наблюдается уширение пиков, относящихся к фазе твердого раствора. Распределение частиц по размерам для образца 4 приведено на рис. 5.
На основании полученных данных можно сделать вывод о возможности получения методом синтеза из расплава в нитрате натрия при 350–450°C однофазных образцов твердого раствора флюоритовой структуры Ba1 –xLaxF2 +x (х = 0.3–0.5). Образование твердого раствора только в ограниченной концентрационной области контрастирует с результатами синтеза образцов в системе из фторидов стронция и лантана [55, 56], а также с данными высокотемпературной фазовой диаграммы системы BaF2–LaF3 (рис. 1). Однако эти данные согласуются с результатами синтеза путем соосаждения из водных растворов [44]. По-видимому, это подтверждает образование низкотемпературной флюоритоподобной фазы Ba4La3F17 в данной системе. Твердый раствор на основе фторида лантана La1 –yBayF3 –y при указанных в настоящей работе условиях синтеза не образуется, кристаллизуется фаза практически чистого фторида лантана.
ЗАКЛЮЧЕНИЕ
Таким образом, определены условия синтеза однофазного твердого раствора на основе фторида бария. Высказано предположение о характере протекающих в системе реакций, а именно о том, что в первую очередь образуются индивидуальные фториды бария и лантана, которые затем взаимодействуют с образованием твердого раствора флюоритовой структуры. Установлено, что при номинальной концентрации фторида лантана >60 мол. % образуется смесь фаз: твердый раствор со структурой флюорита и чистый фторид лантана. Твердый раствор со структурой тисонита не образуется.
Список литературы
Sobolev B.P. The Rare Earth Trifluorides. Part I. The High Temperature Chemistry of the Rare Earth Trifluorides. Institute of Crystallography, Moscow, 2000. Institut d’Estudis Catalans. Barcelona. Spain, 2000. 520 p.
Sobolev B.P. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 395. https://doi.org/10.1134/S0036023620030158
Sobolev B.P., Tkachenko N.L. // J. Less Common Met. 1982. V. 85. P. 155. https://doi.org/10.1016/0022-5088(82)90067-4
Федоров П.П. // Журн. неорган. химии. 2010. Т. 55. № 11. С. 1825. [Fedorov P.P. // Russ. J. Inorg. Chem. 2010. V. 55. № 11. P. 1722.] https://doi.org/10.1134/S0036023610110100
Гусаров В.В., Суворов С.А. // Журн. прикл. химии. 1990. Т. 63. № 8. С. 1689. [Gusarov V.V., Suvorov S.A. // J. Appl. Chem. USSR. 1990. V. 63. № 8. P. 1560.].
Гусаров В.В. // Журн. общ. химии. 1997. Т. 67. № 12. С. 1959. [Gusarov V.V. // Russ. J. Gen. Chem. 1997. V. 67. № 12. P. 1846.]
Fedorov P.P., Mayakova M., Alexandrov A. et al. // Inorganics. 2018. V. 6. P. 38. https://doi.org/10.3390/inorganics6020038
Fedorov P.P., Alexandrov A.A. // J. Fluorine Chem. 2019. V. 227. 109374. https://doi.org/10.1016/j.jfluchem.2019.109374
Hull S. // Rep. Prog. Phys. 2004. V. 67. № 7. P. 1233. https://doi.org/10.1088/0034-4885/67/7/R05
Gschwind F., Rodrigues-Garsia G., Sandbeck D.J.S. et al. // J. Fluorine Chem. 2016. V. 182. P. 76. https://doi.org/10.1016/j.jfluchem.2015.12.002
Wapenaar K.E.D., Van Koesveld J.L., Schoonman J. // Solid State Ionics. 1981. V. 2. P. 145. https://doi.org/10.1016/0167-2738(81)90172-7
Fedorov P.P., Turkina T.M., Sobolev B.P. et al. // Solid State Ionics. 1982. V. 6. P. 331. https://doi.org/10.1016/0167-2738(82)90018-2
Ivanov-Shits A.K., Sorokin N.I., Fedorov P.P. et al. // Solid State Ionics. 1989. V. 31. P. 269. https://doi.org/10.1016/0167-2738(89)90466-9
Cheng X., Wang S., Lin X. // IOP Conf. Ser.: Mater. Sci. Eng. 2019. V. 678. P. 012148. https://doi.org/10.1088/1757-899X/678/1/012148
Sobolev B.P., Sorokin N.I., Bolotina N.B. // Nonstoichiometric Single Crystals M1 –xRxF2 +x and R1 –yMyF3 –y (M = Ca, Sr, Ba: R = Rare Earth Elements) as Fluorine-Ionic Conductive Solid Electrolytes “Photonic & Electronic Properties of Fluoride Materials” / Ed. Tressaud A., Poeppelmeier K. Elsevier, 2016. P. 465. https://doi.org/10.1016/B978-0-12-801639-8.00021-0
Trnovcova V., Garashina L.S., Skubla A. et al. // Solid State Ionics. 2003. V. 157. P. 195. https://doi.org/10.1016/S0167-2738(02)00209-6
отанин А.А. // Рос. хим. журн. 2001. Т. 45. № 5–6. С. 58
Chable J., Dieudonne B., Body M. et al. // Dalton Trans. 2015. V. 44. P. 19625. https://doi.org/10.1039/c5dt02321a
Chable J., Martin A.G., Bourdin A. et al. // J. Alloys Compd. 2017. V. 692. P. 980. https://doi.org/10.1016/j.jallcom.2016.09.135
Breuer S., Gombotz M., Pregartner V. et al. // Energy Storage Mater. 2019. V. 16. P. 481. https://doi.org/10.1016/j.ensm.2018.10.010
Иванов-Шиц А.К., Мурин И.В. Ионика твердого тела: В 2 т. Том 2. СПб.: Изд-во С.-Петерб. ун-та, 2010. 1000 с.
Preishuber-Pflügl F., Bottke P., Pregartner V. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 9580. https://doi.org/10.1039/C4CP00422A
Bevan D.J.M., Strahle J., Greis O. // J. Solid State Chem. 1982. V. 44. I. 1. P. 75. https://doi.org/10.1016/0022-4596(82)90402-9
Сорокин Н.И., Каримов Д.Н. // Физика твердого тела. 2021. Т. 63. № 10.
Wapenaar K.E.D., Koekkoek H.G., Van Turnhout J. // Solid State Ionics. 1981. V. 2. № 3. P. 145. https://doi.org/10.1016/0167-2738(81)90172-7
Ouwerkerk M., Veldkamp F.F., Andersen N.H. et al. // Solid State Ionics. 1985. V. 16. P. 125. https://doi.org/10.1016/0167-2738(85)90033-5
Andersen N.H., Clausen K.N., Kjems J.K. et al. // J. Phys. C. 1986. V. 19. P. 2377. https://doi.org/10.1088/0022-3719/19/14/004
Hartog H.W., Langevoort J.C. // Phys. Rev. B. 1981. V. 24. P. 3547. https://doi.org/10.1103/PhysRevB.24.3547
Hartog H.W., Pen K.F., Meuldijk J. // Phys. Rev. B. 1983. V. 28. P. 6031. https://doi.org/10.1103/PhysRevB.28.6031
Cahill D.G., Pohl R.O. // Phys. Rev. B. 1989. V. 39. P. 10477. https://doi.org/10.1103/PhysRevB.39.10477
Tu J.J., Sievers A.J. // Phys. Rev. B. 2002. V. 66. P. 094206. https://doi.org/10.1103/PhysRevB.66.094206
Andeen C.G., Fontanella J.J., Wintersgillet M.C. et al. // J. Phys. C: Solid State Phys. 1981. V. 14. P. 3557. https://doi.org/10.1088/0022-3719/14/24/012
Murin I.V., Gunsser W. // Solid State Ionics. 1992. V. 53–56. Part. 2. P. 837. https://doi.org/10.1016/0167-2738(92)90262-N
Sobolev B.P., Alexandrov V.B. et al. // Arxius de les Seccions de Ciencies. Barcelona, 1995. 323 p.
Kazanskii S.A., Ryskin A.I., Nikiforov A.E. et al. // Phys. Rev. B. 2005. V. 72. P. 014127. https://doi.org/10.1103/PhysRevB.72.014127
Аминов Л.К., Куркин И.Н., Курзин С.П. и др. // Физика твердого тела. 2007. Т. 49. № 11. С. 1990. [Aminov L.K., Kurkin I.N., Kurzin S.P. et al. // Phys. Solid State. 2007. V. 49. № 11. P. 2086.] https://doi.org/10.1134/S1063783407110121
Гусаров В.В., Семин Е.Г., Суворов С.А. // Журн. прикл. химии. 1983. Т. 56. № 9. С. 1956. [Gusarov V.V., Semin E.G., Suvorov S.A. // J. Appl. Chem. USSR. 1983. V. 56. № 9. P. 1823.]
Nepomnyashchikh A.I., Radzhabov E.A., Erganov A.V. et al. // Nuclear Inst. Methods Phys. Res. A. 2002. V. 486. № 1–2. P. 390. https://doi.org/10.1016/S0168-9002(02)00739-8
Astruc A., Cochon C., Dessources S. et al. // Appl. Catal., A: General. 2013. V. 453. P. 20. https://doi.org/10.1016/j.apcata.2012.11.043
Astruc A., Celerier S., Pavon E. et al. // Appl. Catal., B: Enviromental. 2017. V. 204. P. 107. https://doi.org/10.1016/j.apcatb.2016.11.019
Sobolev B.P. The Rare Earth Thrifluorides. Part II. Introduction to Materials Science of Multicomponent Metal Fluoride Crystals. Institute of Crystallography, Moscow, 2001. Institut d′Estudis Catalans, Barcelona. Spain, 2001. P. 460.
Kuznetsov S.V., Fedorov P.P. // Inorg. Mater. 2008. V. 44. № 13. P. 1434. https://doi.org/10.1134/S0020168508130037
Федоров П.П., Кузнецов С.В., Маякова М. Н. и др. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1604. [Fedorov P.P., Kuznetsov S.V., Mayakova M.N. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. P. 1525. ] https://doi.org/10.1134/S003602361110007X
Кузнецов С.В., Федоров П.П., Воронов В.В. и др. // Журн. неорган. химии. 2010. Т. 55. № 4. С. 536. [Kuznetsov S.V., Fedorov P.P., Voronov V.V. et al. // Russ. J. Inorg. Chem. 2010. V. 55. № 4. P. 484.] https://doi.org/10.1134/S0036023610040029
Gavhane K.H., Bhadane M.S., Jadhav A.P. et al. // J. Lumin. 2019. V. 209. P. 316. https://doi.org/10.1016/j.jlumin.2019.02.011
Li J., Chen X., Tang L. et al. // J. Am. Ceram. Soc. 2019. V. 102. № 1. P. 178. https://doi.org/10.1111/jace.15915
Jiao Y.-M., Luo J.-M. // Adv. Mater. Res. 2017. V. 1142. P. 79. https://doi.org/10.4028/www.scientific.net/AMR.1142.79
Chen X., Wu Y. // J. Alloys Compd. 2020. V. 817. P. 153075. https://doi.org/10.1016/j.jallcom.2019.153075
He W., Du H., Fu J. et al. // New J. Chem. 2021. V. 45. P. 1446. https://doi.org/10.1039/D0NJ05189F
Preishuber-Pflugl F., Wilkening M. // Dalton Trans. 2016. V. 45. P. 8675. https://doi.org/10.1039/C6DT00944A
Wullen L., Schiffmann J.G., Kopp J. et al. // Z. Kristallogr. 2017. V. 232. P. 141. https://doi.org/10.1515/zkri-2016-1975
Duvel A., Bednarcik J., Sepelak V. et al. // J. Phys. Chem. C. 2014. V. 118. P. 7117. https://doi.org/10.1021/jp410018t
Ross A. // Mater. Res. Bull. 1983. V. 18. P. 405. https://doi.org/10.1016/0025-5408(83)90131-9
Buchinskaya I.I., Karimov D.N., Sorokin N.I. // Crystals. 2021. V. 11. P. 629. https://doi.org/10.3390/cryst11060629
Fedorov P.P., Alexandrov A.A., Voronov V.V. et al. // J. Am. Ceram. Soc. 2021. V. 104. № 6. P. 2836. https://doi.org/10.1111/jace.17666
Kieser M., Greis O. // Z. Anorg. Allg. Chem. 1980. Bd. 169. S. 164.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии