Журнал неорганической химии, 2022, T. 67, № 6, стр. 761-769
Формирование ZrTiO4 в гидротермальных условиях
А. К. Бачина a, *, О. В. Альмяшева b, В. И. Попков a
a Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
b Санкт-Петербургский государственный электротехнический университет “ЛЭТИ” им. В.И. Ульянова (Ленина)
197376 Санкт-Петербург, ул. Профессора Попова, 5, Россия
* E-mail: a.k.bachina@gmail.com
Поступила в редакцию 10.11.2021
После доработки 24.11.2021
Принята к публикации 30.11.2021
- EDN: IHMFMS
- DOI: 10.31857/S0044457X22060022
Аннотация
Исследованы процессы формирования нанокристаллов в системе ZrO2–TiO2–H2O в ходе изотермической (240°С) обработки соосажденных гидроксидов в гидротермальных условиях. Показано формирование твердых растворов на основе моноклинного ZrO2, анатаза (TiO2) и высокотемпературной разупорядоченной фазы переменного состава ZrxTi(1 –x)O4 со структурой скрутинита (α-PbO2). Средний размер кристаллитов ZrxTi(1 –x)O4 равен 16 ± 2 нм. Исследованы кинетические особенности фазообразования в системе ZrO2–TiO2–H2O. Показано, что фаза переменного состава ZrxTi(1 –x)O4 является метастабильной и при увеличении продолжительности гидротермальной обработки распадается на твердые растворы на основе моноклинного ZrO2 и анатаза.
ВВЕДЕНИЕ
Система ZrO2–TiO2 является предметом активных исследований в связи с большим количеством областей применения материалов на ее основе [1–7]. Представляют интерес и довольно хорошо изученные индивидуальные компоненты системы в форме различных полиморфных модификаций: диоксид титана со структурой анатаза (a-TiO2), рутила (r-TiO2) и брукита (b-TiO2), а также диоксид циркония с кубической (c-ZrO2), тетрагональной (t-ZrO2) и моноклинной (m-ZrO2) структурой. В научной литературе сообщаются результаты практического применения композитов этих фаз и твердых растворов на их основе [8–12]. Большое внимание уделяется упорядоченным и разупорядоченным полиморфным модификациям титаната циркония, которые интересны как с фундаментальной, так и с практической точки зрения. С фундаментальной точки зрения интерес представляют структурные и термодинамические особенности их формирования [13–19], с практической – диэлектрические свойства керамических материалов на основе титаната циркония [20–22].
В настоящее время известно о существовании фазы переменного состава ZrxTi(1 –x)O4, имеющей четыре полиморфные модификации. Структура трех из них описывается ромбической сингонией (пр. гр. Pbcn), а одной – моноклинной сингонией (пр. гр. C12/c1). К ромбическим относят высокотемпературную разупорядоченную модификацию ZrTiO4 со структурой скрутинита (α-PbO2) и низкотемпературные модификации, претерпевшие упорядочение катионных октаэдров со структурой колумбита/ферсмита, а также фазу (Zr,Ti)2O4 с узкой температурной областью существования от 1160 до 1060°С [14, 17, 18, 23–27]. К моноклинной модификации относят малоизученное соединение Zr1.34Ti0.66O4 со структурой фергюсонита [28].
Возможность формирования определенной модификации ZrxTi(1 –x)O4 в значительной степени зависит от способа и условий синтеза. В литературе имеются данные о высокотемпературной области фазовой диаграммы системы ZrO2–TiO2 и способах получения материалов на основе разупорядоченной формы титаната циркония [15, 18, 20, 23, 29, 30]. Данных о низкотемпературной области фазовой диаграммы ZrO2–TiO2 значительно меньше, и они зачастую противоречат друг другу [14, 17, 24]. Однако было показано, что керамика на основе упорядоченных низкотемпературных модификаций титаната циркония имеет более высокие диэлектрические свойства, которые ухудшаются в присутствии примеси ZrO2 [21].
Гидротермальный синтез является одним из методов “мягкой химии”, с помощью которого успешно получают нанокристаллические оксидные материалы с узким распределением частиц по размерам [31]. Снижение температуры синтеза по сравнению с традиционными методами термической обработки становится возможным за счет частичного растворения реагентов в гидротермальном флюиде при повышенном давлении, что снижает диффузионные ограничения и повышает скорость массопереноса в системе. Это, в свою очередь, приводит к более быстрому достижению состояния равновесия в системе [31].
С учетом вышесказанного целью данного исследования было определение особенностей формирования кристаллической структуры и устойчивости титаната циркония и других компонентов системы ZrO2–TiO2 в гидротермальных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали ZrOCl2 · 8H2O (х. ч., ТУ 6-09-3677-74), TiCl4 (х. ч., ТУ 6-09-2118-77), 25%-ный раствор NH4OH (ГОСТ 24147-80) и дистиллированную воду (ГОСТ 6709-72).
Образцы для исследования получали соосаждением из водных растворов хлорида цирконила (ZrOCl2) и гексахлортитановой кислоты (H2TiCl6) водным раствором аммиака (NH4OH) до pH 10. H2TiCl6 получали из тетрахлорида титана (TiCl4) по методике, описанной в [32]. Cоотношение ZrOCl2 и H2TiCl6 задавали таким образом, чтобы получить композиции ZrxTi(1 –x)O2 с x = 1.0, 0.95, 0.85, 0.75, 0.65, 0.55, 0.45, 0.35, 0.15, 0.05, 0.0 по уравнению химической реакции:
Полученные осадки промывали дистиллированной водой до отрицательной реакции на хлорид-ионы и сушили при 95°С на воздухе. Таким образом получены 11 исходных композиций, которые обозначены как ZT100, ZT95, ZT85, ZT75, ZT65, ZT55, ZT45, ZT35, ZT15, ZT5, ZT0, соответствующие составам ZrxTi(1 –x)O2 при x = 1.0, 0.95, 0.85, 0.75, 0.65, 0.55, 0.45, 0.35, 0.15, 0.05, 0.0.
Полученные композиции подвергали гидротермальной обработке в автоклавах с фторопластовым вкладышем объемом 16 см3 при температуре 240°С и давлении 70 МПа. В качестве гидротермальной среды использовали дистиллированную воду. Продолжительность изотермической выдержки варьировалась от 4 до 48 ч. По окончании изотермической выдержки и полного остывания автоклавов образцы извлекали и сушили при 100°С.
Элементный состав образцов определяли методом рентгеноспектрального микроанализа (РСМА) на сканирующем электронном микроскопе Hitachi S-570, оснащенном микрозондовой системой Bruker Quantax 200. Погрешность определения содержания элементов данным методом в среднем составляет ±0.3 мас. %.
Для рентгеновского исследования был использован дифрактометр Shimadzu XRD 7000 с CuKα-излучением (λ = 1.54056 Å). Съемку осуществляли в диапазоне углов 2θ от 5° до 100°. При проведении рентгенофазового анализа использовали метод порошка. Для идентификации фаз полученные рентгеновские дифрактограммы сравнивали со структурными данными неорганических веществ из базы данных ICSD. Количественный фазовый состав и размер кристаллитов (областей когерентного рассеяния) определяли при помощи полнопрофильного анализа методом Ритвельда, долю аморфной фазы – с использованием внутреннего стандарта – порошка кремния (SRM 640f, NIST, США). Размер кристаллитов рассчитывали по уширению линий рентгеновской дифракции по формуле Шеррера. Все расчеты проводили с помощью пакета программ PDWin 4.0.
Дифференциальный термический анализ выполняли на приборе Netszch STA 449F3. Измерения проводили в температурном интервале 25–1200°C в потоке аргона (20 мл/мин) со скоростью 10 град/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование исходных композиций
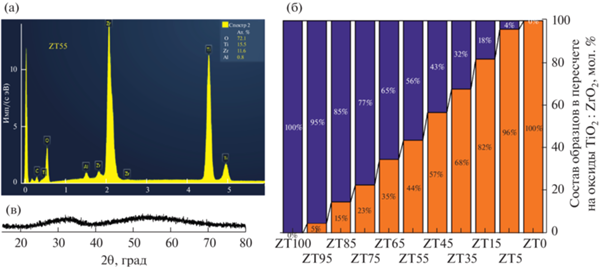
Методом РСМА подтверждено отсутствие химических примесей в полученных исходных композициях. На рис. 1а приведен энергодисперсионный рентгеновский спектр, который показывает, что в образце ZT45 присутствуют три основных элемента: титан Ti, цирконий Zr и кислород O. Характеристические линии алюминия Al и углерода C в спектре являются следствием особенностей пробоподготовки и съемки образцов. Аналогичные спектры были получены для всех образцов, наличие примесей в которых также не наблюдалось. Согласно РСМА, состав элементов в исходных образцах в пересчете на простые оксиды (ZrO2 и TiO2) хорошо согласуется с заданным составом по синтезу; максимальное отклонение не превышает 3 мол. % (рис. 1б). Все исходные образцы были рентгеноаморфными. На рис. 1в в качестве примера приведена рентгеновская дифрактограмма исходного образца ZT45. Подобные дифрактограммы, характерные для рентгеноаморфных веществ, были получены для всех исходных образцов соосажденных гидроксидов.
Простые оксиды ZrO2, TiO2 и твердые растворы на их основе
На рис. 2 приведены участки рентгеновских дифрактограмм, интервал углов 2θ которых соответствует наиболее интенсивным пикам возможных кристаллических фаз в системе ZrO2–TiO2. Согласно данным РФА, гидротермальной обработкой отдельных гидроксидов циркония и титана в течение 4 ч была получена смесь кристаллических фаз ZrO2 с моноклинной и тетрагональной структурой в соотношении 35 : 65 мол. % в случае образца ZT100 и кристаллический TiO2 со структурой анатаза в случае образца ZT0 (рис. 2а). Полученные результаты хорошо согласуются с данными [32–35]. В обоих случаях средний размер нанокристаллов как ZrO2, так и TiO2 составляет ~15 ± 2 нм.
Рис. 2.
Рентгеновские дифрактограммы образцов после гидротермальной обработки при 240°С в течение 4 (а) и 24 ч (б). Рентгеновские дифрактограммы анатаза (1), титаната циркония (2), моноклинного диоксида циркония (3) и тетрагонального диоксида циркония (4) из базы данных ICSD (№ 82082, 51049, 68782 и 68781 соответственно).
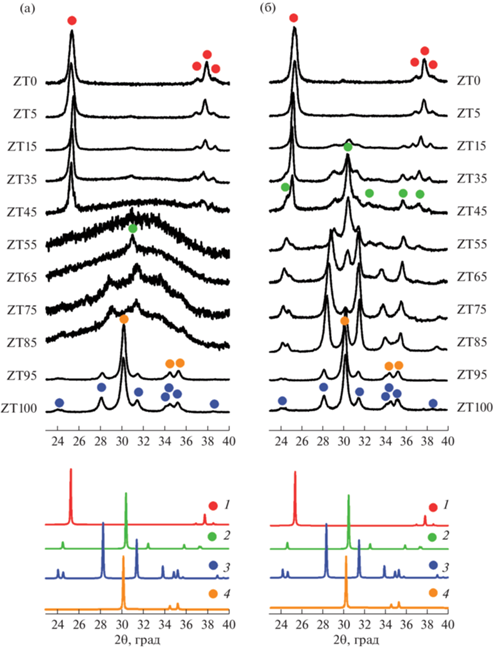
Увеличение продолжительности изотермической выдержки гидротермальной обработки простых гидроксидов до 24 ч приводит к незначительному увеличению средних размеров кристаллитов, фазовый состав не претерпевает заметных изменений (рис. 2б). По данным РФА, фазовый состав в системе ZrO2–H2O не меняется, в системе TiO2–H2O наблюдается появление небольших количеств брукита.
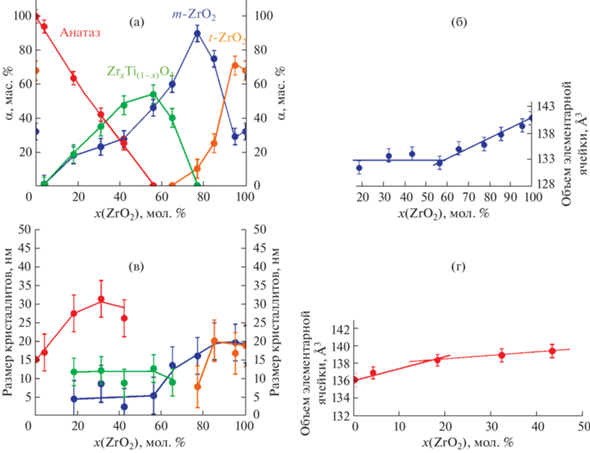
В системе ZrO2–TiO2–H2O в области с низким (до 5 мол. %) содержанием TiO2 (образец ZT95) на дифрактограмме фиксируются только пики m‑ZrO2 и t‑ZrO2. При этом наблюдается смещение рефлексов относительно чистого ZrO2. Методом Ритвельда были уточнены параметры элементарной ячейки m-ZrO2. На рис. 3б показано, что объем элементарной ячейки m-ZrO2 уменьшается при увеличении содержания TiO2 в системе, что свидетельствует о формировании твердых растворов ZrO2 на основе моноклинной (m‑ZrO2(тв.р.)) модификации. Средний размер кристаллитов обеих кристаллических фаз уменьшается по сравнению чистым ZrO2 до 13 ± 5 нм. При этом количественное перераспределение фаз не наблюдается. Увеличение продолжительности изотермической выдержки до 24 ч не приводит к существенным изменениям дифракционной картины (рис. 2).
Рис. 3.
Изменение фазового состава (а) и размера кристаллитов образцов (в) после гидротермальной обработки в течение 24 ч в зависимости от содержания ZrO2 в системе ZrO2–TiO2. Изменение объема элементарной ячейки моноклинного ZrO2 (б) и анатаза (г) в зависимости от содержания ZrO2 в системе ZrO2–TiO2.
В образцах с избытком циркония (ZT85, ZT75, ZT65) после гидротермальной обработки в течение 4 ч на дифрактограммах на фоне аморфного гало фиксируются слабые рефлексы в области (100) пиков m-ZrO2, t-ZrO2 и ZrxTi(1 –x)O4. Такое поведение системы можно объяснить тем, что аналогично гидроксиду циркония в случае простой системы ZrO2–H2O [35, 36] на стадии соосаждения образовался сложный аморфный гидроксид циркония с вошедшим в его структуру титаном и для его дегидратации с последующей кристаллизацией необходимы другие условия синтеза.
При увеличении продолжительности изотермической выдержки в образцах ZT85 и ZT75 происходит кристаллизация t-ZrO2(тв.р.) и m-ZrO2(тв.р.), о чем свидетельствует выраженное смещение рефлексов на дифрактограммах (рис. 2а). При этом доля m-ZrO2(тв.р.) резко возрастает (рис. 3а). Так, в образце ZT75 фиксируется лишь следовое количество t-ZrO2(тв.р.). Рефлексы, отвечающие кристаллическим модификациям TiO2, не наблюдаются ни в одном из этих образцов.
Согласно [17], в системе ZrO2–TiO2 соединение ZrxTi(1 –x)O4 образуется в пределах концентраций TiO2 от 34 до 75 мол. %. В настоящей работе в образце ZT65, соответствующем содержанию TiO2 35 мол. %, после гидротермальной обработки в течение 24 ч с помощью рентгеновской дифракции зафиксированы рефлексы высокотемпературной разупорядоченной модификации ZrxTi(1 –x)O4 со структурой α-PbO2. Наряду с соединением на дифрактограмме присутствуют пики m-ZrO2(тв.р.), а рефлексы, отвечающие кристаллическим модификациям TiO2, не наблюдаются.
При увеличении содержания TiO2 в системе ZrO2–TiO2–H2O до 45 мол. % (образец ZT55) гидротермальная обработка в течение 4 ч не приводит к кристаллизации каких-либо фаз, образец остается рентгеноаморфным. При увеличении продолжительности гидротермальной обработки до 24 ч происходит кристаллизация ZrxTi(1 –x)O4 и m‑ZrO2(тв.р.) в соотношении, близком к 1 : 1.
В системе ZrO2–TiO2–H2O в области низких (от 5 до 45 мол. %) концентраций ZrO2 (образцы ZT5, ZT15, ZT35 и ZT45) гидротермальной обработкой в течение 4 ч получены нанокристаллы TiO2 со структурой анатаза (рис. 2). Смещение пиков анатаза на дифрактограммах с увеличением содержания ZrO2 позволяет предположить, что цирконий входит в структуру анатаза, образуя твердый раствор на его основе (a-TiO2(тв.р.)), о чем также свидетельствует изменение параметров элементарной ячейки (рис. 3г). Помимо твердого раствора на основе анатаза на дифрактограммах фиксируется слабый рефлекс в области 100%-ных пиков ZrxTi(1 –x)O4, t‑ZrO2 и рефлекса (211) брукита. Известно, что предел растворимости ZrO2 в TiO2 сравнительно низкий и, по данным [17, 23, 37], не превышает 18 мол. %. Поэтому можно предположить, что часть циркония, не вошедшего в структуру анатаза, осталась в виде аморфного гидроксида.
Увеличение продолжительности изотермической выдержки до 24 ч приводит к кристаллизации ZrxTi(1 –x)O4 и m‑ZrO2(тв.р.) в образцах ZT15, ZT35 и ZT45. На дифрактограмме, соответствующей образцу ZT5, методом Ритвельда установлено формирование смеси фаз a-TiO2(тв.р.) и брукита (a-TiO2), а цирконийсодержащих фаз не обнаружено (рис. 2 и 3а, 3в).
На рис. 3в показано, как изменяется средний размер кристаллитов ZrO2 и TiO2 при формировании твердых растворов в зависимости от концентрации компонентов. Средний размер кристаллитов твердого раствора ZrO2 на основе моноклинной модификации резко уменьшается с увеличением содержания TiO2 в системе до 44 мол. % (от 18 ± 5 до 5 ± 3 нм) и далее практически не меняется до 82 мол. % TiO2, тогда как средний размер кристаллитов твердого раствора со структурой анатаза монотонно растет с увеличением доли ZrO2 в системе.
Формирование соединения ZrxTi(1 – x)O4 в гидротермальных условиях
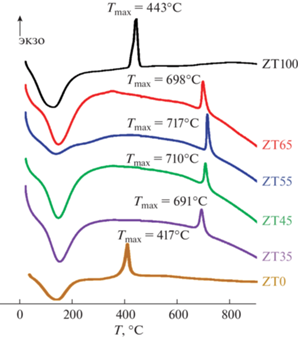
Как было показано выше, фаза ZrxTi(1 –x)O4 не формируется после гидротермальной обработки в течение 4 ч, в то время как индивидуальные оксиды кристаллизуются в этих условиях весьма быстро. Возможно, на стадии совместного соосаждения солей титана и циркония формируется двойной гидроксид, который является структурным предшественником одного из промежуточных соединений в системе ZrO2–TiO2. На рис. 4 показаны кривые ДТА, полученные для исходных аморфных образцов ZT100, ZT65, ZT55, ZT45, ZT35 и ZT0. По представленным данным видно, что экзотермические эффекты, связанные с кристаллизацией чистых оксидов, наблюдаются при более низких температурах, чем экзотермические эффекты, связанные с кристаллизацией соединения ZrxTi(1 –x)O4. Такое выраженное различие температур кристаллизации позволяет сделать вывод, что при получении композиций ZT65, ZT55, ZT45 и ZT35 одним из продуктов соосаждения является двойной гидроксид, структурно отличающийся от чистых гидроксидов титана и циркония. Высказанные предположения согласуются с данными работ [27, 32, 36, 38–42], где было показано формирование в аналогичных условиях аморфных гидроксидов титана и циркония, являющихся структурными предшественниками кристаллических фаз ZrO2, TiO2, и определена температура кристаллизации аморфных прекурсоров ZrO2, TiO2 и ZrTiO4.
Рис. 4.
ДТА-термограммы исходных аморфных образцов, полученные в режиме нагрева со скоростью 10 град/мин в атмосфере аргона.
Кристаллизация соединения ZrxTi(1 –x)O4 происходит в образцах с содержанием титана от 35 до 82 мол. % после изотермической выдержки в течение 24 ч (рис. 2, 3а, 3в). Методом РФА было установлено, что этой фазе соответствует структура высокотемпературной разупорядоченной фазы ZrTiO4 со структурой скрутинита (α-PbO2). Средний размер кристаллитов полученной фазы находится в пределах (8–12) ± 5 нм.
Методом Ритвельда были уточнены параметры кристаллической решетки ZrTiO4. В качестве модели для уточнения использовали структурные данные карточки № 153941 базы данных ICSD. Уточненные параметры образцов ZT35, ZT45, ZT55, ZT65 и образца сравнения приведены в табл. 1.
Таблица 1.
Уточненные параметры кристаллической решетки фазы переменного состава ZrxTi(1 –x)O4 со структурой α-PbO2 (пр. гр. Pbcn) и параметры кристаллической решетки эталона (ICSD-153941)
| Образец | a, Å | b, Å | c, Å | V, Å3 |
|---|---|---|---|---|
| ZT35 | 4.81 ± 0.02 | 5.47 ± 0.02 | 5.03 ± 0.02 | 132.27 ± 0.05 |
| ZT45 | 4.81 ± 0.02 | 5.48 ± 0.02 | 5.01 ± 0.02 | 132.07 ± 0.05 |
| ZT55 | 4.79 ± 0.02 | 5.51 ± 0.02 | 5.02 ± 0.02 | 132.45 ± 0.05 |
| ZT65 | 4.81 ± 0.02 | 5.50 ± 0.02 | 5.02 ± 0.02 | 132.77 ± 0.05 |
| ICSD-153941 | 4.8069 | 5.4785 | 5.0339 | 132.57 |
В работе [23] показано, что с увеличением упорядочения в системе ZrO2–TiO2 параметр b кристаллической решетки претерпевает заметное снижение. Как видно из табл. 1, снижения параметра b в образцах ZT35, ZT45, ZT55 и ZT65 по сравнению с эталонным значением не происходит, однако параметры кристаллической решетки несколько отличаются. Таким образом, можно сделать вывод, что соединение, полученное гидротермальной обработкой соосажденных гидроксидов, представляет собой высокотемпературную метастабильную фазу переменного состава ZrxTi(1 –x)O4 с разупорядоченной структурой α‑PbO2. Уточнение катионного состава полученной фазы требует дополнительного исследования и в рамках настоящей работы не проводилось.
Устойчивость фазы переменного состава ZrxTi(1 – x)O4 со структурой α-PbO2
Как следует из дифрактограмм на рис. 2б, во всех образцах присутствует смесь двух и более фаз, причем ZrxTi(1 –x)O4 всегда наблюдается в присутствии с фазой m-ZrO2(тв.р.). В связи с этим были исследованы кинетические зависимости фазовых превращений в системе ZrO2–TiO2–H2O. В качестве иллюстрации кинетики фазовых превращений в системе ZrO2–TiO2–H2O на рис. 5 на примере образца ZT45 показано изменение дифракционной картины в зависимости от продолжительности гидротермальной обработки и результаты РФА полученных дифрактограмм.
Рис. 5.
Рентгеновские дифрактограммы образца ZT45 после гидротермальной обработки (а), рентгеновские дифрактограммы анатаза (1), титаната циркония (2) и моноклинного диоксида циркония (3) из базы данных ICSD (№ 82082, 51049 и 68782 соответственно); изменение фазового состава (б) и размера кристаллитов (в) в зависимости от продолжительности гидротермальной обработки.
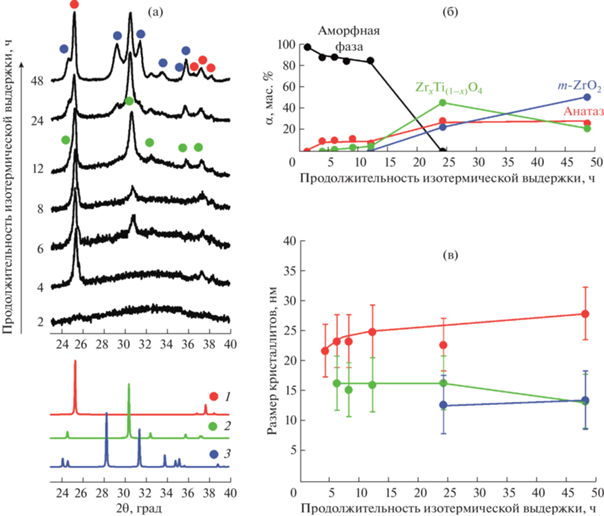
Напомним, что изначально образец ZT45 был рентгеноаморфным. После гидротермальной обработки в течение 2 ч на соответствующей дифрактограмме присутствие кристаллических фаз не зафиксировано. Однако уже 4 ч изотермической выдержки приводят к появлению рефлексов, характерных для фазы a-TiO2(тв.р.). Количественно доля a-TiO2(тв.р.) составила ~10 мас. %, а средний размер кристаллитов – около 22 нм.
Спустя 6 и 8 ч гидротермальной обработки на дифрактограммах появляется слабый рефлекс в области наиболее интенсивного пика ZrxTi(1 –x)O4, соответствующий небольшому количеству данного соединения (рис. 5а).
Доли a-TiO2(тв.р.) и аморфной фазы меняются слабо вплоть до 12 ч гидротермальной обработки (рис. 5б). При этом средний размер кристаллитов a-TiO2(тв.р.) увеличивается до 25 ± 5 нм (рис. 5в). Доля ZrxTi(1 –x)O4 увеличивается до ~8 мас. %. Средний размер кристаллитов этой фазы практически не меняется с увеличением продолжительности изотермической выдержки и составляет около 16 ± 2 нм.
Увеличение продолжительности изотермической выдержки до 24 ч приводит к появлению на дифрактограмме пиков m-ZrO2(тв.р.). При этом вся аморфная фаза уже израсходована и процесс кристаллизации из аморфного вещества можно считать завершенным. Наблюдается резкий рост доли кристаллических фаз (рис. 5а, 5б). Размер кристаллитов ZrxTi(1 –x)O4 не меняется, что также свидетельствует о преобладании процессов зародышеобразования над процессами роста кристаллов. Средний размер кристаллитов m-ZrO2(тв.р.) составляет 12 ± 5 нм.
Увеличение продолжительности изотермической выдержки до 48 ч не приводит к появлению пиков новых фаз на дифрактограммах (рис. 5а). Согласно данным РФА, доля ZrxTi(1 –x)O4 уменьшается, так же как и средний размер его кристаллитов, а доля простых оксидов растет (рис. 5б). Средний размер кристаллитов a-TiO2(тв.р.) увеличивается, а средний размер кристаллитов m-ZrO2(тв.р.) не изменяется.
Совокупность этих наблюдений позволяет предположить, что титан, находящийся в избытке и не вошедший в структуру двойного гидроксида, кристаллизуется в виде твердого раствора со структурой анатаза; двойной гидроксид, по-видимому, имеет структуру, близкую к высокотемпературной разупорядоченной фазе ZrxTi(1 –x)O4 со структурой α-PbO2, и при длительной изотермической выдержке в гидротермальных условиях кристаллизуется в метастабильном состоянии в виде этой фазы, которая, однако, при увеличении продолжительности изотермической выдержки не подвергается упорядочению и переходу в более стабильную модификацию, а претерпевает постепенный распад на твердые растворы на основе простых оксидов.
ЗАКЛЮЧЕНИЕ
Проведено подробное исследование процессов фазообразования в системе ZrO2–TiO2–H2O в гидротермальных изотермических условиях. Показано взаимное влияние компонентов системы на формирование нанокристаллических простых оксидов титана (структуры анатаза) и циркония (моноклинной и тетрагональной структуры) и твердых растворов на их основе. Установлено формирование нанокристаллической высокотемпературной разупорядоченной фазы переменного состава ZrxTi(1 –x)O4 со структурой скрутинита (α-PbO2) и ее ограниченная устойчивость в рассматриваемых гидротермальных условиях. Показано, что распад фазы ZrxTi(1 –x)O4 происходит до твердых растворов на основе диоксида титана со структурой анатаза и диоксида циркония с моноклинной структурой, что соответствует равновесному составу низкотемпературной области актуальной фазовой диаграммы системы ZrO2–TiO2.
Список литературы
Kumar N., Irfan G. // Mater. Today Proc. 2020. V. 38. P. 2649. https://doi.org/10.1016/j.matpr.2020.08.240
Reddy B.M., Khan A. // Catal. Rev. Sci. Eng. 2005. V. 47. № 2. P. 257. https://doi.org/10.1081/CR-200057488
Salahinejad E., Hadianfard M.J., Macdonald D.D. et al. // J. Biomed. Nanotechnol. 2013. V. 9. № 8. P. 1327. https://doi.org/10.1166/jbn.2013.1619
Liu C., Li X., Xu C. et al. // Ceram. Int. 2020. V. 46. № 13. P. 20943. https://doi.org/10.1016/j.ceramint.2020.05.152
Zaleska A. // Recent Patents Eng. 2008. V. 2. № 3. P. 157. https://doi.org/10.2174/187221208786306289
Daghrir R., Drogui P., Robert D. // Ind. Eng. Chem. Res. 2013. V. 52. № 10. P. 3581. https://doi.org/10.1021/ie303468t
Chevalier J., Gremillard L. // J. Eur. Ceram. Soc. 2009. V. 29. № 7. P. 1245. https://doi.org/10.1016/j.jeurceramsoc.2008.08.025
Lebedev V.A., Kozlov D.A., Kolesnik I.V. et al. // Appl. Catal. B: Environ. 2016. V. 195. P. 39. https://doi.org/10.1016/j.apcatb.2016.05.010
Yang Y., Cui Y.-Hang, Miao L.-Lu et al. // Powder Technol. 2018. V. 338. P. 304. https://doi.org/10.1016/j.powtec.2018.07.038
Mozafari M., Salahinejad E., Shabafrooz V. et al. // Int. J. Nanomedicine. 2013. V. 8. P. 1665. https://doi.org/10.2147/IJN.S42659
Grishchenko D.N., Golub A.V., Kuryavyi V.G. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 10. P. 1592. https://doi.org/10.1134/S0036023621100065
Zdravkov A.V., Kudryashova Y.S., Abiev R.S. // Russ. J. Gen. Chem. 2020. V. 90. № 9. P. 1677. https://doi.org/10.1134/S1070363220090145
Newnham R.E. // J. Am. Ceram. Soc. 1967. V. 50. № 4. P. 216. https://doi.org/10.1111/j.1151-2916.1967.tb15085.x
Sham E.L., Aranda M.A.G., Farfan-Torres E.M. et al. // J. Solid State Chem. 1998. V. 139. № 2. P. 225. https://doi.org/10.1006/jssc.1998.7833
Brown F.H., Duwez P. // J. Am. Ceram. Soc. 1954. V. 37. № 3. P. 129.
Coughanour W., Roth R.S., Deprosse V.A. // J. Res. Natl. Bur. Stand. 1954. V. 52. № 1. P. 37.
McHale A.E., Roth R.S. // J. Am. Ceram. Soc. 1986. V. 69. № 11. P. 827.
Bordet P., McHale A., Santoro A. et al. // J. Solid State Chem. 1986. V. 64. № 1. P. 30. https://doi.org/10.1016/0022-4596(86)90119-2
Troitzsch U., Christy A.G., Ellis D.J. // J. Am. Ceram. Soc. 2005. V. 87. № 11. P. 2058. https://doi.org/10.1111/j.1151-2916.2004.tb06360.x
Vittayakorn N. // J. Ceram. Process. Res. 2006. V. 7. № 4. P. 288.
Azough F., Freer R., Wang C.L. et al. // J. Mater. Sci. 1996. V. 31. № 10. P. 2539. https://doi.org/10.1007/BF00687279
Pol S.V., Pol V.G., Gedanken A. et al. // J. Phys. Chem. C. 2007. V. 111. № 6. P. 2484. https://doi.org/10.1021/jp067109z
Troitzsch U., Ellis D.J. // J. Mater. Sci. 2005. V. 40. № 17. P. 4571. https://doi.org/10.1007/s10853-005-1116-7
Troitzsch U., Christy A.G., Ellis D.J. // Phys. Chem. Miner. 2005. V. 32. № 7. P. 504. https://doi.org/10.1007/s00269-005-0027-0
Christoffersen R., Davies P.K. // J. Am. Ceram. Soc. 1992. V. 75. № 3. P. 563. https://doi.org/10.1111/j.1151-2916.1992.tb07843.x
Oanh L.M., Do D.B., Hung N.M. et al. // J. Electron. Mater. 2016. V. 45. № 5. P. 2553. https://doi.org/10.1007/s11664-016-4412-x
Бачина А.К., Альмяшева О.В., Данилович Д.П. и др. // Журн. физ. химии. 2021. V. 95. № 8. P. 1148. https://doi.org/10.31857/S0044453721080057
Troitzsch U., Christy A.G., Ellis D.J. // J. Solid State Chem. 2007. V. 180. № 10. P. 2885. https://doi.org/10.1016/j.jssc.2007.08.020
Gajović A., Šantić A., Djerdj I. et al. // J. Alloys Compd. 2009. V. 479. № 1–2. P. 525. https://doi.org/10.1016/j.jallcom.2008.12.123
López-López E., Baudín C., Moreno R. et al. // J. Eur. Ceram. Soc. 2012. V. 32. № 2. P. 299. https://doi.org/10.1016/j.jeurceramsoc.2011.08.004
Byrappa K., Adschiri T. // Prog. Cryst. Growth Charact. Mater. 2007. V. 53. № 2. P. 117. https://doi.org/10.1016/j.pcrysgrow.2007.04.001
Коленько Ю.В., Бурухин А.А., Чурагулов Б.Р. и др. // Журн. неорган. химии. 2002. V. 47. № 11. P. 1755.
Almjasheva O.V. // Nanosyst. Phys., Chem. Math. 2016. V. 7. № 6. P. 1031. https://doi.org/10.17586/2220-8054-2016-7-6-1031-1049
Denkewicz R.P., TenHuisen K.S., Adair J.H. // J. Mater. Res. 1990. V. 5. № 11. P. 2698. https://doi.org/10.1557/JMR.1990.2698
Шариков Ф.Ю., Альмяшева О.В., Гусаров В.В. // Журн. неорган. химии. 2006. V. 51. № 10. P. 1568.
Пожидаева О.В., Корыткова Э.Н., Романов Д.П. и др. // Журн. орг. химии. 2002. V. 72. № 6. P. 910.
Шевченко А.В., Лопато Л.М., Маистер И.М. и др. // Журн. неорган. химии. 1980. V. 25. P. 1379.
Nishizawa H., Aoki Y. // J. Solid State Chem. 1985. V. 56. № 2. P. 158. https://doi.org/10.1016/0022-4596(85)90052-0
Сухарев Ю.И., Авдин В.В., Лымарь А.А. и др. // Журн. структур. химии. 2006. V. 47. № 1. P. 152.
Hu M.Z.C., Zielke J.T., Lin J.S. et al. // J. Mater. Res. 1999. V. 14. № 1. P. 103. https://doi.org/10.1557/JMR.1999.0017
Bachina A.K., Almjasheva O.V., Popkov V.I. et al. // J. Cryst. Growth. 2021. V. 576. P. 126371. https://doi.org/10.1016/j.jcrysgro.2021.126371
Vasilevskaya A., Almjasheva O.V., Gusarov V.V. // J. Nanoparticle Res. 2016. V. 18. № 7. https://doi.org/10.1007/s11051-016-3494-y
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии