Журнал неорганической химии, 2022, T. 67, № 5, стр. 620-628
Твердофазные равновесия в системе SnTe–Sb2Te3–Te и термодинамические свойства теллуридов олова–сурьмы
А. Э. Сеидзаде a, Э. Н. Оруджлу a, Д. М. Бабанлы b, С. З. Имамалиева a, М. Б. Бабанлы a, *
a Институт катализа и неорганической химии НАН Азербайджана
Az-1143 Баку, пр-т Г. Джавида, 113, Азербайджан
b Азербайджанский государственный университет нефти и промышленности,
Азербайджано-французский университет
Az-1010 Баку, пр-т Азадлыг, 16/21, Азербайджан
* E-mail: babanlymb@gmail.com
Поступила в редакцию 06.10.2021
После доработки 08.10.2021
Принята к публикации 17.10.2021
- EDN: LPCSFK
- DOI: 10.31857/S0044457X22050142
Аннотация
Методом РФА и измерением ЭДС обратимых концентрационных цепей типа (–) SnTe(тв)|жидкий электролит, Sn2+|(Sn–Sb–Te) (тв) (+) в интервале температур 300–400 K исследована система SnTe–Sb2Te3–Te. Построена диаграмма твердофазных равновесий. Установлено, что в системе все теллуридные фазы – тройные соединения SnSb2Te4 и SnSb4Te7, а также твердые растворы на основе SnTe (α) и Sb2Te3 (β) – образуют конноды с элементарным теллуром. Из данных измерений ЭДС получены уравнения температурных зависимостей ЭДС в гетерогенных фазовых областях β + Те, β + + SnSb4Te7 + Те, SnSb4Te7 + SnSb2Te4 + Те, α + SnSb2Te4 + Те и α + Те, из которых вычислены парциальные термодинамические функции SnTe в сплавах. Комбинированием полученных данных с термодинамическими функциями SnTe вычислены парциальные молярные функции олова в сплавах. На основании этих данных и диаграммы твердофазных равновесий системы SnTe–Sb2Te3–Te с использованием соответствующих термодинамических функций Sb2Te3 рассчитаны стандартные свободная энергия Гиббса образования и энтальпия образования, а также стандартная энтропия соединений SnSb2Te4, SnSb4Te7 и твердых растворов на основе Sb2Te3 и SnTe.
ВВЕДЕНИЕ
Тройные соединения систем AIVTe–${\text{B}}_{{\text{2}}}^{{\text{V}}}{\text{T}}{{{\text{e}}}_{3}}$ (AIV = Ge, Sn, Pb; BV = Sb, Bi), кристаллизующиеся в тетрадимитоподобной слоистой структуре, уже многие годы интенсивно изучаются как перспективные термоэлектрики с низкой теплопроводностью [1–7] и материалы с фазовым переходом [8–10]. Благодаря сложным многослойным структурам они имеют более низкие значения решеточной составляющей теплопроводности по сравнению с исходными бинарными соединениями [1, 2]. Согласно недавним исследованиям, указанные соединения также обладают свойствами трехмерного топологического изолятора и весьма перспективны для использования в разнообразных областях высоких технологий, начиная со спинтроники и квантовых вычислений и заканчивая медициной и системами безопасности [11–19].
Разработка и дизайн новых многокомпонентных материалов базируются на комплексах взаимосогласованных данных по фазовым равновесиям и термодинамическим функциям соответствующих систем [20, 21]. Один из эффективных путей получения подобных комплексов данных заключается в использовании в исследованиях метода электродвижущих сил (ЭДС). Различные модификации метода ЭДС с жидкими [22–29] и твердыми [22, 23, 30–32] электролитами успешно применяются при подобных комплексных исследованиях халькогенидных систем.
Фазовые равновесия в системе Sn–Sb–Te изучены в работах [33–36]. Показано, что квазибинарный разрез SnTe–Sb2Te3 этой системы характеризуется образованием одного промежуточного соединения состава SnSb2Te4. По данным [34], оно плавится инконгруэнтно по перитектической реакции при 879 K (по данным [36] – при 876 K). В работе [37] были определены термодинамические функции этого соединения методом ЭДС.
В работе [38] нами представлена новая уточненная фазовая диаграмма системы SnTe–Sb2Te3, согласно которой в ней, кроме SnSb2Te4, существует также соединение состава SnSb4Te7. Оба соединения плавятся инконгруэнтно по перитектическим реакциям при 868 и 866 K соответственно. Индицированием порошковых дифрактограмм установлено, что SnSb2Te4 и SnSb4Te7 имеют тетрадимитоподобную слоистую решетку. В системе также выявлены широкие области твердых растворов на основе исходных соединений SnTe (10 мол. %) и Sb2Te3 (20 мол. %).
Авторы [20] на основании анализа литературных данных [39–41] по фазовым равновесиям в бинарных и тройных системах, образующих тетрадимитоподобные слоистые фазы, отметили сложность получения равновесных образцов традиционным методом сплавления даже после термического отжига в течение нескольких месяцев. Для получения равновесных сплавов подобных систем в работах [26, 42, 43] был применен новый подход, сущность которого заключается в термическом отжиге образцов, полученных путем закалки от жидкого состояния. Это позволило уточнить фазовые диаграммы некоторых бинарных [26, 42] и тройных [38, 43] систем и выявить новые промежуточные соединения, ранее не нашедшие отражение на фазовых диаграммах.
В данной работе представлены результаты комплексного исследования твердофазных равновесий и термодинамических свойств системы SnTe–Sb2Te3–Te с использованием вышеуказанного способа приготовления сплавов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При планировании и проведении экспериментов особое внимание было уделено получению равновесных образцов SnTe–Sb2Te3–Te с учетом новых данных [38] по фазовым равновесиям в квазибинарной системе SnTe–Sb2Te3. Сплавы были получены совместным сплавлением элементарных олова (CAS № 7440-31-5), сурьмы (CAS № 7647-18-9) и теллура (CAS № 13494-80-9) высокой степени чистоты фирмы Alfa Aesar в вакуумированных кварцевых ампулах. После сплавления расплавы закаляли от 1000 K вбрасыванием ампул в ледяную воду, а затем подвергали ступенчатому отжигу при 650 (1000 ч) и 400 K (100 ч).
По указанной методике были приготовлены сплавы различного состава по разрезу SnTe–Sb2Te3 с добавлением 5 или 10 ат. % избытка теллура, которые были исследованы методом РФА (дифрактометр Bruker D8, CuKα-излучение) и измерением ЭДС концентрационных цепей типа
(1)
$\left( {\text{--}} \right){\text{SnТе }}\left( {{\text{тв}}} \right){\text{|жидкий электролит,S}}{{{\text{n}}}^{{{\text{2 + }}}}}{\text{|(SnTe--S}}{{{\text{b}}}_{{\text{2}}}}{\text{T}}{{{\text{e}}}_{{\text{3}}}}{\text{--Te) }}\left( {\text{ + }} \right){\text{.}}$Концентрационные цепи относительно оловянного электрода оказались, как и в других подобных системах [23], необратимыми.
Для приготовления электродов цепей типа (1) отожженные сплавы системы по разрезу SnTe–Sb2Te3 с 5%-ным избытком теллура (правые электроды) и SnTe (электрод сравнения) стирали в порошок и запрессовывали на молибденовые токоотводы в виде таблеток диаметром ∼6 мм и толщиной 2–3 мм.
В качестве электролита использовали глицериновый раствор KCl (CAS № 7447-40-7) и SnCl2 (CAS № 7646-78-8). Учитывая недопустимость присутствия влаги и кислорода в электролите, глицерин (CAS № 56-81-5) тщательно обезвоживали и дегазировали откачкой при температуре ~400 K, использовали безводные KCl и SnCl2.
Методики сборки электрохимической ячейки и измерений ЭДС были аналогичны описанным в [22, 23, 27]. Измерения ЭДС проводили в электрохимической ячейке, заполненной азотом, с помощью цифрового мультиметра Keithley 2100 6 1/2 digital в интервале температур 300–400 K.
Первые равновесные значения ЭДС цепей были получены после выдерживания ячейки при ∼400 K в течение 40–60 ч, последующие − через каждые 3–4 ч после установления определенной температуры. Равновесными считали те значения ЭДС, которые при неоднократном измерении при данной температуре отличались друг от друга не более чем на 0.2 мВ независимо от направления изменения температуры.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
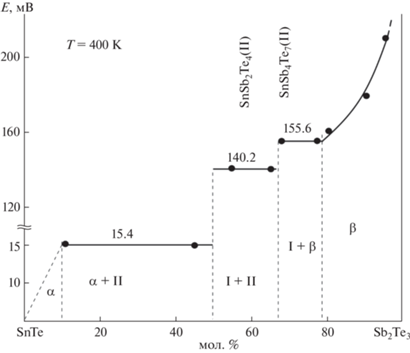
По результатам РФА отожженных сплавов построена диаграмма твердофазных равновесий системы SnTe–Sb2Te3–Те (рис. 1) при 400 K, отражающая характер фазовых равновесий в температурном интервале измерений ЭДС цепей типа (1). Нами установлено, что в данной системе все теллуридные фазы – тройные соединения SnSb2Te4 и SnSb4Te7, а также твердые растворы на основе SnTe (α) и Sb2Te3 (β) – образуют конноды с элементарным теллуром. Это приводит к формированию на фазовой диаграмме следующих двух- и трехфазных областей: β + Те, β + SnSb4Te7 + Те, SnSb4Te7 + SnSb2Te4 + Те, α + SnSb2Te4 + Те и α + + Те. В качестве примера на рис. 2 представлены порошковые дифрактограммы некоторых выборочных сплавов системы SnTe–Sb2Te3–Те. Видно, что их фазовые составы находятся в полном соответствии с рис. 1.
Рис. 1.
Диаграмма твердофазных равновесий системы SnTe–Sb2Te3–Те. Треугольники – сплавы – правые электроды цепей типа (1), квадраты – образцы, порошковые дифрактограммы которых приведены на рис. 2.
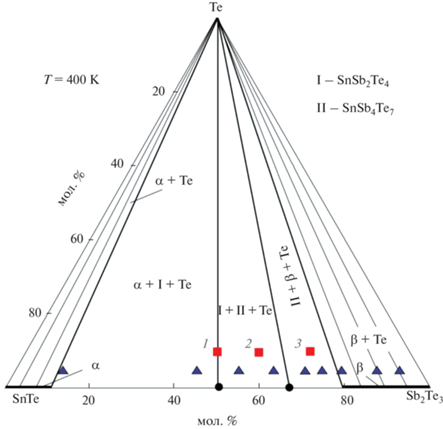
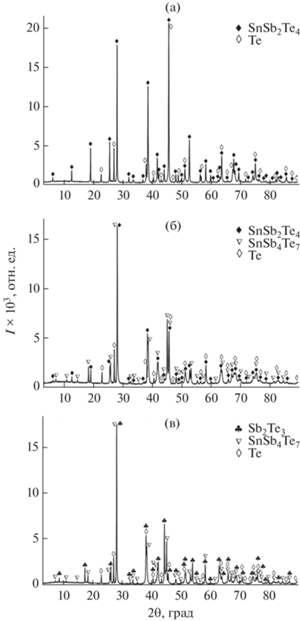
Рис. 2.
Порошковые дифрактограммы сплавов системы SnTe–Sb2Te3–Те, указанных на рис. 1: а – образец 1; б – образец 2; в – образец 3.
Результаты измерений ЭДС цепей типа (1) хорошо воспроизводятся и находятся в соответствии с фазовой диаграммой системы SnTe–Sb2Te3–Те. На рис. 3 представлен график зависимости ЭДС от состава при 400 K по разрезу SnTe–Sb2Te3. Из рисунка видно, что изотерма ЭДС состоит из трех горизонталей со значениями 15.4, 140.2 и 155.6 мВ, которые скачкообразно переходят друг в друга при стехиометрических составах соединений SnSb2Te4 и SnSb4Te7. В области составов >80 мол. % Sb2Te3 ЭДС является непрерывной функцией состава, что подтверждает данные [38] об образовании ∼20 мол. % твердых растворов на основе Sb2Te3. Кроме того, отличные от нуля значения ЭДС для сплавов состава 12 и 45 мол. % SnTe подтверждают образование ограниченных (∼10 мол. %) твердых растворов на основе SnTe.
На рис. 4 представлены температурные зависимости ЭДС цепей типа (1) для сплавов из различных фазовых областей системы SnTe–Sb2Te3–Те. Учитывая линейность этих зависимостей, они были обработаны с помощью компьютерной программы Excel методом наименьших квадратов и представлены, согласно рекомендации [22, 23], в виде
(2)
$E = a + bT \pm t{{\left[ {\left( {{{S_{E}^{2}} \mathord{\left/ {\vphantom {{S_{E}^{2}} n}} \right. \kern-0em} n}} \right) + S_{b}^{2}{{{(T - \bar {T})}}^{2}}} \right]}^{{1/2}}}.$Рис. 4.
Температурные зависимости ЭДС цепей типа (1) для сплавов системы SnTe–Sb2Te3–Те. Фазовые области: 1 – β(Sn0.05Sb1.9Te2.9) + Te; 2 – β(Sn0.1Sb1.9Te2.8) + Te; 3 – β(Sn0.2Sb1.9Te2.6) + Te; 4 – SnSb4Te7 + β(Sn0.05Sb1.6Te2.6) + Te; 5 – SnSb2Te4 + SnSb4Te7 + Те; 6 – α(Sn0.9Sb0.2Te1.2) + SnSb2Te4 + Te.
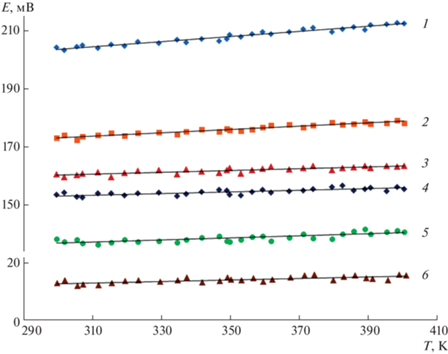
В уравнении (2) n – число пар значений E (мВ) и T (K); SE и Sb – дисперсии отдельных измерений ЭДС и коэффициента b соответственно; $\bar {T}$ – средняя температура; t – критерий Стьюдента, который при n ≥ 20 и доверительном уровне 95% имеет значения ≤ 2.
В табл. S1 приведен ход обработки экспериментальных данных пар Т и Е для сплавов из области SnSb4Te7 + SnSb2Te4 + Те, а в табл. 1 – полученные уравнения типа (2).
Из данных табл. 2 по термодинамическим соотношениям
(5)
$\Delta {{\bar {H}}_{i}} = - zF\left[ {E - T{{{\left( {\frac{{\partial E}}{{\partial T}}} \right)}}_{P}}} \right] = - zFa$Таблица 1.
Температурные зависимости ЭДС цепей типа (1) для сплавов системы SnTe–Sb2Te3–Те в интервале температур 300–400 K
| Фазовая область на рис. 1 | $E = a + bT \pm 2{{\tilde {S}}_{E}}\left( t \right)$ |
|---|---|
| β(Sn0.05Sb1.9Te2.9) + Te | $177.16 + 0.0881T \pm 2{{\left[ {\left( {{{0.35} \mathord{\left/ {\vphantom {{0.35} {30}}} \right. \kern-0em} {30}}} \right) + 1.2 \times {{{10}}^{{ - 5}}}{{{\left( {T - 351.4} \right)}}^{2}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ |
| β(Sn0.1Sb1.9Te2.8) + Te | $156.25 + 0.0561T \pm 2{{\left[ {\left( {{{0.28} \mathord{\left/ {\vphantom {{0.28} {30}}} \right. \kern-0em} {30}}} \right) + 9.6 \times {{{10}}^{{ - 6}}}{{{\left( {T - 351.4} \right)}}^{2}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ |
| β(Sn0.2Sb1.9Te2.6) + Te | $150.46 + 0.0320T \pm 2{{\left[ {\left( {{{0.36} \mathord{\left/ {\vphantom {{0.36} {30}}} \right. \kern-0em} {30}}} \right) + 1.2 \times {{{10}}^{{ - 5}}}{{{\left( {T - 351.4} \right)}}^{2}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ |
| SnSb4Te7 + β(Sn0.05Sb1.6Te2.6) + Te | $144.98 + 0.0265T \pm 2{{\left[ {\left( {{{0.39} \mathord{\left/ {\vphantom {{0.39} {30}}} \right. \kern-0em} {30}}} \right) + 1.3 \times {{{10}}^{{ - 5}}}{{{\left( {T - 351.4} \right)}}^{2}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ |
| SnSb2Te4 + SnSb4Te7 + Te | $125.32 + 0.037T \pm 2{{\left[ {\left( {{{0.68} \mathord{\left/ {\vphantom {{0.68} {30}}} \right. \kern-0em} {30}}} \right) + 2.4 \times {{{10}}^{{ - 5}}}{{{\left( {T - 351.4} \right)}}^{2}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ |
| α(Sn0.9Sb0.2Te1.2) + SnSb2Te4 + Te | $5.20 + 0.0256T \pm 2{{\left[ {\left( {{{0.46} \mathord{\left/ {\vphantom {{0.46} {30}}} \right. \kern-0em} {30}}} \right) + 1.6 \times {{{10}}^{{ - 5}}}{{{\left( {T - 351.4} \right)}}^{2}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ |
Таблица 2.
Парциальные термодинамические функции SnTe в сплавах Sn–Sb–Te при 298 K
| Фазовая область на рис. 1 | $ - {{\overline {\Delta G} }_{{{\text{SnTe}}}}}$ | $ - {{\overline {\Delta H} }_{{{\text{SnTe}}}}}$ | ${{\overline {\Delta S} }_{{{\text{SnTe}}}}}$, Дж/(K моль) |
|---|---|---|---|
| кДж/моль | |||
| β(Sn0.05Sb1.9Te2.9) + Te | 39.26 ± 0.08 | 34.19 ± 0.48 | 17.01 ± 1.35 |
| β(Sn0.1Sb1.9Te2.8) + Te | 33.38 ± 0.07 | 30.15 ± 0.42 | 10.82 ± 1.19 |
| β(Sn0.2Sb1.9Te2.6) + Te | 30.88 ± 0.08 | 29.04 ± 0.48 | 6.18 ± 1.36 |
| SnSb4Te7 + β(Sn0.05Sb1.6Te2.6) + Te | 29.51 ± 0.09 | 27.98 ± 0.50 | 5.11 ± 1.41 |
| SnSb2Te4 + SnSb4Te7 + Те | 26.32 ± 0.12 | 24.18 ± 0.66 | 7.16 ± 1.87 |
| α(Sn0.9Sb0.2Te1.2) + SnSb2Te4 + Tе | 2.48 ± 0.09 | 1.00 ± 0.54 | 4.95 ± 1.54 |
Эти величины являются разностью парциальных молярных величин олова в SnTe $(\overline {\Delta Z} {\text{\;}}_{{{\text{Sn}}}}^{{\text{'}}})$ и сплавах системы SnTe–Sb2Te3–Те $(\overline {\Delta Z} {\text{\;}}_{{{\text{Sn}}}}^{{\text{'}}})$:
(6)
${{\overline {\Delta Z} }_{{{\text{SnTe}}}}} = {{\overline {\Delta Z} }_{{{\text{Sn}}}}}{\text{\;}} - \overline {\Delta Z} {\text{\;}}_{{{\text{Sn}}}}^{{\text{'}}}.$Учитывая, что SnTe является единственным соединением в системе Sn–Te [44], для этого соединения справедливо равенство [22]:
(7)
$\overline {\Delta Z} {\text{\;}}_{{{\text{Sn}}}}^{{\text{'}}}{\text{\; = \;}}{{\Delta }_{f}}{{{\text{Z}}}^{{\text{0}}}}{\text{(SnTe)}}{\text{.}}$Учитывая выражение (7) в (6), получим
(8)
${{\overline {\Delta Z} }_{{{\text{Sn}}}}} = {{\overline {\Delta Z} }_{{{\text{SnTe}}}}}~\,\, + ~\,\,{{\Delta }_{f}}{{{\text{Z}}}^{{\text{0}}}}{\text{(SnTe)}}{\text{.}}$В табл. 3 представлены значения парциальных молярных функций олова в сплавах, рассчитанные по уравнению (8).
Таблица 3.
Парциальные термодинамические функции Sn в сплавах Sn–Sb–Te при 298 K
| Фазовая область на рис. 1 | $ - \overline {{{\Delta }}{{G}_{{{\text{Sn}}}}}} $ | $ - \overline {{{\Delta }}{{H}_{{{\text{Sn}}}}}} $ | $ - \overline {{{\Delta }}{{S}_{{{\text{Sn}}}}}} $ |
|---|---|---|---|
| кДж/моль | Дж/(моль K) | ||
| β(Sn0.05Sb1.9Te2.9) + Te | 100.06 ± 1.08 | 94.89 ± 1.28 | 17.3 ± 3.5 |
| β(Sn0.1Sb1.9Te2.8) + Te | 4.18 ± 1.07 | 90.85 ± 1.22 | 11.2 ± 3.4 |
| β(Sn0.2Sb1.9Te2.6) + Te | 91.68 ± 1.08 | 89.74 ± 1.28 | 6.5 ± 3.5 |
| SnSb4Te7 + β(Sn0.05Sb1.6Te2.6) + Te | 90.31 ± 1.09 | 88.68 ± 1.30 | 5.5 ± 3.5 |
| SnSb2Te4 + SnSb4Te7 + Те | 87.12 ± 1.12 | 84.88 ± 1.46 | 7.5 ± 3.7 |
| α(Sn0.9Sb0.2Te1.2) + SnSb2Te4 + Te | 63.28 ± 1.09 | 61.70 ± 1.34 | 5.3 ± 3.5 |
Расчет стандартных термодинамических функций образования β-твердых растворов проводили графическим интегрированием уравнения Гиббса–Дюгема:
(9)
$\begin{gathered} {{\Delta }_{f}}{{Z}^{0}}\left( {{{\beta - фаза}}} \right) = \left( {1 - x} \right)\int\limits_0^x {\frac{{\overline {\Delta {{Z}_{{{\text{SnTe}}}}}} }}{{{{{(1 - x)}}^{2}}}}} {\kern 1pt} dx + \\ + \,\,\left( {1 - x} \right){{\Delta }_{f}}{{Z}^{0}}\left( {{\text{S}}{{{\text{b}}}_{2}}{\text{T}}{{{\text{e}}}_{3}}} \right) + x{{\Delta }_{f}}{{Z}^{0}}\left( {{\text{SnTe}}} \right) \\ \end{gathered} $Учитывая постоянство составов сосуществующих фаз в трехфазных областях β + SnSb4Te7 + Те, SnSb4Te7 + SnSb2Te4 + Те и α + SnSb2Te4 + Те, стандартные интегральные термодинамические свойства соединений SnSb4Te7, SnSb2Te4 и предельного состава α-твердых растворов (Sn0.9Sb0.2Te1.2) рассчитывали методом потенциалобразующих реакций [22, 23]. Согласно рис. 1, парциальные молярные функции олова в вышеуказанных трехфазных областях являются термодинамическими функциями следующих виртуальных реакций в цепях типа (1):
(10)
${\text{Sn}} + 5{\text{S}}{{{\text{n}}}_{{0.2}}}{\text{S}}{{{\text{b}}}_{{{\text{1}}{\text{.6}}}}}{\text{T}}{{{\text{e}}}_{{2.6}}} + {\text{Te}} = 2{\text{SnS}}{{{\text{b}}}_{{\text{4}}}}{\text{T}}{{{\text{e}}}_{{\text{7}}}},$(11)
${\text{Sn}} + {\text{SnS}}{{{\text{b}}}_{{\text{4}}}}{\text{T}}{{{\text{e}}}_{7}} + {\text{Te}} = 2{\text{SnS}}{{{\text{b}}}_{{\text{2}}}}{\text{T}}{{{\text{e}}}_{4}},$(12)
${\text{Sn}} + 0.125{\text{SnS}}{{{\text{b}}}_{{\text{2}}}}{\text{T}}{{{\text{e}}}_{4}} + {\text{Te}} = 1.25{\text{S}}{{{\text{n}}}_{{{\text{0}}{\text{.9}}}}}{\text{S}}{{{\text{b}}}_{{{\text{0}}{\text{.2}}}}}{\text{T}}{{{\text{e}}}_{{1.2}}}.$Согласно этим реакциям, стандартные термодинамические функции образования тройных фаз были вычислены по соотношениям:
(13)
$\begin{gathered} {{\Delta }_{f}}{{Z}^{0}}\left( {{\text{SnS}}{{{\text{b}}}_{4}}{\text{T}}{{{\text{e}}}_{7}}} \right) = 0.5{\kern 1pt} {{\overline {\Delta Z} }_{{{\text{Sn}}}}} + \\ + \,\,2.5{{\Delta }_{f}}{{Z}^{0}}\left( {{\text{S}}{{{\text{n}}}_{{0.2}}}{\text{S}}{{{\text{b}}}_{{1.6}}}{\text{T}}{{{\text{e}}}_{{2.6}}}} \right), \\ \end{gathered} $(14)
$\begin{gathered} {{\Delta }_{f}}{{Z}^{0}}\left( {S{\text{nS}}{{{\text{b}}}_{2}}{\text{T}}{{{\text{e}}}_{4}}} \right) = \\ = 0.5{{\overline {\Delta Z} }_{{{\text{Sn}}}}} + 0.5{{\Delta }_{f}}{{Z}^{0}}\left( {{\text{SnS}}{{{\text{b}}}_{4}}{\text{T}}{{{\text{e}}}_{7}}} \right), \\ \end{gathered} $(15)
$\begin{gathered} {{\Delta }_{f}}{{Z}^{0}}\left( {{\text{S}}{{{\text{n}}}_{{0.9}}}{\text{S}}{{{\text{b}}}_{{0.2}}}{\text{T}}{{{\text{e}}}_{{1.2}}}} \right) = \\ = 0.8{\kern 1pt} {{\overline {\Delta Z} }_{{{\text{Sn}}}}} + 0.1{{\Delta }_{f}}{{Z}^{0}}\left( {{\text{SnS}}{{{\text{b}}}_{2}}{\text{T}}{{{\text{e}}}_{4}}} \right) \\ \end{gathered} $(16)
$\begin{gathered} {{S}^{0}}\left( {{\text{SnS}}{{{\text{b}}}_{4}}{\text{T}}{{{\text{e}}}_{7}}} \right) = 0.5{\kern 1pt} {{\overline {\Delta S} }_{{{\text{Sn}}}}} + 0.5{{S}^{0}}\left( {{\text{Sn}}} \right) + \\ + \,\,0.5{{S}^{0}}\left( {{\text{Te}}} \right) + 2.5{{S}^{0}}\left( {{\text{S}}{{{\text{n}}}_{{0.2}}}{\text{S}}{{{\text{b}}}_{{1.6}}}{\text{T}}{{{\text{e}}}_{{2.6}}}} \right), \\ \end{gathered} $(17)
$\begin{gathered} {{S}^{0}}\left( {{\text{SnS}}{{{\text{b}}}_{2}}{\text{T}}{{{\text{e}}}_{4}}} \right) = 0.5{\kern 1pt} {{\overline {\Delta S} }_{{{\text{Sn}}}}} + 0.5{{S}^{0}}\left( {{\text{Sn}}} \right) + \\ + \,\,0.5{{S}^{0}}\left( {{\text{Te}}} \right) + 0.5{{S}^{0}}\left( {{\text{SnS}}{{{\text{b}}}_{4}}{\text{T}}{{{\text{e}}}_{7}}} \right), \\ \end{gathered} $(18)
$\begin{gathered} {{S}^{0}}\left( {{\text{S}}{{{\text{n}}}_{{0.9}}}{\text{S}}{{{\text{b}}}_{{0.2}}}{\text{T}}{{{\text{e}}}_{{1.2}}}} \right) = 0.8{{\overline {{\kern 1pt} \Delta S} }_{{{\text{Sn}}}}} + 0.8{{S}^{0}}\left( {{\text{Sn}}} \right) + \\ + \,\,0.8{{S}^{0}}\left( {{\text{Te}}} \right) + 0.1{{S}^{0}}\left( {{\text{SnS}}{{{\text{b}}}_{2}}{\text{T}}{{{\text{e}}}_{4}}} \right). \\ \end{gathered} $В расчетах использовали значения стандартных энтропий белого олова (51.55 ± 0.21 Дж/(K моль)) и теллура (49.50 ± 0.21 Дж/(K моль)), приведенные в [45], а также литературные данные по стандартным интегральным термодинамическим функциям SnTe и Sb2Te3 (табл. 4). Эти данные являются самосогласованными и вполне надежными. Рекомендованные в фундаментальных справочниках [45–47] и обзорной работе [48] значения стандартных энтальпии образования и энтропии указанных соединений практически совпадают, а их стандартные свободные энергии Гиббса образования, рассчитанные нами из энтальпии и энтропии образования, очень близки к результатам [48–51], полученным методом ЭДС.
Таблица 4.
Стандартные интегральные термодинамические функции тройных соединений системы SnTe–Sb2Te3–Те
| Фаза | $ - {{{{\Delta }}}_{f}}G_{{}}^{0}\left( {298~\,\,{\text{K}}} \right)$ | $ - {{{{\Delta }}}_{f}}H_{{}}^{0}\left( {298\,\,~{\text{K}}} \right)$ | ${{{{\Delta }}}_{f}}S_{{}}^{0}\left( {298\,\,~{\text{K}}} \right)$ | $S_{{}}^{0}\left( {298~\,\,{\text{K}}} \right)$ |
|---|---|---|---|---|
| кДж/моль | Дж/(K моль) | |||
| SnTe [40–43] | 60.8 ± 1.0 | 60.7 ± 0.8 | – | 101.3 ± 4.2 |
| Sb2Te3 [40–43] | 58.6 ± 1.0 | 56.5 ± 0.8 | – | 246.4 ± 2.1 |
| (SnTe)0.05(Sb2Te3)0.95 | 60.7 ± 1.0 | 58.4 ± 0.9 | 7.7 ± 3.0 | 246.9 ± 5.2 |
| (SnTe)0.1(Sb2Te3)0.9 | 62.3 ± 1.1 | 59.9 ± 1.0 | 8.0 ± 3.0 | 239.9 ± 5.3 |
| (SnTe)0.2(Sb2Te3)0.8 | 65.2 ± 1.1 | 63.2 ± 1.1 | 6.7 ± 3.0 | 224.1 ± 5.4 |
| SnSb4Te7 | 208.2 ± 3.3 | 202.4 ± 3.4 | 19.5 ± 9.0 | 613 ± 16 |
| SnSb2Te4 | 147.7 ± 2.2 | 143.6 ± 2.5 | 13.8 ± 6.0 | 361.6 ± 11 |
| (SnTe)0.9(Sb2Te3)0.1 | 65.4 ± 1.1 | 63.7 ± 1.3 | 5.7 ± 2.5 | 121.1 ± 5.7 |
При расчетах по уравнениям (9), (13)–(18) погрешности находили методом накопления ошибок.
ЗАКЛЮЧЕНИЕ
Представлен новый комплекс данных по твердофазным равновесиям и термодинамическим свойствам системы SnTe–Sb2Te3–Te. Для получения равновесных сплавов исследуемой системы применена методика синтеза, сущность которой заключается в термическом отжиге образцов, полученных путем закалки от жидкого состояния.
Методом РФА установлено, что элементарный теллур образует коннодные связи со всеми фазами боковой системы SnTe–Sb2Te3. Из данных измерений ЭДС получены линейные уравнения температурных зависимостей ЭДС в фазовых областях β + Те, β + SnSb4Te7 + Те, SnSb4Te7 + + SnSb2Te4 + Те, α + SnSb2Te4 + Те исследуемой системы и рассчитаны парциальные термодинамические функции SnTe в сплавах. Комбинированием этих данных с соответствующими термодинамическими функциями SnTe рассчитаны парциальные молярные функции олова в сплавах. Стандартные термодинамические функции образования β-твердых растворов различных составов вычислены графическим интегрированием уравнения Гиббса–Дюгема по разрезу SnTe–Sb2Te3. Учитывая постоянство составов сосуществующих фаз в вышеуказанных трехфазных областях, стандартные интегральные термодинамические свойства соединений SnSb4Te7, SnSb2Te4 и предельного состава α-твердых растворов (Sn0.9Sb0.2Te1.2) рассчитали методом потенциалобразующих реакций.
Список литературы
Shevelkov A.V. // Russ. Chem. Rev. 2008. V. 77. № 1. P. 1. https://doi.org/10.1070/RC2008v077n01ABEH003746
Shelimova L.E., Karpinskii O.G., Konstantinov P.P. et al. // Inorg. Mater. 2004. V. 40. P. 451. https://doi.org/10.1023/B:INMA.0000027590.43038.a8
Zhang J., Yan Y., Xie H. et al. // Ceram. Int. 2019. V. 45. № 13. P. 16039. https://doi.org/10.1016/j.ceramint.2019.05.119
Hu P., Wei TR., Qiu P. et al. // ACS Appl. 2019. V. 11. № 37 P. 34046. https://doi.org/10.1021/acsami.9b12854
Lee C., Kim J.N., Tak J.-Y. et al. // AIP Adv. 2018. V. 8. № 11. P. 115213. https://doi.org/10.1063/1.5047823
Pan L., Li J., Berardan D. et al. // J. Solid State Chem. 2015. V. 225. P. 168. https://doi.org/10.1016/j.jssc.2014.12.016
Ma W., Record M.C., Tian J. et al. // Mater. 2021. V. 14. № 15. P. 4086. https://doi.org/10.3390/ma14154086
Guo P., Sarangan A.M., Agha I. // Appl. Sci. 2019. V. 9. № 3. P. 530. https://doi.org/10.3390/app9030530
Wuttig M., Raoux S. // Z. Anorg. Allg. Chem. 2012. V. 638. № 15. P. 2455. https://doi.org/10.1002/zaac.201200448
Tominaga J. // MRS Bull. 2018. V. 43. № 5. P. 347. https://doi.org/10.1557/mrs.2018.94
Sterzi A., Manzoni G., Crepaldi A. et al. // J. Electron. Spectrosc. Relat. Phenom. 2018. V. 225. P. 23. https://doi.org/10.1016/j.elspec.2018.03.004
Wu Z., Liang G., Pang W.K. et al. // Adv. Mater. 2020. V. 32. № 2. P. 1905632. https://doi.org/10.1002/adma.201905632
Mal P., Bera G., Turpu G.R. et al. // Phys. Chem. Chem. Phys. 2019. V. 21. № 27. P. 15030. https://doi.org/10.1002/adma.20190563210.1039/c9cp01494b
Hattori Y., Tokumoto Y., Kimoto K. et al. // Sci. Reports. 2020. V. 10. № 1. P. 7957. https://doi.org/10.1002/adma.20190563210.1038/s41598-020-64742-6
Amaladass E.P., Sharma S., Satya A.T. et al. // AIP Conf. Proc. 2018. V. 1951. P. 020015. https://doi.org/10.1063/1.5031723
Nurmamat M., Okamoto K., Zhu S. et al. // ACS Nano. 2020. V. 14. № 7. P. 9059. https://doi.org/10.1021/acsnano.0c04145
Shvets I.A., Klimovskikh I.I., Aliev Z.S. et al. // Phys. Rev. B. 2017. V. 96. P. 235124. https://doi.org/10.1103/PhysRevB.96.235124
Pacile D., Eremeev S.V., Caputo M., et al. // PSS (RRL). 2018. V. 12. № 12. P. 1800341. https://doi.org/10.1002/pssr.201800341
Vilaplana R., Sans J.A., Manjon F.J. et al. // J. Alloys Compd. 2016. V. 685. P. 962. https://doi.org/10.1016/j.jallcom.2016.06.170
Babanly M.B., Chulkov E.V., Aliev Z.S. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1703. https://doi.org/10.1134/S0036023617130034
Babanly M.B., Mashadiyeva L.F., Babanly D.M. et al. // Russ. J. Inorg. Chem. 2019. № 13. P. 1649. https://doi.org/10.1134/S0036023619130035
Морачевский А.Г., Воронин Г.Ф., Гейдерих В.А., Куценок И.Б. Электрохимические методы исследования в термодинамике металлических систем. 2003. М.: ИЦК Академкнига, 2003. 334 с.
Бабанлы М.Б., Юсибов Ю.А. Электрохимические методы в термодинамике неорганических систем. Баку: ЭЛМ, 2011. С. 306.
Vassiliev V.P., Lysenko V.A. // Electrochim. Acta. 2016. V. 222. P. 1770. https://doi.org/10.1016/j.electacta.2016.11.075
Vassiliev V., Gong W. // Electrochemical Cells – New Advances in Fundamental Researches and Applications / Ed. Yan Shao. IntechOpen, 2012. P. 71. https://doi.org/10.5772/39007
Hasanova G.S., Aghazade A.I., Imamaliyeva S.Z. et al. // JOM. 2021. V. 73. № 5. P. 1511. https://doi.org/10.1007/s11837-021-04621-1
Imamaliyeva S.Z., Musayeva S.S., Babanly D.M. et al. // Thermochim. Acta. 2019. V. 679. P. 178319. https://doi.org/10.1016/j.tca.2019.178319
Osadchii E.G., Korepanov Ya.I., Zhdanov N.N. // Instrum. Exper. Techniques. 2016. V. 59. № 2. P. 302. https://doi.org/10.1134/S0020441216010255
Ismailova E.N., Mashadieva L.F., Babanly D.M. et al. // Russ. J. Inorg. Chem. 2021. V. 61. № 1. P. 96. https://doi.org/10.31857/S0044457X21010049
Alverdiev I.J., Abbasova V.A., Yusibov Y.A. et al. // Russ. J. Electrochem. 2018. V. 54. № 2. P. 195. https://doi.org/10.7868/S0424857018020068
Moroz M., Tesfaye F., Demchenko P. et al. // Thermochim. Acta. 2021. V. 698. P. 178862. https://doi.org/10.1016/j.tca.2021.178862
Moroz M., Tesfaye F., Demchenko P. et al. // Energies. 2021. V. 14. № 5. P. 1314. https://doi.org/10.3390/en14051314
Шелимова Л.Е., Томашик В.Н., Грыцив В.И. Диаграммы состояния в полупроводниковом материаловедении. Справочник. М.: Наука, 1991. 368 с.
Elagina E.I., Abrikosov N.K. // Russ. J. Inorg. Chem. 1959. V. 4. P. 1638.
Hirai T., Takeda Y., Kurata K. // J. Less-Common Met. 1967. V. 13. P. 352. https://doi.org/10.1016/0022-5088(67)90143-9
Stegherr A. // Philips Res. Repts. 1969. V. 24. № 6. P. 72.
Guseinov F.N., Seidzade A.E., Yusibov Y.A., Babanly M.B. // Inorg Mater. 2017. V. 53. P. 354. https://doi.org/10.7868/S0002337X17040054
Seidzade A.E., Orujlu E.N., Doert T. et al. // J. Phase Equilib. Diffus. 2021. V. 42. P. 373. https://doi.org/10.1007/s11669-021-00888-8
Abrikosov N.K., Bankina V.F., Poretskaya L.V. et al. Semiconducting II–VI, IV–VI, and V–VI Compounds. Springer US, 1969. 252 p.
Abrikosov N.K., Bankina V.F. // Russ. J. Inorg. Chem. 1958. V. 3. P. 659.
Shelimova L.E., Karpinsky O.G., Kosyakov V.I. et al. // J. Struct. Chem. 2000. V. 41. P. 81. https://doi.org/10.1007/BF02684732
Hasanova G.S., Aghazade A.I., Babanly D.M. et al. // J. Therm. Anal. Calorim. 2021. https://doi.org/10.1007/s10973-021-10975-0
Alakbarova T.M., Meyer H.J., Orujlu E.N. et al. // Phase Transit. 2021. V. 94. № 5. P. 366. https://doi.org/10.1080/01411594.2021.1937625
Massalski T.B. Binary Alloys Phase Diagrams. ASM International. Materials park. Ohio, 1990. 3589 p.
База данных термических констант веществ / Под ред. Юнгмана В.С. 2006. http://www.chem.msu.su/cgi-bin/tkv.
Kubaschewski O., Alcock C.B., Spenser P.J. Materials Thermochemistry. 6th edition. Pergamon Press, 1993. 363 p.
Герасимов Я.И., Крестовников А.Н., Горбов С.И. Химическая термодинамика в цветной металлургии. Справочник. Т. 6. М.: Металлургия, 1974. 312 с.
Мелех Б.Т., Семенкович С.А., Андреев А.А. Термодинамические свойства соединений непереходных элементов IV и V групп с серой, селеном и теллуром // Термодинамические свойства интерметаллических фаз. Киев: Изд-во ИПМ, 1982. 73 с.
Gerasimov Ya.I., Nikol’skaya A.V. // Proc. Fourth Semiconductor Mater. 1961. P. 30.
Semenkovich S.A., Melekh B.T. Chemical Bonds in Solids / Ed. Sirota N.N. N.Y.: Consultants Bureau, 1972. 159 p. https://doi.org/10.1007/978-1-4684-1686-2_27
McAteer I.H., Seltz H. // J. Am. Chem. Soc. 1936. V. 58. P. 2081.
Дополнительные материалы
- скачать ESM.docx
- Таблица S1 Экспериментально значения температур и ЭДС и данные, связанные с расчетами для сплава из фазовой области SnSb4Te7+SnSb2Te4+Те.
Инструменты
Журнал неорганической химии