Журнал неорганической химии, 2022, T. 67, № 4, стр. 450-456
Гидрирование смесей магния с титаном
В. Н. Фокин a, *, П. В. Фурсиков a, Э. Э. Фокина a, Б. П. Тарасов a
a Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, пр-т Академика Семенова, 1, Россия
* E-mail: fvn@icp.ac.ru
Поступила в редакцию 22.06.2021
После доработки 27.09.2021
Принята к публикации 28.09.2021
- EDN: ECZNMV
- DOI: 10.31857/S0044457X22040055
Аннотация
Водородсорбирующие материалы на основе магния или титана перспективны в качестве рабочего вещества для высокотемпературных металлогидридных аккумуляторов водорода из-за содержания большого количества обратимо запасаемого ими водорода. С целью смягчения условий гидрирования магния как главного препятствия для его практического использования исследована возможность взаимодействия с водородом механической смеси крупнокристаллических порошков магния с 10–50 мас. % титана при различных температурах (300–390°C) без предварительной высокоэнергетической активации смеси. Установлено, что добавка 20 мас. % титана с размером частиц 200 мкм к магнию способствует проведению процесса гидрирования магния высокочистым водородом за 5 ч при 380–390°C на 94–95%. Экспериментально показано, что такая смесь перспективна как сорбент водорода в высокотемпературных металлогидридных водородных аккумуляторах многократного действия, работающих при температурах 450–650°C и выделяющих до 6.5 мас. % водорода высокой чистоты (99.999 мас. %).
ВВЕДЕНИЕ
Особый интерес к водородсорбирующим материалам на основе магния или титана для высокотемпературных металлогидридных аккумуляторов водорода обусловлен большим количеством обратимо запасаемого ими водорода. Так, количество водорода в дигидриде магния MgH2 достигает 7.6 мас. %, а в дигидриде титана TiH2 – 4 мас. %, что значительно превосходит водородоемкость наиболее известных и используемых на практике гидридов интерметаллических соединений, содержащих, как правило, 1.3–2 мас. % водорода [1, 2].
Основными препятствиями использования магния как рабочего материала в металлогидридных аккумуляторах водорода являются высокая температура как поглощения водорода, так и его выделения из гидрида, склонность к спеканию, большая чувствительность к примесям кислорода и влаги в водороде, низкая скорость процессов сорбции–десорбции водорода [1–6].
Крупнокристаллический магний при 320–430°C и давлении 1–10 МПа практически не взаимодействует с водородом. Для начала гидрирования его необходимо предварительно превратить в порошок с размером частиц 1–100 мкм и активировать нагреванием в вакууме при 380–430°C.
Стабильная при нормальных условиях α-модификация дигидрида магния α-MgH2 кристаллизуется в тетрагональной сингонии с параметрами решетки a = 4.518, c = 3.020 Å [6]. Известно [7], что под высоким давлением (7 ГПа) и при температуре 400°C часть α-фазы (~70%) превращается в γ-модификацию дигидрида магния γ-MgH2. Эта фаза кристаллизуется в орторомбической сингонии и имеет структуру, изоморфную структуре α‑PbO2. Наличие данной γ-фазы отмечено во многих образцах MgH2, например, полученных непосредственно после помола кристаллического магния в планетарной шаровой мельнице в атмосфере водорода [8].
Одним из способов достижения более мягких условий гидрирования магния и устранения других недостатков практического использования его гидрида является осуществление реакции с водородом в присутствии металлических катализаторов – переходных металлов (Pd [9], V [10], Nb [10, 11], Ni [12, 13], Zr [14], Y [13], Ti [10, 13, 15–23] и др.), а также интерметаллических соединений (TiMn2 [24], Al3Ti [25], Mg2Ni [26, 27] и др.).
В работе [10] синтезированы механохимически в шаровой мельнице в атмосфере водорода композиты состава 0.75Mg + 0.25TM + H (TM = = Ti, Nb или V) и детально исследован механизм реакции выделения и поглощения водорода такими композитами. Экспериментально установлена возможность гидрирования синтезированных композитов при комнатной температуре. Сравнительный анализ систем Mg–Ti, Mg–V и Mg–Nb позволил установить, что наиболее эффективной добавкой, облегчающей поглощение водорода магнием, особенно при комнатной температуре, является ванадий. Он обеспечивает превращение Mg в синтезированном и дегидрированном композите в гидридную фазу на 86% в течение первой минуты гидрирования (20 атм водорода, ~20°C). Установлено, что для процесса дегидрирования лучшей среди исследованных добавок является титан, что подтверждается наименьшим значением энергии активации (Ea = 53.6 кДж/моль) десорбции водорода композитом MgH2–TiH2.
Нанокомпозит магния с 7.5 мас. % Nb, полученный в водородной плазме, содержит наночастицы Nb размером 12 нм, равномерно расположенные на поверхности наноразмерного магния [11]. Обратимая водородоемкость такого композита сильно зависит от температуры и при 400°C и 40 атм достигает 7.0 мас. %. По мнению авторов [11], каталитическое действие ниобия обусловлено эффектом спилловера, наличием d-электронов и электроотрицательностью частиц.
В работе [12] установлено сильное каталитическое влияние специально приготовленных пористых нановолокон никеля на дегидрирование MgH2 с быстрым (за 11 мин) выделением 7.02 мас. % водорода при 325°C. С повышением количества катализатора температура дегидрирования MgH2 уменьшается от 170 до 143°C для содержания волокон Ni 2 и 4% соответственно. Энергия активации для композита MgH2 + 4% пористого Ni составляет 81.5 кДж/моль по сравнению со 141 кДж/моль для композита с 4% порошкообразного Ni, что свидетельствует об увеличении скорости реакции. По-видимому, волокна никеля значительно усиливают контакт с гидридом, создавая более активные каталитические участки [12].
Композиты Mg–Zr–H с микронным размером частиц были получены обработкой смеси MgH2 + Zr (молярное соотношение 20 : 1) в шаровой мельнице в атмосфере водорода под давлением 4 МПа в течение 20 ч при ~20°C с последующей обработкой под давлением водорода 5 МПа (24 ч, 100°C) [14]. По сравнению с магнием полученные композиты гидрировались намного быстрее и при более низких температурах: насыщение при 100°C достигалось за 2 ч, а дегидрирование – при 235°C с уменьшением энергии активации на ~40 кДж/моль. Полученный эффект присутствия Zr авторы объясняют синергетическим действием катализа, уменьшением размера частиц магния, дислокациями дефектов на поверхности магния, обеспечивающих каналы для диссоциации молекул H2 и проникновения атомов H в матрицу магния [14].
Значительное количество работ в этой области посвящено воздействию на процесс гидрирования магния добавок титана в виде наноразмерных композитов Mg–Ti, полученных сплавлением металлов [15], конденсацией паров металлов в атмосфере He/H2 [16], обработкой смеси металлов в шаровой мельнице в атмосфере водорода [17–20], синтезом в плазме [19, 21] и т.д. При этом состав полученных композитов в большой степени зависит от способа их получения (например, Mg1–yTiyHx [15], MgH2–0.1TiH2 [20], Mg – 9.2 мас. % TiH1.971 – 3.7 мас. % TiH1.5 [21]), что сильно затрудняет проведение сравнительного анализа продуктов гидрирования и дегидрирования объектов. Однако, как правило, все способы получения композитов магния с титаном включают стадию сплавления и высокоэнергетическую обработку в шаровой мельнице.
Обратимая сорбция водорода с фазовым превращением гидрида магния в магний наблюдалась в низкой области температур (70–150°C) при использовании наночастиц композита MgH2–TiH2, полученных конденсацией паров Mg–Ti в атмосфере He/H2 [16]. С применением уравнения Вант-Гоффа в области температур до 280°C определены термодинамические параметры разложения гидрида: ΔH = 68.1 ± 0.9 кДж/моль H2, ΔS = = 119 ± 2 Дж/(K моль H2). Установлена быстрая скорость сорбции водорода образцом Mg/Ti, а скорость десорбции MgH2/TiH2 равна 0.18 мас. % H2/мин при 150°C и давлении водорода 1 мбар. Полученные результаты указывают на перспективность использования наноразмерного композита Mg–Ti–H как материала для обратимого хранения водорода в мягких условиях.
В работе [22] было исследовано каталитическое влияние TiH2 на скорость гидрирования Mg/дегидрирования MgH2. Дифференциальный термический анализ показал, что добавление x мас. % TiH2 (х = 5, 10, 15) снижает температуру десорбции водорода из гидрида магния до 160°C, что на 100 и 190°C ниже температуры дегидрирования измельченного в шаровой мельнице и необработанного MgH2 соответственно. Согласно результатам рентгенофазового анализа и рентгеновской фотоэлектронной спектроскопии, фаза TiH2 остается неизменной во время дегидрирования без какого-либо образования промежуточных фаз, что подтверждает каталитическую роль гидрида титана, обеспечивающего участки для поверхностной адсорбции и диссоциации водорода.
По данным [23], механизм катализа (на примере титана) можно разделить на несколько стадий, например, для гидрирования: диссоциация водорода, проникновение на поверхность, диффузия, зародышеобразование гидрида и дальнейшее увеличение его количества. Подобный механизм гидрирования магния предложен в работе [28]. Хотя понимание роли катализаторов на основе Ti все еще остается неясным, было доказано, что катализаторы действительно играют важную роль в стимулировании некоторых стадий. Считалось, что легированные частицы катализатора могут уменьшать энергетический барьер диссоциации молекулы водорода, а также облегчать диффузию водорода в матрице Mg/MgH2.
В работе [13] исследовано влияние добавок одновременно двух металлов к магнию. С этой целью механическим способом в шаровой мельнице в атмосфере водорода были обработаны следующие составы: Mg + 10 мас. % Ti + 5 мас. % Y и Mg + 10 мас. % Ni + 5 мас. % Y. Установлено, что добавление смеси металлов к магнию значительно увеличивает скорость десорбции водорода из MgH2, о чем свидетельствует снижение (в 6 и 15 раз) времени выделения всего водорода из соответствующих композитов при 330°C и давлении 1 атм. При этом легирование магния указанными металлами не снижает термодинамическую устойчивость гидрида магния.
Следует отметить, что во всех известных работах для приготовления композитов с нанометровым размером частиц применялся высокоэнергетический помол в шаровых мельницах в атмосфере водорода. Такая методика требует специальной аппаратуры и больших энергозатрат, трудоемка и, как правило, не приводит к 100%-ному выходу гидридных фаз.
Исследованные двухкомпонентные композиты магния с гидридообразующими металлами также подвергались предварительной обработке для активации компонентов, что требует специальной аппаратуры и энергозатрат. Для смягчения условий гидрирования магния наиболее эффективно, как показано выше, использование добавок титана. Анализ литературных данных позволяет предположить возможность отказа от предварительной высокоэнергетической обработки и подготовки исходных компонентов и использования механических смесей металлов.
Цель настоящей работы – определение возможности гидрирования смеси крупнокристаллических порошков магния с титаном без предварительной высокоэнергетической активации с целью смягчения условий гидрирования магния и нахождение оптимальных условий для проведения этого процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные соединения. В работе использовали порошок магния чистотой 99.95 мас. % со средним размером частиц 200 мкм (Sigma-Aldrich).
Порошок титана получали методом гидридного диспергирования металлических фаз [29]. Прутки иодидного титана гидрировали при повышенной температуре высокочистым водородом до образования дигидрида титана, сохраняющего форму прутка, но охрупченного и покрытого трещинами. Полученный дигидрид титана механически измельчали в титановой ступке в инертной атмосфере при комнатной температуре и из приготовленного порошка удаляли водород нагреванием реактора при 500°C в вакууме [29]. При этом происходило спекание порошка. При дальнейшей механической обработке продукта в инертной атмосфере получали порошок с размером частиц до 500 мкм. Для проведения исследований отсеивали фракцию титана с размером частиц 200 мкм.
Гидрирование как иодидного титана, так и исследуемых в работе смесей Mg + Ti осуществляли высокочистым водородом (99.999%), выделяемым при нагревании металлогидридного аккумулятора на основе интерметаллического соединения LaNi5.
Для приготовления образцов для исследования использовали сухой бокс, в котором навески 200-микронных индивидуальных порошков титана и магния, соответствующие определенному количественному составу смеси, перемешивали механически, растирали в титановой ступке и помещали в кварцевую пробирку. Размерные и морфологические характеристики полученных порошкообразных образцов не изучали.
Методика эксперимента. Гидрирование смеси порошков магния и титана осуществляли в кварцевой пробирке, помещенной в реактор-автоклав металлической лабораторной установки высокого давления типа Сивертса емкостью 60 мл.
Перед гидрированием 3 г смеси дегазировали вакуумированием (10–3 мм рт. ст.) при 300–390°C в течение 1 ч. Затем автоклав при этой же температуре заполняли водородом до давления 30–40 атм. Поглощение водорода начиналось без индукционного периода и продолжалось с высокой скоростью в течение 3–5 мин с повышением температуры в автоклаве на 5–30°C за счет выделения тепла при гидрировании. После самопроизвольного охлаждения реактора до начальной температуры синтеза процесс продолжали при той же температуре в течение 1 ч и нагревание прекращали. Для окончания гидрирования, определяемого прекращением падения давления в системе, реактор снова нагревали до температуры синтеза, выдерживали 2 ч, охлаждали до комнатной температуры и процесс повторяли. После охлаждения до комнатной температуры водород из реактора сбрасывали в аккумулятор, продукт выгружали в атмосфере аргона и анализировали.
Все операции по подготовке образцов как для синтеза, так и для различных видов анализа проводили в сухом боксе фирмы MBRAUN в атмосфере аргона при содержании воды и кислорода не более 0.0001%.
Методы анализа. Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре АДП-1 (CuKα-излучение). Погрешность определения параметров кристаллических решеток не превышала 0.005 Å.
Состав образующихся продуктов гидрирования устанавливали методами волюмометрического и химического анализа. Количество водорода определяли на CHNS/O-элементном анализаторе Vario Micro cube Elementar GmbH.
Термическую устойчивость продуктов реакций исследовали на установке синхронного ТГ–ДТА/ДСК анализа STA 409 Luxx фирмы Netzsch. Регистрацию кривых потерь веса (ТГ) и дифференциальную сканирующую калориметрию (ДСК) проводили при программируемом нагреве со скоростью 10 град/мин в потоке аргона.
Давление водорода измеряли образцовым манометром МО класса точности 0.4.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В системе Ti–H2 образуются три фазы: твердые растворы водорода в α- и β-полиморфных модификациях титана и γ-фаза дигидрида титана. При комнатной температуре γ-фаза состава TiH1.98 имеет ГЦК-решетку (тип CaF2, a = 4.454 Å), которая при более высоком содержании водорода претерпевает тетрагональные искажения (для состава TiH2a = 4.528, c = 4.279 Å) [30].
Температура синтеза дигидрида титана определяется состоянием исходного титана (пруток, губка, порошки различной размерности), способом получения и варьируется в интервале 250–500°C [31]. Содержащий ~4 мас. % водорода дигидрид титана разлагается в две стадии: при 550 (20%) и 660ºC [29].
Смесь порошков магния с титаном (70 : 30 мас. %) дегазировали при комнатной температуре в вакууме ~1 Па в течение 1 ч, затем гидрировали в течение 2 мес. при начальном давлении водорода 30 атм также при комнатной температуре. По данным РФА, полученный продукт содержит гидрид титана состава TiH0.71 (a = 4.345, b = 4.179, c = 4.018 Å). Магний в исследуемых условиях в реакцию с водородом не вступает. По данным дифференциального термического анализа (ДТА), гидрид титана разлагается с одним эндотермическим эффектом при ~648°C.
При температуре гидрирования смесей различного состава от 250°C и выше поглощение водорода начинается без индукционного периода и продолжается с высокой скоростью в течение 3–5 мин с повышением температуры в автоклаве в зависимости от начальной температуры на 5–30°C за счет выделения тепла при гидрировании титана. На рис. 1 приведены кривые поглощения водорода смесью порошков магния с титаном состава 80 : 20 мас. % при температурах 250, 300, 350, 370 и 390°C в начальный момент времени.
Рис. 1.
Кривые поглощения водорода смесью порошков магния с титаном состава 80 : 20 мас. % при температурах 250 (1), 300 (2), 350 (3), 370 (4) и 390°C (5).
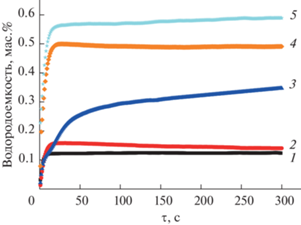
Как следует из рис. 1, реакция начинается с первой секунды отсчета и за ~5 мин выходит на плато при всех исследованных температурах. Дальнейшие процессы поглощения водорода с образованием дигидридов титана и магния происходят с увеличением времени реакции. В начальный момент времени магний в реакцию с водородом не вступает.
При температуре синтеза 390°C исследовано поглощение водорода исходными смесями магния с титаном различного состава (50 : 50, 60 : 40, 70 : 30, 80 : 20 и 90 : 10 мас. %), т.е. исследовано гидрирование Mg в присутствии 50–10 мас. % Ti. Условия и результаты гидрирования смесей Mg–Ti различного состава приведены в табл. 1. Выбор самой высокой температуры синтеза (390°C) и давления водорода 30–40 атм обусловлен отсутствием в этих условиях обратимых реакций дегидрирования гидридов.
Таблица 1.
Условия и результаты гидрирования смесей Mg + Ti
| № образца | Состав Mg : Ti, мас. % |
Условия гидрирования | Продукты гидрирования | |||||
|---|---|---|---|---|---|---|---|---|
| t, °C | τ, ч | содержание водорода, мас. % |
параметры элементарной ячейки, Å | |||||
| найдено | вычислено | TiH2 | MgH2 | |||||
| a | a | c | ||||||
| 1 | 50 : 50 | 390 | 5 | 5.51 | 5.80 | 4.4541 | 4.5180 | 3.0208 |
| 2 | 60 : 40 | 390 | 5 | 5.85 | 6.16 | 4.4540 | 4.5175 | 3.0206 |
| 3 | 70 : 30 | 390 | 5 | 6.19 | 6.52 | 4.4538 | 4.5177 | 3.0210 |
| 4 | 80 : 20 | 390 | 5 | 6.54 | 6.88 | 4.4540 | 4.5153 | 3.0211 |
| 5 | 90 : 10 | 390 | 5 | 6.73 | 7.24 | 4.4535 | 4.5164 | 3.0221 |
| 6 | 70 : 30 | 380 | 5 | 6.19 | 6.52 | 4.4545 | 4.5169 | 3.0235 |
| 7 | 80 : 20 | 370 | 6 | 6.19 | 6.88 | 4.4539 | 4.5177 | 3.0234 |
| 8 | 80 : 20 | 350 | 9 | 6.54 | 6.88 | 4.4540 | 4.5161 | 3.0223 |
| 9 | 70 : 30 | 350 | 5 | 6.06 | 6.52 | 4.4539 | 4.5176 | 3.0216 |
| 10 | 70 : 30 | 300 | 19 | 6.00 | 6.52 | 4.4541 | 4.5178 | 3.0239 |
| 11* | 50 : 50 | 390 | 5 | 4.93 | 5.80 | 4.4539 | 4.5180 | 3.0209 |
Установлено, что поглощение водорода смесью состава 50 : 50 (образец 1) происходит в течение 5 ч на ~95% с образованием смеси гидридов магния и титана с общим содержанием водорода 5.51 мас. %. Дальнейший эксперимент по определению минимальной добавки титана и оптимальных условий проведения процесса гидрирования показал, что для всех исследованных образцов (образцы 2–4) поглощение водорода смесями металлов исследованного состава (60 : 40, 70 : 30 и 80 : 20 мас. %), как и следовало ожидать, происходит с различной скоростью практически на 95% за 5 ч и заканчивается образованием смеси гидридов металлов в соответствующем исходному составу соотношении. В тех же условиях смесь металлов состава 90 : 10 мас. % (образец 5) гидрируется только на 93%. Таким образом, добавка 20 мас. % титана вполне достаточна для проведения практически полного процесса гидрирования металлов. Увеличение продолжительности взаимодействия с водородом в приемлемых интервалах не способствует полноте процесса.
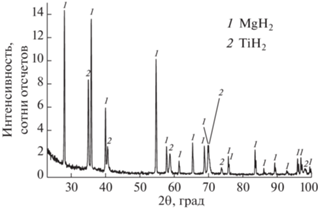
На дифрактограмме образца, полученного гидрированием смеси порошков Mg + Ti состава 80 : 20 мас. % (образец 4), присутствуют отражения, соответствующие тетрагональной фазе MgH2 (a = 4.5153, c = 3.0211 Å) и кубической фазе TiH2 с периодом кристаллической решетки a = = 4.4540 Å (рис. 2).
Рис. 2.
Дифрактограмма образца, полученного гидрированием смеси порошков Mg + Ti состава 80 : 20 мас. % (образец 4).
На примере гидрирования смеси состава 70 : 30 мас. % (образцы 3, 6, 9, 10) исследовано влияние температуры на полноту гидрирования металлов. Установлено, что снижение температуры реакции от 390 или 380°C (образцы 3 и 6) до 350°C (образец 9) без изменения условий взаимодействия характеризуется неполным гидрированием магния, а проведение процесса при 300°C (образец 10) отличается значительной продолжительностью для получения дигидрида магния (до 19 ч).
Понижение температуры гидрирования смеси металлов состава 80 : 20 мас. % от 390°C (образец 4) до 370 и 350°C (образцы 7 и 8), как и для предыдущих образцов, вызывает неполноту гидрирования магния. Для достижения 95%-ного превращения смеси (образец 8) при 350°C необходимо проводить гидрирование в течение 9 ч.
При использовании титана в исходной смеси как промышленного продукта (губка с размером частиц 200 мкм) в количестве 50 мас. % (образец 11) гидрирование магния при 390°C за 5 ч проходит на 80–85%.
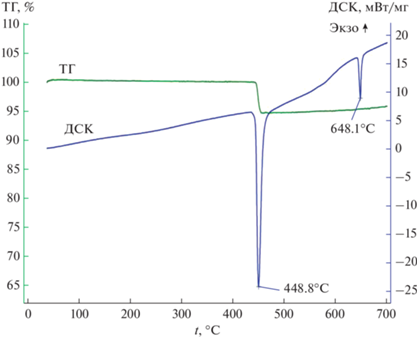
Фазовый состав продуктов гидрирования подтвержден данными РФА и ДТА. В качестве примера на рис. 3 приведена термограмма продуктов гидрирования смеси металлов состава 80 : 20 мас. % при 370°C (образец 7). На кривой ДСК видны два эндотермических пика при 448.8 и 648.1°C, соответствующие температурам разложения дигидридов магния и титана соответственно. Вследствие малого содержания в смеси дигидрида титана первый пик его разложения на термограмме не проявляется.
Рис. 3.
Термограммы продуктов гидрирования смеси металлов состава 80 : 20 мас. % при 370°C (образец 7).
Приведенные значения периодов кристаллических решеток полученных дигидридов магния и титана соответствуют данным литературных источников [6, 17, 30].
В рассматриваемой системе существует возможность реализации модели гидрирования, согласно которой фаза Ti, имеющая на своей поверхности каталитические центры, облегчающие диссоциацию молекул H2 на атомы H c их последующей объемной диффузией, играет роль канала транспорта водорода к фазе магния через межфазную границу раздела Ti/Mg.
Способность смеси магния с титаном поглощать водород при 380–390°C с образованием дигидридов, содержащих >6 мас. % водорода и выделяющих его при 450–650°C, может быть использована в высокотемпературных металлогидридных аккумуляторах водорода многократного действия. Такие аккумуляторы с внешним нагреванием электропечью используются при температурах до 650°C в лабораторных или мелкомасштабных работах с участием высокоактивного водорода высокой чистоты (99.999 мас. %).
Аккумуляторы в виде водородных баллонов повышенного давления со смесью MgH2 + TiH2 в качестве рабочего вещества легко заряжаются, сравнительно дешевы, просты в обращении.
ЗАКЛЮЧЕНИЕ
При исследовании возможности и определении условий процесса гидрирования магния в присутствии порошка титана показано, что добавка 20 мас. % порошка титана без предварительной высокоэнергетической активации смеси металлов позволяет проводить практически полное гидрирование металлов при 380–390°C.
Возможно использование смеси в качестве рабочего вещества в металлогидридных аккумуляторах водорода с внешним нагреванием электропечью, применяемых в лабораторных или мелкомасштабных работах с участием высокоактивного водорода.
Список литературы
Hirscher M., Yartys V.A., Baricco M. et al. // J. Alloys Compd. 2020. V. 827. Art. 153548. https://doi.org/10.1016/j.jallcom.2019.153548
Tarasov B.P. // Int. J. Hydrogen Energy. 2011. V. 36. P. 1196. https://doi.org/10.1016/j.ijhydene.2010.07.002
Yartys V.A., Lototskyy M.V., Akiba E. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 7809. https://doi.org/10.1016/j.ijhydene.2018.12.212
Ouyang L., Liu F., Wang H. et al. // J. Alloys Compd. 2020. V. 832. Art. 154865. https://doi.org/10.1016/j.jallcom.2020.154865
Ismail M. // Int. J. Hydrogen Energy. 2021. V. 46. № 11. P. 8621. https://doi.org/10.1016/j.ijhydene.2020.12.068
Sun Y., Shen C., Lai Q. et al. // Energy Storage Materials. 2018. V. 10. P. 168. https://doi.org/10.1016/j.ensm.2017.01.010
Семененко К.Н., Вербецкий В.Н., Калашников Я.А. и др. // Вестн. Моск. ун-та. Сер. Химия. 1978. Т. 19. № 6. С. 718.
Arbuzov A.A., Mozhzhukhin S.A., Volodin A.A. et al. // Russ. Chem. Bull. 2016. V. 65. № 8. P. 1893. https://doi.org/10.1007/s11172-016-1530-9
Williams M., Sibanyoni J., Lototskyy M. et al. // J. Alloys Compd. 2013. V. 580. Supplement 1. P. S144. https://doi.org/10.1016/j.jallcom.2013.01.086
Korablov D., Jensen T.R., Besenbacher F. // Int. J. Hydrogen Energy. 2018. V. 43. № 34. P. 16804. https://doi.org/10.1016/j.ijhydene.2018.05.091
Liu T., Ma X., Chen C. et al. // J. Phys. Chem. C. 2015. V. 119. P. 14029. https://doi.org/10.1021/acs.jpcc.5b03442
Chen J., Xia G., Guo Z. et al. // J. Mater. Chem. A. 2015. V. 3. P. 15843. https://doi.org/10.1039/c5ta03721b
Ershova O.G., Dobrovolsky V.D., Solonin Y.M. // Phys. Chem. Solid State. 2020. V. 21. № 1. P. 167. https://doi.org/10.15330/pcss.21.1.167-175
Ding X., Li Y., Fang F. et al. // J. Mater. Chem. A. 2017. V. 5. № 10. P. 5067. https://doi.org/10.1039/C7TA00460E
Anastasopol A., Pfeiffer T.V., Middelkoop J. et al. // J. Am. Chem. Soc. 2013. V. 135. P. 7891. https://doi.org/10.1021/ja3123416
Patelli N., Calizzi M., Migliori A. et al. // J. Phys. Chem. C. 2017. V. 121. P. 11166. https://doi.org/10.1021/acs.jpcc.7b03169
Cuevas F., Korablov D., Latroche M. // Phys. Chem. Chem. Phys. 2012. V.14. P. 1200. https://doi.org/10.1039/c1cp23030a
Ponthieu M., Calizzi M., Pasquini L. et al. // Int. J. Hydrogen Energy. 2014. V. 39. № 18. P. 9918. https://doi.org/10.1016/j.ijhydene.2014.01.055
Çakmak G., Károly Z., Mohai I. et al. // Int. J. Hydrogen Energy. 2010. V. 35. P. 10412. https://doi.org/10.1016/j.ijhydene.2010.08.013
Lu J., Choi Y.J., Fang Z.Z. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 15843. https://doi.org/10.1021/ja906340u
Liu T., Chen C., Wang F. et al. // J. Power Sources. 2014. V. 267. P. 69. https://doi.org/10.1016/j.jpowsour.2014.05.066
Jangir M., Jain A., Agarwal S. et al. // Int. J. Energy Res. 2018. V. 42. № 3. P. 1139. https://doi.org/10.1002/er.3911
Zhou C., Zhang J., Bowman R.C. et al. // Inorganics. 2021. V. 9. № 5. Art. 36. https://doi.org/10.3390/inorganics9050036
El-Eskandarany M.S., Al-Ajmi F., Banyan M. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 26428. https://doi.org/10.1016/j.ijhydene.2019.08.093
Pang Y., Yuan T., Yang J. et al. // Catal. Today. 2018. V. 318. P. 107. https://doi.org/10.1016/j.cattod.2017.10.035
Chen Y., Dai J., Song Y. // Int. J. Hydrogen Energy. 2018. V. 43. № 34. P. 16598. https://doi.org/10.1016/j.ijhydene.2018.07.031
Buzanov G.A., Simonenko N.P., Mal’tseva N.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1529. https://doi.org/10.1134/S0036023618120057
Tarasov B.P., Arbuzov A.A., Mozhzhuhin S.A. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 29212. https://doi.org/10.1016/j.ijhydene.2019.02.033
Fokin V.N., Fokina E.E., Tarasov B.P. // Russ. J. Inorg. Chem. 2010. V. 55. № 10. P. 1536. https://doi.org/10.1134/S0036023610100074
Гидриды металлов / Под ред. Мюллера В., Блэкледжа Д., Либовица Дж. М.: Атомиздат, 1973. 432 с.
Fokin V.N., Fokina E.E., Tarasov B.P. // Russ. J. Appl. Chem. 2019. V. 92. № 1. P. 35. https://doi.org/10.1134/S1070427219010051
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


