Журнал неорганической химии, 2022, T. 67, № 4, стр. 540-544
Термическое разложение двойного салицилатного комплекса Со–Cu в атмосфере аргона с получением металл-углеродных композиций
Д. П. Домонов a, *, С. И. Печенюк a, Ю. П. Семушина a
a Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева,
“Кольский научный центр”
184209 Апатиты, Академгородок, 26а, Россия
* E-mail: d.domonov@ksc.ru
Поступила в редакцию 16.09.2021
После доработки 15.10.2021
Принята к публикации 25.10.2021
- EDN: SWYFIU
- DOI: 10.31857/S0044457X22040043
Аннотация
При термическом разложении двойного комплексного соединения (ДКС) [Co(NH3)6]Cl[Cu(C7H4O3)2] · · 3Н2О в инертной атмосфере (аргон) при высоких (>700°C) температурах происходит образование металл-углеродных композиций Co–Cu–C. Процесс проходит путем последовательного отщепления координированного аммиака из катионной части ДКС и разложения координированного салицилата с выделением фенола и его производных.
ВВЕДЕНИЕ
В последнее время большой интерес вызывают металл-углеродные композиции как материалы, поглощающие микроволновое излучение, для нужд военной и гражданской техники [1, 2], а также как компоненты бетонов, связующих, клеев и т.д. [3]. Широко исследуются материалы, включающие углеродные нанотрубки и нановолокна, графен, активированный и аморфный углерод. Для достижения необходимого импеданса и хорошей отражательной способности материала в него внедряют мягкие магнитные материалы, например, 3d-металлы и их сплавы [4–10]. Металлы в виде солей наносят на поверхность или в объем различных волокон и полимеров, после чего подвергают карбонизации [4–10]. Согласно другим методикам, из карбидов металлов удаляют карбидообразующие металлы путем травления кислотой [11–13] или хлорирования [14–17]. Мы исследовали совершенно отличный от вышеуказанных способ сочетания металлов и углерода – термическое разложение двойных комплексных соединений (ДКС) с углеродсодержащими лигандами в инертной атмосфере: [Co(en)3][Fe(C2O4)3] [18], [Ni(NH3)6]3[Fe(CN)6]2 [19], [Co(А)6]х[Fe(CN)6]у · · nH2O (А = NH3, en/2) [20].
Ранее нами было изучено термическое разложение ДКС [Co(NH3)6]Cl[Cu(C7H4O3)2] в атмосфере воздуха и водорода [21]. В этих условиях углерод лигандов подвергался либо окислению, либо гидрированию. Термолиз ДКС в инертной среде протекает исключительно за счет внутрисферных взаимодействий без участия дополнительных реагентов, каковыми являются кислород и водород. В большинстве случаев в продуктах термолиза ДКС в инертной среде обнаруживается остаточный углерод [22, 23].
Цель настоящей работы – получение композиций Co–Cu–C путем прокаливания [Co(NH3)6]Cl[Cu(C7H4O3)2] в инертной атмосфере и изучение их свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез [Co(NH3)6][Cu(C7H4O3)2]Cl · 3H2O осуществляли согласно методике [24]. Препарат анализировали на содержание металлов и углерода:
| Сo | Cu | C | |
| Получено, мас. %: | 10.1; | 11.3; | 28.4. |
| Для C14H32O9N6ClCoCu (М = 586.9) | |||
| вычислено, мас. %: | 10.1; | 10.8; | 28.6. |
Анализ на содержание углерода проводили на автоматическом анализаторе ELTRA CS-2000 (Alpha Resources, LLC, Stevensville, MI, USA). Для определения содержания металлов навески комплекса или продуктов его термолиза растворяли в смеси концентрированных кислот HNO3 и HCl. Полученные растворы анализировали атомно-абсорбционным методом на спектрометре АAnalyst 400 (Perkin Elmer, Inc. Waltham, MA, USA).
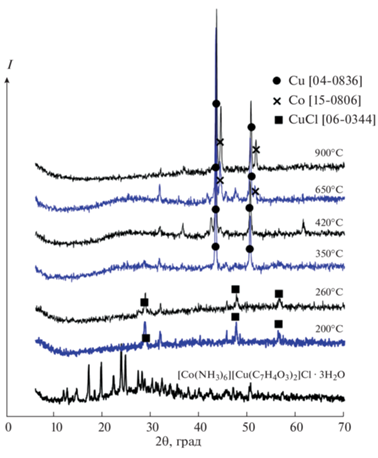
Дифрактограммы получали на дифрактометре Shimadzu XRD 6000 (Shimadzu Corp., Columbia, MD, USA) с использованием CuKα-излучения (графитовый монохроматор, λ = 1.54 Å) и сравнивали их с данными базы JCPDS-ICDD 2002 [25]. Порошковые дифрактограммы исходного соединения и продуктов его термолиза представлены на рис. 1.
Удельные поверхности продуктов термолиза измеряли на установках Tristar 3020 и FlowSorb 2300 (Micromeritics Instrument Corp. Norcross, GA, USA).
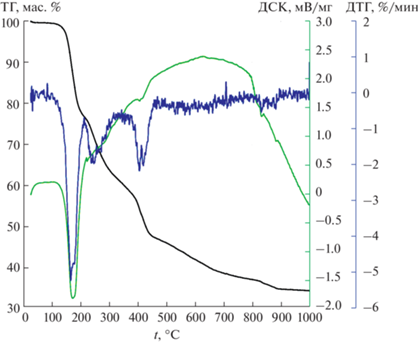
Термический анализ исходного ДКС проводили в атмосфере аргона на приборе Netzsch STA 409 PC/PG (Netzsch-Gerätebau GmbH, Selb, Germany). Навеску образца (7–10 мг) помещали в корундовый тигель и нагревали со скоростью 10 град/мин в диапазоне температур 30–1000°С, скорость продувки аргона составляла 50 мл/мин. Кривые термического анализа представлены на рис. 2.
Сканирующие электронные изображения получены с использованием прибора SEM Leo 420 (LEO, Assing, Italy) (рис. 3).
Рис. 3.
SEM-изображения: а – исходное ДКС; б – продукт термолиза ДКС в аргоне при 900°С; в – углерод, выделенный из продукта термолиза ДКС в аргоне при 900°С.

Проведено физико-химическое исследование продуктов термолиза, полученных при определенных температурах (изотермические эксперименты). Методика подробно описана в работах [18–20], за исключением того, что выделяющуюся газовую фазу подвергали качественному анализу на газовом хромато-масс-спектрометре GCMC‑QP2010 (Shimadzu Corp., Columbia, MD, USA). Результаты анализа продуктов термолиза приведены в табл. 1.
Таблица 1.
Результаты изотермических экспериментов в аргоне для ДКС [Co(NH3)6][Cu(C7H4O3)2]Cl · 3H2O
| t, °С | Остаток, мас. % | Содержание элементов, мас. % | Выделенный NH3, моль/моль ДКС | Sуд продукта термолиза, м2/г | Соотношение элементов в продукте термолиза Co : Cu : C | ||
|---|---|---|---|---|---|---|---|
| Со | Cu | C | |||||
| Исх. | 100 | 10.1 | 11.3 | 28.4 | – | – | 1 : 1 : 14 |
| 200 | 74.6 | 13.7 | 14.4 | 36.1 | 4.2 | – | 1 : 1 : 13.2 |
| 260 | 63.5 | 16.1 | 17.4 | 32.8 | 4.8 | – | 1 : 1 : 10 |
| 420 | 43.4 | 23.8 | 25.2 | 23.1 | 4.7 | 2.0 | 1 : 1 : 4.8 |
| 650 | 37.1 | 27.5 | 30.1 | 29.0 | 4.8 | 38.6 | 1 : 1 : 5.2 |
| 900 | 31.3 | 32.5 | 35.2 | 33.0 | 4.9 | 186 | 1 : 1 : 5 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Термическому анализу подвергали образцы препарата, высушенного при комнатной температуре до постоянной массы. Отсутствие воды в нем хорошо видно на кривой ТГ (рис. 2). До 200°C соединение полностью теряет координированный аммиак (потеря массы 20%, расчетная – 19.1%). Уже при 200°C соединение теряет свою индивидуальность: на дифрактограммах (рис. 1) продуктов термолиза, полученных при 200 и 260°C, видна кристаллическая фаза CuCl на фоне аморфного материала. При 350°C CuCl уже отсутствует. Следовательно, пик ДТГ между 200 и 320°C соответствует удалению хлора. От 390 до 460°C наблюдается еще один пик ДТГ, отвечающий потере массы ~15%, что соответствует удалению из внутренней сферы примерно одной молекулы фенола за счет расщепления салицилат-иона. Выше 460°C идет непрерывная потеря массы, сопровождаемая широким экзотермическим эффектом. Уже при 420°C в продукте термолиза обнаруживается металлическая медь, а при 650°C – и металлический кобальт (рис. 1).
Компоненты выделяющихся при термолизе газов, растворенные в абсорбционном растворе NaOH, экстрагировали хлористым метиленом, а экстракт подвергали хроматографическому анализу. Установлено, что экстракт содержит фенол, дибензофуран, примеси диметилфталата, 2- и 3-феноксифенолов и дибензофуранол. Хроматографическому анализу подвергали также газовые фазы непосредственно для различных диапазонов температур: 260–420, 420–650 и 650–900°C, а также продукт термолиза, полученный при 900°C в течение 1 ч. Все образцы в качестве основных компонентов содержат фенол и 3-метилбутанол-1-ацетат. Дибензофуран появляется при температуре >420°C и преобладает в диапазоне 420–900°C. Следовательно, координированные салицилат-ионы расщепляются с высвобождением фенола и некоторых других продуктов разложения, которые, по-видимому, реагируют друг с другом.
Остаток от прокаливания при 900–1000°C на кривой ТГ составляет 34.5%, расчетный остаток Co + Cu – 20.9%, что свидетельствует о наличии углерода в остатке. Результаты экспериментов при фиксированных температурах показывают, что эта примесь представляет собой углерод, как и в случае других ДКС [18–20, 22, 23], а конечный продукт имеет следующий состав: Со + Cu + (4–5) C. Если сравнить состав этого продукта с составом металл-углеродных композиций Co–Fe–C и Ni–Fe–C, полученных из ДКС [Со(A)6]x[Fe(CN)6]y (A = = NH3, en/2) и [Ni(NH3)6]3[Fe(CN)6]2 с более низким исходным содержанием углерода, можно сделать вывод, что увеличение содержания углерода в лигандах не приводит к увеличению его содержания в конечном продукте прокаливания в инертной среде.
Происходящую реакцию схематично можно записать в виде уравнения:
Из остатков термолиза при 650 и 900°С действием смеси соляной и азотной кислот выделен углерод. Выход 0.46 г С/г продукта (650°C) и 0.33 г/г; Sуд = 48 и 466 м2/г С соответственно.
ЗАКЛЮЧЕНИЕ
Термическое разложение [Co(NH3)6][Cu(C7H4O3)2]Cl · 3H2O в атмосфере аргона протекает через ряд внутрисферных превращений координированных в составе аниона ДКС лигандов – салицилат-ионов с образованием фенола, феноксифенолов и других циклических соединений. В остатке от прокаливания остаются металлические кобальт, медь и свободный углерод. Увеличение содержания углерода в лигандах не приводит к увеличению его содержания в конечном продукте после прокаливания в инертной среде.
Список литературы
Shahzad F., Alhabeb M., Hatter C.B. et al. // Science. 2016. V. 353. P. 1137. https://doi.org/10.1126/science.aag2421
Hualiang Lv, Zhihong Yang, Paul Luyuan Wang et al. // Adv. Mater. 2018. V. 30. Art. 1706343. https://doi.org/10.1002/adma.201706343
Тринеева В.В., Вахрушина М.А., Кодолов В.И. // Вестник Удмуртского ун-та. Физика, химия. 2012. Вып. 1. С. 39.
Jun Xiang, Xionghui Zhang, Qin Ye et al. // Mater. Res. Bull. 2014. V. 60. P. 589. https://doi.org/10.1016/j.materresbull.2014.09.032
Song Z., Liu X., Sun X. et al. // Carbon. 2019. V. 151. P. 36. https://doi.org/10.1016/j.carbon.2019.05.025
Liu Sh., Du Xia, Xu J., Guo S. // Solid State Commun. 2020. V. 312. Art. 113876. https://doi.org/10.1016/j.ssc.2020.113876
Haibo Yang, Bo Wen, Lei Wang. // Appl. Surf. Sci. 2020. V. 509. Art. 145336. https://doi.org/10.1016/j.apsusc.2020.145336
Lyu L., Wang F., Zhang X. et al. // Carbon. 2021. V. 172. P. 488. https://doi.org/10.1016/j.carbon.2020.10.021
Hailong Xu, Xiaowei Yin, Minghang Li et al. // Carbon. 2018. V. 132. P. 343. https://doi.org/10.1016/j.carbon.2018.02.040
Yizao Wan, Jian Xiao, Chunzhi Li et al. // J. Magn. Magn. Mater. 2016. V. 399. P. 252. https://doi.org/10.1016/j.jmmm.2015.10.006
Кютт З.Н., Данишевский А.М., Сморгонская Э.А. и др. // Физика и техника полупроводников. 2003. Т. 37. № 7. С. 811. https://doi.org/10.1134/1.1592850
Кютт З.Н., Сморгонская Э.А., Данишевский А.М. и др. // Физика твердого тела. 1999. Т. 41. № 5. С. 891. https://doi.org/10.1134/1.1130879
Кютт З.Н., Сморгонская Э.А., Данишевский А.М. и др. // Физика твердого тела. 1999. Т. 41. № 8. С. 1484. https://doi.org/10.1134/1.1130998
Дзидзигури Э.Л., Сидорова Е.Н., Багдасарова К.А. и др. // Кристаллография. 2008. Т. 51. № 2. С. 342. https://doi.org/10.1134/S1063774508020223
Дзидзигури Э.Л., Сидорова Е.Н., Земцов Л.М. и др. // Российские нанотехнологии. 2012. № 1–2. С. 60. https://doi.org/10.1134/S1995078012010041
Тринеева В.В., Кодолов В.И., Махнева Т.М. // Нанотехника. 2013. № 4. С. 3.
Кодолов В.И., Ковязин Ю.В., Захаров А.И. и др. // Матер. практ. конф. “Нанотехнологии – производству-2010”. Фрязино, 2010. С. 53.
Domonov D.P., Pechenyuk S.I., Semushina Yu.P. et al. // Thermochim. Acta. 2020. V. 687. Art. 178578. https://doi.org/10.1016/j.tca.2020.178578
Domonov D.P., Pechenyuk S.I., Belyaevskii A.T. et al. // MDPI Nanomaterials. 2020. V. 10(2). Art. 389. https://doi.org/10.3390/nano10020389
Pechenyuk S.I., Domonov D.P., Semushina Yu.P. et al. // Thermochim. Acta. 2021. V. 703. Art. 179009. https://doi.org/10.1016/j.tca.2021.179009
Домонов Д.П., Печенюк С.И., Михайлова Н.Л. и др. // Журн. неорган. химии. 2007. Т. 52. № 7. С. 1104. https://doi.org/10.1134/S0036023607070091
Печенюк С.И., Домонов Д.П., Шимкин А.А. и др. // Рос. хим. журн. 2015. Т. 59. № 4. С. 85. https://doi.org/10.1134/S1070363217090481
Печенюк С.И., Домонов Д.П., Гостева А.Н. // Рос. хим. журн. 2018. Т. 62. № 3. С. 116. https://doi.org/10.1134/S107036322109
Gmelins' Handbuch der anorganische Chemie: Kupfer (Chemie, Weinheim, 1961), Teil B, Lief. 2, S. 736.
JCPDS-ICDD card. Newtown Square (PA, USA): International Centre for Diffraction Data, 2002.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии