Журнал неорганической химии, 2022, T. 67, № 2, стр. 148-155
Синтез и свойства полимерных композитов на основе магнийзамещенного гидроксиапатита
А. И. Никитина a, О. А. Голованова a, *
a Омский государственный университет им. Ф.М. Достоевского
644077 Омск, пр-т Мира, 55а, Россия
* E-mail: golovanoa2000@mail.ru
Поступила в редакцию 27.05.2021
После доработки 02.09.2021
Принята к публикации 10.09.2021
- EDN: HQBMTD
- DOI: 10.31857/S0044457X22020118
Аннотация
Осуществлен синтез из водного раствора солей магния, кальция, диаммонийфосфата и аммиака магнийзамещенного гидроксиапатита Ca10 –xMgx(PO4)6(OH)2 (Mg-ГА) в присутствии полимерной матрицы хитозана и хитина. Представлены результаты исследования физико-химических свойств синтезированных композитов. Приведены результаты определения состава, морфологических, термических и биоактивных характеристик полученных композитов. Установлено, что все образцы имеют близкий фазовый состав и морфологию, характерную для магнийзамещенного гидроксиапатита. Показано, что размер кристаллитов для композитов с хитозаном уменьшается с увеличением содержания полимера, а для композитов с хитином существует обратная зависимость. Обнаружено, что при растворении образцов в изотоническом растворе скорости образования ионов кальция в жидкой фазе увеличиваются с содержанием хитозана и хитина в синтезированных композитах.
ВВЕДЕНИЕ
В настоящее время в медицине имеются различные методы лечения травм костной ткани, возникающих по разным причинам. Хрящевые и костно-хрящевые дефекты являются сложными проблемами [1–3], поэтому для восстановления нормального функционирования поврежденного участка костной ткани применяют имплантаты [4, 5] – биоматериалы, способные индуцировать регенерацию кости (предпочтительно с помощью одностадийной процедуры с целью снижения затрат и заболеваемости человека) и избегать барьеры для манипулирования клетками [6, 7].
В последнее время интерес вызывает концепция реконструкции костной ткани, основанная на использовании материалов, со временем резорбируемых в организме и замещаемых новообразованной костной тканью. Такие материалы должны быть нетоксичными и иметь необходимые для построения костной ткани ионы Ca2+ и ${\text{PO}}_{4}^{{3 - }}.$ С этой целью часто применяют фосфаты кальция (ФК) [8–12].
Для создания биосовместимых кальций-фосфатных материалов часто используют гидроксиапатит (ГА), который имеет сходную структуру с костной тканью и обладает биосовместимостью [13–15] и высокой устойчивостью к белкам, химиотерапевтическим препаратам и антигенам, а также способен противостоять гидролитическому разложению.
Но в связи с низкой растворимостью синтетического ГА его не используют в чистом виде в качестве имплантируемого материала [16–20]. Для повышения биоактивности ГА проводят его модифицирование биологически активными ионами, находящимися в составе природной костной ткани, что позволяет управлять растворимостью материалов на его основе [21–23] и придавать биоматериалам ряд важных дополнительных свойств.
Одним из таких ценных материалов является гидроксиапатит, допированный ионами магния (Мg-ГА) [23]. Ион магния является необходимым макроэлементом для клеток и тканей. Вследствие меньшего радиуса иона и большей энергии ионизации ион Mg2+ образует более прочные связи, чем ион Ca2+, поэтому является более активным катализатором ферментативных процессов [24] и оказывает дестабилизирующее воздействие на структуру ГА.
Для приближения свойств синтезируемого материала к составу костной ткани синтез проводят в присутствии органического биополимера, что способствует образованию и росту кристаллов Mg-ГА в виде наночастиц. Такие биокомпозиты характеризуются повышенной биоактивностью и могут быть использованы для доставки лекарственных препаратов в организм человека на клеточном уровне и изготовления нанокристаллической керамики.
Для создания новых материалов часто используют такие биополимеры, как хитин и хитозан [25, 26]. Эти природные полисахариды биологически совместимы, обладают антимикробным, противоопухолевым, ранозаживляющим и гемостатическим действием [27]. В организме они могут распадаться под действием фермента лизоцима на N-ацетилглюкозамин – продукт метаболизма. Изучение механизма воздействия хитина и хитозана на иммунную систему организма показало, что они увеличивают активность ферментов гликолиза фагоцитов [28].
Хитин представляет собой линейный полисахарид, содержащийся во внешних покровах членистоногих и роговых частях животных, стенках грибов, а также в водорослях. По своему строению, физико-химическим свойствам и биологической роли хитин очень похож на целлюлозу. Из-за высокой жесткости полимерной цепи хитин растворяется в ограниченном количестве растворителей: концентрированных кислотах, растворах хлорида лития в диметилацетамиде.
Хитозан – простейшее производное хитина, образующееся при его дезацетилировании. В отличие от хитина, хитозан хорошо растворяется в разбавленных органических растворителях. Как отмечают авторы [29], для хитозана характерна зависимость вязкости раствора от концентрации полимера [29].
Цель настоящей работы – синтез композитов Mg-ГА-хитозан и Mg-ГА-хитин с разным содержанием полимеров, определение состава, морфологических и термических свойств и биоактивности синтезируемых композитов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе проведено два эксперимента (табл. 1).
Таблица 1.
Композиты для исследования
| Состав композита | Масса добавляемого в раствор полимера, г | Масса синтезируемого композита, г | |
|---|---|---|---|
| неорганический компонент | полимер | ||
| ГА-Mg | Хитозан | 0.02 | 3.2265 |
| 0.08 | 3.3476 | ||
| 0.16 | 3.4583 | ||
| Хитин | 0.02 | 4.5792 | |
| 0.08 | 4.6981 | ||
| 0.16 | 4.8164 | ||
Синтез композита Mg-ГА-хитозан осуществляли в присутствии хитозана методом осаждения из водных растворов при 27°С. Для этого готовили раствор нитрата магния (0.025 моль/л) и нитрата кальция (0.005 моль/л) объемом 500 мл [29]. Второй раствор состоял из 500 мл эквимолярного количества раствора диаммонийфосфата. В колбу с (NH4)2HPO4 добавляли навеску хитозана массой 0.02, 0.08 или 0.16 г.
К раствору, содержащему ионы кальция и магния, с помощью магнитной мешалки медленно (в течение 1 ч) прикапывали раствор, содержащий фосфат-ионы и взвесь хитозана (общий объем раствора 1000 мл). После смешения добавляли 10 мл 25%-ного водного раствора NH4OH и выравнивали рН системы до 12 ± 0.05 при помощи 20%-ного раствора NaOH. В основе синтеза лежит реакция (1):
(1)
$\begin{gathered} (10 - x){\text{Ca(N}}{{{\text{O}}}_{{\text{3}}}}{{)}_{2}} + x{\text{Mg(N}}{{{\text{O}}}_{3}}{{)}_{2}} + \\ + \,\,6{{({\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{4}} + {\text{8N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} = \\ {\text{ = }}\,\,{\text{C}}{{{\text{a}}}_{{10 - x}}}{\text{M}}{{{\text{g}}}_{x}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{(OH}})}_{2}} + 20{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{3}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $При смешивании растворов происходило образование осадков белого цвета. После отстаивания растворов в течение 3 сут осадки отфильтровывали и высушивали в сушильном шкафу при 80°С до полного удаления воды.
Синтез композита Mg-ГА-хитин проводили аналогично получению Mg-ГА-хитозана, используя вместо хитозана полимер хитин. При приготовлении раствора, содержащего фосфат-ионы, добавляли хитин массой 0.02, 0.08 или 0.16 г. Полученные порошки исследовали физико-химическими методами.
Рентгенофазовый анализ (РФА) порошков проводили на рентгеновском дифрактометре ДРОН-3М в монохроматизированном CuⱩα-излучении. Условия съемки дифрактограмм: напряжение 40 кВт, ток накала 40 мА, диапазон углов 2θ 5°–80°, шаг сканирования 0.05°, время интегрирования сигнала в точке 10 с. Качественный анализ фазового состава образца проводили по сопоставлению экспериментальных значений интенсивности дифракционных максимумов и межплоскостных расстояний по данным порошковой дифрактометрии PDF-2. Предел обнаружения методики составляет 5%. С использованием формулы Дебая–Шеррера рассчитаны размеры кристаллитов [30].
Метод ИК-Фурье-спектроскопии. ИК-спектры снимали на спектрофотометре ФСМ 2202 (Инфраспек, Россия). В ходе исследования образец в виде порошка смешивали с KBr, наносили на германиевую кювету и прессовали. Регистрацию спектров исследуемых образцов проводили в области от 400 до 4000 см–1 с разрешением 4 см–1, общее число сканирований 50. Обработку данных осуществляли с использованием программы OriginPro8.0. Предел обнаружения составляет 5%.
Оптическую микроскопию проводили для изучения морфологии. Форму частиц твердых фаз определяли c помощью микроcкопa серии XSP-140. В качестве материала для исследования использовали осадок фосфатов кальция с добавкой полимера. Пробы тонким слоем наносили на часовое стекло и изучали материал под микроскопом.
Термогравиметрический анализ. Образцы композитов (в виде нанопорошков) массой 0.2000 ± ± 0.0002 г прокаливали в муфельной печи LF-7/13-G1 (LOIP) при температурах 200, 400, 600 и 800°С (±2°С) в течение 2 ч после выхода печи на рабочий режим. Прокаленные образцы охлаждали на воздухе до комнатной температуры, затем взвешивали на аналитических весах и переносили в маркированные емкости. По разнице масс до и после прокаливания рассчитывали убыль массы вещества в результате термообработки.
Изучение закономерностей растворения образцов в 0.9%-ном растворе NaCl. Для изучения кинетики 0.2000 ± 0.0002 г композита помещали в 100 мл 0.9%-ного раствора NaCl при 27°С. Измерения проводили в течение 2 ч при перемешивании с постоянной скоростью в постоянном объеме жидкой фазы. В ходе эксперимента контролировали рН системы (рН-метр рН-150МИ) от времени и концентрацию ионов кальция, переходящих в жидкую фазу. Концентрацию ионов кальция определяли методом прямой потенциометрии на ионометре И-160МИ. Для определения скорости растворения осадков все кинетические кривые анализировали с помощью регрессионного анализа [8].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
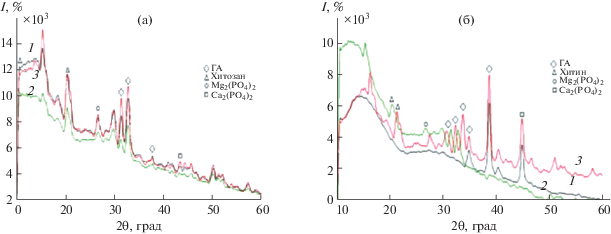
Методом РФА установлено, что синтезированные композиты Mg-ГА-хитозан и Mg-ГА-хитин состоят из гидроксиапатита в качестве основной фазы: 2θ = 31.38°, 32.73°, 32.72° и 37.68° (рис. 1, карточка № 89-6437 базы данных по порошковой дифракции ICDD PDF-2, версия 2006 г.). На рис. 1а присутствуют интенсивные линии в области углов 2θ 20.30°, 20.38°, 20.28° и слабый пик при 10.49°, что характерно для хитозана [31], причем с увеличением содержания хитозана интенсивность пика увеличивается. Аналогичная картина наблюдается для хитина (рис. 1б) – присутствуют интенсивные линии при 20.28° и 21.18° [31], интенсивность которых увеличивается с ростом содержания полимера, что подтверждает образование в изучаемой системе биокомпозитов состава Mg-ГА-хитозан и Mg-ГА-хитин. На дифрактограммах также отмечается незначительное присутствие примесных фаз Mg3(PO4)2 (2θ = = 26.48°, 26.58°) и Ca3(PO4)2 (2θ = 49.99°, 43.39°), их содержание не превышает 5%.
Рис. 1.
Дифрактограммы композитов Мg-ГА-хитозан (а) и Мg-ГА-хитин (б) с концентрацией хитозана и хитина: 1 – 0.02; 2 – 0.08; 3– 0.16 г/л.
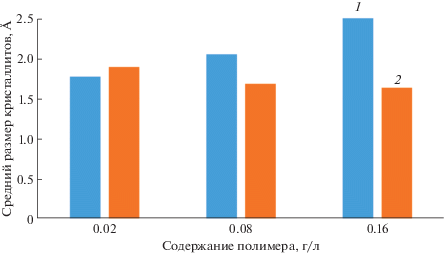
По данным РФА были определены размеры кристаллитов. Установлено, что с увеличением массы хитозана (рис. 2) в исходном растворе размеры кристаллитов незначительно уменьшаются (0.02 г/л – 1.9 Å; 0.08 г/л – 1.69 Å; 0.16 г/л – 1.64 Å). Это, вероятно, связано с тем, что кристаллиты Мg-ГА накапливаются в аморфной части полимера, увеличивается вязкость раствора (при увеличении концентрации хитозана), и это затрудняет рост больших кристаллов.
В случае композитов Mg-ГА-хитин фиксируется увеличение размеров кристаллов (от 1.8 до 2.6 Å) с ростом содержания хитина в растворе для синтеза (рис. 2).
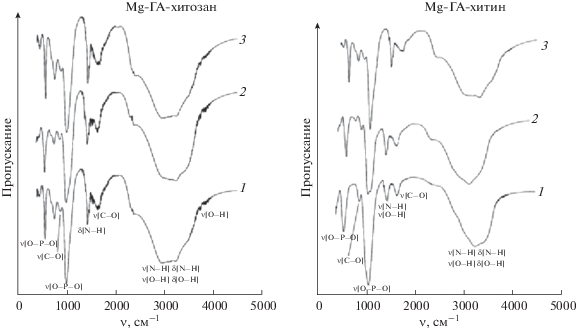
По данным ИК-Фурье-спектроскопии, синтезированные композиты имеют весь набор полос, соответствующий полимерам хитозан/хитин и фосфатным группам (рис. 3). Основные полосы поглощения связи О–P–O, содержащейся в ионах ${\text{HPO}}_{4}^{{2 - }}$ и ${\text{PO}}_{4}^{{3 - }},$ характеризуются максимумами поглощения при 1006 и 571 см–1. Широкая полоса поглощения в области 2955–3237 см–1 соответствует валентным и деформационным колебаниям –ОH- и NH2-групп. Колебания связи С–О в ионе ${\text{CO}}_{3}^{{2 - }}$ проявляются в спектре при 878 см–1 (карбонатзамещенный гидроксиапатит относится к Б-типу) [32, 33].
В ИК-спектре хитозана в составе композита наблюдаются полосы поглощения с частотой 3737 см–1, относящиеся к колебаниям связи О–Н. При частоте 1648 см–1 проявляется полоса колебаний связей –C=O в группе CONHR, а при 1436 см–1 – деформационное колебание аминогруппы –NH2.
Для спектра хитина в составе композита гидроксиапатит-хитин характерны следующие полосы: 1458 см–1 – валентные колебания O–Hалиф, пики в области 3273 см–1 – валентные колебания группы N–H ацетамида, 1655 см–1 – колебания C=O ацетамида, 1458 см–1 – колебания NH в ацетамиде, 1003 и 1074 см–1 – C–O–C в глюкозамине [8].
Таким образом, установлено, что образцы, полученные в присутствии разных полимеров (хитин и хитозан), имеют близкий фазовый и групповой состав. Разница в ИК-спектрах хитозана и хитина фиксируется только в разной интенсивности пиков функциональных групп, характерных для использованных полимеров.
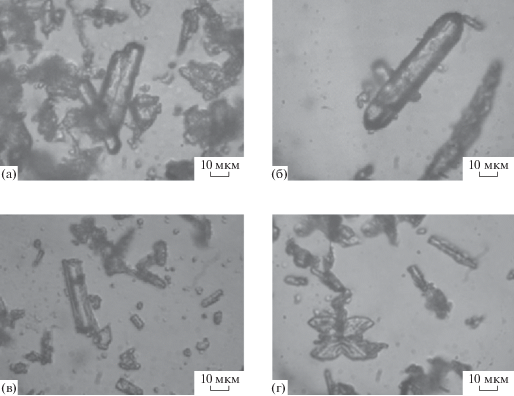
С помощью метода оптической микроскопии выявлено, что агрегаты Мg-ГА-хитозан и Мg-ГА-хитин имеют пластинчатую удлиненную форму, характерную для кристаллов магнийсодержащего гидроксиапатита (рис. 4) [23].
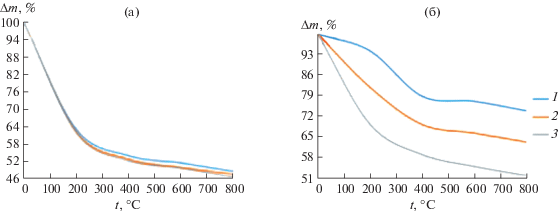
Для исследования термических свойств синтезированных композитов использован термогравиметрический анализ. Установлено, что все синтезированные образцы характеризуются непрерывной потерей массы практически до 800°С (рис. 5). Диапозон 100–400°С соответствует наибольшей потере массы образцов, это связано с удалением легколетучих примесей и адсорбционной воды. Наибольшая потеря массы наблюдается для композитов с максимальным содержанием полимера: хитозан 0.16 г/л – 46.87%; хитин 0.16 г/л – 51.82%. Это доказывает, что образцы с хитином более устойчивы термически по сравнению с хитозаном. При температуре 400–600°С происходит деструкция полимеров.
Рис. 5.
Изменение массы образцов с содержанием хитозана/хитина (1 – 0.02, 2 – 0.08, 3 – 0.16 г/л) после термообработки при различных тепловых режимах для композитов Мg-ГА-хитозан (а) и Мg-ГА-хитин (б).
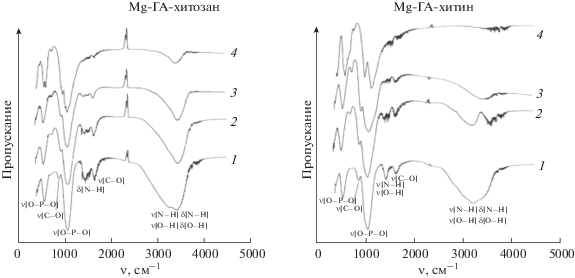
Методом ИК-Фурье-спектроскопии доказано изменение функционально-группового состава композитов после прокаливания (рис. 6). На спектрах при 200 и 400°С состав твердых фаз не изменяется. При 600°С исчезают пики, отвечающие валентным и деформационным колебаниям –ОН- и –NH2-групп в структуре хитозана, а для композитов на основе хитина их интенсивность уменьшается с увеличением температуры. При 600°С исчезает также пик, соответствующий колебаниям ассоциированной аминогруппы, в композитах на основе хитозана. Наблюдается сужение основных полос поглощения при переходе вплоть до температуры 800°С, что свидетельствует об увеличении кристалличности образца Mg-ГА. Содержание полимера влияет на массу осадка после прокаливания: чем выше концентрация полимера в образце, тем меньше масса осадка после прокаливания. Это указывает на удаление полимера из образца и коррелирует с данными [8].
Рис. 6.
ИК-спектры композитов с содержанием хитозана и хитина 0.08 г/л после термической обработки при 200 (1), 400 (2), 600 (3) и 800°С (4).
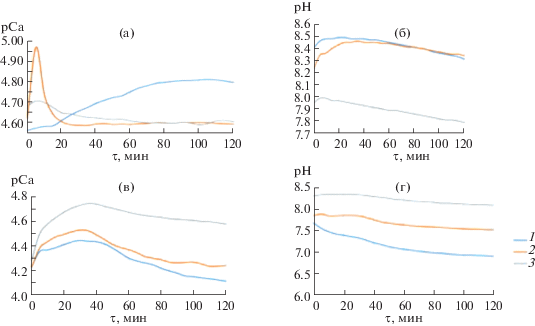
Для определения биоактивности [34] синтезированных композитов отмечали изменение рН и концентрации ионов кальция в изотоническом растворе в течение 2 ч потенциометрическим методом. Установлено, что на начальном этапе растворения композитов происходит повышение рСа, затем кривые переходят на плато (рис. 7). Значение pH раствора во время растворения композитов с хитозаном уменьшалось с увеличением концентрации полимера, а для образцов с хитином, напротив, увеличивалось с ростом концентрации полимера (рис. 7б, 7г).
Рис. 7.
Зависимость pCa (а, в) и pH (б, г) системы от времени растворения композитов с концентрацией хитозана (а, б) и хитина (в, г) 0.02 (1), 0.08 (2), 0.16 г/л (3).
Известно, что хитозан, в отличие от хитина, имеет дополнительную реакционноспособную функциональную группу (аминогруппа ${\text{NH}}_{2}^{ - }$), поэтому способность связывать ионы металлов (кальция и магния) в хелатные комплексы возрастает [31].
Кроме того, хитин является высококристаллическим полимером, в котором существуют внутри- и межмолекулярные связи между гидроксильными группами, а также связи между гидроксильными и аминоацетильными группами. Это объясняет низкую способность связывания хитином ионов металлов в хелатные комплексы
По полученным кинетическим кривым рСа = = f(τ) рассчитаны начальные значения скоростей перехода ионов кальция в раствор (табл. 2). Начальная скорость выделения ионов кальция в раствор не изменяется для композитов с концентрацией хитозана 0.02 и 0.08 г/л, а для образцов с максимальной концентрацией хитозана в исходном растворе резко возрастает в пять раз. Для композитов, полученных в присутствии хитина, начальная скорость перехода ионов кальция в раствор увеличивается с ростом концентрации хитина в исходном растворе.
Таблица 2.
Начальные скорости растворения композитов
| Масса полимера при синтезе, г | Кинетическое уравнение | Скорость, мин–1 | ||
|---|---|---|---|---|
| Мg-ГА-хитозан | Мg-ГА-хитин | Мg-ГА-хитозан | Мg-ГА-хитин | |
| 0.02 | y = 5.3657 + 0.0001x | y = 4.3233 + 0.0039x | 0.0001 | 0.0039 |
| 0.08 | y = 4.6151 – 0.0001x | y = 4.3445 + 0.0074x | 0.0001 | 0.0074 |
| 0.16 | y = 4.6508 – 0.0005x | y = 4.4755 + 0.0093x | 0.0005 | 0.0093 |
Сравнение скоростей растворения композитов фосфатов кальция, полученных на основе хитозана и хитина, показало, что большую скорость растворения в физиологическом растворе имеют композиты, синтезированные в присутствии хитина. Таким образом, для использования композитов в качестве материалов с высокой биодеградацией лучше использовать композит Мg-ГА-хитин с максимальным содержанием хитина.
ЗАКЛЮЧЕНИЕ
Синтезированные композиты на основе Mg-ГА, хитина и хитозана имеют постоянный состав, наличие функциональных групп ГА и полимеров подтверждено методом ИК-спектроскопии, присутствие фаз установлено методом РФА. Все композиты имеют идентичную морфологию и кристаллизуются в виде кристаллитов определенной формы. Средний размер кристаллита Мg-ГА-хитозан уменьшается с увеличением концентрации полимера, а у композитов с хитином наблюдается обратная зависимость.
С увеличением температуры прокаливания масса всех композитов уменьшается. Скорость перехода ионов кальция из синтезированных материалов в раствор для композитов с хитином выше, чем с хитозаном.
Список литературы
Gomoll A.H., Filardo G., de Girolamo L. et al. // Knee Surg. Sports Traumatol. Arthrosc. 2012. V. 20. P. 450.
Supova M. // Ceram. Int. 2015. P. 9203. https://doi.org/10.1016/j.ceramint.2015.03.316
Cordonnier T., Sohier J., Rosset P. et al. // Adv. Eng. Mater. 2011. V. 13. P. 135. https://doi.org/10.1002/adem.201080098
Лукина Ю.С., Свентская Н.В., Андреев Д.В. // Международный научно-исследовательский журн. 2019. № 4. С. 118.
Mavrogenis A.F., Dimitriou R., Parvizi J. et al. // J. Musculoskelet. Neuronal Interact. 2009. V. 9. P. 61.
Kon E., Roff A., Filardo G. et al. // J. Arthrosc. Relat. Surg. 2015. V. 31. P. 767.
Stipniece L., Wilson S., Curran J.M. et al. // Ceram. Int. 2021. V. 47. P. 3368. https://doi.org/10.1016/j.ceramint.2020.09.182
Fadeeva T.V., Golovanova O.A. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 690. https://doi.org/10.1134/S0036023619070064
Орловский В.П., Ежова Ж.А., Родичева Г.В. и др. // Журн. неорган. химии. 1992. Т. 37. Вып. 4. С. 881.
Крутько В.К. // Вестник нац. АН Белорусii. Сер. хiм. навук. 2008. № 4. С. 100.
Fratzl P., Gupta H., Paschalis E. et al. // J. Mater. Chem. 2004. V. 14. P. 2115.
Данильченко С.Н., Калинкевич О.В., Погорелов М.В. // Ортопедия, травматология и протезирование. 2009. № 1. С. 66.
Гурин А.Н. Сравнительная оценка влияния различных остеопластических материалов на основе фосфатов кальция на заживление костных дефектов. Дис. … канд. мед. наук. М., 2009. 161 с.
Izmailov R.R., Golovanova O.A., Tserikh Y.V. et al. // Russ. J. Inorg. Chem. 2016. Т. 61. № 7. С. 817. [Измайлов Р.Р., Голованова О.А., Церих Ю.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 7. С. 856.] https://doi.org/10.1134/S0036023616070081
Chen Z.F., Darvell B.W., Leung V.W. // Archives Oral Biol. 2004. V. 49. P. 359.
Supova M. // Ceram. Int. 2015. V. 41. P. 9203.
Li P., Jia Z., Wang Q. et al. // J. Mater. Chem. 2018. V. 6. P. 7427. https://doi.org/10.1039/C8TB01672K
Pilmane M., Salma-Ancane K., Loca D. et al. // Mater. Sci. Eng. 2017. V. 78. P. 1222. https://doi.org/10.1016/j.msec.2017.05.042
Ressler A., Cvetni M., Antunovi M. et al. // J. Biomed. Mater. Res. 2020. V. 108. P. 1697. https://doi.org/10.1002/jbm.b.34515
Chen S., Shi Y., Zhang X. et al. // J. Biomed. Mater. Res. 2019. V. 107. P. 2512. https://doi.org/10.1002/jbm.a.36757
Mocanua A. // Appl. Surf. Sci. 2014. V. 298. P. 225.
Треушников В.М., Викторова Е.А. // СТМ. 2015. Т. 7. № 3. С. 149.
Severin A.V., Rudin V.N., Paul M.E. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1436. https://doi.org/10.1134/S003602362009017X
Сидельникова В.М. // Акушерство и гинекология. 2002. № 6. С. 47.
Камская В.Е. // Биологические науки. 2016. № 6. С. 36.
Муравьев А.А. Растворы смесей целлюлозы и хитина в ионных жидкостях и композиционные материалы на их основе. Дис. … канд. хим. наук. М., 2017. 111 с.
Жоголев К.Д., Никитин В.Ю., Цыган В.Н. // Мед. иммунология. 2001. № 2. С. 316.
Федосеева Е.Н., Смирнова Л.А., Федосеев В.Б. // Вестн. Нижегородского ун-та им. Н.И. Лобачевского. 2008. № 4. С. 59.
Лясникова А.В., Пичхидзе С.Я., Дударева О.А. и др. // Журн. техн. физики. 2015. Т. 85. Вып. 11. С. 152.
Васильев Е.К. Качественный рентгенофазовый анализ. Новосибирск: Наука, 1986. 200 с.
Хитин и хитозан: получение, свойства, применение / Под ред. Скрябина К.Г., Вихоревой Г.А., Варламова В.П. М.: Наука, 2020. С. 368.
Данильченко C.H. // Вестник СумДУ. Серия Физика, математика, механика. 2007. № 2. С. 33.
Frank-Kamenetskaya O., Kol’tsov A., Kuz’mina M. et al. // J. Mol. Struct. 2011. V. 992. № 1–3. C. 9.
Бакунова Н.В., Баринов С.М., Комлев В.С. и др. // Научные ведомости. Серия: математика, физика. 2011. Вып. 23. С. 173.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии