Журнал неорганической химии, 2022, T. 67, № 2, стр. 156-167
Получение и свойства сорбентов на основе высокодисперсного бемита, поверхностно-модифицированного фосфоновыми комплексонами
Т. Н. Кропачева a, *, А. Р. Газизянова a, В. И. Корнев a
a Удмуртский государственный университет
426034 Ижевск, ул. Университетская, 1, Россия
* E-mail: krop@uni.udm.ru
Поступила в редакцию 09.06.2021
После доработки 11.08.2021
Принята к публикации 23.08.2021
- EDN: YPIILL
- DOI: 10.31857/S0044457X22020088
Аннотация
Синтезированы новые комплексообразующие сорбенты путем химического модифицирования поверхности высокодисперсного бемита (γ-AlO(OH)) фосфоновыми комплексонами (ФК), а именно: нитрилтри(метиленфосфоновой) кислотой (НТФ), 1-гидроксиэтилидендифосфоновой кислотой (ОЭДФ), N-гидроксиэтилимино-N,N-ди(метиленфосфоновой) кислотой (ГЭИДФ), имино-N,N-диуксусной-N-метиленфосфоновой кислотой (ИДУМФ). Полученные материалы (ФК-бемит) исследованы методами РФА, БЭТ, СЭМ, ПЭМ, ИК-спектроскопии. Установлено, что модифицированный бемит, в котором якорем модификатора является одна из фосфоновых групп комплексона, проявляет свойства комплексообразующего носителя по отношению к двухзарядным ионам металлов. Определены кинетические характеристики и сорбционная емкость ФК-бемита. Селективность комплексообразования на модифицированной поверхности представлена последовательностью: Pb(II) > Cu(II) > Zn(II) ≈ Ni(II) ≈ Co(II) ≈ Cd(II) > Ca(II). Устойчивость сорбированного состояния ионов металлов изменяется в ряду поверхностно-закрепленных комплексонов следующим образом: ИДУМФ > НТФ > ОЭДФ > ГЭИДФ. Установленные закономерности указывают на тесную корреляцию между процессами комплексообразования с участием фосфоновых комплексонов в растворе и на поверхности бемита.
ВВЕДЕНИЕ
Для создания функциональных гибридных материалов на основе оксидов железа, алюминия, кремния, титана, циркония, олова и др. широко используется ковалентное модифицирование их поверхности различными органическими соединениями [1, 2]. Наличие в составе органического компонента функциональных групп, выступающих в качестве лигандов по отношению к ионам металлов, позволяет получить материалы, обладающие комплексообразующими свойствами, что представляет большой интерес для сорбционного концентрирования и разделения ионов металлов, для удаления токсичных металлов из природных и сточных вод, а также для получения нанесенных металлокатализаторов [3–6]. Использование органических кислот фосфора(V) для получения поверхностно-модифицированных материалов с минеральной подложкой на основе оксидов является новым подходом для получения разнообразных гибридных носителей [7, 8]. Легкость образования и гидролитическая устойчивость связи М–О–Р позволяют в определенных условиях получать монослойное покрытие поверхности за счет замещения поверхностных гидроксогрупп оксидов на фосфоновые. Среди исследованных фосфоновых модификаторов оксидной поверхности наиболее полно описаны длинноцепочечные алкилфосфоновые кислоты, фенилфосфоновая кислота, фторированные фосфоновые кислоты, дифосфоновые кислоты и др., в то время как модификаторы с комплексообразующими функциональными группами изучены недостаточно [9–12]. В связи с этим целью настоящей работы являлось получение новых оксидных материалов, функционализированных комплексообразующими производными фосфоновых кислот и изучение их сорбционных свойств по отношению к ионам некоторых металлов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения органоминеральных сорбентов использовали синтетический гидроксид алюминия – бемит (γ-AlO(OH)), а модификаторами его поверхности служили коммерчески доступные фосфоновые комплексоны, обладающие хорошими комплексообразующими свойствами в растворах [13, 14]. Синтез бемита γ-AlO(OH) проводили путем низкотемпературного щелочного гидролиза Al(NO3)3 по методике, представленной в работах [15, 16]. Для модифицирования поверхности бемита использовали препараты фосфоновых комплексонов (табл. 1): нитрилтри(метиленфосфоновую) кислоту (НТФ), 1-гидроксиэтилидендифосфоновую кислоту (ОЭДФ), N-гидроксиэтилимино-N,N-ди(метиленфосфоновую) кислоту (ГЭИДФ) (все реактивы производства Zschimmer and Schwarz), имино-N,N-диуксусную-N-метиленфосфоновую кислоту (ИДУМФ) (Sigma-Aldrich). Химическое модифицирование поверхности бемита фосфоновыми комплексонами (ФК) проводили путем обработки навески бемита водными растворами комплексонов в оптимальных условиях, установленных в ходе предварительных опытов (4–6 ч при температуре 20°С, рН 2, соотношение 1 ммоль ФК/1 г оксида). Содержание ОН-групп на поверхности бемита определяли путем замещения их фторид-ионами, а для определения содержания ФК на поверхности использовали элементный анализ на фосфор [16].
Таблица 1.
Характеристика исследуемых сорбентов на основе бемита
| Комплексон | Сорбент | Функциональная группа поверхности | Концентрация привитых групп, ммоль/г |
|---|---|---|---|
| – | Бемит | 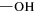 |
0.86 |
ОЭДФ Гидроксиэтилидендифосфоновая кислота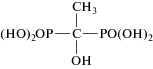 |
ОЭДФ-бемит | 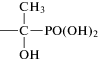 |
0.69 |
ГЭИДФ N-гидроксиэтилимино-N,N-ди(метиленфосфоновая) кислота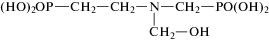 |
ГЭИДФ-бемит | 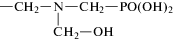 |
0.58 |
НТФ Нитрилтри(метиленфосфоновая) кислота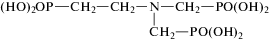 |
НТФ-бемит | 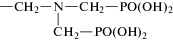 |
0.77 |
| ИДУМФ Имино-N,N-диуксусная-N-метиленфосфоновая кислота 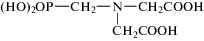 |
ИДУМФ-бемит | 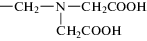 |
0.53 |
Рентгенодифракционные спектры порошков получали на рентгеновском дифрактометре ДРОН-3.0 (АО “ИЦ “Буревестник”, Россия) в монохроматическом FeKα-излучении (λ = = 0.193735 нм) в интервале брэгговских углов 12°–105° в режиме пошагового сканирования с шагом 0.1° и временем экспозиции в точке 15 с.
Морфологию и средний размер частиц определяли с помощью электронной микроскопии. СЭМ-изображения получали на сканирующем электронном микроскопе Camscan-S2 (Cambridge Instruments, Великобритания) при ускоряющем напряжении 20 кВ, фокусном расстоянии 10 мм в режиме регистрации вторичных электронов. Перед съемкой на образец порошка напыляли золотопалладиевое покрытие. Элементный состав поверхности образцов определяли с помощью сканирующего электронного микроскопа FEI Inspect S50 (FEI Company, США) с системой рентгеновского дисперсионного микроанализа. Просвечивающую электронную микроскопию (ПЭМ) проводили на приборе Jem-1011 (JEOL Ltd, Япония) при ускоряющем напряжении 80 кВ. Образец наносили на углеродные пленки путем ультразвукового распыления водной суспензии.
Удельную площадь поверхности и пористость определяли на основании изотерм низкотемпературной сорбции–десорбции азота методом БЭТ на автоматическом газоадсорбционном анализаторе поверхности и пористости TriStar 3020 (Micromeritics, США). Перед проведением измерений образцы подвергали дегазации в вакууме при остаточном давлении 10–2 атм при температуре 230°С в течение 5 ч (бемит) и при 80°С в течение 48 ч (НТФ-бемит). Расчет удельной поверхности проводили пятиточечным методом БЭТ по сорбционной ветви изотермы в области парциальных давлений p/p0 = 0.1–0.4. Распределение пор по размерам рассчитывали по десорбционной ветви изотермы по методике BJH.
ИК-Фурье-спектры полученных образцов регистрировали на ИК-спектрометре ФСМ-2201 (ООО “ИНФРАСПЕК”, Россия) в диапазоне частот 400–4000 см–1 (шаг 2 см–1) в таблетках KBr (2.5 мг на 250 мг KBr), полученных с помощью ручного гидравлического пресса. Оптическую плотность растворов измеряли на спектрофотометре UNICO 1201 (United Products & Instruments, США). Измерения рН растворов проводили с использованием иономера И-160 МИ (ООО “Измерительная техника”, Россия).
Для изучения гидролитической стабильности привитого слоя осуществляли обработку модифицированного бемита водными растворами HNO3/KOH при постоянной ионной силе 0.1 моль/л (KNO3) в течение 2 ч с последующим определением остаточного содержания комплексона на поверхности.
Изучение кинетики сорбции ионов Cu(II) проводили в статическом режиме путем измерения потенциала медь-селективного электрода (Элит-227) в растворе в ходе сорбции. Для этого в раствор, содержащий 0.1 ммоль/л Cu(II) с заданным исходным значением рН 7 и постоянной ионной силой I = 0.1 моль/л (KNO3) погружали Cu(II)-ИСЭ и после внесения навески сорбента (концентрация 1 г/л) фиксировали уменьшение потенциала в течение 150 мин при непрерывном перемешивании раствора.
Влияние кислотности среды на степень извлечения проводили для растворов нитратов металлов (Cu(II), Pb(II), Ni(II), Co(II), Zn(II), Cd(II), Ca(II)) с постоянной концентрацией при ионной силе раствора I = 0.1 моль/л (KNO3) и температуре 20 ± 1°С. Для этого предварительно готовили растворы солей металлов с концентрацией 0.1 ммоль/л и установленным значением рН (с помощью HNO3/KOH) в диапазоне рН 2–9 в зависимости от исследуемой системы. При установлении верхней границы рН исключали возможность образования осадка гидроксида металла и десорбции комплексона с поверхности бемита. К полученному раствору объемом 25 мл добавляли навеску сорбента массой 25 мг, суспензию встряхивали в течение 2 ч. Выбранное время сорбции было больше, чем необходимо для установления сорбционного равновесия (~60 мин). После удаления сорбента путем центрифугирования остаточную концентрацию ионов металлов в растворе определяли спектрофотометрическим методом по реакциям образования окрашенных комплексов с пиридилазорезорцином. Степень извлечения (R) рассчитывали по формуле: R(%) = = 100 × (С0 – С)/С0 , где С0 и С – исходная и равновесная концентрация иона металла в растворе соответственно. Относительная погрешность определения R составляла 5–10%.
Для изучения десорбции исследуемый образец с известным содержанием сорбированного металла массой 10 мг обрабатывали 2 мл раствора HNO3 с концентрацией 0.01 моль/л (рН 2.1) в течение 20 мин при перемешивании. Степень десорбции металла рассчитывали на основании полученной концентрации металла в растворе, которую определяли спектрофотометрически.
Сорбционную емкость сорбентов определяли в статических условиях на основании изотерм сорбции Cu(II), полученных при варьировании исходной концентрации Cu(II) в диапазоне 0.1–5.0 ммоль/л при равновесном значении рН 4.5 ± 0.2 и времени сорбции 2 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
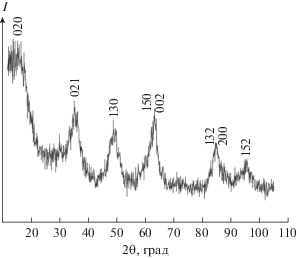
Текстурные и морфологические характеристики бемита γ-AlO(OH), определяющие его функциональные свойства для последующего использования в качестве носителя, зависят от метода и условий синтеза: температуры, давления, кислотности раствора, прекурсоров и др. [17–19]. Так, щелочной гидролиз неорганических солей Al(III) может приводить к образованию как аморфного гидроксида Al(III), так и кристаллических тригидроксидов – байерита α-Al(OH)3 и гиббсита γ-Al(OH)3, а также оксигидроксида – бемита γ-AlO(OH) [15, 20–22]. В использованных в настоящей работе условиях синтеза (медленное добавление раствора NaOH к раствору Al(NO3)3 до мольного соотношения Al(III) : OH– = 1 : 3.04, последующее выдерживание осадка при температуре 90°С в течение 4 ч, фильтрование и промывание осадка, нагревание при температуре 220°С в сушильном шкафу ШC-80-01 (ОАО “Смоленское СКТБ СПУ”, Россия) в течение 4 ч [16]) полученный образец, по данным рентгенофазового анализа, является бемитом (JCPDS card 5-190) (рис. 1). В отличие от рентгеновских спектров хорошо окристаллизованного бемита [18, 19], синтезированный образец характеризуется уширением дифракционных линий, а также некоторыми изменениями в соотношении их интенсивностей, как это ранее наблюдалось для образцов, полученных другими авторами [17, 20, 23, 24]. Отмеченные особенности указывают на то, что в используемых в работе условиях синтеза образуется высокодисперсный бемит (нанобемит, псевдобемит). Средний размер кристаллитов для полученного образца нанобемита, рассчитанный по формуле Дебая–Шеррера (по полуширине линий 021, 130, 002), составляет 5.6 ± 0.9 нм. Модифицирование полученного нанобемита фосфоновыми комплексонами (НТФ), по данным рентгенофазового анализа, не приводит к изменению его кристаллической структуры и не влияет на размер кристаллитов (5.0 ± 0.5 нм) [16].
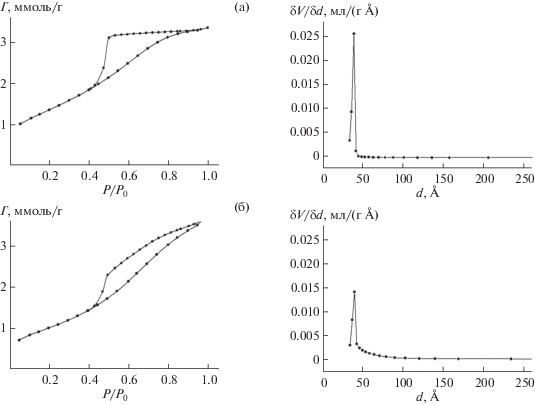
Изучение изотерм низкотемпературной адсорбции–десорбции азота на бемите и модифицированном бемите показывает наличие характерной петли гистерезиса в области парциальных давлений p/p0 > 0.4, что указывает на мезопористую структуру носителей (рис. 2). Синтезированный бемит имеет высокую удельную поверхность, которая варьируется в пределах Sуд = 230–250 м2/г, что значительно больше, чем для образцов крупнокристаллического бемита (5–100 м2/г). Модифицирование бемита фосфоновыми комплексонами (НТФ) приводит к уменьшению его удельной поверхности до значений Sуд = 90–110 м2/г, при этом общий объем пор (Vп = 0.11–0.12 мл/г) и их распределение по размерам, а также средний размер пор (dп = 4–6 нм) существенно не изменяются (рис. 2).
Рис. 2.
Изотермы сорбции–десорбции азота и распределение пор по размерам на бемите (а) и НТФ-бемите (б).
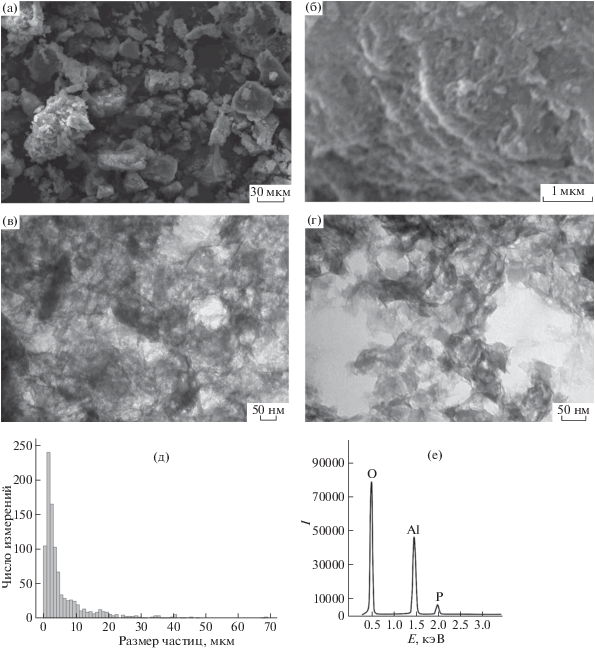
По данным СЭМ, полученные образцы высокодисперсного бемита представляют собой агломераты размером 0.5–400 мкм с максимальным количеством агломератов размером 2–4 мкм (рис. 3а, 3б, 3д). Данные ПЭМ (рис. 3в, 3г) позволяют зафиксировать морфологию синтезированных частиц бемита, которые представляют собой пластинки эллипсоидной формы, собранные в ленты, со средним размером отдельных частиц <10 нм, что согласуется с результатами РФА. По данным СЭМ, модифицирование бемита НТФ приводит к разрушению крупных агломератов (>50 мкм), а максимальное количество агломератов фиксируется для несколько меньшего по сравнению с бемитом размера 1–2 мкм (рис. 4а, 4б, 4д). ПЭМ (рис. 2в, 2г) фиксирует увеличение дисперсности исходных частиц бемита после обработки НТФ, при этом форма и размеры наноразмерных частиц бемита, входящих в состав агломератов, не изменяются. Результаты локального энергодисперсионного анализа показывают наличие в образце бемита основных элементов – O (42 ат. %) и Al (57 ат. %), а также следов Na (1 ат. %) (рис. 3е). В спектре бемита, модифицированного НТФ, доля кислорода увеличивается (О 54 ат. %, Al 38 ат. %) и появляется сигнал фосфора P (8 ат. %), доказывающий присутствие фосфонового комплексона на поверхности (рис. 4е).
Рис. 3.
СЭМ (а, б) и ПЭМ (в, г) изображения, распределение агломератов по размерам (д), спектр рентгеновского энергодисперсионного анализа (е) бемита.
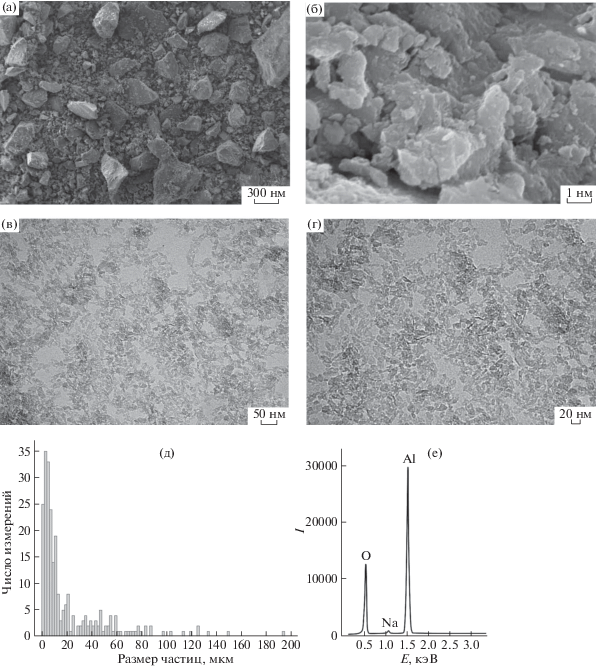
Рис. 4.
СЭМ (а, б) и ПЭМ (в, г) изображения, распределение по размерам агломератов (д), спектр рентгеновского энергодисперсионного анализа (е) бемита, модифицированного НТФ.
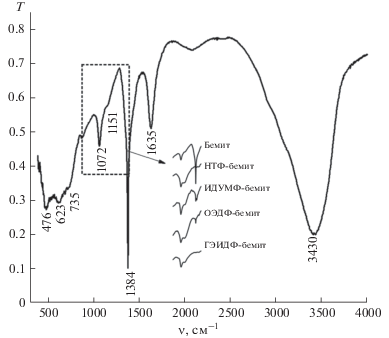
В ИК-спектре синтезированного бемита (рис. 5) присутствуют полосы поглощения при 476, 623 и 735 (валентные колебания связи Al–O), 3430 и 1635 см–1 (соответственно валентные и деформационные колебания связи O–Н поверхностных ОН-групп и адсорбированных молекул воды). Характерные для бемита полосы при 1072 и 1150 см–1 обусловлены симметричными и асимметричными деформационными колебаниями О–Н межслоевых гидроксогрупп бемита [15, 18, 19, 21]. Узкий интенсивный пик при 1384 см–1 относится к хемосорбированным ${\text{NO}}_{3}^{ - }$-ионам ввиду использования при синтезе в качестве прекурсора нитрата алюминия. В ИК-спектрах бемита, модифицированного фосфоновыми комплексонами, наиболее отчетливые изменения наблюдаются в области 1000–1400 см–1 (рис. 5, вставка), где происходит усиление поглощения, вызванное валентными колебаниями связей с участием атома фосфора –PO(OH)2-групп закрепленных комплексонов [25].
По данным элементного анализа на фосфор, содержание фосфоновых комплексонов на бемите составляет 0.50–0.80 ммоль/г. С учетом удельной поверхности модифицированных носителей площадь, приходящаяся на одну молекулу фосфонового комплексона, составляет 0.22–0.29 нм2, что сопоставимо с площадью, занимаемой фосфоновой группой при образовании плотного монослоя (0.23 нм2). Таким образом, образующееся на поверхности бемита фосфоновое покрытие близко к монослойному заполнению. Исследование гидролитической устойчивости фосфонового покрытия на бемите показывает, что степень десорбции при обработке в течение 2 ч водными растворами с рН 2–9 (в конце обработки рН 3–7) составляет не более 2%, за исключением ОЭДФ-покрытия, для которого степень десорбции выше (10–15%). При более высоких значениях щелочности среды (исходный раствор с рН 10–12, равновесный раствор с рН 8–10) десорбция возрастает до 10–30%. Таким образом, образующееся фосфоновое покрытие на бемите гидролитически устойчиво при рН 2–7. Неустойчивость сорбированного состояния фосфоновых комплексонов на оксидах железа в условиях щелочной среды была также установлена ранее вследствие протекания реакции:
На основании имеющихся в литературе представлений о взаимодействии изучаемых фосфоновых комплексонов с поверхностью (гидр)оксидов железа [26] и алюминия [27] можно предположить, что связывание всех фосфоновых комплексонов с поверхностью бемита происходит с участием в качестве “якоря” только одной фосфоновой группы комплексонов (табл. 1). Аргументом в пользу такого механизма является тот факт, что содержание всех фосфоновых комплексонов на бемите близко к содержанию его поверхностных ОН-групп, что возможно, если реакция модифицирования протекает по схеме: ≡Al–OH + –R–PO(OH)2 → ≡Al–O–PO(OH)R + + H2O. Это предполагает взаимодействие с поверхностью только одной фосфоновой группы по моноядерному монодентатному механизму связывания [6, 8]. Таким образом, наличие в модифицированном носителе не связанных с поверхностью функциональных групп, является предпосылкой для проявления модифицированным бемитом комплексообразующих свойств.
Сорбция ионов металлов комплексообразующими носителями наиболее часто описывается как процесс образования поверхностных комплексов ионов металлов с привитыми функциональными группами носителя. Теория комплексообразования на поверхности хорошо разработана для количественной интерпретации сорбции ионов металлов гидроксидами железа, алюминия, марганца, в которых в роли простейших лигандов по отношению к ионам металлам выступают гидроксильные группы поверхности [28]. Количественное описание процессов комплексообразования ионов металлов на поверхности с более сложными фукциональными группами, результатом которого являлось бы установление состава и устойчивости поверхностных комплексов, встречается в литературе значительно реже. Для изучения комплексообразующих свойств носителей были выбраны наиболее распространенные ионы тяжелых металлов: Cu(II), Pb(II), Ni(II), Co(II), Zn(II), Cd(II), а также ионы Ca(II), являющиеся макрокомпонентами многих природных и техногенных водных систем.
Скорость установления сорбционного равновесия с участием комплексообразующих сорбентов играет важную роль при их применении для сорбционного концентрирования и разделения ионов металлов, особенно при использовании динамических условий (колонки, патроны, картриджи). В общем случае время установления сорбционного равновесия зависит от начальной концентрации металла в растворе, содержания сорбента, его пористости и размера частиц, рН раствора, температуры, скорости перемешивания и пр. Изучение кинетики сорбции ионов металлов модифицированным бемитом проводили на примере ионов Cu(II), за изменением концентрации которых в растворе в ходе сорбции непосредственно следили с помощью медь-селективного электрода, потенциал которого уменьшался при внесении сорбента в раствор Cu(II). Как видно из рис. 6, в выбранных условиях опыта сорбционное равновесие как для исходного, так и для модифицированного бемита (независимо от природы привитого фосфонового комплексона) устанавливается за ~60 мин. Достаточно медленное установление равновесия может быть обусловлено диффузионным контролем сорбционного процесса при использовании высокодисперсного узкопористого сорбента. Все сорбционные кривые хорошо аппроксимируются (R2 = 0.99) кинетическим уравнением псевдопервого порядка с константами скорости k1 = 0.052 ± 0.001 мин–1 (бемит); k1 = 0.056 ± 0.001 мин–1 (НТФ-бемит); k1 = = 0.057 ± 0.001 мин–1 (ИДУМФ-бемит). Полученные данные можно сопоставить с результатами исследования кинетики сорбции ионов тяжелых металлов силикагелями с привитыми группами аминополикарбоновых комплексонов (ИДА, НТА, ЭДТА, ДТПА), для которых были получены следующие значения: k1 = 0.0009–0.0014 мин–1 (ионы Co(II), Ni(II) на ЭДТА-SiO2, ДТПА-SiO2 [29]); k1 = 0.339 мин–1 (ионы Cu(II), НТА-SiO2); k1 = 0.105 мин–1 (ионы Cd(II), НТА-SiO2) [30]. При этом время установления сорбционного равновесия варьировалось от 20 мин до 24 ч [29–32].
Рис. 6.
Кинетические кривые сорбции ионов Cu(II) на бемите (1), НТФ-бемите (2), ИДУМФ-бемите (3). Линии проведены на основании рассчитанных констант кинетического уравнения псевдопервого порядка. рНисх/равн 7.3/6.0 (1); 7.2/5.7 (2); 7.2/5.0 (3). СCu(II)= 0.1 ммоль/л, Ссорбент = 1 г/л, соотношение объем раствора (мл): масса сорбента (г) V/m = 103.
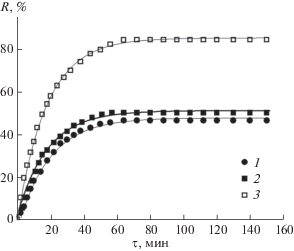
Изменения в состоянии сорбционных центров, вызванные модифицированием поверхности бемита, наиболее отчетливо проявляются при изучении влияния кислотности среды на сорбцию ионов металлов. Степень извлечения ионов всех металлов на модифицированных сорбентах при повышении рН раствора увеличивается, достигая 90–100% при рН 7 (рис. 7). Количественная десорбция ионов металлов достигается путем обработки сорбента раствором HNO3 c рН ~ 2 в течение 20 мин, при этом сам сорбент регенерируется и может быть использован повторно.
Рис. 7.
Зависимость степени сорбции ионов Ni(II) на бемите (1), ОЭДФ-бемите (2), НТФ-бемите (3), ИДУМФ-бемите (4) от кислотности среды (а). Зависимость степени сорбции ионов Pb(II) (1), Cu(II) (2), Cd(II) (3), Ca(II) (4) на НТФ-бемите от кислотности среды (б). СМ(II) = 0.1 ммоль/л, Ссорбент = 1 г/л, соотношение объем раствора (мл)/ масса сорбента (г) V/m = 103, время сорбции 2 ч.
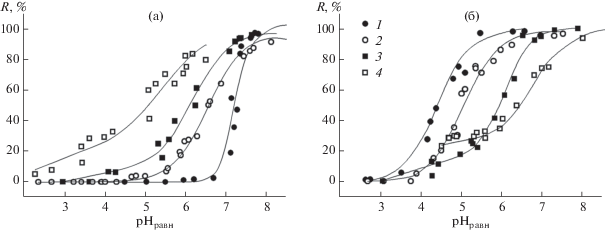
В качестве наиболее простой количественной характеристики, отражающей способность иона металла к образованию поверхностных комплексов, может быть использовано значение кислотности среды, отвечающее его 50%-ной степени сорбции (рН50). По сравнению с исходным бемитом сорбционные кривые и значения рН50 для модифицированных носителей смещаются в сторону более низких значений кислотности среды (рис. 7а), что указывает на более высокую устойчивость поверхностных комплексов с участием функциональных групп фосфоновых модификаторов по сравнению с комплексами с поверхностными ОН-группами бемита. Известно [13, 14], что в водных растворах все изучаемые фосфоновые комплексоны (HnL) образуют с двухзарядными ионами металлов (M2+) комплексы мольного состава 1 : 1 с различной степенью протонирования MHiLi+ 2 –n (I = 0, 1, 2, .., n – 1):
Можно предположить, что в случае привитых к поверхности комплексонов связывание ионов металлов происходит в результате аналогичных поверхностных реакций:
Сопоставление сорбции ионов Ni(II)/Cu(II) на различных модифицированных носителях показывает, что природа функциональной поверхностной группы привитого фосфонового комплексона в значительной степени определяет устойчивость поверхностных комплексов (рис. 7а). На основании величины рН50 (рис. 8а) можно заключить, что наилучшее связывание ионов металлов наблюдается в случае закрепленной иминодиацетатной группы (ИДУМФ-бемит). Этот сорбент, по существу, является аналогом широко распространенных сорбентов на основе силикагеля с привитыми группами иминодиуксусной кислоты (ИДА-SiO2) [31, 33–35]. Фосфоновый аналог ИДУМФ-бемита, содержащий вместо иминодиацетатной иминоди(метиленфосфоновую) группу (НТФ-бемит), связывает ионы металлов слабее, а замена одной метиленфосфоновой группы на гидроксиэтильную (ГЭИДФ-бемит) еще в большей степени снижает комплексообразующую способность привитого комплексона. В целом полученная последовательность величины рН50 (рис. 8а) хорошо коррелирует с комплексообразующей способностью изучаемых комплексонов по отношению к ионам Ni(II)/Cu(II): в водных растворах ИДУМФ > > НТФ > ОЭДФ > ГЭИДФ [14]. Для всех модифицированных сорбентов связывание иона Cu(II) происходит сильнее, чем Ni(II), аналогично тому, как это имеет место в растворах.
Рис. 8.
Значения рН, соответствующие 50% степени сорбции ионов металлов на бемите и модифицированном бемите (а). Значения рН, соответствующие 50% степени сорбции ионов различных металлов на бемите и бемите, модифицированном НТФ (б). СМ(II) = 0.1 ммоль/л, Ссорбент = 1 г/л, соотношение объем раствора (мл)/масса сорбента (г) V/m = = 103, время сорбции 2 ч.
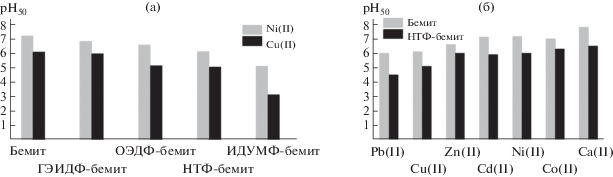
Влияние природы металла на устойчивость сорбционных комплексов было исследовано на примере НТФ-бемита (рис. 7б). На основании величины рН50 ряд селективности для изученных металлов на НТФ-бемите представлен следующей последовательностью: Pb(II) > Cu(II) > > Zn(II) ≈ Ni(II) ≈ Co(II) ≈ Cd(II) > Ca(II) (рис. 8б). Наиболее высокая сорбционная способность ионов Cu(II) и Pb(II) по сравнению с другими исследованными ионами на НТФ-бемите согласуется с более высокой устойчивостью их гомогенных комплексов с НТФ. Замыкающие ряд ионы Ca(II) образуют с НТФ в растворах наименее прочные комплексы. Таким образом, устойчивость поверхностных комплексов ионов металлов на модифицированном бемите коррелирует с устойчивостью их гомогенных аналогов в растворах.
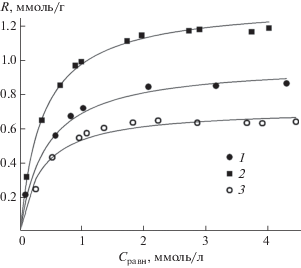
Сорбционная емкость является важной характеристикой комплексообразующих сорбентов, которая определяет эффективность их применения для сорбционного излечения/концентрирования ионов металлов. Сорбционная емкость по ионам Cu(II) для исходного бемита (0.85 ммоль/г) практически совпадает с концентрацией его поверхностных ОН-групп (рис. 9). Для бемита, модифицированного ОЭДФ, сорбционная емкость составляет 0.62 ммоль/г, что близко к концентрации этого комплексона на поверхности, в то время как для НТФ-бемита значение сорбционной емкости (1.15 ммоль/г) выше, чем концентрация привитых групп. Полученные результаты указывают на образование поверхностных комплексов с мольным составом M : L = 1 : 1 в случае ОЭДФ- бемита и комплексов состава M : L = 1 : 1, а также М : L = 2 : 1 (при избытке ионов металла) в случае НТФ-бемита. Значения сорбционной емкости для модифицированного бемита сопоставимы с данными для силикагелей, содержащих привитые иминодиацетатные и аминодифосфоновые группы: 0.3–0.4 ммоль/г (Cu(II), Pb(II), Ni(II) на ИДА-SiO2) [34], 1.23 ммоль/г (Cu(II) на ИДА-SiO2) [29], 0.09–0.14 ммоль-экв/г (Zn(II) на ИДА-SiO2) [35], 0.3 ммоль/г (Cu(II) на АДФК-SiO2) [36].
Рис. 9.
Изотермы сорбции Cu(II) на бемите (1), НТФ-бемите (2), ОЭДФ-бемите (3). рНравн 4.8 (1); 4.5 (2); 4.5 (3). Ссорбент = 1 г/л, соотношение объем раствора (мл)/масса сорбента (г) V/m = 103, время сорбции 2 ч. Линии проведены на основании рассчитанных констант уравнения Ленгмюра.
Предположения о механизме связывания ионов металлов с модифицированным бемитом можно сделать исходя из координационных возможностей функциональных групп привитых фосфоновых комплексонов (табл. 1). Комплексоны, содержащие свободную фосфоновую группу/группы (ОЭДФ-бемит, ГЭИДФ-бемит, НТФ-бемит), в кислой среде образуют с ионами металлов поверхностные комплексы с участием двух атомов кислорода фосфоновой группы c замыканием четырехчленного цикла. Подобный механизм описан для образования комплексов ионов металлов с фосфоновыми комплексонами в растворах [13] и при связывании ионов металлов фосфоновыми/аминофосфоновыми ионитами [37] и силикагелями с привитыми фосфоновыми/аминофосфоновыми группами [9]. Комплексообразующая иминодиацетатная группа ИДУМФ-бемита в кислой среде связывает ионы металлов за счет диссоциированных карбоксильных групп (группы). В условиях более щелочной реакции среды закрепленные на поверхности аминофосфоновые комплексоны (ГЭИДФ-бемит, НТФ-бемит) и иминодикарбоновый комплексон (ИДУМФ-бемит) могут более прочно связывать ион металла за счет образования пятичленного хелатного металлоцикла (циклов) с участием атома кислорода фосфоновой/ карбоксильной группы (групп) и депротонированного атома азота, как это имеет место в растворах и на поверхности [9, 37].
Полученные комплексообразующие носители могут найти применение для сорбционного группового концентрирования ионов изученных тяжелых металлов. По сравнению с исходным бемитом сорбция этих ионов на модифицированных носителях происходит в более кислой среде (сдвиг на одну-две единицы рН), что снижает негативное влияние процессов гидролиза и осаждения на сорбцию. Мешающее влияние ионов Ca(II), которые являются распространенными макрокомпонентами многих водных систем, ожидается при концентрировании группы слабосорбирующихся ионов тяжелых металлов (Ni(II), Co(II), Zn(II), Cd(II)), в то время как селективность концентрирования ионов Pb(II) и Cu(II) в присутствии Ca(II) является достаточной высокой. Полученные комплексообразующие сорбенты на основе γ-AlO(OH) могут дополнить ряд уже нашедших практическое применение аналогичных по функциям сорбентов, в которых в роли неорганической подложки выступает SiO2, а привитыми группами являются аминополикарбоновые кислоты (ИДА, НТА, ЭДТА и др.). Модифицирование поверхности (гидр)оксидов алюминия и железа производными фосфоновых кислот протекает в мягких условиях в результате одностадийной реакции, что значительно проще, чем синтез аналогичных комплексообразущих сорбентов на основе силикагеля. С учетом широкого выбора коммерчески доступных фосфоновых комплексонов разработанный метод модифицирования оксидной поверхности открывает возможность получения разнообразных функциональных материалов, включая комплексообразующие.
ЗАКЛЮЧЕНИЕ
Полученные результаты показывают возможность иммобилизации различных фосфоновых комплексонов (НТФ, ОЭДФ, ГЭИДФ, ИДУМФ) на поверхности синтетического нанобемита, приводящей к образованию плотного монослойного покрытия. Модифицированный бемит обладает свойствами комплексообразующего носителя по отношению к ионам металлов (Pb(II), Cu(II), Ni(II), Co(II), Zn(II), Cd(II), Ca(II)) благодаря наличию свободных от взаимодействия с поверхностью функциональных групп фосфоновых комплексонов. При этом закономерности, присущие комплексообразованию с участием фосфоновых комплексонов в растворах, сохраняются и при их закреплении на поверхности. Это позволяет на основании накопленной информации по комплексообразованию в гомогенных системах делать обоснованный выбор фосфонового комплексона-модификатора для решения конкретных задач, связанных с получением поверхностно-закрепленного состояния того или иного иона металла.
Список литературы
Химия привитых поверхностных соединений / Под ред. Лисичкина Г.В. М.: Физматлит, 2003. 592 с.
Pujari S.P., Scheres L., Marcelis T.M. et al. // Angew. Chem. Int. Ed. 2014. V. 53. № 25. P. 6322. https://doi.org/10.1002/anie.201306709
Золотов Ю.А., Цизин Г.И., Дмитриенко С.Г. и др. Сорбционное концентрирование микрокомпонентов из растворов: применение в неорганическом анализе. М.: Наука, 2007. 320 с.
Cashin V.B., Eldridge D.S., Zhao D. et al. // Environ. Sci. Water Res. Technol. 2017. V. 4. P. 110. https://doi.org/10.1039/C7EW00322F
Olenin A.Y., Lisichkin G.V. // Russ. J. Gen. Chem. 2019. V. 89. № 7. P. 1451. [Оленин А.Ю., Лисичкин Г.В. // Журн. общей химии. 2019. Т. 89. № 7. С. 1101. https://doi.org/10.1134/S0044460X19070163]https://doi.org/10.1134/S1070363219070168
Manyangadzea M., Chikuruwob N.H.M., Narsaiahc T.B. et al. // S. Afr. J. Chem. Eng. 2020. V. 31. P. 25. https://doi.org/10.1016/j.sajce.2019.11.003
Mingalyov P.G., Lisichkin G.V. // Russ. Chem. Rev. 2006. V. 75. № 6. P. 541. [Мингалев П.Г., Лисичкин Г.В. // Успехи химии. 2006. Т. 75. № 6. С. 604.]https://doi.org/10.1070/RC2006v075n06ABEH002478
Queffelec C., Petit M., Janvier P. et al. // Chem. Rev. 2012. V. 112. № 7. P. 3777. https://doi.org/10.1021/cr20042121
Nesterenko P.N., Shaw M.J., Hill S.J. et al. // Microchem. J. 1999. V. 62. № 1. P. 58. https://doi.org/10.1006/mchj.1999.1717
Demin A.M., Mekhaev A.V., Esin A.A. et al. // Appl. Surf. Sci. 2018. V. 440. P. 1196. https://doi.org/10.1016/j.apsusc.2018.01.147
Kropacheva T.N., Antonova A.S., Kornev V.I. // Mendeleev Commun. 2019. V. 29. P. 358. https://doi.org/10.1016/j.mencom.2019.05.040
Kropacheva T.N., Antonova A.S., Zhuravleva A.Y. // Prot. Met. Phys. Chem. Surf. 2020. V. 56. № 3. P. 473. [Кропачева Т.Н., Антонова А.С., Журавлева А.Ю. // Физикохимия поверхности и защита материалов. 2020. Т. 56. № 3. С. 237. https://doi.org/10.31857/S0044185620030225]https://doi.org/10.1134/S2070205120030223
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988. 544 с.
Pettit L.D., Powell H.K.J. // IUPAC Stability Constants Database, version 4.74, Academic Software. www.acadsoft.co.uk
Rajabi L., Derakhshan A. // Sci. Adv. Mater. 2010. V. 2. № 2. P. 163. https://doi.org/10.1166/sam.2010.1063
Kropacheva T.N., Gazizyanova A.R., Gil’mutdinovb F.Z. // Russ. J. Inorg. Chem. 2020. V. 65. № 8. P. 1150. [Кропачева Т.Н., Газизянова А.Р., Гильмутдинов Ф.З. // Журн. неорган. химии. 2020. Т. 65. № 8. С. 1044. https://doi.org/10.31857/S0044457X20080073]https://doi.org/10.1134/S0036023620080070
Santos P.S., Coelho A.C., Santos H.S. et al. // Mater. Res. 2009. V. 12. № 4. P. 437. https://doi.org/10.1590/S1516-14392009000400012
Kozerozhets I.V., Panasyuk G.P., Semenov E.A. et al. // Theor. Found. Chem. Eng. V. 54. № 3. P. 465. [Козерожец И.В., Панасюк Г.П., Семенов Е.А. и др. // Теор. основы хим. технол. 2020. Т. 54. № 3. С. 345. https://doi.org/10.31857/S0040357120030082]https://doi.org/10.1134/s0040579520030082
Kozerozhets I.V., Panasyuk G.P., Semenov E.A. et al. // Ceram. Int. 2020. V. 46. P. 28961. https://doi.org/10.1016/j.ceramint.2020.08.067
Tettenhorst R., Hofmann D.A. // Clays Clay Miner. 1980. V. 28. № 5. P. 373. https://doi.org/10.1346/ccmn.1980.0280507
Hochepied J.-F., Nortier P. // Powder Technol. 2002. V. 128. P. 268. https://doi.org/10.1016/s0032-5910(02)00178-x
Кириллова С.А., Смирнов А.В., Федоров Б.А. и др. // Наносистемы: физика, химия, математика. 2012. Т. 3. № 4. С. 101.
Alphonse P., Courty // Thermochim. Acta. 2005. V. 425. P. 75. https://doi.org/10.1016/j.tca.2004.06.009
Stefanic G., Music S. // Croat. Chem. Acta. 2011. V. 84. № 4. P. 481. https://doi.org/10.5562/cca1884
Zenobi M.C., Luengo C.V., Avena M. J. et al. // Spectrochim. Acta, Part A. 2010. V. 75. P. 1283. https://doi.org/10.1016/j.ssa.2009.12.059
Nowack B., Stone A.T. // J. Colloid Interface Sci. 1999. V. 214. P. 20. https://doi.org/10.1006/jcis.1999.6111
Zenobi M.C., Rueda E.H. // Quim. Nova. 2012. V. 35. № 3. P. 505. https://doi.org/10.1590/S0100-40422012000300012
Surface Complexation Modelling / Ed. Lutzenkirchen J. Academic Press, 2006. 652 p.
Repo E., Warchoł J.K., Bhatnagar A. et al. // Water Res. 2013. V. 47. № 14. P. 4812. https://doi.org/10.1016/j.watres.2013.06.020
Li Y., He J., Zhang K. et al. // RSC Advances. 2019. V. 9. № 1. P. 397. https://doi.org/10.1039/c8ra08638a
El-Nahhal I.M., Zaggout F.R., Nassar M.A. et al. // J. Sol-Gel Sci. Technol. 2003. V. 28. № 2. P. 255. https://doi.org/10.1023/a:1026093419515
Лакиза Н.В., Неудачина Л.К., Ятлук Ю.Г. // Сорбц. и хроматогр. процессы. 2006. Т. 6. № 6. С. 1001.
KholinY.V., Shabaeva Y.V., Khristenko I.V. // Russ. J. Appl. Chem. 1998. V. 71. № 3. P. 407. [Холин Ю.В., Шабаева Ю.В., Христенко И.В. // Журн. прикл. химии. 1998. Т. 71. № 3. С. 394.]
Suzuki T.M., Itabashi O., Goto T. et al. // Bull. Chem. Soc. Jpn. 1987. V. 60. № 8. P. 2839. https://doi.org/10.1246/bcsj.60.2839
Nesterenko P.N., Shpigun O.A. // Russ. J. Coord. Chem. 2002. V. 28. № 10. P. 726. [Нестеренко П.Н., Шпигун О.А // Коорд. химия. 2002. Т. 28. № 10. С. 772.]https://doi.org/10.1023/A:1020455513002
Костенко Л.С., Ахмедов С.А., Зайцев В.Н. // Методы и объекты хим. анализа. 2006. Т. 1. № 2. С. 116. https://doi.org/10.17721/moca
Hubicki Z., Kolodynska D. // Ion Exchange Technologies. Istanbul: IntechOpen, 2012. P. 193. https://doi.org/10.5772/51040
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии