Журнал неорганической химии, 2022, T. 67, № 2, стр. 208-215
Термодинамические свойства Pr2Hf2O7 в области низких температур
А. В. Гуськов a, *, П. Г. Гагарин a, В. Н. Гуськов a, А. В. Тюрин a, К. С. Гавричев a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: a.gus@igic.ras.ru
Поступила в редакцию 17.08.2021
После доработки 14.09.2021
Принята к публикации 21.09.2021
- EDN: ZTMPQL
- DOI: 10.31857/S0044457X22020052
Аннотация
Методами релаксационной и адиабатической калориметрии измерена молярная теплоемкость гафната празеодима со структурой пирохлора в интервале температур 2.4–345.6 K. Рассчитаны термодинамические функции Pr2Hf2O7, оценена величина аномальной энтропии в области 0–20 K. Определен общий вид аномальной теплоемкости при температурах 20–300 K.
ВВЕДЕНИЕ
Двойной высокотемпературный оксид Pr2Hf2O7 структурного типа пирохлора (Fd3m) – единственное соединение в системе Pr2O3–HfO2 [1]. Из приведенной в работе [2] диаграммы системы Pr2O3–HfO2 следует, что Pr2Hf2O7 при температурах порядка 1873 K характеризуется областью гомогенности ~10 мол. %, а выше 2473 K претерпевает разупорядочение и превращается в твердый раствор структурного типа дефектного флюорита (Fm3m). По мнению авторов [3, 4], гафнат празеодима конгруэнтно плавится при температуре 2613 ± 30 K. Других превращений во всей температурной области существования гафната празеодима не обнаружено, кроме магнитных превращений в области самых низких температур (<10 K), характерных для соединений лантаноидов, за исключением лантана и лютеция [5]. Физические свойства гафната празеодима в низкотемпературной области изучали с точки зрения образования квантовой системы спинового льда [6, 7]. Для этих же целей в работах [8, 9] были выращены образцы монокристаллического Pr2Hf2O7 с параметром кубической решетки типа пирохлора 10.68411(2) и 10.6727(1) Å соответственно. При температурах 0.5–20 K были проведены исследования магнитной восприимчивости и изотермической намагниченности, а также молярной теплоемкости при 1.8–300 [6, 9] и 0.35–10.0 K [7] методом релаксационной калориметрии. Магнитные превращения приводят к возрастанию теплоемкости при понижении температуры от 10 K. К сожалению, в численном виде, необходимом для расчета термодинамических функций гафната празеодима, данные по температурной зависимости теплоемкости в этих работах не представлены. Помимо магнитных превращений в низкотемпературной области (<10 K) кристаллические соединения лантаноидов, за исключением лантана и лютеция, характеризуются избыточной теплоемкостью (Сexc), обусловленной взаимодействием 4f-электронов с кристаллическим полем (аномалия Шоттки, СSch) [10–13]. Авторами [6] проанализирована температурная зависимость избыточной теплоемкости гафната празеодима (СSch(T)) в области 1.8–300 K вычитанием решеточной теплоемкости Pr2Hf2O7, оцененной из теплоемкости La2Hf2O7. Показано наличие плавного максимума при 50 K на кривой избыточной теплоемкости Сexc(T) и ее дальнейшее возрастание при повышении температуры.
Цель настоящего исследования – измерение молярной теплоемкости Pr2Hf2O7 структурного типа пирохлора методами релаксационной и адиабатической калориметрии в области низких температур, расчет термодинамических функций (приращения энтальпии, энтропии и приведенной энергии Гиббса), а также определение температурной зависимости вклада аномальной теплоемкости и величины избыточной энтропии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
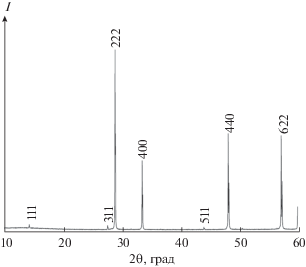
Гафнат празеодима получали методом обратного осаждения. Исходными веществами служили оксид празеодима Pr6O11 (99.99 мас. %), диоксид гафния (99.99 мас. %) производства ООО “Ланхит”, соляная кислота (35–38 мас. %, ос. ч. 20-4) и раствор аммиака (25–28 мас. % NH4OH, ос.ч.) производства ООО “Химмед”. Синтез, методы измерения термического расширения, теплоемкости и обработки результатов подробно описаны в работах [14, 15]. Полученный в результате окончательного прокаливания при 1550 K (4 ч) образец, по данным химического анализа, имел состав Pr1.94Hf2O6.91 (величина индекса при кислороде рассчитана исходя из соотношения оксидов металлов). Такое отклонение от стехиометрии по соотношению оксидов, по нашей оценке, не может внести существенной погрешности в величину теплоемкости [16]. Проведенные дифракционные (рис. 1) исследования показали, что полученный однофазный образец имеет кубическую структуру типа пирохлора с параметром решетки a = 10.671(9) Å, удовлетворительно соответствующим данным [9]. Расчет по методу Дебая–Шеррерa и растровая электронная микроскопия показали (рис. 2), что образец не является наноразмерным и поправок на размерный фактор вводить не требуется. Молекулярную массу рассчитывали из атомных масс [17], она составила 750.79112 г/моль. Измерения молярной теплоемкости методом релаксационной калориметрии (2.9–35.0 K) проводили с помощью автоматизированного комплекса измерения физических свойств Quantum Design PPMS-9 (США). Измерения адиабатическим методом (4.6–346 K) осуществляли в автоматическом низкотемпературном калориметре БКТ-3 АОЗТ “Термис” (Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
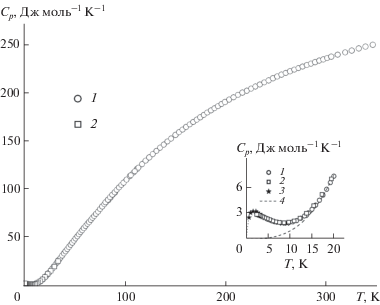
Молярная теплоемкость гафната празеодима структурного типа пирохлора измерена методом релаксационной калориметрии в 24 точках в интервале температур 2.9–35.0 K и методом адиабатической калориметрии в 136 точках в диапазоне 4.6–345.6 K (табл. 1, рис. 3).
Таблица 1.
Экспериментальная теплоемкость гафната празеодима по результатам адиабатической и релаксационной калориметрии, М.м. = 750.79112 г/моль, р = 101.3 кПа
| T, K | Cp, Дж моль–1 K–1 | T, K | Cp, Дж моль–1 K–1 | T, K | Cp, Дж моль–1 K–1 |
|---|---|---|---|---|---|
| Релаксационная калориметрия (RC) | |||||
| 34.97 | 26.15 | 13.80 | 3.013 | 5.36 | 2.249 |
| 31.17 | 20.30 | 12.29 | 2.450 | 4.77 | 2.359 |
| 27.69 | 15.89 | 10.94 | 2.131 | 4.23 | 2.487 |
| 24.63 | 12.85 | 9.71 | 1.961 | 3.77 | 2.597 |
| 21.92 | 9.639 | 8.63 | 1.920 | 3.36 | 2.710 |
| 19.50 | 7.095 | 7.63 | 1.947 | 2.99 | 2.776 |
| 17.37 | 5.249 | 6.79 | 2.025 | 2.67 | 2.850 |
| 15.47 | 3.915 | 6.03 | 2.128 | 2.39 | 2.894 |
| Адиабатическая калориметрия (AC) | |||||
| 4.56 | 2.29 | 53.85 | 51.84 | 157.8 | 162.5 |
| 4.63 | 2.41 | 55.5 | 53.97 | 161.3 | 165.2 |
| 4.74 | 2.4 | 57.16 | 56.07 | 164.8 | 167.9 |
| 4.85 | 2.35 | 58.82 | 58.20 | 168.3 | 170.4 |
| 4.97 | 2.34 | 60.48 | 60.39 | 171.8 | 172.9 |
| 5.17 | 2.28 | 62.13 | 62.61 | 175.3 | 175.4 |
| 5.45 | 2.23 | 63.80 | 64.75 | 178.7 | 177.8 |
| 5.74 | 2.18 | 65.46 | 66.73 | 182.3 | 180.2 |
| 6.03 | 2.12 | 67.12 | 68.79 | 185.8 | 182.5 |
| 6.44 | 2.03 | 68.78 | 70.91 | 189.3 | 184.7 |
| 7.05 | 1.99 | 70.44 | 72.82 | 192.8 | 186.9 |
| 7.84 | 1.93 | 72.30 | 75.09 | 196.3 | 189.1 |
| 8.78 | 1.88 | 74.36 | 77.50 | 199.8 | 191.2 |
| 9.71 | 1.91 | 76.43 | 80.19 | 203.9 | 193.6 |
| 10.62 | 2.00 | 78.49 | 82.78 | 208.3 | 196.1 |
| 11.51 | 2.16 | 80.56 | 85.17 | 212.6 | 198.5 |
| 12.46 | 2.43 | 82.63 | 87.46 | 217.0 | 200.9 |
| 13.33 | 2.71 | 84.71 | 89.46 | 221.3 | 202.8 |
| 14.20 | 3.07 | 86.78 | 92.02 | 225.6 | 205.0 |
| 15.05 | 3.49 | 88.85 | 94.89 | 229.8 | 207.3 |
| 15.90 | 3.99 | 90.93 | 97.03 | 234.2 | 209.3 |
| 16.75 | 4.56 | 86.20 | 92.37 | 238.5 | 211.5 |
| 17.58 | 5.17 | 88.41 | 94.92 | 242.8 | 213.6 |
| 18.41 | 5.86 | 90.63 | 97.46 | 247.1 | 215.8 |
| 19.25 | 6.64 | 92.85 | 99.99 | 251.3 | 217.7 |
| 20.07 | 7.40 | 95.08 | 102.5 | 255.6 | 219.5 |
| 21.38 | 8.73 | 97.32 | 105.0 | 259.8 | 221.3 |
| 22.95 | 10.50 | 99.57 | 107.5 | 263.9 | 223.1 |
| 24.53 | 12.35 | 102.5 | 110.6 | 268.1 | 224.8 |
| 26.11 | 14.31 | 105.9 | 114.4 | 272.3 | 226.4 |
| 27.70 | 16.32 | 109.4 | 118.1 | 276.4 | 228.0 |
| 29.30 | 18.41 | 112.9 | 121.7 | 280.5 | 229.6 |
| 30.91 | 20.67 | 106.7 | 115.2 | 284.6 | 231.0 |
| 32.52 | 22.91 | 110.6 | 119.3 | 288.7 | 232.6 |
| 34.14 | 25.04 | 114.2 | 123.1 | 292.7 | 234.1 |
| 35.76 | 27.22 | 117.8 | 126.7 | 296.8 | 235.4 |
| 37.39 | 29.63 | 121.3 | 130.3 | 300.7 | 236.8 |
| 39.02 | 31.90 | 124.9 | 133.7 | 304.6 | 238.2 |
| 40.66 | 34.10 | 128.4 | 137.2 | 311.0 | 240.3 |
| 42.3 | 36.31 | 132.0 | 140.5 | 318.4 | 242.7 |
| 43.94 | 38.51 | 135.6 | 143.8 | 324.8 | 244.6 |
| 45.58 | 40.75 | 139.2 | 147.0 | 331.8 | 246.7 |
| 47.24 | 43.01 | 142.8 | 150.2 | 338.4 | 248.6 |
| 48.89 | 45.25 | 146.5 | 153.3 | 345.6 | 250.6 |
| 50.54 | 47.47 | 150.9 | 157.0 | ||
| 52.19 | 49.66 | 154.4 | 159.8 | ||
Экспериментальные данные по температурной зависимости теплоемкости гафната празеодима в интервале 3.0–345 K сглажены с использованием линейной комбинации ортонормированных полиномов [18]:
(1)
${{C}_{p}} = {\text{ }}\sum {{{A}_{i}}{{{\left[ {1--{\text{exp}}\left( {--0.001T} \right)} \right]}}^{i}}} ,$Таблица 2.
Коэффициенты аппроксимирующего полинома Cp (Дж моль–1 K–1) = ΣAi[1 – exp(–0.001T)]i (уравнение (1)) для интервала температур 3.0–345 K
| i | Ai |
|---|---|
| 0 | 0.381986 |
| 1 | –0.69561 |
| 2 | –2.04339 |
| 3 | 4.640465 |
| 4 | –2.38401 |
| 5 | 5.74687 |
| 6 | –8.67931 |
| 7 | 8.740106 |
| 8 | –6.02801 |
| 9 | 2.860411 |
| 10 | –8.57257 |
| 11 | 1.787394 |
| 12 | –2.03701 |
| 13 | 9.631161 |
Оценка теплоемкости в интервале температур 0–3 K проведена с дополнительным использованием графических данных работы [7] в предположении отсутствия аномалий в области 0–0.5 K. По сглаженным значениям теплоемкости рассчитаны термодинамические функции гафната празеодима в интервале 0–345 K (табл. 3).
Таблица 3.
Сглаженная теплоемкость и термодинамические функции гафната празеодима (пирохлор)
| T, K | $C_{p}^{^\circ },$ Дж моль–1 K–1 | S°(T), Дж моль–1 K–1 | H°(T) – H°(0 K), Дж моль–1 | Φ°(T), Дж моль–1 K–1 |
|---|---|---|---|---|
| 0.1 | 0.42 | 0.21 | 0.021 | 0.000 |
| 0.2 | 0.84 | 0.63 | 0.084 | 0.210 |
| 0.3 | 1.26 | 1.05 | 0.19 | 0.420 |
| 0.4 | 1.70 | 1.47 | 0.34 | 0.628 |
| 0.5 | 2.10 | 1.90 | 0.53 | 0.846 |
| 0.6 | 2.50 | 2.32 | 0.76 | 1.057 |
| 0.7 | 2.80 | 2.73 | 1.02 | 1.267 |
| 0.8 | 2.95 | 3.11 | 1.31 | 1.470 |
| 0.9 | 3.04 | 3.46 | 1.61 | 1.670 |
| 1.0 | 3.16 | 3.79 | 1.92 | 1.869 |
| 1.2 | 3.24 | 4.37 | 2.56 | 2.236 |
| 1.4 | 3.27 | 4.88 | 3.21 | 2.586 |
| 1.6 | 3.26 | 5.31 | 3.87 | 2.894 |
| 1.8 | 3.27 | 5.7 | 4.52 | 3.189 |
| 2.0 | 3.26 | 6.04 | 5.17 | 3.454 |
| 2.5 | 3.10 | 6.76 | 6.76 | 4.058 |
| 3 | 2.917 | 7.31 | 8.28 | 4.551 |
| 4 | 2.603 | 8.121 | 11.04 | 5.361 |
| 5 | 2.322 | 8.679 | 13.50 | 5.979 |
| 6 | 2.091 | 9.085 | 15.70 | 6.468 |
| 7 | 1.923 | 9.397 | 17.71 | 6.867 |
| 8 | 1.829 | 9.649 | 19.59 | 7.200 |
| 9 | 1.817 | 9.864 | 21.41 | 7.485 |
| 10 | 1.891 | 10.06 | 23.27 | 7.733 |
| 15 | 3.624 | 11.08 | 36.15 | 8.670 |
| 20 | 7.458 | 12.60 | 63.10 | 9.445 |
| 25 | 12.88 | 14.83 | 113.4 | 10.29 |
| 30 | 19.28 | 17.73 | 193.5 | 11.28 |
| 35 | 26.16 | 21.21 | 307.0 | 12.44 |
| 40 | 33.16 | 25.16 | 455.3 | 13.78 |
| 45 | 40.08 | 29.47 | 638.4 | 15.28 |
| 50 | 46.83 | 34.04 | 855.8 | 16.92 |
| 60 | 59.80 | 43.74 | 1389 | 20.59 |
| 70 | 72.29 | 53.9 | 2050 | 24.61 |
| 80 | 84.5 | 64.35 | 2834 | 28.93 |
| 90 | 96.42 | 74.99 | 3739 | 33.45 |
| 100 | 107.9 | 85.75 | 4761 | 38.14 |
| 110 | 118.8 | 96.55 | 5895 | 42.96 |
| 120 | 129.0 | 107.3 | 7135 | 47.84 |
| 130 | 138.6 | 118.0 | 8474 | 52.82 |
| 140 | 147.6 | 128.6 | 9906 | 57.84 |
| 150 | 156.1 | 139.1 | 11430 | 62.93 |
| 160 | 164.2 | 149.5 | 13030 | 68.08 |
| 170 | 171.7 | 159.6 | 14710 | 73.09 |
| 180 | 178.7 | 169.7 | 16460 | 78.26 |
| 190 | 185.3 | 179.5 | 18280 | 83.29 |
| 200 | 191.3 | 189.2 | 20160 | 88.39 |
| 210 | 196.9 | 198.6 | 22100 | 93.34 |
| 220 | 202.3 | 207.9 | 24100 | 98.35 |
| 230 | 207.4 | 217 | 26150 | 103.3 |
| 240 | 212.3 | 225.9 | 28250 | 108.20 |
| 250 | 217.0 | 234.7 | 30390 | 113.13 |
| 260 | 221.4 | 243.3 | 32590 | 118.0 |
| 270 | 225.6 | 251.7 | 34820 | 122.7 |
| 280 | 229.4 | 260.0 | 37100 | 127.5 |
| 290 | 233.0 | 268.1 | 39410 | 132.2 |
| 298.15 | 235.9 ± 1.2 | 274.6 ± 2.9 | 41320 ± 230 | 136.0 ± 21.5 |
| 300 | 236.5 | 276.1 | 41760 | 136.9 |
| 310 | 240.0 | 283.9 | 44140 | 141.5 |
| 320 | 243.3 | 291.6 | 46560 | 146.1 |
| 330 | 246.2 | 299.1 | 49000 | 150.6 |
| 340 | 248.9 | 306.5 | 51480 | 155.1 |
| 345 | 250.4 | 310.1 | 52730 | 157.3 |
Температурная зависимость теплоемкости гафната празеодима имеет гладкий S-образный вид и при температурах выше ~20 K не содержит признаков структурных переходов. Низкотемпературная область (0–20 K, вставка на рис. 3), напротив, характеризуется вполне ожидаемым аномальным поведением теплоемкости Pr2Hf2O7, которое впервые было экспериментально зафиксировано в работах [6–9]. На рис. 3 (вставка) представлены экспериментальные значения теплоемкости, полученные нами методами адиабатической (кривая 1) и релаксационной (кривая 2) калориметрии, и данные (кривая 3), приведенные в работе [7] в графическом виде. Из рисунка видно, что все три типа данных хорошо согласуются между собой. Кривая теплоемкости характеризуется максимумом при ~2 K и минимумом при ~8.6–8.8 K. Для сравнения на рис. 3 (вставка) приведена полученная нами [19] температурная зависимость теплоемкости гафната лантана, которая определяется практически только решеточной составляющей Clat, так как аномальные явления у La2Hf2O7 отсутствуют [10]. В области температур около 20 K и выше теплоемкости La2Hf2O7 и Pr2Hf2O7 (вставка на рис. 3) достаточно близки. Это может быть вызвано разнонаправленностью действия на теплоемкость факторов увеличения массы лантаноида и лантаноидного сжатия. По нашей оценке, влияние магнитных аномальных явлений на теплоемкость гафната празеодима заканчивается около 20 K, что позволяет оценить избыточную энтропию как
Используя результаты настоящей работы и данные [18], получим
В соединениях празеодима различного состава и структуры в области самых низких температур могут наблюдаться различные явления: переход из одного магнитного состояния в другое с завершенной переориентацией спинов (например, антиферропарамагнетик у фосфата гадолиния [20]), переход в состояние спинового льда (Pr2Sn2O7 [21]), аномалия Шоттки (например, в Pr(OH)3) [12]), которые характеризуются различной избыточной энтропией. В отличие от перехода парамагнетик–антиферромагнетик, являющегося кооперативным явлением, что определяет относительно узкий температурный интервал протекания такого перехода, при превращении в спиновый лед происходит специфическое упорядочение спинов, аналогичное структуре льда. Аномалия Шоттки имеет иную природу, так как для нее отмечается некооперативный характер. При увеличении температуры происходит постепенное заполнение вышележащих электронных уровней, что приводит к появлению аномальной теплоемкости в виде плавного максимума (bell-like shape). Поскольку энергетические уровни в электронном спектре различных соединений магнитных лантаноидов могут существенно различаться, вид аномальной теплоемкости и температура ее максимумов различны. В отличие от магнитных переходов, имеющих кооперативный характер, который определяет относительно узкий температурный интервал их протекания, аномальная теплоемкость Шоттки присутствует во всей температурной области существования вещества, поэтому ее термодинамические характеристики могут оказывать существенное влияние на расчет энергии Гиббса в широком температурном диапазоне.
Полученное значение избыточной энтропии не позволяет однозначно определить природу аномалии: авторы [6–9] говорят о ее магнитном происхождении, тогда как авторы [12], обнаружившие аналогичную аномалию для Pr(OH)3, считают ее суперпозицией антиферромагнитной аномалии и аномалии Шоттки – взаимодействия 4f-электронной оболочки с кристаллическим полем Pr(OH)3. Кроме того, в работах [6–9] обсуждается возможность образования спинового льда у Pr2Hf2O7, при этом ожидаемое значение избыточной энтропии для состояния спинового льда составляет [22]:
Таким образом, основываясь на том, что полученная величина избыточной энтропии у Pr2Hf2O7 меньше расчетного значения (2Rln2 = = 11.52 Дж моль–1 K–1), можно предположить переход в состояние спинового льда. Однако прямых доказательств существования спинового льда у гафната празеодима, так же как и у Pr2Zr2O7 [23], пока не найдено.
С другой стороны, аномалия теплоемкости Pr2Hf2O7 в области >20 K достаточно хорошо может быть описана как аномалия Шоттки. Вклад аномалии Шоттки в теплоемкость однозначно обнаруживается при более высоких температурах. Определить общий вид температурной зависимости избыточной теплоемкости Cexc можно двумя способами [10, 24]. Первый способ – расчет избыточной теплоемкости по частотам электронных уровней из спектроскопических данных [5, 10], второй – предварительная оценка решеточной теплоемкости Clat и вычитание ее из измеренной теплоемкости [25]:
Как было отмечено выше, решеточная теплоемкость гафната празеодима приблизительно совпадает с теплоемкостью гафната лантана Clat ≈ ≈ Cp(La2Hf2O7), и определить общий вид аномального вклада в теплоемкость можно по разности:
Температурная зависимость аномальной теплоемкости в области 0–300 K, на которой виден ряд пологих максимумов, показана на рис. 4. Нами дано описание полученной зависимости аномальной теплоемкости с помощью предложенной ранее зависимости для описания теплоемкости в модели Шоттки [25] как суммы вкладов (кривая 5) от уровней с частотами 90 (кривая 2), 350 (кривая 3) и 700 см–1 (кривая 4):
(2)
${{C}_{{Sch}}} = R{{(\Delta {\text{/}}T)}^{2}}{{{\text{e}}}^{{\Delta /T}}}{\text{/}}{{(1 + {{{\text{e}}}^{{\Delta /T}}})}^{2}},$Рис. 4.
Вид температурной зависимости избыточной теплоемкости: 1 – избыточная теплоемкость, рассчитанная как разность экспериментальной и решеточной теплоемкости Pr2Hf2O7 (вертикальные штрихи – неопределенность расчета избыточной теплоемкости гафната празеодима). Вычисленный по уравнению (2) вклад теплоемкости для частот: 2 – 90, 3 – 350, 4 – 700 см–1, 5 – сумма рассчитанных вкладов.
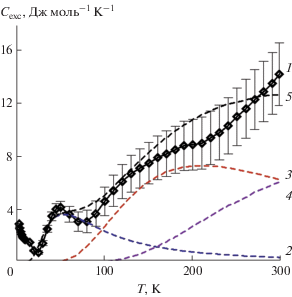
Можно видеть, что избыточная теплоемкость, рассчитанная как разность теплоемкостей гафнатов празеодима и лантана, описывается суммой от трех вкладов с неопределенностью, не превышающей погрешности экспериментального измерения теплоемкости Pr2Hf2O7, хотя вид постоянно увеличивающейся кривой в области температур около 300 K позволяет предположить наличие в спектре уровней с бóльшими энергиями. Полученные при описании избыточной теплоемкости оценочные значения частот удовлетворительно коррелируют с величинами для Pr2O3 [26] и PrPO4 [27].
ЗАКЛЮЧЕНИЕ
Синтезирован и охарактеризован гафнат празеодима со структурой пирохлора (Fd3m). Методами релаксационной и адиабатической калориметрии измерена его молярная теплоемкость в температурном интервале 2.4–345.6 K. С учетом литературных данных по теплоемкости в интервале 0.5–10 K и сглаженных значений температурной зависимости теплоемкости Pr2Hf2O7 выполнен расчет энтропии, приращения энтальпии и приведенной энергии Гиббса, которые при 298 K составляют: $C_{p}^{^\circ }$ (Дж моль–1 K–1) = = 235.9 ± 1.2, S° (Дж моль–1 K–1) = 274.6 ± 2.9, H°(T) – H°(0 K) (Дж моль–1) = 41320 ± 230, Φ° (Дж моль–1 K–1) = 136.0 ± 21.5. Оценена избыточная энтропия Sexc ≈ 10.09 Дж моль–1 K–1 при 0–20 K. Определен общий вид аномалии теплоемкости при температурах >20 K.
Список литературы
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363. https://doi.org/10.1016/jeurceramsoc.2008.01.009
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Шевченко А.В., Лопато Л.М., Зайцева З.А. // Изв. АН СССР. Неорган. материалы. 1984. Т. 20. С. 1530.
Портной К.И., Тимофеева Н.И., Салибеков С.Е., Романович И.В. // Изв. АН СССР. Неорган. материалы. 1970. Т. 6. С. 91.
Tari A. The Specific Heat of Matter at Low Temperatures. Imperial College Press, 2003. 211 p. https://doi.org/10.1142/9781860949395_0006
Anand V.K., Opherden L., Xu J. et al. // Phys. Rev. B. 2016. V. 94. P. 144415. https://doi.org/10.1103/PhysRevB.94.144415
Sibile R., Lhotel E., Hatnean M.C. et al. // Phys. Rev. B. 2016. V. 94. P. 024436. https://doi.org/10.1103/PhysRevB.94.024436
Hatnean M.C., Sibile R., Lees M.R. et al. // J. Phys.: Condens. Matter. 2017. V. 29. P. 075902. https://doi.org/10.1088/1361-648X/29/7/075902
Anand V.K., Islam A.T.M.N., Samartzis A. et al. // J. Cryst. Growth. 2018. V. 498. P. 124. https://doi.org/10.1016/J.jcrysgro.2018.06.011
Westrum E.F. // J. Chem. Thermodyn. 1983. V. 15. P. 305. https://doi.org/10.1016/0021-9614(83)90060-5
Sommers J.A., Westrum E.F. // J. Chem. Thermodyn. 1976. V. 8. P. 1115. https://doi.org/10.1016/0021-9614(76)90119-1
Chirico R.D., Westrum E.F., Gruber J.B., Warmkessel J. // J. Chem. Thermodyn. 1979. V. 11. P. 835. https://doi.org/10.1016/0021-9614(79)90064-8
Gruber J.B., Burriel R., Westrum E.F. // J. Chem. Phys. 1991. V. 95. P. 1964. https://doi.org/10.1063/1.460993
Ryumin M.A., Nikiforova G.E., Tyurin A.V. et al. // Inorg. Mater. 2020. V. 56. P. 97. [Рюмин М.А., Никифорова Г.Е., Тюрин А.В. и др. // Неорган. материалы. 2020. Т. 56. С. 102.]https://doi.org/10.1134/S0020168520010148
Guskov V.N., Tyurin A.V., Guskov A.V. et al. // Ceram. Int. 2020. V. 46. P. 12822. https://doi.org/10.1016/j.ceramint.2020.02.052
Gagarin P.G., Guskov A.V., Guskov V.N. et al. // Ceram. Int. 2021. V. 47. P. 2892. https://doi.org/10.1016/j.ceramint.2020.09072
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051. https://doi.org/10.1351/pac200678112051
Гуревич В.М., Хлюстов В.Г. // Геохимия. 1979. Т. 6. С. 829.
Guskov V.N., Gagarin P.G., Guskov A.V. // Russ. J. Inorg. Chem. 2020. V. 64. P. 1436. https://doi.org/1134/S0036023619110068 [Гуськов В.Н., Гагарин П.Г., Гуськов А.В. // Журн. неорган. химии. 2019. Т. 64. С. 1210.]
Popa K., Jutier F., Wastin F., Konings R.J.M. // J. Chem. Thermodyn. 2006. V. 38. P. 1306. https://doi.org/10.1016/j.jct.2006.02.006
Matsuhira K., Hinatsu Y., Tenya K. et al. // J. Phys. Soc. Jpn. 2002. V. 71. P. 1576. https://doi.org/10.1143/JPSJ.71.1576
Lau G.C., Freitas R.S., Ueland B.G. et al. // Nature Physics. 2006. V. 2. P. 249. https://doi.org/10.1038/nphys270
Hallas A. // Ho2Ge2O7 and Pr2Zr2O7: A tale of two spin ices. University of Manitoba (Canada), 2013.101 p.
Tyurin A.V., Khoroshilov A.V., Ryumin M.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1891. https://doi.org/1034/S0036023620120207 [Тюрин А.В., Хорошилов А.В., Рюмин М.А. и др. // Журн. неорган. химии. 2020. Т. 65. С. 1668.]
Westrum E.F. Jr. // J. Therm. Anal. 1985. V. 30. P. 1209. https://doi.org/10.1007/BF01914288
Gruber J.B., Justice B.H., Westrum E.F. Jr., Zandi B. // J. Chem. Thermodyn. 2002. V. 34. P. 457. https://doi.org/10.1006/jcht.2001.0860
Thiriet C., Konings R.J.M., Javorsky P. et al. // J. Chem. Thermodyn. 2005. V. 37. P. 131. https://doi.org/10.1016/j.jct.2004.07.031
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии