Журнал неорганической химии, 2022, T. 67, № 10, стр. 1373-1378
Рост кристаллов и теплоемкость вольфрамата лития, замещенного молибденом
Н. И. Мацкевич a, *, В. Н. Шлегель a, В. Д. Григорьева a, Д. А. Самошкин a, b, С. В. Станкус b, А. Н. Семерикова a, В. А. Кузнецов a, А. Ю. Новиков a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Институт теплофизики им. С.С. Кутателадзе СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 1, Россия
* E-mail: nata.matskevich@yandex.ru
Поступила в редакцию 17.04.2022
После доработки 29.04.2022
Принята к публикации 05.05.2022
- EDN: FMWUOP
- DOI: 10.31857/S0044457X22100579
Аннотация
Низкоградиентным методом Чохральского выращены монокристаллы вольфрамата лития с содержанием молибдена 10 и 15 мол. %. Показано, что монокристаллы имеют структуру фенакита (пр. гр. $R\bar {3}$). Теплоемкость монокристалла Li2W0.85Mo0.15O4 измерена методом дифференциальной сканирующей калориметрии в температурных интервалах 190–370 и 320–970 K. Теплоемкость в интервале температур 190–970 K хорошо описывается уравнением: Cp = 37.95541 + 0.42875T – 4.87201 × × 10–4T2 + 2.15184 × 10–7T3(Дж/(K моль)). Установлено, что для монокристалла Li2W0.85Mo0.15O4 отсутствуют фазовые переходы во всем исследуемом интервале температур. Это делает данный монокристалл перспективным для поиска редких событий, таких как двойной безнейтринный β-распад и упругое когерентное рассеяние нейтрино на ядрах.
ВВЕДЕНИЕ
Кристаллы молибдатов и вольфраматов различных металлов являются перспективными материалами для создания сцинтилляционных детекторов ионизирующих излучений, используемых в медицине, физике высоких энергий, оптоэлектронике и др. [1–10]. Оптические и люминесцентные характеристики молибдатов и вольфраматов заметно отличаются в зависимости от используемого катиона. Одним из существенных недостатков кристаллов молибдатов и вольфраматов является наличие радиоактивных изотопов катионов, из-за которых кристалл при регистрации редких событий дает постоянный неустранимый фон. В этой связи наиболее интересно исследовать кристаллы, которые не содержат долгоживущих радиоактивных изотопов, мешающих регистрации редких событий, например молибдаты и вольфраматы лития, принадлежащие к структурному типу фенакита Be2SiO4. Материалы на основе таких соединений позволяют сконструировать устройство, способное и генерировать редкие события, и регистрировать их. Например, эти монокристаллы широко используются для решения одной из важнейших задач современной физики элементарных частиц – регистрации безнейтринного двойного β-распада, а также упругого когерентного рассеяния нейтрино на ядрах. В 2017 г. получила старт программа BASKET, цель которой – разработка криогенных болометров, пригодных для обнаружения и измерения упругого когерентного рассеяния нейтрино. В качестве таких болометров подходят сцинтилляционные кристаллы, содержащие тяжелые элементы, например вольфрам и молибден, а также литий для уменьшения радиоактивного фона.
Однако, по данным [1, 5], получение кристаллов незамещенного Li2WO4 методом Чохральского прямой кристаллизацией из расплава со стехиометрическими количествами исходных веществ невозможно из-за фазового перехода шпинель–фенакит (583 K) [11], происходящего при охлаждении кристалла, после которого происходит сильное расширение, приводящее к разрушению кристалла. В попытках решить эту проблему исследователи стали использовать систему Li2MoO4–Li2WO4 [1, 5]. Выбор молибдена в качестве добавки обусловлен сходными свойствами вольфраматов и молибдатов, а также одинаковой фенакитовой структурой. По некоторым данным, в системе Li2MoO4–Li2WO4 при содержании >5 мол. % молибдена фенакитная структура стабилизируется. Поэтому задача роста кристаллов Li2Mo1 – xWxO4 с составом, близким к Li2WO4, и структурой фенакита является актуальной и важной.
В настоящей работе низкоградиентным методом Чохральского были выращены кристаллы вольфрамата лития с содержанием молибдена 10 и 15 мол. %, выполнено их исследование и измерена теплоемкость монокристалла вольфрамата лития с содержанием молибдена 15 мол. %. В литературе отсутствует информация о свойствах кристаллов с таким составом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рост монокристаллов вольфрамата лития, замещенного 10 и 15 мол. % молибдена (Li2W1 –xMoxO4, x = 0.1, 0.15), проводили низкоградиентным методом Чохральского с весовым контролем, разработанным в ИНХ СО РАН [12–14]. Исходными реагентами служили карбонат лития Li2CO3 (ос. ч. 15-2, ТУ 609 589-77, Новосибирский завод редких металлов) и прошедшие глубокую очистку в ИНХ СО РАН оксиды вольфрама WO3 и молибдена MoO3. Очистку проводили по методикам, представленным в работах [15, 16].
Качество и состав исходных материалов имеют огромное значение при выращивании низкофоновых сцинтилляционных кристаллов. Содержание радиоактивных примесей в веществах, как правило, не приводится в сертификатах на них. По этой причине не все вещества можно использовать для выращивания низкофоновых кристаллов. Почти всегда требуется предварительная химическая подготовка исходного материала и вспомогательных веществ для удаления основной массы примесей. Очищение исходных реагентов от примесей, особенно радиоактивных Ra, Th и 40K, необходимо для получения вольфраматов лития с хорошими оптическими характеристиками.
Очистку карбоната лития проводили путем растворения порошка Li2CO3 в муравьиной кислоте, кристаллизации полученного формиата лития и осаждения карбоната лития раствором карбоната аммония. Для получения высокоочищенного WO3 применяли перекристаллизацию метавольфрамата аммония, полученного термолизом твердого паравольфрамата аммония. Очистка оксида молибдена от многих примесей возможна разными способами, в том числе вакуумной возгонкой. Вакуумную возгонку MoO3 с исходным содержанием примесей не более 10 ppm проводили в кварцевом реакторе при температуре 873 K и пониженном давлении со скоростью 50 г/ч. За две операции возгонки содержание многих примесей в очищенном образце снижалось до уровня <1 ppm, кроме содержания примесей Ca, Na, Si. Степень очистки MoO3 возрастала с увеличением количества циклов возгонки.
Исходные порошки тщательно перемешивали в стехиометрических пропорциях и помещали для спекания в тот же платиновый тигель и ростовую установку, в которых затем осуществляли рост кристаллов. Это делали для уменьшения потенциального загрязнения кристаллов. Твердофазный синтез проводили в диапазоне температур 623−723 K при нагреве со скоростью 15 град/ч по реакции:
Полноту прохождения реакции оценивали по изменению веса тигля вследствие улетучивания углекислого газа. Расхождение реального изменения веса с расчетным весом составляло <0.5 вес. %.
Особенность низкоградиентного метода Чохральского (LTG Cz) заключается в аксиальных и радиальных градиентах температур, сниженных на два порядка по сравнению с традиционным методом Чохральского, от более 100 град/см до менее 1 град/см. Благодаря этому нет локальных перегревов расплава, подавляются процессы разложения и улетучивания компонентов расплава. Поскольку кристаллы в течение всего процесса роста находятся в околоравновесных условиях, количество термоупругих напряжений в них значительно меньше. Это особенно важно при работе с такими соединениями, как Li2WO4, для которых характерны полиморфные переходы при изменении температуры.
Уникальная методика роста кристаллов методом Чохральского в условиях низких градиентов температур имеет ряд важных преимуществ, а именно: высокий коэффициент использования шихты (до 90 вес. %) по сравнению с традиционным методом Чохральского, где вес выращенного кристалла составляет 25–30 вес. % от веса загружаемой шихты; низкие потери исходных материалов; высокое качество кристаллов. Первые два качества ставят метод практически вне конкуренции, когда речь идет о росте кристаллов из дорогостоящих обогащенных изотопов. Ростовая установка представляет собой камеру с печью [12–14] и механизмом вытягивания и вращения штока. Камера с печью находится внутри водоохлаждаемой оболочки, на верхней плите камеры установлен механизм подъема и вращения штока, на нижней плите – крепление датчика весов. Печь, используемая в ростовой установке, состоит из секционного нагревателя (зоны 1, 2, 3), слоя теплоизоляции, кожуха и крышки с отверстием для затравкодержателя.
Процесс роста кристаллов управляется системой для автоматического контроля диаметра сечения кристалла. Перед каждым экспериментом вводили следующие данные: геометрию кристалла, длину и сечение на каждом участке, скорость кристаллизации, скорость вращения, распределение температуры по зонам, коэффициент регулирования для устранения рассогласования реального и программного веса кристалла.
По завершении твердофазного синтеза температуру в тигле увеличивали до 998 K со скоростью 60 град/ч и выдерживали не менее 3 ч до полной гомогенизации расплава. Затем температуру понижали до температуры затравления со скоростью 50 град/ч и параллельно в тигель через патрубок крышки опускали платиновый затравкодержатель, закрепленный на сапфировом стержне. Первые процессы роста проводили на платине затравкодержателя, где вырастал поликристалл. Из полученного поликристалла были изготовлены затравки, используемые в последующих ростовых процессах для получения монокристаллов. Скорость вращения в процессе роста составляла 20 об./мин, скорость кристаллизации – 0.6 мм/ч.
Решить проблему повышения выхода монокристаллов удалось, доведя градиенты температуры в зоне кристаллизации до уровня ~0.1–1 град/см. После завершения программы роста готовый кристалл отрывали от поверхности расплава и охлаждали со скоростью 60 град./ч.
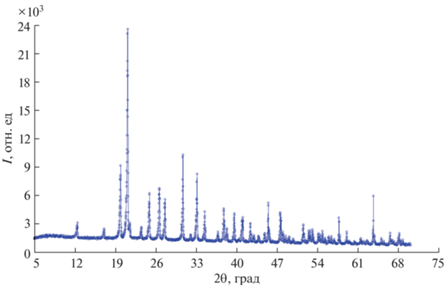
Рентгенофазовый анализ монокристаллов Li2W0.85Mo0.15O4 и Li2W0.9Mo0.1O4 проводили на дифрактометре Shimadzu XRD-7000 (шаг 0.05°, 10°–70°, CuKα-излучение).
Измерения теплоемкости монокристалла Li2W0.85Mo0.15O4 проводили в температурных интервалах 190–370 и 320–970 K на установке DSC 404 F1 с использованием платиновых тиглей с корундовыми вкладышами и платиновых крышек со скоростью нагрева 6 град/мин в проточной атмосфере аргона (20 мл/мин). Методика проведения измерений детально описана в работах [17–19]. Для измерения теплоемкости из выращенного монокристалла были вырезаны цилиндры размером 1.5 × 5 мм со шлифованными основаниями. Такие цилиндры помещали непосредственно в тигель для обеспечения необходимого теплового контакта с его поверхностью. Образцы взвешивали на электронных весах AND GH-252 с погрешностью не более 0.03 мг. Масса навески для измерения в области температур 190–370 K составляла 73.52 мг. Масса образца для измерения высокотемпературной теплоемкости составляла 73.46 мг. После проведения всех измерений масса образцов не изменялась. Перед проведением каждого термического цикла рабочий объем установки откачивали до вакуума 1 Па и несколько раз промывали аргоном, чистота которого составляла 99.992 об. %, а основными примесями являлись, об. %: O2 – 0.0001; N2 – 0.0005; H2O – 0.0004; CO2 – 0.00002; CH4 – 0.0001; H2 – 0.0001. В качестве калибровочного образца использовали сапфир массой 85.26 мг.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1, 2 представлены выращенные монокристаллы вольфрамата лития, замещенного 15 и 10 мол. % молибдена.
Рентгенофазовый анализ подтвердил структуру фенакита (пр. гр. $R\bar {3}$) в образцах Li2W0.9Mo0.1O4 и Li2W0.85Mo0.15O4. Типичная дифрактограмма образцов представлена на рис. 3. Параметры решетки для Li2W0.85Mo0.15O4: a = b = 14.354(4) Å, c = 9.599(5) Å. Параметры решетки для Li2W0.9Mo0.1O4: a = b = 14.357(4) Å, c = 9.601(5) Å. Параметры решетки были определены при температуре 295 K. Для замещенных вольфраматов лития провели энергодисперсионный, химический и масс-спектрометрический анализы. Согласно проведенным анализам, кристаллы имеют высокую радиационную чистоту (содержание K составляет 91 ppb, Ra – 54 ppb, Th – 45 ppt, U – 8 ppt) и монокристаллы близки к формулам Li2W0.9Mo0.1O4 и Li2W0.85Mo0.15O4.
Для измерения теплоемкости монокристалла Li2W0.85Mo0.15O4 проводили три термических цикла. Данные по теплоемкости второго и третьего нагрева хорошо согласуются между собой, но отличаются от данных первого нагрева. Это связано с тем, что при первом нагреве происходит отжиг образца и выделение с его поверхности абсорбированных примесей.
Полученные значения величин теплоемкости соединения Li2W0.85Mo0.15O4 (третий нагрев) для интервала температур 190–370 K приведены на рис. 4 (кривая 1). Полученные значения величин теплоемкости соединения Li2W0.85Mo0.15O4 для интервала температур 320–970 K (третий нагрев) также представлены на рис. 4 (кривая 2).
Для сглаживания теплоемкости использовали разные полиномы. Сглаживание теплоемкости проводили для обоих температурных интервалов одним полиномом. Показано, что наилучший результат при сглаживании теплоемкости Li2W0.85Mo0.15O4 во всем исследуемом интервале температур 190–970 K достигается с помощью полинома третьей степени: Cp = 37.95541 + 0.42875 T – – 4.87201 × 10–4T 2 + 2.15184 × 10–7T3 (Дж/(K моль)). Сглаживание проводили по программам БНД СМЭТ (Банк данных по свойствам материалов электронной техники). Отклонение экспериментально измеренной теплоемкости от сглаженного значения во всем температурном интервале не превышало 1.5%.
Как видно из рис. 4, температурная зависимость теплоемкости Li2W0.85Mo0.15O4 меняется плавно, какие-либо аномалии отсутствуют. Таким образом, полученные впервые данные по теплоемкости для соединения Li2W0.85Mo0.15O4 свидетельствуют об отсутствии фазовых переходов в интервале температур 190–970 K.
В настоящей работе с использованием низкоградиентного метода Чохральского впервые выращены два монокристалла состава Li2W0.85Mo0.15O4 и Li2W0.9Mo0.1O4. Кристаллы являются низкофоновыми. Содержание радиоактивных примесей составляет: Ra – 54 ppb, Th – 45 ppt, U – 8 ppt. Низкофоновость кристаллов достигнута за счет специальной очистки карбоната лития, оксида вольфрама и оксида молибдена. Теплоемкость монокристалла вольфрамата лития, замещенного 15 мол. % молибдена, впервые измерена методом дифференциальной сканирующей калориметрии в двух температурных интервалах: 190–370 и 320–970 K. Как было установлено, для этого соединения отсутствуют фазовые переходы. Это делает его перспективным для практики.
Следует отметить, что низкофоновость монокристаллов очень важна для практики и позволяет использовать эти кристаллы для исследования процессов, связанных с когерентным рассеянием нейтрино.
Замечено, что в литературе крайне мало информации по изучению теплоемкости соединений в системе Li2MoO4–Li2WO4 [20–25]. Так, в работe [20] методом калориметрии смешения изучена высокотемпературная теплоемкость Li2MoO4 и Li2WO4. Показано, что температурная кривая для Li2MoO4 является плавной, а температурная кривая для Li2WO4 имеет излом выше 964 K. В работах [21–25] измерена низкотемпературная теплоемкость Li2MoO4 и вольфрамата лития, замещенного 5 мол. % молибдена.
ЗАКЛЮЧЕНИЕ
Впервые низкоградиентным методом Чохральского получены монокристаллы Li2W0.9Mo0.1O4 и Li2W0.85Mo0.15O4, имеющие соответственно длину 50 и 30 мм, диаметр 50 и 20 мм. Рентгенофазовый анализ определил структуру фенакита (пр. гр. $R\bar {3}$). Измерения теплоемкости соединения Li2W0.85Mo0.15O4 в интервалах температур 190–370 и 320–970 K проведены впервые. Экспериментальные данные по теплоемкости Li2W0.85Mo0.15O4 показывают отсутствие фазовых переходов.
Список литературы
Barinova O., Sadovskiy A., Ermochenkov I. et al. // J. Cryst. Growth. 2017. V. 468. P. 365. https://doi.org/10.1016/j.jcrysgro.2016.10.009
Gavrichev K.S., Smirnova N.N., Khoroshilov A.V. et al. // Russ. J. Inorg. Chem. 2007. V. 52. P. 727. https://doi.org/10.1134/S0036023607050129
Matskevich N.I., Shlegel V.N., Sednev A.L. et al. // J. Chem. Thermodyn. 2020. V. 143. P. 106059. https://doi.org/10.1016/j.jct.2020.106059
Simonenko T.L., Bocharova V.A., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1779. https://doi.org/10.1134/S0036023621120160
Aliane A., Avetissov I., Barinova O. et al. // Nucl. Instrum. Methods Phys. Res., Sect. A. 2020. V. 949. P. 162 784. https://doi.org/10.1016/j.nima.2019.162784
Fattakhova Z.A., Vovkotrub E.G., Zakharova G.Z. // Russ. J. Inorg. Chem. 2021. V. 66. P. 35. https://doi.org/10.1134/S0036023621010022
Kustov L.M., Kustov A.L., Salmi T. // Mendeleev Commun. 2022. V. 32. P. 1. https://doi.org/10.1016/j.mencom.2022.01.001
Xu F., Zhang G., Luo M. et al. // Nat. Sci. Rev. 2021. V. 8. P. 104. https://doi.org/10.1093/nsr/nwaa104
Khoroshilov A.V., Sharpataya G.A., Gavrichev K.S. et al. // Russ. J. Inorg. Chem. 2012. V. 57. P. 1123. https://doi.org/10.1134/S0036023612080074
Makarova M.V., Kazin P.E., Tretyakov Yu.D. et al. // Physica C. 2005. V. 419. P. 61. https://doi.org/10.1016/j.physc.2004.12.003
Pistorius C.W.F.T. // J. Solid State Chem. 1975. V. 13. P. 325. https://doi.org/10.1016/0022-4596(75)90147-4
Atuchin V.V., Bekenev V.L., Borovlev Yu.A. et al. // J. Opt. Adv. Mater. 2017. V. 19. P. 86.
Pandey I.R., Karki S., Daniel D.J. et al. // J. Alloys Compd. 2021. V. 860. P. 158510. https://doi.org/10.1016/j.jallcom.2020.158510
Grigorieva V.D., Shlegel V.N., Borovlev Y.A. et al. // J. Cryst. Growth. 2019. V. 523. P. 125144. https://doi.org/10.1016/0022-4596(75)90147-4
Berge L., Boiko R.S., Chapellier M. et al. // JINST. 2014. P06004. https://doi.org/10.1088/1748-0221/9/06/P06004
Ivanov I.M., Stenin Yu.G., Shlegel V.N. et al. // Inorg. Mater. 2008. V. 44. P. 1330. https://doi.org/10.1134/S0020168508120121
Matskevich N.I., Wolf T., Le Tacon M. et al. // J. Therm. Anal. Calorim. 2017. V. 130. P. 1125. https://doi.org/10.1007/s10973-017-6493-z
Uspenskaya I.A., Vakhovskaya Z.S., Efremova M.M. et al. // Russ. J. Phys. Chem. A. 2006. V. 80. P. 529. https://doi.org/10.1134/S0036024406040078
Samoshkin D.A., Agazhanov A.Sh., Stankus S.V. // J. Phys.: Conf. Series. 2021. V. 2119. P. 012138. https://doi.org/10.1088/1742-6596/2119/1/012138
Denielou L., Petitet J.P., Tequi C. // J. Chem. Thermodyn. 1975. V. 7. P. 901. https://doi.org/10.1016/0021-9614(75)90100-7
Velazquez M., Veber P., Moutatouia M. // Solid State Sci. 2017. V. 65. P. 41. https://doi.org/10.1016/j.solidstatesciences.2016.12.006
Musikhin A.E., Naumov V.N., Bespyatov M.A. et al. // J. Alloys Compd. 2015. V. 639. P. 145. https://doi.org/10.1016/j.jallcom.2015.03.159
Musikhin A.E., Bespyatov M.A., Kuzin T.M. et al. // J. Phys.: Conf. Ser. 2021. V. 2119. P. 012137. https://doi.org/10.1088/1742-6596/2119/1/012137
Gamsjager E., Wiessner M. // Monatsh Chem. 2018. V. 149. P. 357. https://doi.org/10.1007/s00706-017-2117-3
Naumov V.N., Musikhin A.E. // Comput. Mater. Sci. 2017. V. 130. P. 257. https://doi.org/10.1016/j.commatsci.2017.01.025
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии