Журнал неорганической химии, 2022, T. 67, № 10, стр. 1453-1458
Термодинамические характеристики реакций комплексообразования серебра(I) с некоторыми N- и N,N'-замещенными тиомочевинами в водном растворе
А. С. Самадов a, *, И. В. Миронов b, Г. З. Казиев a, А. Г. Чередниченко c, Э. Ф. Файзуллозода d, А. Ф. Степнова a, c
a Московский педагогический государственный университет
129164 Москва, ул. Кибальчича, 6, корп. 3, Россия
b Институт неорганической химии СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
c Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
d Таджикский национальный университет
734025 Душанбе, пр-т Рудаки, 17, Таджикистан
* E-mail: s.s.rasul@mail.ru
Поступила в редакцию 27.12.2021
После доработки 28.03.2022
Принята к публикации 27.04.2022
- EDN: FEZBIU
- DOI: 10.31857/S0044457X22100257
Аннотация
Потенциометрическим методом в водном растворе изучены реакции комплексообразования серебра(I) с тиомочевиной (Tu), N-фенилтиомочевиной (Phtu), N,N'-дифенилтиомочевиной (Bphtu), N-ацетилтиомочевиной (Aсtu) и тиосемикарбазидом (Tsc) в интервале температур 278.2–328.2 K при ионной силе I = 0.11 моль/л (0.1 NaNO3 + 0.01 HNO3). Показано, что процесс проходит с образованием комплексов различного состава согласно схеме Ag+ + i L = ${\text{AgL}}_{i}^{ + }$, где i = 1–3 и $С_{{{\text{A}}{{{\text{g}}}^{ + }}}}^{0}$ = = (1–5) × 10–5 моль/л. Определены термодинамические характеристики (lgβi, ΔrG0, ΔrH0 и ΔrS0) этих реакций. Установлено, что максимальный рост экзотермичности (ΔrH0) наблюдается для второй ступени комплексообразования: AgL+ + L = ${\text{AgL}}_{2}^{ + }.$ Исключением является реакция с тиосемикарбазидом. Устойчивость монокоординированных комплексов изменяется в ряду: Aсtu < Tsc < < Bphtu < Phtu < Tu, что хорошо коррелирует с константами протонирования органических лигандов. Для комплексов типа ${\text{AgL}}_{2}^{ + }$ и ${\text{AgL}}_{3}^{ + }$ с Phtu и Bphtu данная закономерность нарушается, что связано с влиянием фенильных заместителей на комплексообразующие свойства этих производных тиомочевины.
ВВЕДЕНИЕ
Изучение равновесий в водных растворах соединений серебра(I) с тиомочевиной и ее производными представляет научный и практический интерес. Эти результаты могут быть использованы в гидрометаллургии при извлечении благородных металлов и серебра из вторичного сырья (электронный лом, ювелирные изделия и др.) [1–5]. В этом случае производные тиомочевины представляют собой селективные комплексообразующие агенты, способствующие эффективному извлечению требуемого компонента [6]. Другой областью применения комплексов серебра с серосодержащими органическими лигандами является медицина. Эти соединения могут проявлять широкий спектр антибактериальной [7, 8], противовирусной [9] и противоопухолевой [10] активности. Таким образом, определение констант равновесий образующихся комплексов в водном растворе и влияния температуры на их устойчивость является актуальной и практически важной задачей.
Известно, что при взаимодействии серебра(I) с тиомочевиной и ее производными могут образовываться моно- и биядерные комплексы. В некоторых случаях эти соединения синтезированы, выделены в виде индивидуальных веществ и охарактеризованы [11–15]. Установлено, что в моноядерных комплексах Ag+ координируется с атомом серы лиганда, а в биядерных комплексах между атомами серы может образовываться мостиковая связь. Исследованы равновесия образования моно- и биядерных комплексов Ag(I) с тиомочевиной и некоторыми ее N-замещенными производными в водном растворе при 25°С с применением потенциометрических и спектрофотометрических методов анализа [16–20]. Установлено, что при низких концентрациях комплексообразователя (${{С}_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ < 1 × 10–4 моль/л) в растворе преимущественно присутствуют моноядерные комплексы [17], а при более высоких концентрациях – биядерные [16, 21]. Данные о константах устойчивости комплексов Ag(I) с N-фенилтиомочевиной (Phtu), N,N'-дифенилтиомочевиной (Bphtu), N-ацетилтиомочевиной (Aсtu) и тиосемикарбазидом (Tsc) при разных температурах и термодинамических характеристиках этих процессов в научной и технической литературе отсутствуют.
Цель работы – определение термодинамических характеристик равновесных реакций комплексообразования ионов серебра(I) с тиомочевиной (Tu), N-фенилтиомочевиной (Phtu), N,N'-дифенилтиомочевиной (Bphtu), N-ацетилтиомочевиной (Aсtu) и тиосемикарбазидом (Tsc) в водном растворе при 278.2–328.2 K и ионной силе 0.11 моль/л (0.1 NaNO3 + 0.01 HNO3).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения исследований использовали нитрат серебра(I) “ч. д. а.”, нитрат натрия “х. ч.”, тиомочевину (Tu) “оc. ч.”, N-фенилтиомочевину (Phtu) “х. ч.”, N,N'-дифенилтиомочевину (Bphtu) “х. ч.”, N-ацетилтиомочевину (Actu) “х. ч.”, тиосемикарбазид (Tsc) “х. ч.”. Исследования выполняли с помощью потенциометрического метода анализа. Индикаторным электродом служила серебряная проволока (содержание серебра >99.99%), а электродом сравнения – хлорсеребряный электрод. Солевой мост заполняли насыщенным раствором KNO3 во избежание образования AgCl на границе с исследуемым раствором. ЭДС системы измеряли с помощью прибора Эксперт-001. Потенциометрическое титрование проводили в интервале температур 278.2–318.2 K с использованием жидкостного термостата U15. Отклонение температуры от заданных значений не превышало ±0.1°С. Предварительные проверки обратимости серебряного электрода при отсутствии лигандов и при разных температурах показали, что в этих условиях ${{С}_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ = [Ag+]. Наклон зависимости E = = E∅+ θlgCAg в исследуемом интервале температур (θ) составлял от 55 до 63 мВ/pAg с возможным отклонением ±2 мВ, что соответствует теоретическому значению электродной функции. В ходе проведенных экспериментов применяли растворы AgNO3 и лигандов с концентрациями СAg = = (1–5) × 10–5 моль/л и СL = (0.1–10) × 10–2 моль/л. Все растворы готовили непосредственно перед началом экспериментов с использованием прокипяченной дистиллированной воды. Ионную силу системы поддерживали постоянной раствором 0.1 моль/л NaNO3 и 0.01 моль/л HNO3. Стакан с рабочим раствором (30 мл) был закрыт крышкой с четырьмя отверстиями: для Ag-электрода, ввода титранта, термометра и трубки солевого мостика. Отверстия снабжены манжетами, обеспечивающими герметичность соединений. В ходе эксперимента раствор с заданной концентрацией $С_{{{\text{Ag}}}}^{0}$ титровали раствором лигандов и измеряли потенциал серебряного электрода.
Обработку экспериментальных данных для расчета констант устойчивости проводили с помощью нелинейного метода наименьших квадратов [16, 22]. Для этого на основе известных аналитических концентраций компонентов (${{С}_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ и CL) с использованием констант равновесия первого приближения рассчитывали концентрации образующихся комплексов (${\text{AgL}}_{i}^{ + },$ i = 1–3). Равновесные концентрации ионов [Ag+] определяли с помощью уравнения Нернста: ∆E = E – E0 = = θlg ([Ag+]/$C_{{{\text{Ag}}}}^{0}$) = $ - {{\theta }}\lg (1 + \sum {{{{\beta }}}_{i}} \cdot {{[{\text{L}}]}^{i}})$, где Е0 – потенциал Ag-электрода при СL = 0 в исходном растворе с $C_{{{\text{Ag}}}}^{0}.$ Из рассчитанных ∆Eрасч и экспериментальных ∆Eэксп значений потенциалов находили функцию S2 = ∑(∆Eрасч – ∆Eэксп). Далее, варьируя величины констант, последовательно минимизировали среднее квадратичное отклонение S2, чтобы его значение по каждой экспериментальной точке составляло не более 1.5 мВ. Такие расчеты проводили для всех серий титрования при разных температурах. Стандартные отклонения lg βi оценивали при доверительном интервале P = 0.95 [17].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Потенциометрическое титрование проводили при ${{С}_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ = (1–5) × 10–5 моль/л и T = 278.2–318 K. В случае низких концентраций комплексообразователя в изучаемых системах протекает моноядерное комплексообразование согласно схеме:
(1)
${\text{A}}{{{\text{g}}}^{ + }} + i{\text{L}} = {\text{AgL}}_{i}^{ + },{\text{ }}{{\beta }_{i}}.~~~~$В качестве примера можно рассмотреть результаты потенциометрического титрования для тиосемикарбазидных комплексов серебра(I) при разных температурах (рис. 1). При титровании для всех лигандов максимальное изменение значения потенциала наблюдали при соотношении CL/CAg ~ 2.0, что свидетельствует об образовании устойчивых комплексов ${\text{AgL}}_{2}^{ + }.$ Кроме того, при СL < 0.01 моль/л при разных исследуемых температурах и различных лигандах значение наклона зависимости (ΔE/Δlg CL)CAg = 126–138 мВ (рис. 1а), а при СL ≥ 0.01 моль/л эта величина составляет (ΔE/ΔlgCL)CAg = 180–196 мВ (рис. 1б), что соответствует теоретическому значению (110–126 и 166–189 мВ/лог. ед. соответственно). Вышеуказанные рассуждения подтверждает рассмотрение частных производных ${{d\lg F} \mathord{\left/ {\vphantom {{d\lg F} {d\lg [{\text{L}}]}}} \right. \kern-0em} {d\lg [{\text{L}}]}} = \bar {n},$ $F = 1 + \sum {{\beta }_{i}}{{[Tsc]}^{i}},$ где функция образования ($\bar {n}$) варьирует от 0 до 3. Такие концентрационные зависимости наблюдали для всех лигандов, кроме систем с N,N'-дифенилтиомочевиной, и при всех используемых температурах. Этот экспериментальный факт указывает на то, что в исследуемых системах образуются комплексы состава ${\text{AgL}}_{2}^{ + }$ и ${\text{AgL}}_{3}^{ + }.$ Значения констант устойчивости моно- и бис-координированных комплексов рассчитывали при СL < 0.01 моль/л, а константы трис-координированных комплексов были определены при более высоких концентрациях лигандов (СL ≥ 0.01 моль/л). Величину константы устойчивости комплекса AgBphtu$_{3}^{ + }$ не удалось определить из-за низкой растворимости N,N'-дифенилтиомочевины (СBphtu ~ (4–5) × 10–5 моль/л). Значения логарифмов констант устойчивости комплексов Ag+ с тиомочевиной и ее N- и N,N'-замещенными в интервале температур 278.2–318.2 K для реакции Ag+ + iL = ${\text{AgL}}_{i}^{ + }$ (i = 1–3) приведены в табл. 1.
Рис. 1.
Зависимости потенциала серебряного электрода от логарифма общей концентрации тиосемикарбазида и ${{С}_{{{\text{A}}{{{\text{g}}}^{ + }}}}}$ = = 1 × 10–5 (а); 5 × 10–5 моль/л (б). Т = 278.2 (1); 288.2 (2); 298.2 (3); 308.2 (4); 318.2 K (5). Точки соответствуют экспериментальным данным, сплошная линия – расчетным.
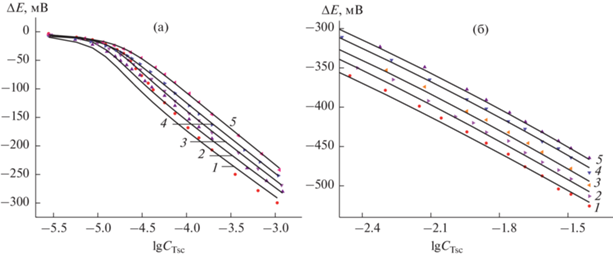
Таблица 1.
Значения логарифмов констант устойчивости комплексов Ag(I) с тиомочевиной и ее производными при 278.2–318.2 K, I = 0.11 моль/л (0.1 NaNO3 + 0.01 HNO3)
| Лиганд | lg βi | 278.2 K | 288.2 K | 298.2 K | 308.2 K | 318.2 K |
|---|---|---|---|---|---|---|
| Tu pKTu = 1.15 [24] |
1 | 5.85 ± 0.10 | 5.70 ± 0.06 | 5.61 ± 0.10 [16] | 5.33 ± 0.10 | 5.14 ± 0.09 |
| 2 | 11.68 ± 0.08 | 11.07 ± 0.05 | 10.62 ± 0.03 [16] | 10.24 ± 0.04 | 9.85 ± 0.03 | |
| 3 | 14.25 ± 0.15 | 13.69 ± 0.10 | 13.05 ± 0.11 [16] | 12.53 ± 0.08 | 12.00 ± 0.08 | |
| Tsc pKTsc = 1.85 [23] |
1 | 5.90 ± 0.11 | 5.68 ± 0.09 | 5.41 ± 0.10 [16] | 5.23 ± 0.04 | 4.96 ± 0.04 |
| 2 | 11.34 ± 0.10 | 10.86 ± 0.08 | 10.36 ± 0.03 [16] | 10.06 ± 0.05 | 9.73 ± 0.06 | |
| 3 | 13.5 ± 0.15 | 12.95 ± 0.08 | 12.47 ± 0.10 [16] | 11.84 ± 0.06 | 11.50 ± 0.03 | |
| Actu – |
1 | 5.31 ± 0.10 | 5.15 ± 0.08 | 4.92 ± 0.04 [16] | 4.86 ± 0.08 | 4.65 ± 0.06 |
| 2 | 9.84 ± 0.06 | 9.42 ± 0.09 | 9.01 ± 0.07 [16] | 8.63 ± 0.03 | 8.19 ± 0.05 | |
| 3 | 12.24 ± 0.10 | 11.73 ± 0.09 | 11.01 ± 0.10 [16] | 10.61 ± 0.08 | 9.92 ± 0.07 | |
| Phtu pKPhtu = 1.59 [24] |
1 | 5.80 ± 0.10 | 5.69 ± 0.05 | 5.58 ± 0.08 [16, 17] | 5.29 ± 0.10 | 5,13 ± 0.08 |
| 2 | 11.86 ± 0.15 | 11.32 ± 0.10 | 10.77 ± 0.06 [16, 17] | 10.32 ± 0.03 | 9.94 ± 0.06 | |
| 3 | 15.81 ± 0.20 | 15.12 ± 0.12 | 14.19 ± 0.09 [16, 17] | 13.44 ± 0.10 | 12.79 ± 0.04 | |
| Bphtu pKBphtu = 1.80 [24] |
1 | 5.11 ± 0.06* | – | 5.56 ± 0.10 [16] | 5.40 ± 0.08 | 5.27 ± 0.08 |
| 2 | 10.05 ± 0.05* | – | 11.32 ± 0.09 [16] | 10.80 ± 0.15 | 10.44 ± 0.09 |
Анализ полученных результатов при ступенчатом комплексообразовании показал, что значения констант для трис-координированного комплекса ${\text{AgL}}_{3}^{ + }$ с использованными лигандами, кроме фенилтиомочевинных комплексов, заметно меньше, чем для моно- и бис-координированных комплексов. Это связано с необходимостью избыточного присоединения лигандов (более двух), что нехарактерно для ионов серебра (координационное число (КЧ) = 2). Увеличение температуры закономерно приводит к уменьшению устойчивости комплексов для отдельных стадий комплексообразования. Значения констант монокоординированных N- и N,N'-замещенных комплексов ниже, чем монокоординированных тиомочевинных комплексов. В ряду Actu < Tsc < Bphtu < < Phtu < Tu устойчивость комплексов увеличивается. Данная закономерность прослеживается также с константами равновесия (KH лигандов) реакции протонирования лигандов L + H+ = HL+ (pKTsc = = 1.85 [23], pKBphtu = 1.80, pKPhtu = 1.59, pKTu = 1.15 [24]). Поскольку в исследованных производных тиомочевины атом водорода замещен на электроноакцепторные фрагменты ацетильных и фенильных групп, их влияние приводит к уменьшению основных свойств атома серы в лигандах и способствует уменьшению устойчивости комплексов. Установлено, что константа устойчивости N-ацетилтиомочевинных комплексов на 0.5–2.0 лог. ед. ниже, чем остальных комплексов, это связано с уменьшением донорных свойств атома серы лиганда за счет влияния ацетильной группы. Таким образом, полученные значения констант монокоординированных комплексов lg β1 (табл. 1) удовлетворительно коррелируют с константами протонирования соответствующих лигандов, что соответствует имеющимся литературным данным [25].
Характерно, что устойчивость бис- и трис-координированных комплексов изменяется следующим образом: Actu < Tsc < Tu < Phtu < Bphtu. Для второй и третьей ступени комплексообразования серебра с Phtu и Bphtu наблюдается исключение из общей закономерности, характерной для первой ступени. Действительно, влияние фенильных заместителей на константы устойчивости комплексов может быть различным. С одной стороны, происходит снижение донорных свойств атома серы, а с другой – на устойчивость влияют гидрофобные свойства фенильных заместителей. Вклад каждого из эффектов определяет наблюдаемый результат для конкретного случая. Если комплекс имеет низкую устойчивость, то влияние гидрофобных свойств арильных заместителей можно не учитывать. Для высокоустойчивых комплексов серебра(I) влияние гидрофобных свойств таких заместителей, например на устойчивость бис- и трис-координированных комплексов, превосходит эффект от снижения донорных свойств серы, связанных с константой протонирования.
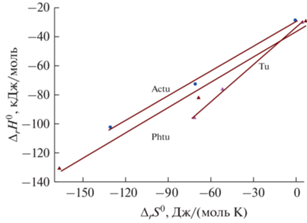
В ходе проведенных исследований с использованием уравнения Вант–Гоффа ∆G0 = –RTlnβi = = ∆H0 – T∆S0 были рассчитаны значения энергии Гиббса (ΔrG0), энтальпии (ΔrH0) и энтропии (ΔrS0) реакций образования комплексов Ag+ + iL = = ${\text{AgL}}_{i}^{ + },$ i = 1–3 (рис. 2). Термодинамические характеристики (ΔrG0, ΔrH0 и ΔrS0) реакций образования комплексов серебра(I) с тиомочевиной и некоторыми ее производными приведены в табл. 2. Видно, что для всех лигандов величина энергии Гиббса (ΔrG0, кДж/моль) имеет отрицательные значения, что говорит о самопроизвольном протекании процессов в водных растворах. При ступенчатом комплексообразовании Ag+ + iL = ${\text{AgL}}_{i}^{ + }$ и увеличении КЧ сродство ионов металла к лиганду уменьшается (особенно для трис-координированных комплексов) в следующей последовательности: ${{\Delta }_{r}}G_{1}^{0}$ < ${{\Delta }_{r}}G_{2}^{0}$ < ${{\Delta }_{r}}G_{3}^{0}.$
Рис. 2.
Зависимости lg βi от обратной температуры для комплексов серебра(I) с Tsc, AgTsc+ (1); ${\text{AgTsc}}_{2}^{ + }$ (2); ${\text{AgTsc}}_{3}^{ + }$ (3).
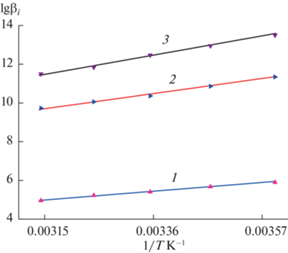
Таблица 2.
Термодинамические характеристики реакций комплексообразования Ag(I) с Tu и ее производными при 298.2 К (Ag+ + i L = ${\text{AgL}}_{i}^{ + }{\text{,}}$ i = 1–3)
| Лиганд | ${\text{AgL}}_{i}^{ + }$ | lg βi | ΔrG0, кДж/моль | ΔrH0, кДж/моль | ΔrS0, Дж/(моль K) |
|---|---|---|---|---|---|
| Tu | 1 | 5.51 | –31.45 ± 0.31 | –30.17 ± 0.64 | 4.31 ± 0.87 |
| 2 | 10.66 | –60.88 ± 0.18 | –76.31 ± 0.32 | –51.79 ± 0.25 | |
| 3 | 13.07 | –74.59 ± 0.52 | –95.92 ± 0,76 | –71.54 ± 0.55 | |
| Tsc | 1 | 5.43 | –31.00 ± 0.37 | –41.37 ± 0.65 | –34.77 ± 2.37 |
| 2 | 10.46 | –59.72 ± 0.28 | –71.40 ± 0.24 | –39.18 ± 0.46 | |
| 3 | 12.44 | –71.02 ± 0.62 | –90.77 ± 1.52 | –66.25 ± 2.15 | |
| Actu | 1 | 4.97 | –28.40 ± 0.24 | –28.59 ± 0.15 | –0.63 ± 0.05 |
| 2 | 9.01 | –51.43 ± 0.34 | –72.59 ± 0.81 | –70.97 ± 2.07 | |
| 3 | 11.09 | –63.31 ± 0.87 | –102.30 ± 0.35 | –130.77 ± 2.42 | |
| Phtu | 1 | 5.49 | –31.32 ± 0.34 | –29.30 ± 0.74 | 6.79 ± 1.08 |
| 2 | 10.81 | –61.71 ± 0.55 | –82.18 ± 1.21 | –68.64 ± 0.38 | |
| 3 | 14.22 | –81.17 ± 0.83 | –130.84 ± 2.71 | –166.58 ± 1.44 | |
| Bphtu | 1 | 5.56 | –31.75 ± 0.35 | –27.71 ± 0.82 | 13.55 ± 2.50 |
| 2 | 11.29 | –64.47 ± 0.46 | –78.23 ± 0.25 | –46.17 ± 0.64 |
В изученных системах протекают экзотермические реакции, и наблюдаемое изменение энтальпии ΔrH0 благоприятствует образованию комплексов. Максимальное смещение величины ${{\Delta }_{r}}H_{2}^{0}$ при ступенчатом комплексообразовании в отрицательную область наблюдается при образовании комплексов ${\text{AgL}}_{2}^{ + }{\text{.}}$ Например, для тиомочевины ${{\Delta }_{r}}H_{2}^{0}$ ~ –46.0 кДж/моль, а значения энтальпий для других лигандов находятся в диапазоне ±5.0 кДж/моль от этой величины. Исключение составляют тиосемикарбазидные комплексы, для которых наблюдается обратная тенденция. Изменение энтальпии при присоединении третьего лиганда имеет меньшую величину, как и его ступенчатая константа устойчивости для комплекса ${\text{AgL}}_{3}^{ + }{\text{,}}$ что снижает вероятность протекания данного процесса.
Проведенные расчеты показали, что величина энтропии для монокоординированных комплексов Ag+ с Bphtu, Phtu и Tu имеет положительные значения, а для комплексов с остальными лигандами – отрицательные. В ряду Tsc < Actu < Tu < < Phtu < Bphtu значения ΔrS0 увеличиваются. Такое изменение величины энтропии объясняется тем, что на первой стадии комплексообразования для Bphtu, Phtu и Tu, вероятно, происходит вытеснение координированных молекул воды из сольватационной оболочки катионов серебра(I), что не наблюдается в случае тиосемикарбазида и ацетилтиомочевины. Бис- и трис-координированные комплексы энтальпийно стабилизированы. Таким образом, наличие разных заместителей в молекуле тиомочевины различным образом влияет на ступенчатые значения энтальпии и энтропии. Соответствующие зависимости для реакции комплексообразования Ag+ + i L = ${\text{AgL}}_{i}^{ + }$ (i = = 1–3) приведены на рис. 3. Отмечено, что общая энтальпийно-энтропийная зависимость для всех лигандов, за исключением систем с Tsc, имеет монотонный характер.
ЗАКЛЮЧЕНИЕ
Изучены равновесия комплексообразования серебра(I) с Tu, Aсtu, Tsc, Phtu, Bphtu при Т = = 278.2–328.2 K и ионной силе 0.11 моль/л (0.1 NaNO3 + 0.01 HNO3). Определены термодинамические характеристики lgβi, ΔrG0, ΔrH0 и ΔrS0 образующихся комплексов. Для монокоординированных комплексов устойчивость изменяется в ряду: Aсtu < Tsc < Bphtu < Phtu < Tu, который совпадает с рядом изменения констант протонирования лигандов. Для комплексов типа ${\text{AgL}}_{2}^{ + }$ и ${\text{AgL}}_{3}^{ + }$ с Phtu и Bphtu данная закономерность нарушается. Вероятно, для этих высокоустойчивых систем влияние гидрофобных свойств арильных заместителей превосходит эффект от снижения донорных свойств серы, связанных с константой протонирования рассматриваемых лигандов. Максимальное изменение энтальпии (ΔrH0) в отрицательную область значений наблюдается на второй ступени комплексообразования, когда ион металла координирует вторую молекулу органического лиганда: AgL+ + L = ${\text{AgL}}_{2}^{ + }{\text{,}}$ ${{\Delta }_{r}}H_{2}^{0}$ ~ –46 ± ± 5 кДж/моль. Исключением является реакция с Tsc. Величина ΔrS0 для монокоординированных комплексов Ag+ c Bphtu, Phtu и Tu положительная, что, вероятно, связано с выходом координированных молекул воды из сольватационной оболочки иона Ag+. Энтальпийно-энтропийная зависимость для всех лигандов, кроме систем с Tsc, имеет монотонный характер. Проведенные исследования показали, что большинство использованных лигандов, по-видимому, не будут иметь заметных преимуществ при их практическом применении в гидрометаллургии по сравнению с тиомочевиной. Однако полученные результаты представляют интерес для формации, где играют роль не только процессы комплексообразования с соответствующим металлом, но и эффективность доставки и взаимодействия действующего вещества с биологической мишенью, а также его токсичность, которые в этом случае определяются особенностями строения органического лиганда.
Список литературы
Смольков А.А., Белобелецкая М.В., Медков М.А. и др. // Химическая технология. 2000. № 8. С. 5.
Белобелецкая М.В. Экстракция золота и серебра из тиокарбамидных, тиоцианатных и смешанных тиокарбамидно-тиоцианатных растворов. Автореф. дис. … канд. хим. наук. Владивосток, 2004. 22 с.
Calla-Choque D., Lapidus G.T. // Hydrometallurgy. 2020. V. 192. P. 105289. https://doi.org/10.1016/j.hydromet.2020.105289
Fupeng Liu, Jinliang Wang, Chao Peng et al. // Hydrometallurgy. 2019. V. 185 P. 38. https://doi.org/10.1016/j.hydromet.2019.01.017
Yang Tao, Zhang Liang, Zhong Lvling et al. // Hydrometallurgy. 2018. V. 175. P. 1796. https://doi.org/10.1016/j.hydromet.2017.11.007
Кальный Д.Б., Коковкин В.В., Миронов И.В. // Журн. общей химии. 2011. Т. 81. Вып. 5. С. 705.
Shuiping Chen, Guozhong Wu, Hongyan Zeng. // Carbohydrate Polymers. 2005. V. 60. № 1. P. 33. https://doi.org/10.1016/j.carbpol.2004.11.020
Ewelina N., Marta S. Magdalena M. et al. // Current Medicinal Chem. 2019. V. 26. № 4. P. 664. https://doi.org/10.2174/0929867325666180228164656
Finch R.A., Liu M.C., Cory A.H. et al. // Adv. Enzym Regul. 1999. V. 39. P. 3. https://doi.org/10.1016/S0065-2571(98)00017-X
Elwakeel K.Z., Al-Bogami A.S., Guibal Eric. // Chem. Eng. J. 2021. V. 403. P. 126265. https://doi.org/10.1016/j.cej.2020.126265
Meena K., Muthu K., Rajasekar M. et al. // J. Therm. Anal. Calorim. 2013. V. 112. P. 1077. https://doi.org/10.1007/s10973-013-3062-y
Saeed A., Ivelina G., Muhammad H. et al. // J. Mol. Model. 2019. V. 25. № 90. P. 1. https://doi.org/10.1007/s00894-019-3970-2
Saeed A.A., Isab A., Waqar A. // Inorg. Chem. Commun. 2002. V. 5 P. 816.
Graham A.B., Chaveng P., Saowanit S. et al. // Dalton Trans. 2010. V. 39 P. 4391. https://doi.org/10.1039/c001398f
Bowmaker G.A., Chaichit N., Pakawatchai C. et al. // Can. J. Chem. 2009. V. 87. P. 161.
Самадов А.С., Миронов И.В., Горичев И.Г.и др. // Журн. неорган. химии. 2020. Т. 65. № 7. С. 995. https://doi.org/10.31857/S0044457X2007017X
Самадов А.С., Миронов И.В., Горичев И.Г. и др. // Журн. общей химии. 2020. Т. 90. № 11. С. 1738. https://doi.org/10.31857/S0044460X20110141
Domenico De Marco. // ISRN Inorg. Chem. 2013. V. 2013. P. 1.
Самадов А.С., Горичев И.Г., Кузьменко А.Н. и др. // Вестн. Моск. ун-та. Cер. 2, химия. 2021. Т. 62. № 2. С. 152.
De Marco D., Zona G. // Thermochim. Acta. 2002. V. 386. P. 173.
Lukinskas P., Savickaja I., Vita S. et al. // J. Coord. Chem. 2008. V. 61. P. 2528.
Миронов И.В., Харламова В.Ю. // Журн. неорган. химии. 2018. Т. 63. № 7. С. 933. https://doi.org/10.1134/S0044457X18070176
Самадов А.С., Горичев И.Г., Файзуллоев Э.Ф. и др. // Вестник Таджикского нац. ун-та. Сер. естественных наук. 2020. № 1. С. 200.
Головнев Н.Н., Новикова Г.В., Лешок А.А. // Журн. неорган. химии. 2009. Т. 54. № 2. С. 374.
Бек М. Химия равновесий реакций комплексообразования. М.: Мир, 1973. 359 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии