Журнал неорганической химии, 2022, T. 67, № 1, стр. 127-136
Биостекло 45S5, легированное диоксидом циркония: получение и свойства
Д. Н. Грищенко a, *, Е. Э. Дмитриева a, А. Н. Федорец b, М. А. Медков a
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
b Дальневосточный федеральный университет
690922 Владивосток, о. Русский, п. Аякс, 10, Россия
* E-mail: grishchenko@ich.dvo.ru
Поступила в редакцию 02.06.2021
После доработки 06.07.2021
Принята к публикации 17.07.2021
- EDN: MCQKMD
- DOI: 10.31857/S0044457X22010056
Аннотация
Предложен метод синтеза биоактивного стекла и стеклокерамики легированием Bioglass 45S5 диоксидом циркония. Метод основан на пиролизе смеси органических растворов, содержащих олеат натрия, олеат кальция, тетраэтоксисилан, трибутилфосфат и олеат цирконила. Легирование проведено в широком диапазоне (5–60 мас. % ZrO2). Влияние диоксида циркония на свойства стекла исследовано методами рентгенофазового анализа, рентгеноэлектронной микроскопии, “экстремальных растворов”, погружения в SBF. Установлено, что легирование меняет физические и химические свойства Bioglass 45S5. Рентгеноаморфное состояние и пониженная химическая растворимость сохраняются при содержании диоксида циркония в стекле до 10 мас. %. Легирование свыше 10 мас. % частично выводит натрий и кремний из сетки стекла в нерастворимую кристаллическую фазу, что приводит к увеличению химической растворимости получившейся стеклокерамики. При этом потери биоактивных свойств материала не происходит. Предложен способ получения плотной стеклокерамики на основе ZrO2, где биоактивной фазой выступает Bioglass 45S5. Материал обладает прочностью >450 МПа и может найти применение в восстановительной хирургии в качестве нагружаемых имплантов.
ВВЕДЕНИЕ
Биоактивные стекла начали разрабатываться группой американских ученых в конце семидесятых годов прошлого века. Первые клинические применения датируются 1980 г. Исследования показали, что биостекла, деградируя, способны стимулировать процесс остеогенеза, хондрогенеза и срастаться с мягкими соединительными тканями. Существует два основных метода синтеза биостекол: первый – плавление смеси оксидов при температурах выше 1400°C [1], второй – золь-гель синтез. Этот процесс занимает более длительный период, но осуществляется при более низких температурах [2–4]. Биостекла применяют в качестве материалов, стимулирующих восстановление и устранение дефектов костной ткани, а также в качестве ненагружаемых имплантатов в восстановительной хирургии [5, 6]. Показатели механической прочности и трещиностойкости биостекол существенно ниже, чем у естественной костной ткани, поэтому они не применяются в качестве несущих конструкций.
Композиция состава 45 SiO2, 24.5 Na2O, 24.5 CaO, 6 мас. % P2O5 известна как Bioglass 45S5. Указанное биостекло считается остеокондуктивным, остеоиндуктивным и деградируемым. Оно обеспечивает рост новой костной ткани вдоль границы кость–имплант за счет способности осаждать на своей поверхности слой гидроксилированного карбоната апатита, схожего с минеральной фазой кости [7–9].
Известны недостатки использования Bioglass 45S5. Несоответствие скоростей деградации имплантируемого материала и роста костной ткани приводит к образованию зазора между костью и имплантом. Скорость образования костной ткани зависит от многих факторов, в том числе от индивидуальных особенностей пациента. В связи с этим появляется необходимость в создании искусственных материалов с разной скоростью резорбции. Известно, что натрий, высвобождаемый в процессе деградации материала, увеличивает pH окружающих тканей [10]. Функциональные добавки способны минимизировать негативное влияние. Изменяя состав биостекла, можно управлять его биоактивностью и резорбируемостью [11, 12]. Внедрение различных катионов в матрицу стекла влияет на его физические свойства и микроструктуру. Такие функциональные добавки, как оксиды магния, цинка, стронция, меди, могут способствовать формированию и восстановлению здоровой костной ткани [13, 14]. Активные разработки новых продуктов для клинического применения способствуют расширению списка материалов, используемых в медицине, и созданию более перспективных стекол.
В мезопористых биостеклах состава SiO2/CaO/P2O5 = 80 : 15 : 5 (мол. %) проведено замещение CaO [15] или SiO2 [16] на ZrO2 в пределах 15 мол. %. В стеклах состава SiO2/CaO/P2O5/SrO = = 58 : 30 : 7 : 5 (мас. %) проведено замещение CaO на ZrO2 в пределах 11 мас. % [17]. Плавлением смеси оксидов получены биоактивные стекла 45S5, легированные диоксидом циркония. Легирование проведено путем замещения Na2O на ZrO2 в пределах 12 мас. % [18] и SiO2 на ZrO2 в пределах 10 мас. % [19]. Исследованы свойства полученных стекол. Авторы заявляют об улучшении свойств легированного биостекла. При сохранении способности к образованию апатита и отсутствии токсичности отмечено увеличение рентгеноконтрастности и прочности, уменьшение растворимости, а также снижение pH среды, окружающей материал.
Целью настоящего исследования является разработка нового способа получения композитов SiO2–Na2O–CaO–P2O5–ZrO2 и изучение взаимодействия ZrO2 с биостеклом 45S5 в широком интервале концентраций диоксида циркония (0–60 мас. %) для создания биоактивных материалов, используемых в инженерии костной ткани.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Замещением диоксидом циркония общей массы биостекла получены образцы стекла и стеклокерамики на основе Bioglass 45S5, содержащей 5, 10, 20, 40 и 60 мас. % ZrO2. В работе использовали: олеат натрия (C18H33O2Na, 98%), олеат кальция (C36H66O4Ca, 98%), тетраэтоксисилан (C8H20O4Si, 99.5%), трибутилфосфат (C12H27O4P, 99%), олеат цирконила (C36H66O5Zr, 98%). Органическим растворителем служила смесь скипидара (сульфатного очищенного, для органического синтеза) с толуолом (C7H8, 99.5%); соотношение компонентов раствора составляло 50 : 50.
Стекло, легированное диоксидом циркония, получали следующим способом. В приготовленный органический раствор олеата натрия с тетраэтоксисиланом добавляли раствор олеата кальция с трибутилфосфатом, затем раствор олеата цирконила. После смешивания всех компонентов выполняли отгонку растворителя при 150–200°С. Полученный прекурсор подвергали пиролизу в муфельной печи Nabertherm L5/13/B180 при температуре 1300°С в течение 30 мин. Средняя скорость нагрева составляла 7 град/мин. Стеклование обеспечивали переносом в камеру отжига с температурой 550°С, где образец выдерживали 2 ч, а затем охлаждали при комнатной температуре.
Прочная стеклокерамика изготовлена следующим способом. Полученный вышеуказанным методом материал, содержащий 25 мас. % Bioglass 45S и 75 мас. % ZrO2, измельчали на вибрационной микромельнице Fritsch Pulverisette-0. 80% частиц имели размер <50 мкм. Размер частиц полученного порошка определяли ситовым методом (сито № 005). Порошок прессовали при 50 МПа на испытательной машине Shimadzu Autograp AG-X plus методом одноосного холодного прессования со скоростью 0.5 мм/с и выдержкой 120 с. Формованный образец прокаливали в муфельной печи Nabertherm L5/13/B180 до 1300°С. Изготовлено три одинаковых образца. Предел прочности образцов при сжатии определяли на испытательной машине Shimadzu Autograp AG-X plus.
Исследована химическая растворимость полученных материалов. За основу принят ГОСТ ISO 10993-14-2011 “Изделия медицинские. Оценка биологического действия медицинских изделий. Ч. 14. Идентификация и количественное определение продуктов деградации изделий из керамики”. Для исследования выбран метод “экстремального раствора”. Он заключается в следующем. Высушенные до постоянного веса образцы (из расчета 1 г образца на 20 мл жидкости) помещали в модельный раствор. Исследовали неизмельченный материал, поэтому для тестирования были отобраны образцы с одинаковой массой и формой. В растворе материал находился 120 ч при ежесуточном встряхивании и постоянной температуре 37°С, поддерживаемой термостатом Binder BD 115. Затем образцы промывали дистиллированной водой и сушили при температуре 100°С в течение 5 ч. В качестве модельного раствора использовали буферный раствор лимонной кислоты с уровнем рН 3.0. Химическую растворимость (А, %) рассчитывали по формуле: А = (М1 – М2)/М1 × 100, где М1 – масса образца до испытания в модельном растворе, г; M2 – масса образца после испытания в модельном растворе, г. Исследование фильтрата осуществляли на атомно-абсорбционном спектрофотометре Shimadzu AА 7000.
Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре Stoe STADI P. Состав продуктов определяли с помощью программы поиска EVA c использованием базы порошковых данных ICDD PDF-2. Для исследования качественного, количественного элементного состава и морфологии поверхности образцов использовали метод растровой электронной микроскопии (РЭМ). Изображения и энергодисперсионные спектры образцов получали на приборе CrossBeam 1540 XB с приставкой для энергодисперсионного спектрального анализа “ЭДС-микроанализ”. Для исследования образцы подвергали напылению тонкого проводящего слоя углерода. Измерения толщины образовавшегося покрытия выполнены на приборе CrossBeam 1540 XB.
Оценка влияния ZrO2 на биологическую активность биостекла проведена in vitro с помощью модельной среды – SBF-раствора. Модельный раствор был приготовлен в соответствии с процедурой, предложенной в работе [20], pH доведен до 7.4. Образцы выдерживали в растворе в течение 19 сут при температуре 37°С. Раствор обновляли каждые 48 ч. Постоянную температуру поддерживали термостатом Binder BD 115.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее был разработан метод получения биостекол пиролизом органических растворов [21]. Отмечен ряд преимуществ использования этого метода, в том числе возможность допирования биостекла различными соединениями при сохранении гомогенности прекурсора. В представленной статье пиролизом органических растворов получены биоактивные стекла и стеклокерамика, содержащие ZrO2. Допирование проводили замещением общей массы Bioglass 45S5 диоксидом циркония для сохранения отношения Si/Na/Ca/P.
РФА образцов с различным содержанием ZrO2 в зависимости от температуры обжига прекурсора обнаружил фазы, указанные в табл. 1.
Таблица 1.
Результаты рентгенофазового анализа образцов, полученных при различных температурах
| Номер образца | Состав прекурсора, мас. % | Фазы при обжиге | ||
|---|---|---|---|---|
| 500°С | 1000°С | 1300°С | ||
| 1 | 45 SiO2, 24.5 Na2O, 24.5 CaO, 6 P2O5 |
р/а*; Na2CaSi3O8; Na3PO4; Ca2SiO4 · Ca3(PO4)2 |
р/а*; Na2CaSi3O8; Na3PO4; Ca2SiO4 · Ca3(PO4)2 |
р/а* |
| 2 | 5 ZrO2 42.75 SiO2, 23.275 Na2O, 23.275 CaO, 5.7 P2O5 |
р/а*; Ca2SiO4 |
р/а*; Ca2SiO4 Na4Ca4Si6O18 |
р/а* |
| 3 | 10 ZrO2 40.5 SiO2, 22.05 Na2O, 22.05 CaO, 5.4 P2O5 |
р/а*; Ca2SiO4 |
р/а*; Na2ZrSi2O7; Na15.78Ca3Si6O12 |
р/а* |
| 4 | 20 ZrO2 36 SiO2, 19.6 Na2O, 19.6 CaO, 4.8 P2O5 |
р/а* | р/а*; Na2ZrSi2O7; Na4Ca4Si6O18 |
р/а*; Na2ZrSi2O7 |
| 5 | 40 ZrO2 27 SiO2, 14.7 Na2O, 14.7 CaO, 3.6 P2O5 |
р/а* | р/а*; Na2ZrSi2O7; Na4Zr2Si3O12 |
р/а*; Na4Zr2Si3O12 ZrO2 |
| 6 | 60 ZrO2 18 SiO2, 9.8 Na2O, 9.8 CaO, 2.4 P2O5 |
р/а* | р/а*; Na2ZrSi2O7; Na4Zr2Si3O12 ZrO2 Ca0.2Zr0.8O1.8 |
р/а*; Na4Zr2Si3O12 ZrO2 |
Поверхность образцов 1 и 2 однородна (рис. 1а, 1б). На поверхности образца 3, содержащего 10 мас. % ZrO2, с помощью микроскопии обнаружены мелкие включения, равномерно распределенные в стеклофазе (рис. 1в). Образец 4 непрозрачен, помимо рентгеноаморфной фазы содержит дополнительную фазу Na2ZrSi2O7. Микроскопия показывает многочисленные скопления мелких частиц (рис. 1г). Образец 5 кроме рентгеноаморфной фазы содержит две дополнительные фазы: Na4Zr2Si3O12 и ZrO2. Образец керамики состоит из стеклофазы, а также частиц сферической и кубической формы. Средний диаметр сферических частиц составляет 1 мкм, сторона ребра частиц кубической формы – 1.5 мкм (рис. 1д). Образец 6 схож с образцом 5: наблюдаются частицы кубической и сферической формы, но стеклофаза в основном распределена в пространстве между частицами (рис. 1е).
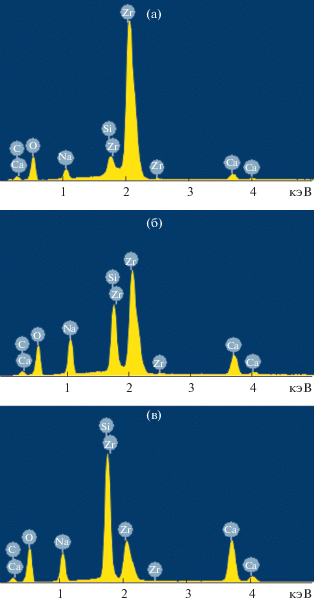
На рис. 2 представлены энергодисперсионные спектры (ЭДС) образовавшихся фаз образца 5. Спектр, соответствующий сферическим частицам, содержит преимущественно линии циркония и относится к ZrO2 (рис. 2а). Спектр, соответствующий кубическим частицам, содержит в основном линии кремния, натрия, циркония и относится к Na4Zr2Si3O12 (рис. 2б). Стеклофаза характеризуется повышенным содержанием кальция и кремния, она образует рентгеноаморфную фазу, являющуюся биоактивной (рис. 2в).
Рис. 2.
Энергодисперсионный спектр образца 5 в точках, указанных на рис. 1д: 1 – (а), 2 – (б), 3 – (в).
Как следует из карт элементов, все атомы равномерно распределены в матрице стекла для образцов с содержанием ZrO2 до 20 мас. % включительно. Для образцов с более высоким содержанием диоксида циркония (5 и 6) обращает на себя внимание идентичное распределение фосфора и циркония (рис. 3).
Сопоставление данных РФА и РЭМ (карты элементов) позволяет сделать заключение, что обнаруженные в образцах 5 и 6 фазы Na4Zr2Si3O12 являются твердыми растворами состава Na1 +xZr2SixP3 –xO12, которые кристаллизуются в ромбоэдрической сингонии и имеют типичный состав Na3Zr2Si2PO12, известный как NASICON [22, 23]. В образце, содержащем 20% оксида циркония, присутствует паракелдышит Na2ZrSi2O7, кристаллизующийся в триклинной сингонии. Как отмечено выше, при содержании оксида циркония <20 мас. % образцы рентгеноаморфны, что может соответствовать композиции Na1 +zZr2 –x/3SixP3 –xO12 – 2x/3 в стеклообразной форме с частичным катионным замещением натрия на кальций (натриевое суперионное проводящее стекло, известное как NASIGLAS [24]). Таким образом, взаимодействие оксида циркония с биостеклом, вероятно, можно представить как трансформацию Bioglass 45S5 → NASIGLAS → NASICON.
Все исследованные образцы после пребывания в SBF-растворе имеют покрытия из гидроксиапатита в виде плотной растрескавшейся корки (рис. 4). На рис. 5 представлены микрофотографии покрытия и его ЭДС. Покрытие имеет слоистую структуру (рис. 5а), состоящую из наноразмерных частиц диаметром 20–40 нм (рис. 5б). В энергодисперсионном спектре содержатся все компоненты: кремний, кислород, натрий, кальций, фосфор и цирконий (рис. 5в), однако содержание кальция и фосфора в покрытии заметно выше их количества в образце до помещения в модельный раствор, что свидетельствует об образовании кальций-фосфатного слоя. Сравнительная табл. 2 это подтверждает. Спектр показывает наличие незначительных количеств Mg, источником которого является SBF-раствор.
Рис. 4.
РЭМ-изображения образцов после пребывания в SBF-растворе: 1 (а), 2 (б), 3 (в), 4 (г), 5 (д), 6 (е).

Рис. 5.
РЭМ-изображения покрытия (а, б) и его энергодисперсионный спектр в области сканирования, указанной на рис. 5б (в).

Таблица 2.
Результаты элементного анализа образца 5
| Элемент | Содержание в стеклофазе до SBF, ат. % | Содержание в сферической частице до SBF, ат. % | Содержание в кубической частице до SBF, ат. % | Содержание в покрытии (суммарный спектр), ат. % |
|---|---|---|---|---|
| CK | 23.71 | 33.40 | 25.79 | 14.76 |
| OK | 54.02 | 51.30 | 52.47 | 59.32 |
| NaK | 5.22 | 2.19 | 6.69 | 7.93 |
| SiK | 10.01 | 1.21 | 5.17 | 11.48 |
| CaK | 3.90 | 0.67 | 2.09 | 3.91 |
| Zr L | 3.08 | 11.23 | 7.79 | 1.68 |
| PK | 0.06 | 0.00 | 0.00 | 0.73 |
| MgK | 0.19 |
В работе [25] показано, что Ta2O5 улучшает механические и физические свойства стекла, но снижает биологическую активность материала. Добавка в количестве 3 мол. % Ta2O5 (или 18 мас. %) полностью лишает материал биоактивности. Исследование [26] показало резкое уменьшение биоактивности стекла для образца с 8 мас. % Bi2O3. К аналогичным выводам приходят авторы работ [21, 27, 28] при рассмотрении легирования стекол оксидами висмута, вольфрама, тантала, титана. Содержание функциональной добавки, достаточной для резкого снижения биоактивности материала, находится в пределах 8–12 мас. %. На примере оксида тантала изучена причина подавления биологической активности стекол [29]. Легирование оксидом тантала приводит к образованию в материале нерастворимых кристаллов CaTa2O6. Таким образом, происходит выведение катионов кальция, участвующих в образовании биоактивного слоя, из сетки стекла в кристаллическую фазу, что является основной причиной снижения биоактивности материала.
Согласно нашим исследованиям, диоксид циркония ведет себя иначе. Он частично выводит натрий и кремний из сетки стекла, образуя кристаллы Na2ZrSi2O7 или Na4Zr2Si3O12 (табл. 1). В результате содержание кальция, участвующего в формировании слоя апатита, остается на прежнем уровне. Очевидно, это является причиной сохранения биоактивности материала. Предположение подтверждается исследованиями толщины биоактивного слоя, образовавшегося в SBF-растворе, на образцах. Средняя толщина покрытия составляет 2.5 мкм для образцов 1 и 2, 1.8 мкм для образца 3, 1 мкм для образца 4, 0.5 мкм для образца 5 и 0.3 мкм для образца 6. Уменьшение толщины покрытия, на наш взгляд, нельзя расценивать как снижение биоактивности. Толщина, образовавшегося кальций-фосфатного слоя, закономерно снижается с уменьшением массовой доли биоактивной стеклофазы в образце. Частичное выведение натрия из сетки стекла в нерастворимую фазу должно препятствовать высвобождению большого количества натрия в живую ткань при деградации биоактивной фазы. Как следствие, это должно поддерживать более стабильное значение pH во время биохимических процессов вокруг импланта. Наши исследования согласуются с результатами работ [15–19], где легирование биостекла сохраняло способность к образованию апатита и снижало pH модельной среды.
Химическая растворимость – важный показатель для материалов медицинской практики. Для исследования материала выбран метод экстремального раствора. Модельная жидкость имитирует биологическую среду, в которой лимонная кислота высвобождается остеокластами. Низкие значения рН необходимы для исследования деградации керамических материалов в ускоренном режиме. Метод используется в качестве скрининг-теста.
Растворимость образцов представлена в табл. 3. Исследования показывают, что величина химической растворимости зависит от содержания ZrO2 в образце. Ее значения падают при увеличении содержания ZrO2 до 10 мас. % и растут с последующим увеличением оксида легирующего элемента. Увеличение растворимости стекла при содержании ZrO2 > 10 мас. %, вероятно, связано с изменением элементного состава стеклофазы за счет образования кристаллических цирконосиликатов. Относительное уменьшение растворимости образца, содержащего 60 мас. % ZrO2, скорее всего, связано с уменьшением массовой доли резорбируемой фазы в общей массе материала. Эти данные согласуются с результатами работ [15–19], где химическая растворимость материалов с рентгеноаморфной структурой падала с увеличением содержания ZrO2.
Таблица 3.
Зависимость химической растворимости образца и концентрации высвобождающихся в модельный раствор элементов от содержания ZrO2
| Содержание ZrO2, мас. % | Химическая растворимость А, % | Ca, мг/л | Si, мг/л | Na, мг/л |
|---|---|---|---|---|
| 0 | 2.0 | 440 | 45 | 514 |
| 5 | 0.8 | 150 | 25 | 185 |
| 10 | 0.4 | 83 | 22 | 135 |
| 20 | 3.2 | 280 | 220 | 550 |
| 40 | 9.1 | 430 | 888 | 1325 |
| 60 | 8.3 | 377 | 507 | 808 |
Приведенные в табл. 3 данные об изменении в растворе концентрации кальция, натрия и кремния в зависимости от содержания в образцах диоксида циркония косвенно свидетельствуют о различной скорости резорбции, что расширяет возможности выбора материалов для имплантации. Можно предположить, что цирконийсодержащие биостекла и стеклокерамика, полученные пиролизом органических растворов, будут обладать всеми свойствами, выявленными авторами других работ у аналогичных материалов, а именно: рентгеноконтрастностью, повышенной прочностью, отсутствием токсичности и более низким значением pH по сравнению с нелегированным биостеклом.
Предлагаемый нами метод позволяет получать стеклокерамику на основе Bioglass 45S5 с содержанием ZrO2 в широком интервале концентраций и с широким диапазоном свойств. Например, стеклокерамика, содержащая 25 мас. % биостекла 45S5 и 75 мас. % ZrO2, имеет предел прочности при сжатии 470 ± 20 МПа. Материал имеет потенциальное применение в инженерии костной ткани.
ЗАКЛЮЧЕНИЕ
Разработан новый способ получения композитов SiO2–Na2O–CaO–P2O5–ZrO2. Исследовано взаимодействие диоксида циркония с биостеклом 45S5 в широком интервале концентраций ZrO2 (0–60 мас. %) для создания биоактивных материалов, используемых в инженерии костной ткани.
Установлено, что ZrO2 меняет физические и химические свойства Bioglass 45S5, сохраняя биоактивную способность материала.
Показано, что легирование Bioglass 45S5 диоксидом циркония до 10 мас. % сохраняет рентгеноаморфное состояние и уменьшает химическую растворимость композита. Материал может быть использован в восстановительной хирургии в качестве ненагружаемых или слабонагружаемых имплантов, а также порошковых материалов для заполнения дефектов костной ткани.
Полученная в работе плотная стеклокерамика, состоящая из 25 мас. % биостекла 45S5 и 75 мас. % ZrO2, обладает прочностью >450 МПа и биоактивной фазой. Материал пригоден для обработки и создания импланта любой конфигурации без ущерба для биоактивности конструкции. После дополнительных исследований материал может быть предложен для производства нагружаемых имплантов.
Список литературы
Prasad S., Datta S., Adarsh T. et al. // J. Non-Cryst. Solids. 2018. V. 498. P. 204. https://doi.org/10.1016/j.jnoncrysol.2018.06.027
Deliomanli A.M., Yildirim M. // J. Austral. Ceram. Soc. 2016. V. 52. № 2. P. 9. md5:7cea23b06c018a3c17bbcd7e93b59f12
Furlan R.G., Correr W.R., Costa Russi A.F. et al. // J. Sol-Gel Sci. Technol. 2018. V. 88. № 1. P. 181. https://doi.org/10.1007/s10971-018-4806-8
Jie Q., Lin K., Zhong J. et al. // J. Sol-Gel Sci. Technol. 2004. V. 30. № 1. P. 49. https://doi.org/10.1023/B:JSST.0000028196.09929.a3
Wu C., Miron R., Sculean A. et al. // Biomaterials. 2011. 32. № 29. P. 7068. https://doi.org/10.1016/j.biomaterials.2011.06.009
Yang Q., Chen S., Shi H. et al. // Mater. Sci. Eng., C. 2015. V. 55. P. 105. https://doi.org/10.1016/j.msec.2015.05.049
Бучилин Н.В., Строганова Е.Е. // Стекло и керамика. 2008. № 8. С. 8.
Chen Q.Z., Thompson I.D., Boccacini A.R. // Biomaterials. 2006. V. 27. P. 2414.
Hench L., Jones J. Biomaterials, Artificial Organs and Tissue Engineering. Woodhead Publishing, 2005. 304 p.
Silver I.A., Deas J., Erecinska M. // Biomaterials. 2001. V. 22. № 2. P. 175. https://doi.org/https://doi.org/10.1016/S0142-9612(00)00173-3
Ahmed I., Lewis M., Olsen I., Knowles J.C. // Biomaterials. 2004. V. 25. P. 491. https://doi.org/10.1016/S0142-9612(03)00546-5
Navarro M., Ginebra M.-P., Clement J. et al. // J. Am. Ceram. Soc. 2003. V. 86. P. 1345. https://doi.org/10.1111/j.1151-2916.2003.tb03474.x
Gentleman E., Fredholm Y.C., Jell G. et al. // Biomaterials. 2010. V. 31. № 14. P. 3949. https://doi.org/10.1016/j.biomaterials.2010.01.121
Cacciotti I. // J. Mater. Sci. 2017. V. 52. P. 8812. https://doi.org/10.1007/s10853-017-1010-0
Zhu Y., Zhang Y., Wu C. et al. // Microporous Mesoporous Mater. 2011. V. 143. № 2–3. P. 311. https://doi.org/10.1016/j.micromeso.2011.03.007
Tallia F., Gallo M., Pontiroli L. et al. // Mater. Lett. 2014. V. 130. P. 281. https://doi.org/10.1016/j.matlet.2014.05.062
Yin P., Yuan J.-W., Liu L.-H. et al. // Ceram. Int. 2017. V. 43. № 13. P. 9691. https://doi.org/10.1016/j.ceramint.2017.04.143
Kang T.-Y., Seo J.-Y., Ryu J.-H. et al. // J. Biomed. Mater. Res. 2021. V. 109. P. 1196. https://doi.org/10.1002/jbm.a.37113
Mondal D., So-Ra S., Lee B.-T. // J. Mater Sci. 2013. V. 48. № 5. P. 1863. https://doi.org/10.1007/s10853-012-6956-3
Kokubo T., Takadama H. // Biomaterials. 2006. V. 27. № 15. P. 2907. https://doi.org/10.1016/j.biomaterials.2006.01.017
Medkov M.A., Grishchenko D.N., Dmitrieva E.E., Kudryavyi V.G. // Theor. Found. Chem. Eng. 2020. V. 54. № 4. P. 1005. https://doi.org/10.1134/S0040579520050188
Zhao C., Liu L., Qi X. et al. // Adv. Energy Mater. 2018. V. 8. P. 1703012. https://doi.org/10.1002/aenm.201703012
Jalalian-Khakshour A., Phillips C.O., Jackson L., et al. // J. Mater Sci. 2020. V. 55. P. 2291. https://doi.org/10.1007/s10853-019-04162-8
Niyompan A., Holland D. // J. Non-Cryst. Solids. 2001. V. 293. № 1. P. 709. https://doi.org/10.1016/S0022-3093(01)00781-5
Riaz M., Zia R., Saleemi F., et al. // Mater. Sci. Poland. 2016. V. 34. № 1. P. 13. https://doi.org/10.1515/msp-2016-0013
Sakthi Prasad S., Itishree Ratha, Tarun Adarsh, et al. // J. Mater. Res. 2018. V. 33. № 2. P. 178.
Magyari K., Stefan R., Vulpoi A., Baia L. // J. Non-Cryst. Solids. 2015. V. 410. P. 112. https://doi.org/10.1016/j.jnoncrysol.2014.11.033
Medkov M.A., Grishchenko D.N. Radiopaque bioactive glasses: preparation and properties. “Scientific research of the SCO countries: synergy and integration”. February 11-12, 2019. Beijing, PRC Part 1 – Reports in English. P. 128.
Grishchenko D.N., Slobodyuk A.B., Kuryavyi V.G., Medkov M.A. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1606. [Грищенко Д.Н., Слободюк А.Б., Курявый В.Г., Медков М.А. // Журн. неорган. химии. 2020. Т. 65. № 10. С. 1408.]https://doi.org/10.1134/S0036023620100083
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии




