Журнал неорганической химии, 2021, T. 66, № 9, стр. 1303-1313
ВОЗМОЖНОСТИ МЕТОДА ВИЛЬСОНА ДЛЯ РАСЧЕТА ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ ОКСИДНЫХ СИСТЕМ ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ
В. Л. Столярова a, В. А. Ворожцов a, b, *
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
b Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Адмирала Макарова, 2, Россия
* E-mail: st011089@student.spbu.ru
Поступила в редакцию 10.02.2021
После доработки 23.03.2021
Принята к публикации 25.03.2021
Аннотация
Проиллюстрированы потенциальные возможности полуэмпирического метода Вильсона для расчета термодинамических свойств как бинарных, так и трехкомпонентных систем, содержащих оксиды редкоземельных элементов, по данным для соответствующих бинарных систем при высоких температурах. Проанализирована возможность расчета энергетических параметров взаимодействия компонентов с привлечением впервые найденных коэффициентов уравнения Вильсона в бинарных оксидных системах при высоких температурах. На примере систем Sm2O3–Y2O3–HfO2, Sm2O3–ZrO2–HfO2 и Y2O3–ZrO2–HfO2 при температурах выше 2000 K с привлечением данных для соответствующих бинарных систем, полученных ранее методом высокотемпературной масс-спектрометрии, рассчитаны значения избыточной энергии Гиббса с использованием подхода Вильсона при сопоставлении с результатами методов Редлиха–Кистера и Колера. Установлено, что наилучшее соответствие экспериментальных и рассчитанных значений избыточной энергии Гиббса в указанных выше системах наблюдается в случае привлечения метода Вильсона по сравнению с методами Редлиха–Кистера и Колера, причем в концентрационных областях, в значительной степени удаленных от бинарных систем.
ВВЕДЕНИЕ
Разработка керамических материалов высшей огнеупорности, а также оптимизация перспективных высокотемпературных технологий, используемых в различных областях современной техники, невозможны без достоверных данных о термодинамических свойствах оксидных систем при высоких температурах [1–3]. В современных высокотемпературных исследованиях оксидных систем и материалов, несмотря на существование широкого спектра экспериментальных методов термодинамических исследований, таких как методы термического анализа [4], метод электродвижущих сил [5], масс-спектрометрический эффузионный метод Кнудсена [6, 7], повышение температурных интервалов исследований при сохранении достоверности получаемых значений термодинамических свойств по-прежнему является актуальной задачей [8, 9]. Привлечение и расширение набора различных корректных полуэмпирических методов расчета термодинамических свойств оксидных систем при высоких температурах позволяет найти оптимальные пути синтеза и эксплуатации материалов при воздействии высоких температур без проведения трудоемких экспериментальных исследований.
Среди многообразия полуэмпирических методов расчета термодинамических свойств многокомпонентных систем по данным о равновесиях в бинарных системах [5] в настоящее время лишь немногие из них нашли применение для расчета термодинамических свойств оксидных систем. Среди них следует отметить методы Редлиха–Кистера [10] и Колера [11], возможность использования которых для оценки избыточных энергий Гиббса в многокомпонентных системах, содержащих оксиды редкоземельных элементов, циркония и гафния, была продемонстрирована в работах [12–14] при высоких температурах (до 3000 K). Однако, как показано в работах [15, 16], необходимость расширения возможностей расчетных методов требует привлечения более широкого спектра различных полуэмпирических подходов для оценки термодинамических свойств в многокомпонентных системах по данным о равновесиях в соответствующих бинарных системах. Следует отметить, что в ряде случаев соответствие друг другу результатов расчетов термодинамических величин с привлечением различных полуэмпирических методов может быть использовано как критерий достоверности полученного термодинамического описания исследуемой системы [15, 16].
В настоящей работе рассмотрены потенциальные возможности метода Вильсона [17] с учетом последующей модификации [18]. Ранее метод Вильсона успешно применялся для описания термодинамических свойств и равновесий конденсированная фаза–пар на примере жидкофазных растворов низкомолекулярных органических веществ [17–20], многокомпонентных растворов полимеров [21, 22], водных растворов электролитов [23], твердых алканов [24], металлических сплавов [16, 25, 26], а также оксидных стеклообразующих систем: CaO–Al2O3–SiO2 [27], Na2O–B2O3–SiO2 и Na2O–K2O–SiO2 [28]. Однако в настоящее время в литературе не найдено упоминаний о возможности применения метода Вильсона для расчета термодинамических свойств оксидных систем, основы керамики высшей огнеупорности, содержащей оксиды редкоземельных элементов, циркония и гафния. Восполнение этого пробела является предметом данного исследования.
РАСЧЕТНАЯ ЧАСТЬ
Суть классического метода Вильсона [17] состоит в аппроксимации концентрационной зависимости избыточной энергии Гиббса в бинарной системе полиномом Вильсона, вид которого впоследствии был модифицирован [18] следующим образом:
(1)
$\Delta G_{{12}}^{E} = RT( - {{x}_{1}}\ln ({{x}_{1}} + {{x}_{2}}{{\Lambda }_{{12}}}) - {{x}_{2}}\ln ({{x}_{1}}{{\Lambda }_{{21}}} + {{x}_{2}})),$К основным достоинствам метода Вильсона необходимо отнести следующие: 1) коэффициенты уравнения (1) являются “полутеоретическими” [17] и могут характеризовать взаимодействия компонентов друг с другом в рамках модели локального состава; 2) указанный метод позволяет рассчитать избыточные энергии Гиббса в многокомпонентных системах с использованием данных только для соответствующих бинарных систем. Рассмотрим отмеченные особенности данного метода более подробно [18].
Коэффициент Λ12 в уравнении (1) одновременно учитывает геометрические различия компонентов в растворе и энергетические параметры их взаимодействия согласно уравнению (2):
(2)
${{\Lambda }_{{12}}} = \frac{{{{{v}}_{2}}}}{{{{{v}}_{1}}}}\exp \left( { - \frac{{{{\lambda }_{{12}}} - {{\lambda }_{{11}}}}}{{RT}}} \right),$Как уже отмечалось ранее [16], метод Вильсона относится к классу полиномиальных моделей, в которых проводится аппроксимация значений избыточной энергии Гиббса в бинарных системах и дальнейшее использование результатов аппроксимации для расчета термодинамических свойств многокомпонентных систем. Величина избыточной энергии Гиббса $\left( {\Delta G_{{123}}^{E}} \right)$ в трехкомпонентной системе при расчете по данным о равновесиях в соответствующих бинарных системах по методу Вильсона равна:
(3)
$\begin{gathered} \Delta G_{{123}}^{E} = RT( - {{x}_{1}}\ln ({{x}_{1}} + {{x}_{2}}{{\Lambda }_{{12}}} + {{x}_{3}}{{\Lambda }_{{13}}}) - \\ - \,\,{{x}_{2}}\ln ({{x}_{1}}{{\Lambda }_{{21}}} + {{x}_{2}} + {{x}_{3}}{{\Lambda }_{{23}}}) - \\ - \,\,{{x}_{3}}\ln ({{x}_{1}}{{\Lambda }_{{31}}} + {{x}_{2}}{{\Lambda }_{{32}}} + {{x}_{3}})), \\ \end{gathered} $Ранее нами была рассмотрена возможность расчета величин избыточных энергий Гиббса в следующих трехкомпонентных системах, содержащих оксиды редкоземельных элементов, циркония и гафния: Gd2O3–Y2O3–HfO2 [12, 29], La2O3–Y2O3–HfO2 [30], Y2O3–ZrO2–HfO2 [13], Sm2O3–Y2O3–HfO2 и Sm2O3–ZrO2–HfO2 [14, 31, 32], на основе как полиномиального подхода Редлиха–Кистера [10], так и геометрического метода Колера [11, 33]. Показано, что указанные методы наиболее успешно позволяют рассчитать термодинамические свойства трехкомпонентных систем в концентрационных диапазонах вблизи соответствующих бинарных систем (мольная доля третьего компонента меньше 0.3), однако повышение содержания третьего компонента приводит к значительным расхождениям с экспериментальными данными. По этой причине рассмотрение потенциальных возможностей еще одного полуэмпирического метода (метода Вильсона) для расчета термодинамических свойств многокомпонентных систем является весьма актуальным.
Таким образом, в настоящей работе были решены следующие задачи:
1. Найдены коэффициенты в уравнении Вильсона при аппроксимации концентрационных зависимостей термодинамических свойств, полученных методом высокотемпературной масс-спектрометрии в бинарных системах на основе оксидов самария, иттрия, циркония и гафния: Sm2O3–Y2O3, Sm2O3–HfO2, Sm2O3–ZrO2, Y2O3–ZrO2, ZrO2–HfO2 и Y2O3–HfO2.
2. Рассчитаны значения энергетических параметров λij взаимодействия компонентов i и j, являющихся неотъемлемой частью уравнения Вильсона, на основе экспериментальных данных о термодинамических свойствах в рассмотренных бинарных системах.
3. Выполнен расчет величин избыточной энергии Гиббса в трехкомпонентных системах Y2O3–ZrO2–HfO2, Sm2O3–Y2O3–HfO2 и Sm2O3–ZrO2–HfO2 на основе метода Вильсона при сопоставлении как с экспериментальными данными, так и с рассчитанными значениями, полученными на основе полуэмпирических методов Колера и Редлиха–Кистера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Определение коэффициентов в уравнении Вильсона при аппроксимации концентрационных зависимостей термодинамических свойств в бинарных системах на основе оксидов самария, иттрия, циркония и гафния
Следует отметить, что для расчета энергетических параметров взаимодействия (λij) в уравнении (2) необходимо аппроксимировать концентрационные зависимости ΔGE в таком количестве систем, чтобы число неизвестных энергетических параметров было равно числу уравнений типа (2), которое после логарифмирования должно принять следующий вид, удобный для последующего рассмотрения в разделе 2:
(4)
$\left\{ \begin{gathered} {{\lambda }_{{12}}} - {{\lambda }_{{11}}} = RT\left( {\ln \frac{{{{v}_{2}}}}{{{{v}_{1}}}} - \ln {{\Lambda }_{{12}}}} \right), \hfill \\ {{\lambda }_{{12}}} - {{\lambda }_{{22}}} = RT\left( {\ln \frac{{{{v}_{1}}}}{{{{v}_{2}}}} - \ln {{\Lambda }_{{21}}}} \right). \hfill \\ \end{gathered} \right.$Необходимо подчеркнуть, что для бинарной системы, для которой известна концентрационная зависимость избыточной энергии Гиббса, могут быть получены два уравнения, аналогичные соотношениям, приведенным в системе (4), с тремя неизвестными энергетическими параметрами. Следовательно, чтобы иметь возможность определения неизвестных энергетических параметров, целесообразно рассматривать бинарные системы с повторяющимися компонентами. Это позволит увеличить количество рассматриваемых уравнений без повышения числа неизвестных. Очевидно, что количество уравнений будет больше числа неизвестных энергетических параметров при изучении следующих пяти систем: Sm2O3–Y2O3, Sm2O3–ZrO2, Sm2O3–HfO2, Y2O3–ZrO2 и ZrO2–HfO2. Количество энергетических параметров в указанных системах равно девяти (λSY, λSZ, λSH, λSS, λZZ, λHH, λYZ, λYY, λZH, здесь и далее S – Sm2O3, Y – Y2O3, Z – ZrO2, H – HfO2) при десяти уравнениях, аналогичных (4). Таким образом, необходимо провести аппроксимацию концентрационных зависимостей избыточных энергий Гиббса в пяти указанных выше бинарных системах.
Экспериментальные значения термодинамических свойств в рассматриваемых системах, определенные методом высокотемпературной масс-спектрометрии, были получены ранее в следующих работах: Sm2O3–Y2O3, Sm2O3–HfO2 и Sm2O3–ZrO2 при температуре 2373 K [34], Y2O3–ZrO2 при температуре 2660 K [35] и ZrO2–HfO2 при температуре 2773 K [36]. Отметим, что в первых трех из перечисленных выше систем аппроксимация величин избыточной энергии Гиббса проведена методом наименьших квадратов, позволившим получить коэффициенты Λ12 и Λ21 в уравнении (1). В системе Y2O3–ZrO2 для определения коэффициентов ΛYZ и ΛZY проводилась аппроксимация концентрационных зависимостей коэффициентов активности Y2O3 и ZrO2 уравнениями Вильсона для коэффициентов активности компонентов. Таким образом, в табл. 1 приведены найденные в настоящей работе аппроксимационные коэффициенты Λ12 и Λ21 концентрационных зависимостей избыточных энергий Гиббса в следующих пяти бинарных системах: Sm2O3–Y2O3, Sm2O3–ZrO2, Sm2O3–HfO2, Y2O3–ZrO2 и ZrO2–HfO2.
Таблица 1.
Коэффициенты Λ12 и Λ21 в уравнении Вильсона (1) концентрационной зависимости избыточных энергий Гиббса в системах Sm2O3–Y2O3, Sm2O3–ZrO2, Sm2O3–HfO2, Y2O3–ZrO2, ZrO2–HfO2 и Y2O3–HfO2, определенные в настоящей работе при температуре эксперимента (Tэксп) и при 2373 K, где R2 – коэффициент детерминации, SD – квадратный корень из оценки дисперсии ошибок, характеризующие качество аппроксимации данных
| Система | Tэксп, K | Λ12* | Λ21 | R2 | SD, кДж/моль | T = 2373 K | |
|---|---|---|---|---|---|---|---|
| Λ12 | Λ21 | ||||||
| Sm2O3–Y2O3 | 2373 | 7.167 | 13.909 | 0.994 | 1.54 | 7.167 | 13.909 |
| Sm2O3–HfO2 | 2373 | 17.203 | 4.720 | 0.999 | 0.75 | 17.203 | 4.720 |
| Sm2O3–ZrO2 | 2458 | 10.396 | 5.045 | 0.997 | 0.62 | 11.509 | 5.199 |
| Y2O3–ZrO2 | 2660 | 3.036 | 8.679 | 0.948 | – | 3.791 | 10.325 |
| ZrO2–HfO2** | 2773 | 1.000 | 1.000 | – | – | 1.000 | 1.000 |
| Y2O3–HfO2 | 2843 | 2.679 | 9.411 | 0.998 | 0.79 | 3.758 | 12.714 |
* Индексы 1 и 2 в значениях Λ12 и Λ21 соответствуют первому и второму оксидам в обозначении системы в первом столбце таблицы. **Для системы ZrO2–HfO2 характерно идеальное поведение при указанной температуре согласно результатам [36]: значения коэффициентов Λ12 и Λ21 приняты равными единице.
Как отмечалось ранее [18], в уравнении Вильсона в “умеренном” температурном интервале справедливо допущение о независимости разности энергетических параметров взаимодействия компонентов в бинарных системах (λ12 – λ11 и λ12 – λ22) от температуры. Это позволяет в рамках метода Вильсона оценить значения интегральной энтальпии смешения $\left( {\Delta H_{{12}}^{M}} \right)$ и избыточной энтропии $\left( {\Delta S_{{12}}^{E}} \right)$ в исследуемой бинарной системе по изотермическим данным о величинах избыточной энергии Гиббса согласно уравнениям:
(5)
$\begin{gathered} \Delta H_{{12}}^{M} = \frac{{{{x}_{1}}{{x}_{2}}{{\Lambda }_{{12}}}}}{{{{x}_{1}} + {{x}_{2}}{{\Lambda }_{{12}}}}}({{\lambda }_{{12}}} - {{\lambda }_{{11}}}) + \\ + \,\,\frac{{{{x}_{1}}{{x}_{2}}{{\Lambda }_{{21}}}}}{{{{x}_{1}}{{\Lambda }_{{21}}} + {{x}_{2}}}}({{\lambda }_{{12}}} - {{\lambda }_{{22}}}), \\ \end{gathered} $(6)
$\begin{gathered} \Delta S_{{12}}^{E} = R({{x}_{1}}\ln ({{x}_{1}} + {{x}_{2}}{{\Lambda }_{{12}}}) + {{x}_{2}}\ln ({{x}_{1}}{{\Lambda }_{{21}}} + {{x}_{2}})) + \\ + \,\,\frac{{{{x}_{1}}{{x}_{2}}{{\Lambda }_{{12}}}}}{{{{x}_{1}} + {{x}_{2}}{{\Lambda }_{{12}}}}}\frac{{({{\lambda }_{{12}}} - {{\lambda }_{{11}}})}}{T} + \frac{{{{x}_{1}}{{x}_{2}}{{\Lambda }_{{21}}}}}{{{{x}_{1}}{{\Lambda }_{{21}}} + {{x}_{2}}}}\frac{{({{\lambda }_{{12}}} - {{\lambda }_{{22}}})}}{T}, \\ \end{gathered} $Следовательно, сочетание результатов определения величин избыточной энергии Гиббса методом высокотемпературной масс-спектрометрии и аппроксимации полученных данных уравнением Вильсона по аналогии с табл. 1 однозначно позволяет в рамках рассматриваемого подхода оценить полный набор термодинамических функций смешения и соответствующих избыточных свойств в исследуемой системе.
2. Расчет значений энергетических параметров λij взаимодействия компонентов i и j в уравнении Вильсона для рассматриваемых бинарных систем
Следует отметить, что для расчета энергетических параметров λij взаимодействия компонентов на основе данных, приведенных в табл. 1, необходимо использовать девять уравнений типа (4) для следующих коэффициентов Λij, оцененных методом наименьших квадратов: ΛSY, ΛYS, ΛSZ, ΛZS, ΛYZ, ΛZY, ΛSH, ΛZH и ΛHZ. В связи с тем, что количество неизвестных λij меньше, чем число оцененных в настоящей работе коэффициентов Λij, один из найденных коэффициентов ΛHS не будет использован при определении λij. Однако этот коэффициент может быть учтен позднее для проверки согласованности рассчитанных значений. Отметим, что ΛZH = ΛHZ = 1, поскольку, согласно [36], система ZrO2–HfO2 может быть описана в рамках модели идеального раствора.
Для определения энергетических параметров λij необходимы также данные о молярных объемах индивидуальных компонентов. В настоящем исследовании значения молярных объемов оксидов редкоземельных элементов приняты на основании данных, приведенных в [37]: 44.804 см3/моль (Y2O3), 44.263 см3/моль (Sm2O3), 21.693 см3/моль (ZrO2) и 21.745 см3/моль (HfO2). Следует добавить, что в настоящей работе сделано допущение о независимости величин молярных объемов компонентов от температуры.
Для проведения дальнейших расчетов целесообразно представить рассматриваемую систему линейных уравнений типа (4) в матричном виде. Для указанных выше девяти неизвестных энергетических параметров (λSY, λSS, λYY, λSZ, λZZ, λYZ, λSH, λHH и λZH) система линейных уравнений имеет следующую матрицу коэффициентов:
| λSY | λSS | λYY | λSZ | λZZ | λYZ | λSH | λHH | λZH | b, кДж/моль |
(7) | |
| ΛSY | 1 | –1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | –38.62 | |
| ΛYS | 1 | 0 | –1 | 0 | 0 | 0 | 0 | 0 | 0 | –52.18 | |
| ΛSZ | 0 | –1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | –62.27 | |
| ΛZS | 0 | 0 | 0 | 1 | –1 | 0 | 0 | 0 | 0 | –18.45 , | |
| ΛYZ | 0 | 0 | –1 | 0 | 0 | 1 | 0 | 0 | 0 | –40.60 | |
| ΛZY | 0 | 0 | 0 | 0 | –1 | 1 | 0 | 0 | 0 | –31.75 | |
| ΛSH | 0 | –1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | –70.15 | |
| ΛZH | 0 | 0 | 0 | 0 | –1 | 0 | 0 | 0 | 1 | 0.05 | |
| ΛHZ | 0 | 0 | 0 | 0 | 0 | 0 | 0 | –1 | 1 | –0.05 |
где в первом столбце отмечены коэффициенты, уравнения для которых записаны в соответствующей строке; в первой строке указаны энергетические параметры, коэффициенты при которых приведены в основной части матрицы; b – свободный член в уравнении типа (4), имеющий размерность энергии кДж/моль.
Определитель матрицы коэффициентов (7) равен нулю, ранг этой матрицы равен восьми. Следовательно, можно предположить, что система (7) имеет решение, зависящее от одного свободного параметра. По этой причине в настоящей работе сделано допущение, что λHH есть свободный параметр и он равен –100 кДж/моль. Следует отметить, что, хотя коэффициент λHH имеет размерность энергии, в данном случае он не имеет четкого физического смысла, поскольку значение –100 выбрано произвольно, а сам коэффициент λij лишь пропорционален энергии взаимодействия компонентов, но не равен ей [12]. Корректнее было бы представить размерность величины λHH в условных единицах, однако, чтобы обеспечить безразмерную величину показателя степени в уравнении (2), требуется введение размерности кДж/моль. Таким образом, с учетом равенства λHH = –100 кДж/моль матрица коэффициентов (7) имеет следующий вид:
| λSY | λSS | λYY | λSZ | λZZ | λYZ | λSH | λHH | λZH | b, кДж/моль |
(8) | |
| ΛSY | 1 | –1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | –38.62 | |
| ΛYS | 1 | 0 | –1 | 0 | 0 | 0 | 0 | 0 | 0 | –52.18 | |
| ΛSZ | 0 | –1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | –62.27 | |
| ΛZS | 0 | 0 | 0 | 1 | –1 | 0 | 0 | 0 | 0 | –18.45 . | |
| ΛYZ | 0 | 0 | –1 | 0 | 0 | 1 | 0 | 0 | 0 | –40.60 | |
| – | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | –100.00 | |
| ΛSH | 0 | –1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | –70.15 | |
| ΛZH | 0 | 0 | 0 | 0 | –1 | 0 | 0 | 0 | 1 | 0.05 | |
| ΛHZ | 0 | 0 | 0 | 0 | 0 | 0 | 0 | –1 | 1 | –0.05 |
Ввиду того, что ранг матрицы коэффициентов равен девяти и соответствует рангу расширенной матрицы, по теореме Кронекера–Капелли, система линейных алгебраических уравнений (8) имеет только одно решение. Найденные таким образом значения энергетических параметров λij приведены в табл. 2.
Таблица 2.
Значения энергетических параметров λij взаимодействия компонентов i и j в системах на основе оксидов самария, иттрия, циркония и гафния, полученные в результате решения системы уравнений (8)
| Параметр* | λSY | λSS | λYY | λSZ | λZZ | λYZ | λSH | λHH | λZH |
|---|---|---|---|---|---|---|---|---|---|
| Значение, кДж/моль | –94.91 | –56.29 | –42.73 | –118.56 | –100.11 | –80.33 | –126.45 | –100.00 | –100.05 |
Как следует из табл. 2, параметры взаимодействия λHH, λZH и λZZ соответствуют друг к другу в пределах 0.11%, что вполне объяснимо при идеальном поведении системы ZrO2–HfO2. Небольшие различия величин указанных параметров связаны с необходимостью равенства единице аппроксимационных коэффициентов Λij полинома Вильсона для идеального раствора. Для выполнения этого условия разности рассматриваемых энергетических параметров взаимодействия компонентов должны компенсировать различия в молярных объемах индивидуальных оксидов циркония и гафния. При рассмотрении других энергетических параметров, приведенных в табл. 2, наблюдается следующая закономерность. Параметры взаимодействия компонента самого с собой (λii и λjj) всегда больше (или по модулю меньше), чем смешанный параметр взаимодействия рассматриваемых компонентов λij. Как отмечалось ранее в работе [18], более отрицательное значение параметра λij соответствует, как правило, большей энергии взаимодействия компонентов. Следовательно, указанная закономерность изменения рассчитанных величин параметров взаимодействия λij вполне объяснима, поскольку во всех рассмотренных системах, кроме ZrO2–HfO2, наблюдались отрицательные отклонения от идеальности.
Некоторое исключение из отмеченной выше тенденции представляет собой энергетический параметр взаимодействия λYZ, имеющий большее значение, чем λZZ. Это вступает в некоторые противоречия с найденными ранее при высоких температурах отрицательными отклонениями от идеальности в системе Y2O3–ZrO2 [35, 36]. Указанное несоответствие, по-видимому, связано с тем, что при расчете значений энергетических параметров взаимодействия компонентов в бинарных системах не был принят во внимание второй коэффициент в уравнении Вильсона для данной системы ΛZY.
Необходимо отметить, что если включить в расчет энергетических параметров (т.е. в матрицу (8)) другой набор коэффициентов Λij, то будут получены новые значения λij, отличающиеся от приведенных в табл. 2. Таким образом, результаты расчетов λij, полученные по методу Вильсона, могут, в частности, зависеть от методики расчета и произвольного выбора уравнений для коэффициентов Λij, включенных в матрицу (8). Следовательно, нецелесообразно проведение дальнейшего расчета значений энергетических параметров взаимодействия компонентов с использованием метода Вильсона. Этим ограничением обусловлено также отсутствие в настоящее время реальных перспектив создания базы данных энергетических параметров взаимодействия компонентов с помощью метода Вильсона, которая обеспечивала бы согласование концентрационных зависимостей термодинамических свойств во всех рассмотренных бинарных системах и энергетических характеристик взаимодействия изученных компонентов.
Среди ряда причин, затрудняющих в настоящее время создание единой базы энергетических параметров взаимодействия компонентов, можно отметить следующие. Во-первых, следует иметь в виду, что метод Вильсона был предложен для описания термодинамических свойств органических растворов при температурах, близких к комнатной температуре, когда данные о равновесиях могут быть получены с минимальными погрешностями. В настоящей работе использованы величины термодинамических свойств в оксидных системах, определенные методом высокотемпературной масс-спектрометрии при температурах выше 2000 K, что неизбежно ведет к увеличению погрешности получаемых значений как минимум до 20%. Следовательно, недостаточная согласованность термодинамических свойств, найденных в различных бинарных системах на основе оксидов редкоземельных элементов, могла привести к возрастанию погрешностей и несогласованности аппроксимационных коэффициентов в уравнениях Вильсона в рассмотренных системах. Во-вторых, недостатком проведенного рассмотрения может быть предположение о независимости от температуры разности энергетических параметров (λ12 – λ11) и (λ12 – λ22), что могло повлиять на корректность пересчета значений аппроксимационных коэффициентов Λ12 и Λ21 от температуры экспериментов к температуре 2373 K для систем Sm2O3–ZrO2, Y2O3–ZrO2 и ZrO2–HfO2 и последующего определения значений всех энергетических параметров (λSY, λSS, λYY, λSZ, λZZ, λYZ, λSH, λHH и λZH). В-третьих, следует признать, что предположение о независимости молярных объемов индивидуальных компонентов является весьма грубым, а его необходимость вызвана лишь отсутствием необходимых данных. Однако, по-видимому, для дальнейшего рассмотрения вопроса о возможности создания базы данных энергетических параметров взаимодействия компонентов в бинарных системах, рассчитанных по методу Вильсона, в первую очередь целесообразно проведение аналогичных расчетов концентрационных зависимостей избыточной энергии Гиббса при низких температурах в системах, образующих жидкофазные растворы, с привлечением экспериментальных данных, полученных более прецизионными методами.
Следует отметить, что бóльшая часть выводов двух предыдущих абзацев относится к значениям отдельных энергетических параметров λ12, но не к их разности λ12 – λ22. Это связано с тем, что каждая разность энергетических параметров λ12 – λ22 соответствует одному и только одному аппроксимационному коэффициенту Λ21 уравнения Вильсона. Следовательно, величины разности λ12 – λ22 могут быть определены только на основе экспериментальных результатов именно для системы 12, а не с использованием данных, найденных для других бинарных систем.
Рассмотрим изменения разности энергетических параметров (λ12 – λ22) на примере изученных систем по аналогии с рассмотрением, проведенным ранее в работе [18]. В табл. 3 представлены величины разностей параметров взаимодействия компонентов в системах Sm2O3–ZrO2, Sm2O3–HfO2, Y2O3–ZrO2, ZrO2–HfO2 и Y2O3–HfO2, полученные с привлечением данных, приведенных в табл. 1.
Таблица 3.
Величины разности параметров взаимодействия λ12 – λ22 компонентов в системах Sm2O3–ZrO2, Sm2O3–HfO2, Y2O3–ZrO2, ZrO2–HfO2 и Y2O3–HfO2, найденные согласно аппроксимационным коэффициентам Λ21 в уравнении Вильсона, приведенным в табл. 1
| λ12 – λ22* | λYH – λHH | λYZ – λZZ | λSZ – λZZ | λSH – λHH | λZH – λHH | λZH – λZZ |
|---|---|---|---|---|---|---|
| Значение, кДж/моль | –35.90 | –31.75 | –18.45 | –16.59 | –0.05 | 0.05 |
В табл. 3 величины разностей энергетических параметров взаимодействия компонентов упорядочены по возрастанию, т.е. по уменьшению энергии взаимодействия компонентов в исследуемых системах. Можно отметить, что изменение энергии взаимодействия компонентов соответствует тенденциям в изменении кислотно-основных свойств индивидуальных оксидов согласно кислотно-основной концепции взаимодействия оксидных расплавов, изложенной, в частности, в монографии [38]. Для рассматриваемых оксидов кислотные свойства возрастают в следующем ряду: Y2O3, Sm2O3, HfO2, ZrO2, причем Y2O3 является наиболее основным, а ZrO2 – наиболее кислотным из обсуждаемых оксидов. На основе предположения, что λZZ и λHH близки друг к другу в силу соответствия кислотно-основных свойств и энергий взаимодействия HfO2 и ZrO2, можно сделать следующие заключения. Наиболее основный оксид Y2O3 демонстрирует более сильные взаимодействия с HfO2 и ZrO2, чем менее основный Sm2O3. При этом энергия взаимодействия Sm2O3 с ZrO2 выше, чем с HfO2, в силу менее выраженных кислотных свойств последнего. Однако эта тенденция не наблюдается для Y2O3, который, согласно данным табл. 3, характеризуется более интенсивным взаимодействием с HfO2, чем с ZrO2, что не вполне соответствует кислотно-основной концепции. Возможной причиной этого несоответствия может быть недостаточная корректность предположения о независимости разности энергетических параметров взаимодействия компонентов от температуры, что нашло отражение в погрешностях, возникающих при пересчете экспериментальных данных, полученных в системах Y2O3–ZrO2 и Y2O3–HfO2 при температуре опыта, к одной и той же (единой) температуре. Аналогичные рассмотрения могут быть проведены и на других наборах разностей энергетических параметров взаимодействия компонентов (λ12 – λ22), где в качестве λ22 могут быть выбраны λSS или λYY.
3. Расчет значений избыточной энергии Гиббса в трехкомпонентных системах Sm2O3–Y2O3–HfO2, Sm2O3–ZrO2–HfO2 и Y2O3–ZrO2–HfO2 по данным о равновесиях в соответствующих бинарных системах
Полученный в настоящей работе набор параметров, найденных по уравнению Вильсона (табл. 1), позволяет рассчитать величины избыточных энергий Гиббса в следующих четырех трехкомпонентных системах и в одной четырехкомпонентной системе: Sm2O3–Y2O3–HfO2, Sm2O3–ZrO2–HfO2, Sm2O3–Y2O3–ZrO2, Y2O3–ZrO2–HfO2 и Sm2O3–Y2O3–ZrO2–HfO2. Следует подчеркнуть, что такой расчет методом Вильсона возможен только по данным о равновесиях в соответствующих бинарных системах. Однако необходимо отметить, что в данном случае расчет может быть выполнен лишь в предположении о существовании гипотетического непрерывного твердого раствора и отсутствии фазового разделения в рассматриваемых концентрационных областях трехкомпонентной системы [17–19, 25]. Ниже даны значения рассчитанных избыточных энергий Гиббса в системах Sm2O3–Y2O3–HfO2, Sm2O3–ZrO2–HfO2 и Y2O3–ZrO2–HfO2 при сопоставлении с экспериментальными данными, полученными методом высокотемпературной масс-спектрометрии ранее [13, 14, 39].
Для систем, содержащих оксид самария, расчет избыточных энергий Гиббса выполнен по уравнению (3) с использованием значений аппроксимационных коэффициентов Λ12, Λ21, Λ13, Λ31, Λ23 и Λ32 при температуре 2373 K, приведенных в табл. 1. В табл. 4 и на рис. 1 сопоставлены величины избыточных энергий Гиббса в системах Sm2O3–Y2O3–HfO2 и Sm2O3–ZrO2–HfO2, полученные методом высокотемпературной масс-спектрометрии [14, 39], а также рассчитанные с использованием полуэмпирических методов Вильсона [17, 18], Редлиха–Кистера [10] и Колера [11].
Таблица 4.
Значения избыточной энергии Гиббса (ΔGE, кДж/моль) в системе Sm2O3–Y2O3–HfO2 при температуре 2373 K, полученные методом высокотемпературной масс-спектрометрии [14] (I) и рассчитанные по данным для соответствующих бинарных систем полуэмпирическими методами Вильсона (II), Редлиха–Кистера (III) и Колера (IV)
| Мольная доля | ΔGE, кДж/моль | |(I–II)/I| | |(I–IV)/I| | |||||
|---|---|---|---|---|---|---|---|---|
| Sm2O3 | Y2O3 | HfO2 | I | II | III | IV | ||
| 0.484 | 0.258 | 0.258 | –19.4 | –37.8 | –42.4 | –42.5 | 0.94 | 1.19 |
| 0.375 | 0.313 | 0.313 | –22.2 | –38.2 | –42.8 | –42.9 | 0.72 | 0.93 |
| 0.250 | 0.375 | 0.375 | –25.5 | –37.0 | –39.9 | –39.8 | 0.45 | 0.56 |
| 0.125 | 0.438 | 0.438 | –26.9 | –33.7 | –33.4 | –33.2 | 0.25 | 0.24 |
| 0.500 | 0.375 | 0.125 | –16.5 | –36.6 | –40.5 | –40.6 | 1.22 | 1.46 |
| 0.375 | 0.469 | 0.156 | –18.7 | –37.1 | –41.1 | –41.2 | 0.98 | 1.20 |
| 0.250 | 0.563 | 0.188 | –19.6 | –35.1 | –37.2 | –37.2 | 0.79 | 0.90 |
| 0.126 | 0.656 | 0.218 | –18.3 | –30.0 | –28.4 | –28.2 | 0.64 | 0.54 |
| 0.500 | 0.125 | 0.375 | –23.4 | –36.4 | –40.5 | –40.6 | 0.55 | 0.73 |
| 0.375 | 0.156 | 0.469 | –26.5 | –36.1 | –39.7 | –39.7 | 0.36 | 0.50 |
| 0.250 | 0.188 | 0.563 | –29.2 | –34.2 | –35.8 | –35.7 | 0.17 | 0.22 |
| 0.126 | 0.218 | 0.656 | –28.7 | –30.8 | –29.4 | –29.3 | 0.07 | 0.02 |
| Среднее значение: | 0.60 | 0.71 | ||||||
Рис. 1.
Значения избыточной энергии Гиббса в системе Sm2O3–ZrO2–HfO2 при температуре 2373 K и соотношении содержаний (мол. д.) ZrO2 и HfO2, равном 1. I – значения ΔGE, полученные по экспериментальным данным работы [39]. II, III и IV – значения ΔGE, рассчитанные по данным для соответствующих бинарных систем полуэмпирическими методами Вильсона, Редлиха–Кистера и Колера соответственно.
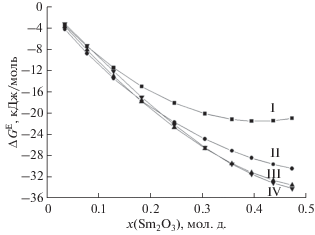
Как следует из данных, приведенных в табл. 4 и на рис. 1, результаты, полученные полиномиальным методом Редлиха–Кистера и геометрическим методом Колера, близки друг к другу в пределах нескольких десятых кДж/моль, а также характеризуются заниженными значениями ΔGE по сравнению с экспериментальными данными. Величины ΔGE, полученные методом Вильсона, также меньше соответствующих экспериментальных данных. При этом метод Вильсона демонстрирует большее соответствие экспериментальным результатам в концентрационных диапазонах, далеких от бинарных систем, на несколько кДж/моль превышая соответствующие результаты, рассчитанные методами Редлиха–Кистера и Колера. При содержании Sm2O3 < 0.25 мол. дол. ситуация меняется, и результаты расчета методами Колера и Редлиха–Кистера приводят к значениям ΔGE, более близким к экспериментальным данным по сравнению с величинами, рассчитанными методом Вильсона. Как следует из рис. 1, не наблюдается сближения величин ΔGE в системе Sm2O3–ZrO2–HfO2, рассчитанных методом Вильсона, и экспериментальных данных даже при содержании Sm2O3 < 0.04 мол. дол. (относительное отклонение рассчитанных значений от экспериментальных величин сохраняет постоянное значение ~20%). При расчетах по методам Колера и Редлиха–Кистера в данном случае наблюдается тенденция уменьшения относительного и абсолютного отклонений рассчитанных величин от экспериментальных значений по мере уменьшения мольной доли Sm2O3.
Для расчета термодинамических свойств в системе Y2O3–ZrO2–HfO2 аппроксимационные коэффициенты ΛYZ, ΛZY, ΛYH, ΛHY, ΛZH и ΛHZ в уравнении Вильсона, описывающем концентрационные зависимости ΔGE в соответствующих бинарных системах, были пересчитаны (с учетом независимости разности энергетических параметров взаимодействия компонентов λ12 – λ11 и λ12 – λ22 от температуры) к температуре 2660 K, при которой ранее были получены экспериментальные данные в системе Y2O3–ZrO2–HfO2 [13]. Результаты расчета значений ΔGE методом Вильсона приведены на рис. 2 при сопоставлении с экспериментальными данными [13] и величинами, полученными методами Редлиха–Кистера и Колера.
Рис. 2.
Избыточная энергия Гиббса в системе Y2O3–ZrO2–HfO2 при температуре 2660 K и постоянном содержании ZrO2, равном 0.21 мол. д. I – значения ΔGE, полученные методом высокотемпературной масс-спектрометрии в работе [13]. II, III и IV – значения ΔGE, рассчитанные по данным для соответствующих бинарных систем полуэмпирическими методами Вильсона, Редлиха–Кистера и Колера соответственно.
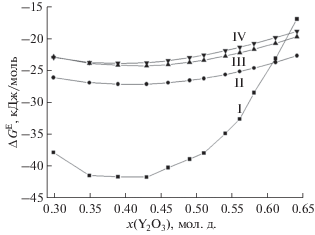
На рис. 2 наблюдается противоположная тенденция в изменении значений ΔGE по сравнению с приведенными ранее примерами систем Sm2O3–Y2O3–HfO2 и Sm2O3–ZrO2–HfO2. За исключением первого состава на рис. 2 величины, рассчитанные полуэмпирическими методами, завышены по сравнению с экспериментальными данными. Однако, как и в табл. 4 и на рис. 1, результаты, рассчитанные методом Вильсона, отличают наименьшие относительные отклонения от экспериментальных данных по сравнению с полуэмпирическими методами Колера и Редлиха–Кистера в концентрационных областях, далеких от соответствующих бинарных систем.
ЗАКЛЮЧЕНИЕ
Рассмотрены возможности применения метода Вильсона для расчета значений избыточных энергий Гиббса в многокомпонентных системах, содержащих оксиды редкоземельных элементов, по соответствующим данным для бинарных систем при высоких температурах. Отмечены достоинства и ограничения использования энергетических параметров взаимодействия компонентов бинарных систем, рассчитанных методом Вильсона, для выявления тенденции изменения энергии взаимодействия оксидов редкоземельных элементов, циркония и гафния в рассмотренных системах Sm2O3–Y2O3, Sm2O3–HfO2, Sm2O3–ZrO2, Y2O3–ZrO2, ZrO2–HfO2 и Y2O3–HfO2. Показано, что результаты расчета избыточных энергий Гиббса в изученных трехкомпонентных системах Sm2O3–Y2O3–HfO2, Sm2O3–ZrO2–HfO2 и Y2O3–ZrO2–HfO2, найденные методом Вильсона, в наибольшей степени по сравнению с другими рассмотренными полуэмпирическими методами соответствуют экспериментальным данным в концентрационных диапазонах, удаленных от бинарных систем.
Рассмотренные в настоящей работе потенциальные возможности метода Вильсона для расчета термодинамических свойств многокомпонентных систем могут найти применение для прогнозирования термодинамических свойств оксидных систем, перспективных для получения материалов высшей огнеупорности. Не менее важна фундаментальная значимость полученных результатов. С одной стороны, рассчитанные значения термодинамических свойств могут быть использованы при рассмотрении фазовых равновесий в многокомпонентных системах на основе оксидов редкоземельных элементов, экспериментальное изучение которых затруднено в силу значительной трудоемкости высокотемпературных исследований. С другой стороны, тестирование адекватности полуэмпирических подходов и выявление области их применимости является важнейшим шагом в процессе создания национальной базы термодинамических данных и моделей, необходимой для дальнейшего прогнозирования физико-химических свойств как в оксидных системах, так и в материалах на их основе с целью поиска оптимальных технологических решений при экстремальных температурных воздействиях при синтезе и эксплуатации.
Список литературы
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2014. V. 59. № 7. P. 643. [Кузнецов Н.Т. // Журн. неорган. химии. 2014. Т. 59. № 7. С. 832. https://doi.org/10.7868/S0044457X14070162]https://doi.org/10.1134/S0036023614070122
Данилов В.П., Кузнецов Н.Т., Новоторцев В.М. // Журн. неорган. химии. 2014. V. 59. № 7. С. 836. https://doi.org/10.7868/s0044457x14070058
Stolyarova V.L., Vorozhtcov V.A., Shilov A.L., Sokolova T.V. // Pure Appl. Chem. 2020. V. 92. № 8. P. 1259. https://doi.org/10.1515/pac-2019-1217
Ushakov S.V., Navrotsky A. // J. Am. Ceram. Soc. 2012. V. 95. № 5. P. 1463. https://doi.org/10.1111/j.1551-2916.2012.05102.x
Морачевский А.Г., Воронин Г.Ф., Гейдерих В.А., Куценок И.Б. Электрохимические методы в термодинамике металлических систем. М.: ИКЦ “Академкнига”, 2003. 334 с.
Drowart J., Chatillon C., Hastie J., Bonnell D. // Pure Appl. Chem. 2005. V. 77. № 4. P. 683. https://doi.org/10.1351/pac200577040683
Семенов Г.А., Столярова В.Л. Масс-спектрометрическое исследование испарения оксидных систем. Л.: Наука, 1990. 300 с.
Stolyarova V.L. // Russ. Chem. Rev. 2016. V. 85. № 1. P. 60. [Столярова В.Л. // Успехи химии. 2016. Т. 85. № 1. С. 60.] https://doi.org/10.1070/RCR4549
Stolyarova V.L. // Calphad. 2019. V. 64. P. 258. https://doi.org/10.1016/j.calphad.2018.12.013
Redlich O., Kister A.T. // Ind. Eng. Chem. 1948. V. 40. № 2. P. 345. https://doi.org/10.1021/ie50458a036
Kohler F. // Monatsh. Chem. 1960. V. 91. № 4. P. 738. https://doi.org/10.1007/BF00899814
Kablov E.N., Stolyarova V.L., Lopatin S.I. et al. // Rapid Commun. Mass Spectrom. 2017. V. 31. № 13. P. 1137. https://doi.org/10.1002/rcm.7892
Kablov E.N., Stolyarova V.L., Vorozhtcov V.A. et al. // Rapid Commun. Mass Spectrom. 2019. V. 33. № 19. P. 1537. https://doi.org/10.1002/rcm.8501
Kablov E.N., Stolyarova V.L., Vorozhtcov V.A. et al. // Rapid Commun. Mass Spectrom. 2020. V. 34. № 8. P. e8693. https://doi.org/10.1002/rcm.8693
Morachevskii A.G., Tsymbulov L.B., Kolosova E.Y., Tsemekhman L.S. // Russ. J. Appl. Chem. 2005. V. 78. № 1. P. 57. [Морачевский А.Г., Цымбулов Л.Б., Колосова Е.Ю., Цемехман Л.Ш. // Журн. прикл. химии. 2005. Т. 78. № 1. С. 59.]https://doi.org/10.1007/s11167-005-0231-1
Morachevskii A.G., Kolosova E.Y., Tsemekhman L.S., Tsymbulov L.B. // Russ. J. Appl. Chem. 2007. V. 80. № 7. P. 1040. [Морачевский А.Г., Колосова Е.Ю., Цемехман Л.Ш., Цымбулов Л.Б. // Журн. прикл. химии. 2007. Т. 80. № 7. С. 1071.]https://doi.org/10.1134/S107042720707004X
Wilson G.M. // J. Am. Chem. Soc. 1964. V. 86. № 2. P. 127. https://doi.org/10.1021/ja01056a002
Orye R.V., Prausnitz J.M. // Ind. Eng. Chem. 1965. V. 57. № 5. P. 18. https://doi.org/10.1021/ie50665a005
McDonald C.M., Floudas C.A. // Ind. Eng. Chem. Res. 1995. V. 34. № 5. P. 1674. https://doi.org/10.1021/ie00044a020
Reddy K.R., Kumar D.B.K., Rao G.S. et al. // J. Chem. Eng. Data. 2012. V. 57. № 5. P. 1412. https://doi.org/10.1021/je3002078
Xu X., Madeira P.P., Teixeira J.A., Macedo E.A. // Fluid Phase Equilib. 2003. V. 213. № 1–2. P. 53. https://doi.org/10.1016/S0378-3812(03)00185-7
Sadeghi R. // J. Chem. Thermodyn. 2005. V. 37. № 1. P. 55. https://doi.org/10.1016/j.jct.2004.08.007
Zhao E., Yu M., Sauvé R.E., Khoshkbarchi M.K. // Fluid Phase Equilib. 2000. V. 173. № 2. P. 161. https://doi.org/10.1016/S0378-3812(00)00393-9
Derevich I.V., Ermolaev V.S., Zol’nikova N.V., Mordkovich V.Z. // Theor. Found. Chem. Eng. 2013. V. 47. № 3. P. 191. [Деревич И.В., Ермолаев В.С., Зольникова Н.В., Мордкович В.З. // Теорет. основы хим. технологии. 2013. Т. 47. № 3. С. 243. https://doi.org/10.7868/S0040357113020024]https://doi.org/10.1134/S0040579513020024
Dong Ping Tao. // Thermochim. Acta. 2000. V. 363. № 1–2. P. 105. https://doi.org/10.1016/S0040-6031(00)00603-1
Korolev A.A., Krayukhin S.A., Mal’tsev G.I. // Russ. Metall. 2018. V. 2018. № 5. P. 473. [Королев А.А., Краюхин С.А., Мальцев Г.И. // Расплавы. 2017. № 5. С. 435.]https://doi.org/10.1134/S0036029518050075
Stolyarova V.L. // Rapid Commun. Mass Spectrom. 1993. V. 7. № 11. P. 1022. https://doi.org/10.1002/rcm.1290071112
Stolyarova V.L., Shornikov S.I., Ivanov G.G., Shultz M.M. In: Proc. 4th Intern. Conf. on Molten Slags and Fluxes. Sendai: The Iron and Steel Institute of Japan, 1992. P. 185.
Vorozhtcov V.A., Shilov A.L., Stolyarova V.L. // Russ. J. Gen. Chem. 2019. V. 89. № 3. P. 475. [Ворожцов В.А., Шилов А.Л., Столярова В.Л. // Журн. общ. химии. 2019. Т. 89. № 3. С. 452. https://doi.org/10.1134/S0044460X19030181]https://doi.org/10.1134/S1070363219030186
Kablov E.N., Stolyarova V.L., Vorozhtcov V.A. et al. // Rapid Commun. Mass Spectrom. 2018. V. 32. № 9. P. 686. https://doi.org/10.1002/rcm.8081
Kablov E.N., Doronin O.N., Artemenko N.I. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 914. [Каблов Е.Н., Доронин О.Н., Артеменко Н.И. и др. // Журн. неорган. химии. 2020. Т. 65. № 6. С. 846. https://doi.org/10.31857/S0044457X20060070]https://doi.org/10.1134/S0036023620060078
Shilov A.L., Stolyarova V.L., Vorozhtsov V.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 5. P. 773. [Шилов А.Л., Столярова В.Л., Ворожцов В.А. и др. // Журн. неорган. химии. 2020. Т. 65. № 5. С. 703. https://doi.org/10.31857/S0044457X20050219]https://doi.org/10.1134/S0036023620050216
Chartrand P., Pelton A.D. // J. Phase Equilibria. 2000. V. 21. № 2. P. 141. https://doi.org/10.1361/105497100770340192
Stolyarova V.L., Vorozhtcov V.A., Shilov A.L. et al. // Mater. Chem. Phys. 2020. V. 252. P. 123240. https://doi.org/10.1016/j.matchemphys.2020.123240
Kablov E.N., Stolyarova V.L., Vorozhtcov V.A. et al. // J. Alloys Compd. 2019. V. 794. P. 606. https://doi.org/10.1016/j.jallcom.2019.04.208
Белов А.Н., Семенов Г.А. // Журн. физ. химии. 1985. Т. 59. № 3. С. 589.
Zinkevich M. // Prog. Mater. Sci. 2007. V. 52. № 4. P. 597. https://doi.org/10.1016/J.PMATSCI.2006.09.002
Stolyarova V.L., Semenov G.A. Mass Spectrometric Study of the Vaporization of Oxide Systems. Chichester: John Wiley, 1994. 434 p.
Stolyarova V.L., Vorozhtcov V.A. // Russ. J. Phys. Chem. A. 2020. V. 94. № 13. P. 2640. https://doi.org/10.1134/S0036024420130257
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


