Журнал неорганической химии, 2021, T. 66, № 9, стр. 1247-1254
Координационный полимер Ba2+ с анионами 2-фуранкарбоновой кислоты: синтез, строение и термические свойства
М. Е. Никифорова a, *, И. А. Луценко a, М. А. Кискин a, Ю. В. Нелюбина b, П. В. Примаков b, О. Б. Беккер c, А. В. Хорошилов a, И. Л. Еременко a
a Институт общей и неорганической химии им. Н.С. Курнакова PAH
119991 Москва, Ленинский пр-т, 31, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова PAH
119991 Москва, ул. Вавилова, 28, Россия
c Институт общей генетики им. Н.И. Вавилова PAH,
119991 Москва, ул. Губкина, 3, Россия
* E-mail: nikiforova.marina@gmail.com
Поступила в редакцию 12.03.2021
После доработки 16.04.2021
Принята к публикации 20.04.2021
Аннотация
Взаимодействием гидроксида бария(II) и 2-фуранкарбоновой кислоты (пирослизевая кислота, Hfur) получен 1D-координационный полимер состава {[Ba3(fur)6(Hfur)2(H2O)8]}n · 4nH2O (I). По данным РСА, I содержит два симметрически независимых катиона бария, каждый из которых имеет различное окружение: Ba(1) координирует шесть анионов fur–, тогда как Ва(2) представляет фрагмент гетеролептической координации (fur–, Hfur и H2O) (CIF files CCDC № 2063380). Супрамолекулярная полимерная организация I определена мостиковыми молекулами воды и многочисленными водородными связями между координированными и сольватными молекулами воды с формированием 1D-мотива. Расположение ионов Ba2+ в трехъядерном фрагменте {Ba3(fur)6(Hfur)2(H2O)8} полимера практически линейное. Термическое поведение I, исследованное методом синхронного термического анализа (атмосфера аргона), показало ступенчатый характер термолиза, обусловленный постепенным разрушением водородно-связанного каркаса и последующей частичной деструкцией органической части. Анализ биологической активности I в отношении непатогенного штамма Mycolicibacterium smegmatis показал низкую чувствительность бактериальной стенки к исследуемому комплексу.
ВВЕДЕНИЕ
Химия соединений щелочноземельных металлов относится к числу активно развивающихся областей неорганической химии [1–7]. Например, катионы бария, обладая большими координационными возможностями, с успехом используются для построения металлорганических координационных полимеров (МОКП) [8–11]. Устойчивый интерес к пористым МОКП на основе s-блоков обусловлен их способностью высокоселективного люминесцентного зондирования органических молекул [12–14]. По результатам исследований биологической активности комплексов на основе Ba, они обладают высокой токсичностью, в отличие от соединений Са и Mg, что делает их перспективными для получения компонентов пестицидов, гербицидов и др. [9]. Барий не относится к эссенциальным (жизненно необходимым) металлам, но в небольших количествах находится во всех органах и тканях (среднее содержание ~20 мг для взрослого человека [15]). Несмотря на токсичность большинства соединений, некоторые все-таки нашли свое применение в медицине, например, в качестве контрастных агентов при рентгенографическом исследовании внутренних органов. Однако при синтезе комплексов бария возникают трудности, вызванные малым зарядом и большим атомным радиусом. Данную проблему позволяют решить карбоксилатные лиганды, обеспечивающие различные варианты координационного связывания и возможность реализации разнообразных КЧ(Ba) (от 7 до 12) [16, 17]. Цель настоящего исследования – синтез соединения бария(II) с 2-фуранкарбоновой кислотой, определение структуры, термических свойств и установление биологической активности in vitro в отношении Mycolicibacterium smegmatis.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез нового комплексного соединения проводили на воздухе с использованием дистиллированной воды. Для синтеза использовали коммерчески доступные реактивы: 2-фуранкарбоновую кислоту (Hfur) (Acros Organics, 98%) и моногидрат гидроксида бария(II) (Acros Organics, 98%).
Элементный анализ выполняли на автоматическом С,H,N-анализаторе Carlo Erba EA 1108. ИК-спектры соединения регистрировали на ИК-спектрофотометре с Фурье-преобразованием Perkin–Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Биологическую активность определяли в тест-системе M. smegmatis mc2 155 методом бумажных дисков. Фиксировали величину зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях. Бактерии, смытые с чашек Петри со средой Триптон–соевый агар М-290 (Himedia), выращивали в течение ночи в жидкой среде Lemco-TW (Lab Lemco’ Powder 5 g L–1 (Oxoid), Peptone special 5 g L–1 (Oxoid), NaCl 5 g L–1, Tween-80) при +37°С до среднелогарифмической фазы роста при оптической плотности OD600 = 1.5, затем смешивали с расплавленной агаризованной средой М-290 в соотношении 1 : 9 : 10 (культура: Lemco-TW: М-290). Культуру инкубировали в течение 24 ч при +37°С. Минимальной ингибирующей концентрацией (MИК) считали концентрацию вещества, при которой зона подавления роста минимальна. Тест-система M. smegmatis проявляет более высокую степень устойчивости к антибиотикам и противотуберкулезным агентам, чем M. tuberculosis, поэтому критерием отбора является концентрация вещества <100 мкг/диск. Метод испытания включает количественную оценку диаметра зоны подавления роста культуры M. smegmatis, выращенной газоном на агаризованной среде, вокруг бумажных дисков, пропитанных испытуемыми соединениями. Исследуемое соединение наносили на диски в разных концентрациях и регистрировали диаметр halo (зона ингибирования роста).
Синтез {[Ba3(fur)6(Hfur)2(H2O)8]}n · 4nH2O (I). Навески Ba(OH)2 · H2O (0.2534 г, 1.34 ммоль) и Hfur (0.30 г, 2.68 ммоль) растворяли в 15 мл дистиллированной воды. Реакционную смесь перемешивали в течение 30 мин при 65°C. Полученный раствор выдерживали при комнатной температуре. Образовавшиеся через 2 мес. бесцветные шестигранные кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией и сушили на воздухе. Выход соединения I составил 0.424 г (63% в расчете на Ba(OH)2 · H2O).
ИК-спектр (НПВО), ν, см–1: 3547 сл, 3367 ш. ср, 3143 сл, 3123 сл, 3099 сл, 2641 ш. сл, 2537 ш. сл, 1693 ср, 1586 с, 1548 ш. оч. с, 1472 ш. оч. с, 1409 с, 1388 оч. с, 1360 оч. с, 1288 с, 1235 сл, 1223 ср, 1186 с, 1128 с, 1077 с, 1010 оч. с, 932 с, 884 с, 795 с, 775 с, 754 оч. с, 740 с, 594 с, 524 ср, 472 оч. сл, 451 сл, 439 сл, 431 сл, 415 сл, 408 сл, 403 сл.
Рентгеноструктурный анализ координационного полимера I проводили при 120 K на дифрактометре Bruker ApexII DUO (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор). Структура расшифрована с использованием программы ShelXT [18] и уточнена полноматричным МНК с помощью программы Olex2 [19] в анизотропном приближении для неводородных атомов. Атомы водорода OH-групп локализованы из разностных синтезов Фурье, положения остальных атомов водорода рассчитаны геометрически, все они уточнены в изотропном приближении в модели “наездника”. Кристаллографические параметры и детали уточнения для соединения I следующие: C40H50Ba3O36, M = 1518.82 г/моль, кристаллы – бесцветные параллелепипеды, пр. гр. C2/c, a = 18.778(5), b = 12.079(3), c = 25.052(9) Å, β = = 106.402(5)°, V = 5451(3) Å3, Z = 4, ρвыч = 1.851 г/см3, μ = 22.46 cм–1, 15713 измеренных рефлексов, 4200 рефлексов с I > 2.0σ(I), Rint = 0.0775, GOOF = = 1.236, R1 (I > 2σ(I)) = 0.1254, wR2 (I > 2σ(I)) = = 0.2915, Tmin/max = 0.956/0.976. Координаты атомов и другие параметры структуры I депонированы в Кембриджском банке структурных данных (№ 2063380; deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
Термическое поведение соединения I изучали методом синхронного термического анализа (СТА) в атмосфере аргона с одновременной регистрацией кривых термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Исследование проводили на приборе CTA 449 F1 Jupiter (фирмы Netzsch) в алюминиевых тиглях под крышкой с отверстием, обеспечивающим давление паров при термическом разложении образцов в 1 атм. Скорость нагрева до 500°С составляла 10 град/мин. Масса навески 1.64 мг (I). Точность измерения температуры ±0.7°С, изменение массы ±1 × 10−2 мг. При съемке кривых ТГ и ДСК использовали файл коррекции, а также калибровки по температуре и чувствительности для заданной температурной программы и скорости нагрева. После проведения термического анализа качественное определение химического состава и микроморфологию остаточного вещества анализировали с помощью растрового электронного микроскопа Carl Zeiss NVision 40, оснащенного рентгеноспектральным детектором Oxford X-Max, при ускоряющем напряжении 1 и 20 кВ соответственно. Увеличение составляло ×30000.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученный продукт взаимодействия гидроксида бария(II) и фуранкарбоновой кислоты в водном растворе был выделен в виде монокристаллов и структурно охарактеризован. Он представляет собой 1D-координационный полимер состава {[Ba3(fur)6(Hfur)2(H2O)8]}n · 4nH2O (I) и кристаллизуется в моноклинной пр. гр. С2/c с двумя симметрически независимыми ионами бария Ba(1) и Ba(2), первый из которых занимает в кристалле частное положение – центр инверсии (рис. 1), и двумя сольватными молекулами воды в симметрически независимой части элементарной ячейки, имеющей состав [Ba1.5(fur)3(Hfur)(H2O)4] · · 2H2O.
Рис. 1.
Общий вид фрагмента {Ba3(fur)6(Hfur)2(H2O)8} в кристалле I, в котором ион бария Ba(1) занимает частное положение – центр инверсии. Нумерация приведена для гетероатомов симметрически независимой части элементарной ячейки. Здесь и далее атомы водорода H(C), сольватные молекулы воды и вторые компоненты разупорядоченных молекул воды и анионов фуранкарбоновой кислоты не показаны. Неводородные атомы представлены в виде эллипсоидов тепловых колебаний (p = 30%), а водородные связи изображены пунктирными линиями.
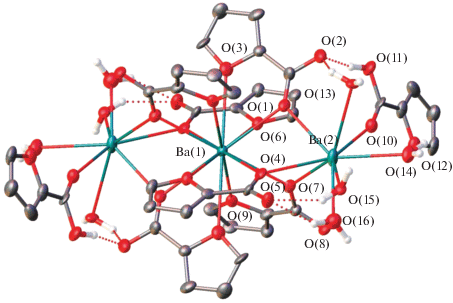
В трехъядерных фрагментах {Ba3(fur)6(Hfur)2(H2O)8} исследуемого 1D-координационного полимера ионы бария лежат на одной прямой (угол Ba(2)…Ba(1)…Ba(2) равен 180.0°) и связаны друг с другом тремя атомами кислорода трех мостиковых карбоксилатных групп (Ba–O 2.760(13)–2.836(13) Å) (табл. 1). Между собой фрагменты {Ba3(fur)6(Hfur)2(H2O)8} связаны двумя мостиковыми молекулами воды (Ba(2)–O 2.797(14)–2.908(15) Å) с углом Ba(2)O(14)Ba(2) 99.5(4)°–100.1(4)° (рис. 2).
Таблица 1.
Основные длины связей (d) и валентные углы (ω) в структуре I
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Ва(1) | |||
| Ва(1)–О(1) | 2.836(13) | Ва(1)–О(6) | 2.943(13) |
| Ва(1)–О(3) | 3.004(15) | Ва(1)–О(7) | 2.813(13) |
| Ва(1)–О(4) | 2.806(13) | Ва(1)–О(9) | 2.902(14) |
| Ва(2) | |||
| Ва(2)–О(1) | 2.760(13) | Ва(2)–О(13) | 2.97(3), 2.70(4) |
| Ва(2)–О(4) | 2.786(13) | Ва(2)–О(14) | 2.908(15), 2.797(14) |
| Ва(2)–О(7) | 2.805(13) | Ва(2)–О(15) | 2.78(3), 2.90(2) |
| Ва(2)–О(10) | 2.845(14) | Ва(2)–О(16) | 2.68(3), 3.08(3) |
Рис. 2.
Фрагмент кристаллической упаковки I, иллюстрирующий образование 1D-координационного полимера.
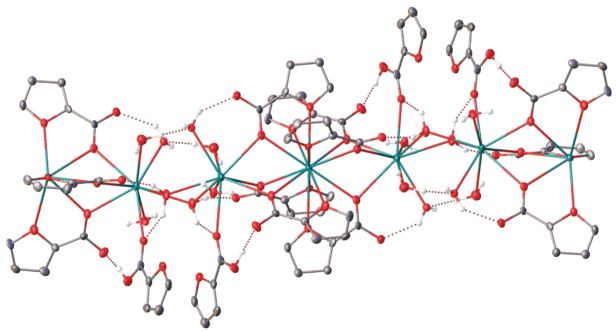
Один из двух симметрически независимых ионов бария – Ba(1) – находится в координационном окружении двенадцати атомов кислорода (КЧ = 12): шести атомов кислорода карбоксилатных групп (Ba(1)–O 2.760(13)–2.836(13) Å) и шести атомов кислорода фурановых колец (Ba(1)–O 2.902(14)–3.004(15) Å), расположенных в вершинах практически идеального икосаэдра. Координационное окружение второго симметрически независимого иона бария – Ba(2) – имеет форму, близкую к трехшапочной тригональной призме (КЧ = 9). Она образована тремя мостиковыми атомами кислорода трех карбоксилатных групп (Ba(2)–O 2.760(13)–2.805(13) Å), атомом кислорода молекулы фуранкарбоновой кислоты (Ba(2)–O(10) 2.845(14) Å), в которой гидроксильная группа образует водородную связь с атомом кислорода одного из таких анионов (O(11)…O(2) 2.61(2) Å, O(11)H(11)O(2) 169.2(11)°, табл. 2), и пятью молекулами воды (Ba(2)–O 2.68(3)–3.08(3) Å), две из которых выполняют роль мостиковых лигандов между соседними фрагментами (рис. 2, табл. 1). Они же участвуют в образовании водородных связей (табл. 2) с двумя атомами кислорода молекулы фуранкарбоновой кислоты и одним атомом кислорода мостикового аниона фуранкарбоновой кислоты (O…O 2.63(4)–3.54(2) Å, OHO 134.5(10)°–159.4(17)°). Остальные молекулы воды, координированные к иону бария Ba(2), образуют водородные связи друг с другом (O(15)…O(16') 2.47(4) Å, OHO 160(2)°) и с карбоксильными группами мостиковых анионов фуранкарбоновой кислоты (O…O 2.68(3)–3.37(6) Å, OHO 118(3)°–168(2)°). Четыре сольватные молекулы воды, приходящиеся на один фрагмент {Ba3(fur)6(Hfur)2(H2O)8}, соединяют между собой соседние 1D-координационные цепочки посредством аналогичных водородных связей (O…O 2.72(3)–3.25(4) Å, OHO 138(3)°–172.5(15)°), приводя к формированию в кристалле I водородно-связанного трехмерного каркаса (табл. 2).
Таблица 2.
Геометрические параметры водородных связей в структуре I
| Контакт D–H⋅⋅⋅A | d, Å | Угол DHA, град | Преобразование симметрии | ||
|---|---|---|---|---|---|
| D–H | H⋅⋅⋅A | D⋅⋅⋅A | |||
| O(11)–H(11)…O(2) | 0.941 | 1.683 | 2.613 | 169.19 | |
| O(14)–H(14A)…O(10) | 0.984 | 2.043 | 2.821 | 134.45 | –x, y, –z + 1/2 |
| O(14)–H(14A)…O(12) | 0.984 | 2.625 | 3.543 | 155.23 | –x, y, –z + 1/2 |
| O(14)–H(14B)…O(8') | 0.920 | 1.924 | 2.694 | 139.91 | –x, y, –z + 1/2 |
| O(14)–H(14B)…O(8) | 0.920 | 1.783 | 2.665 | 159.51 | –x, y, –z + 1/2 |
| O(15)–H(15A)…O(5) | 0.842 | 1.997 | 2.680 | 137.71 | |
| O(15)–H(15B)…O(17) | 0.994 | 1.842 | 2.758 | 151.82 | –x, y, –z + 1/2 |
| O(16')–H(16A)…O(15) | 0.932 | 1.568 | 2.465 | 160.35 | –x, y, –z + 1/2 |
| O(16')–H(16B)…O(8') | 0.843 | 2.534 | 3.363 | 168.17 | |
| O(13')–H(13A)…O(2) | 1.042 | 2.120 | 2.988 | 139.34 | |
| O(13)–H(13A)…O(2) | 0.874 | 2.120 | 2.644 | 117.88 | |
| O(13')–H(13B)…O(18) | 0.918 | 2.078 | 2.910 | 150.06 | –x, y, –z + 1/2 |
| O(13)–H(13B)…O(18) | 0.783 | 2.078 | 2.711 | 138.02 | –x, y, –z + 1/2 |
| O(15')–H(15C)…O(17') | 0.849 | 2.479 | 3.251 | 151.66 | –x, y, –z + 1/2 |
| O(15')–H(15D)…O(5) | 0.893 | 1.866 | 2.706 | 155.97 | |
| O(16)–H(16C)…O(5) | 0.921 | 2.064 | 2.881 | 147.04 | |
| O(17)–H(17A)…O(8) | 0.900 | 2.194 | 3.040 | 156.24 | |
| O(17)–H(17B)…O(2) | 0.950 | 1.941 | 2.715 | 137.18 | x–1/2, y + 1/2, z |
| O(17)–H(17B)…O(2) | 0.905 | 1.941 | 2.734 | 145.28 | x–1/2, y + 1/2, z |
| O(18)–H(18A)…O(8') | 0.998 | 2.029 | 2.892 | 143.45 | |
| O(18)–H(18A)…O(8) | 0.998 | 2.092 | 2.811 | 127.30 | |
| O(18)–H(18B)…O(17) | 0.829 | 1.923 | 2.747 | 172.55 | |
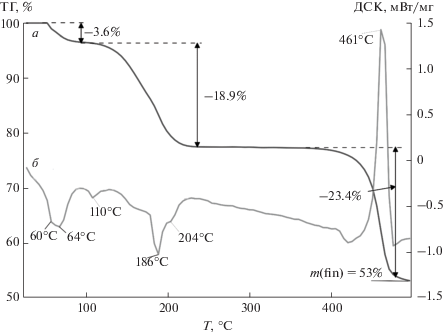
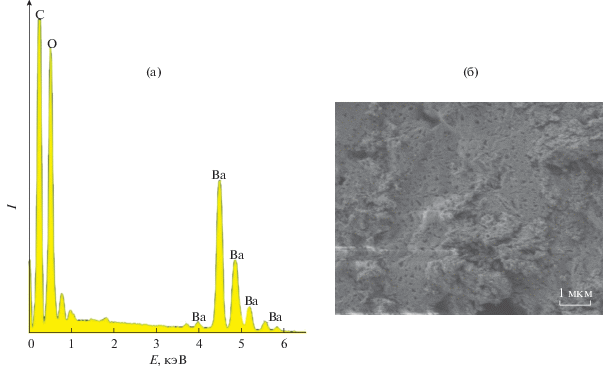
Термическое поведение I было исследовано методом СТА в атмосфере аргона с одновременной регистрацией кривых ТГ и ДСК до 500°С (рис. 3). Количественную характеристику термолиза рассмотрим на примере [Ba1.5(fur)3(Hfur)(H2O)4] · · 2H2O, представляющего симметрически независимую часть элементарной ячейки. Процесс термолиза складывается из трех основных стадий. Первая связана с десорбцией двух сольватных и одной координированной молекулы воды (mтеор/эксп = 3.6%). На кривой ДСК (рис. 3, кривая б) присутствует составной эндотермический пик с близкими экстремумами при 60 и 64°С. Небольшой эндотермический эффект при 110°С соответствует плавлению десольватированного комплекса (табл. 3). Следующий этап характеризуется десорбцией двух координированных Hfur и четырех молекул воды (mтеор/эксп = 18.6/18.9%) (рис. 3, кривая а). При этом на кривой ДСК (рис. 3, б) этому процессу соответствует сложный эндотермический эффект с экстремумами при 186 и 204°С (выделение H2O и Hfur соответственно; Ткип(Hfur) = 230°C). Интегральные интенсивности данного эффекта количественно соотносятся с десорбирующимися молекулами. Заключительный этап является более продолжительным, чем два предшествующих (215–496°С). На кривой ДСК (рис. 3, кривая б) присутствует мощный экзотермический эффект поверхностного окисления с экстремумом при 461°С, характерный для О-насыщенных комплексов бария [20]. Всего к 500°С десорбируется лишь 47% от первоначальной массы соединения, поэтому масса остатка после термолиза свидетельствует о сильно зауглероженном продукте. Для определения состава финального вещества I был проведен EDX-анализ и проанализирована микроморфология (рис. 4). Результаты эксперимента показывают наличие в продукте термолиза Ba (13.58%), O (11.75%) и С (74.67%).
Таблица 3.
Данные СТА для комплекса I (атмосфера аргона)
| Комплекс | Этап/ΔT, °С | Δm (TГ), % | Tэндо/экзо, °С | mфин, % |
|---|---|---|---|---|
| I | 1/52–82 | 3.6 | 60 ± 0.7; 68 ± 0.7 | |
| 2/82–215 | 110 ± 0.7 | |||
| 18.9 | (плавление) | |||
| 3/215–496 | 23.4 | 186 ± 0.7 | 53.1 | |
| 461 ± 0.7 |
Рис. 4.
Энергодисперсионный спектр (а) и фотография микроморфологии остатка I (б), увеличение ×30000.
Антибактериальная активность I была определена в отношении непатогенного штамма M. smegmatis. Полученные результаты биоактивности in vitro соотносились с активностью для изониазида (INH) и рифампицина (Rif) в данных условиях эксперимента. Противомикробная активность индивидуальной Hfur в отношении M. smegmatis незначительна (табл. 4). Известно, что устойчивость микобактерий к химиотерапевтическим агентам связана с низкой проницаемостью микобактериальной клеточной стенки, с ее необычной структурой. M. smegmatis – быстрорастущие непатогенные бактерии и поэтому используются в качестве модельного организма для медленно растущих бактерий M. tuberculosis, а также для первичного скрининга противотуберкулезных препаратов [21]. Результаты антибактериальной активности в тестовой системе M. smegmatis mc2 155 и ее изменение с течением времени для I приведены в табл. 4. Ранее [22–25] была исследована биологическая активность in vitro для соединений с d-металлами-комплексообразователями Fe3+, Cu2+, Zn2+, Co2+ и анионами Hfur, а также дополнительными N-донорными лигандами (табл. 4). Результаты экспериментов показывают, что наибольшую биоактивность проявляют комплексы на основе Cu2+, Zn2+ и Fe3+. Прослеживается характерная тенденция зависимости эффективности воздействия на культуру от дополнительных лигандов, входящих в состав комплексов. Очевидно, что 2,2'-бипиридин (bpy), 4-фенилпиридин (phpy) и в наибольшей степени 1,10'-фенантролин (phen) способны значительно повышать биологическую активность. Для соединения I, у которого в качестве комплексообразователя выступает s-элемент и отсутствуют cолиганды, биологической активности не наблюдается. Таким образом, клеточная стенка M. smegmatis является индифферентной по отношению к исследуемому веществу I.
Таблица 4.
Результаты антибактериальной активности in vitro в отношении Mycolicibacterium smegmatis
| Соединение | MИК, мкг/диск | Зона ингибирования, мм | Литература | |
|---|---|---|---|---|
| 24 ч | 24 ч | 120 ч | ||
| I | >1000 | 0 | 0 | Наст. работа |
| [Fe3O(fur)6(THF)3] · 3THF | 13 | 7** | 0 | [22] |
| ([Co3O(fur)6(H2O)3] | 120 | 6.5 ± 0.3** | 6.5 ± 0.3** | [22] |
| [Co6(piv)8(Hpiv)4(fur)2(OH)2] | 143 | 6.5 ± 0.3** | 0 | [22] |
| [Cu(fur)2(phen)] | 2 | 7 ± 0.5** | 7 ± 0.5** | [23] |
| [Zn2(fur)4phpy2] | 41 | 6.5 ± 0.5** | 6.5 ± 0.5** | [23] |
| [Zn(fur)2(bpy)] | 44 | 6.5 ± 0.5** | 6.5 ± 0.5** | [24] |
| [Cu(fur)2(bpy)(H2O)] | 46 | 7 ± 0.5 | 7 ± 0.5* | [24] |
| [Co3(fur)6(phen)2] | 60 | 7 ± 0.5 | 7 ± 0.5* | [22] |
| [Cu2(fur)4(py)2] | 146 | 7 ± 0.5 | 7 ± 0.5* | [23] |
| [Cu(fur)2(py)2(H2O)] | 153 | 7 ± 0.5 | 7 ± 0.5* | [23] |
| [Cu(fur)2(phpy)2(H2O)] ⋅ phpy | 224 | 7.0 ± 0.5 | 7.0 ± 0.5* | [25] |
| [Zn2(fur)4py2] | 366 | 6.5 ± 0.3** | 6.5 ± 0.3** | [23] |
| INH | 100 | 7** | 6.5** | |
| Rif | 10 | 6.5 | 6.5* | |
Список литературы
Dimé K.D.A., Cattey H., Lucas D., Devillers Ch.H. // Eur. J. Inorg. Chem. 2018. V. 2018. P. 4834. https://doi.org/10.1002/ejic.201801142
Bhattacharjee J., Harinath A., Sarkar A., Panda T.K. // ChemCatChem. 2019. V. 11. P. 3366. https://doi.org/10.1002/cctc.201900920
Nandi S., Luna Ph., Maity R. et al. // Mater. Horiz. 2019. V. 6. P. 1883. https://doi.org/10.1039/C9MH00133F
Paluchowska B., Maurin J.K., Leciejewicz J. // J. Chem. Crystall. 1997. V. 27. P. 177. https://doi.org/10.1007/BF02575986
Yang J., Yin Xin, Wu Le et al. // Inorg. Chem. 2019. V. 57. P. 150105. https://doi.org/10.1021/acs.inorgchem.5b00113
Wan Ke-Ke, Yu Jie-Hui, Yang Qing-Feng et al. // Eur. J. Inorg. Chem. 2019. P. 3094. https://doi.org/10.1002/ejic.201900558
Roueindeji H., Ratsifitahina A., Roisnel T. // Chem. Eur. J. 2019. V. 25. P. 8854. https://doi.org/10.1002/chem.201901262
Maity T., Saha D., Das S., Koner S. // Eur. J. Inorg. Chem. 2012. V. 30. P. 4914. https://doi.org/10.1002/ejic.201200417
Xu X., Hu F., Shuai Q. // New J. Chem. 2017. V. 41. P. 13 319. https://doi.org/10.1039/C7NJ03046K
Su W., Shi Y., Hao X. et al. // Inorg. Chim. Acta. 2019. V. 490. P. 29. https://doi.org/10.1016/j.ica.2019.02.037
Liu F., Xu Y., Zhao L. et al. // J. Mater. Chem. A. 2015. V. 3. P. 21545. https://doi.org/10.1039/C5TA03680A
Kreno L.E., Leong K., Farha O.K. et al. // Chem. Rev. 2012. V. 112. P. 1105. https://doi.org/10.1021/cr200324t
Wang J.H., Li M., Li D. // Chem. Sci. 2013. V. 4. P. 1793. https://doi.org/10.1039/C3SC00016H
Xiao J., Wu Y., Li M. et al. // Chem. Eur. J. 2013 V. 19. P. 1891. https://doi.org/10.1002/chem.201203515
Муравьева Д.А., Самылина И.А., Яковлева Г.П. Фармакогнозия. М.: Медицина, 2007. 654 с.
Bartolome E., Bartolome J., Melnic S. et al. // Dalton Trans. 2014. V. 43. P. 10999. https://doi.org/10.1039/C4DT00538D
Bhargao P.H., Srinivasan B.R. // J. Coord. Chem. 2019. V. 72. P. 2599. https://doi.org/10.1080/00958972.2019.1666980
Sheldrick G.M. // Acta Crystallogr., Sect. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Chabira S.F., Sebaa M. // Rev. Sci. Technol. Synthese. 2012. V. 24. P. 44.
Bekker O.B., Sokolov D.N., Luzina O.A. et al. // Med. Chem. Res. 2015. V. 24. P. 2926. https://doi.org/10.1007/s00044-015-1348-2
Lutsenko I.A., Yambulatov D.S., Kiskin M.A. et al. // Chem. Select. 2020. V. 5. P. 11837. https://doi.org/10.1002/slct.202003101
Луценко И.А., Баравиков Д.Е., Кискин М.А. и др. // Коорд. химия. 2020. Т. 46. № 6. С. 366. https://doi.org/10.31857/S0132344X20060055
Луценко И.А., Ямбулатов Д.С., Кискин М.А. и др. // Коорд. химия. 2020. Т. 46. № 12. С. 715.
Луценко И.А., Кискин М.А., Кошенскова К.А. и др. // Изв. АН. Сер. хим. 2021. Т. 70. № 3. С. 463. https://doi.org/10.1007/s11172-021-3109-3
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы 1
- скачать 1.cif
- Дополнительные материалы 2
Инструменты
Журнал неорганической химии