Журнал неорганической химии, 2021, T. 66, № 9, стр. 1287-1296
Особенности фиксации аммиака ионами меди(II), никеля(II) и кобальта(II) в пивалатах
С. Е. Нефедов a, *, И. Л. Еременко a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: snef@igic.ras.ru
Поступила в редакцию 07.04.2021
После доработки 23.04.2021
Принята к публикации 27.04.2021
Аннотация
Установлено, что реакция аддукта Cu2(OOCBut)4(thf)2 и полиядерных пивалатов никеля(II) (получен из NiCl2, HOOCBut и KOH) и кобальта(II) (получен термолизом ацетата Со(II) c избытком пивалиновой кислоты при 160°С) в ТГФ со значительным избытком раствора аммиака в воде при комнатной температуре приводит к образованию моноядерного молекулярного комплекса Cu(OOCBut)2(NH3)2, ионного комплекса [Ni(NH3)6](OOCBut)2 и необычного смешановалентного трехъядерного комплекса {CoII(OOCBut)2(NH3)2[(µ-OH)CoIII(NH3)5]2}(OOCBut)4(H2O)2. Полученные соединения исследованы методами химического и рентгеноструктурного анализа, а также ИК-спектроскопии.
ВВЕДЕНИЕ
Основные положения координационной теории, которые легли в базовые принципы современной координационной химии, были сформулированы Альфредом Вернером при изучении химии комплексных соединений, в том числе комплексов кобальта с аммиаком [1]. Недавно, используя сохранившиеся в музее образцы комплексов, полученных А. Вернером, проф. Х. Берке (директор Института неорганической химии Цюрихского университета (UZH) с 1991 по 2012 гг., созданного на основе лаборатории А. Вернера) с соавторами установили их строение методом современного рентгеноструктурного анализа, подтвердив предположения, высказанные А. Вернером более века назад [2].
Известно, что аммиак, помимо его широкого использования в промышленности (при производстве азотных удобрений, энергоемких веществ и полимеров, азотной кислоты, соды, а также в качестве хладоагента и др.), играет важнейшую роль в качестве источника азота для живых организмов, в том числе являясь конечным продуктом многих природных химических процессов, катализируемых активной частью металлоферментов, в частности, превращений атмосферного азота, мочевины и др. [3–7].
В отличие от триэтиламина, имеющего три донорных органических заместителя, двухэлектронодонорный NH3 является менее сильным и стерически нагруженным основанием Льюиса.
Ранее было показано, что в реакциях пивалатов 3d-металлов с Et3N независимо от состава, строения и способа синтеза исходных соединений формируются биядерные тетрамостиковые “комплексы-фонарики” M2(µ-OOCBut)4(NEt3)2 (M = Zn [8], Cu [9], Ni [10], Co [11], Fe [12]), в которых триэтиламин располагается в аксиальной позиции, причем в молекулах отсутствуют такие лиганды, как вода, гидроксо- и оксомостики, а также координированная пивалиновая кислота, что делает их удобными объектами для изучения реакций депротонирования различных органических молекул в присутствии координированного амина как акцептора протонов. В таких димерах расстояние металл–металл существенным образом определяется природой 3d-металла.
В настоящей работе представлены результаты исследования реакций биядерного пивалата меди(II), а также полиядерных пивалатов никеля(II) и кобальта(II) с раствором аммиака в одинаковых условиях (ТГФ–H2O, 22°С) и при близких концентрациях исходных соединений. В работе также рассмотрены данные рентгеноструктурного исследования монокристаллов конечных продуктов реакций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные пивалаты меди(II), никеля(II) и кобальта(II) получали согласно методикам, приведенным в работах [13–15].
ИК-спектры кристаллических образцов регистрировали в интервале 4000–550 см–1 методом НПВО на ИК-фурье-спектрометре Nexus фирмы NICOLET с использованием приставки MIRacle фирмы PIKETechnologies с алмазным кристаллом.
Рентгеноструктурные исследования кристаллов 1–3 проводили по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (λMo, графитовый монохроматор, ω-сканирование).
Уточнение структур выполнено с использованием комплекса программ SHELXTL PLUS (PC-версия) [16–19].
В комплексе 2 неупорядоченные атомы О(4) и N(2) уточнены с кратностью 0.5.
Кристаллографические данные и детали уточнения приведены в табл. 1, основные геометрические параметры изученных комплексов – в табл. 2–4. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (CCDC 2074956-2074958).
Таблица 1.
Кристаллографические параметры и детали уточнения структур комплексов 1–3
| Параметр | 1 | 2 | 3 |
|---|---|---|---|
| CCDC | 2 074 956 | 2 074 958 | 2 074 957 |
| Брутто-формула | C10H24CuN2O4 | C10H33N6NiO4 | C30H96Co3N12O16 |
| М. м. | 299.85 | 360.13 | 1057.98 |
| Цвет | Синий | Фиолетовый | Красно-фиолетовый |
| T, K | 100(2) | 100(2) | 150(2) |
| Сингония | Моноклиная | Орторомбическая | Моноклинная |
| Пр. гр. | P2(1)/c | Рnma | P2(1)/c |
| a, Å | 12.2017(15) | 23.1740(7) | 13.6231(9) |
| b, Å | 5.8149(7) | 25.8022(8) | 16.4040(11) |
| c, Å | 10.2582(12) | 6.1262(2) | 11.8385(8) |
| α, град | 90 | 90 | 90 |
| β, град | 105.361(5) | 90 | 100.840(2) |
| γ, град | 90 | 90 | 90 |
| V, Å3 | 701.83(15) | 3663.1 | 2598.4(3) |
| Z | 2 | 8 | 2 |
| dрасч, мг/м3 | 1.419 | 1.306 | 1.352 |
| µ, мм–1 | 1.561 | 1.082 | 1.015 |
| F(000) | 318 | 1560 | 1138 |
| Размеры кристалла, мм | 0.24 × 0.22 × 0.20 | 0.24 × 0.22 × 0.20 | 0.22 × 0.20 × 0.18 |
| θ-область сканирования, град | 3.46–30.00 | 1.76–27.99 | 1.96–25.95 |
| Интервалы индексов отражений | –17 ≤ h ≤ 17, –8 ≤ k ≤ 8, –14 ≤ l ≤ 13 |
–28 ≤ h ≤ 30, –34 ≤ k ≤ 34, –8 ≤ l ≤ 8 |
–16 ≤ h ≤ 15, –19 ≤ k ≤ 19, –14 ≤ l ≤ 13 |
| Число отражений | 7561 | 38 923 | 18 938 |
| Число независимых отражений | 2038 [R(int) = 0.0715] | 4493 [R(int) = 0.0666] | 4586 [R(int) = 0.0481] |
| GOOF | 1.035 | 1.076 | 1.074 |
| R[I > 2σ(I)] | R1 = 0.0429, wR2 = 0.0968 | R1 = 0.0700, wR2 = 0.1795 | R1 = 0.0687, wR2 = 0.1744 |
| R (по всем рефлексам) | R1 = 0.0659, wR2 = 0.1041 | R1 = 0.0812, wR2 = 0.1866 | R1 = 0.0923, wR2 = 0.1860 |
| max/min пики электронной плотности, e Å–3 | 1.346 и–0.558 | 1.451 и –0.844 | 1.152 и –2.026 |
Таблица 2.
Основные длины связей и валентные углы в комплексе 1
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Cu(1)–O(1) | 1.9693(17) | Cu(1)–O(1)#1 | 1.9693(17) |
| Cu(1)–N(1)#1 | 1.981(2) | Cu(1)–N(1) | 1.981(2) |
| Угол | ω, град | Угол | ω, град |
| O(1)Cu(1)O(1)#1 | 180.0 | O(1)Cu(1)N(1)#1 | 90.55(9) |
| O(1)#1Cu(1)N(1)#1 | 89.45(9) | O(1)Cu(1)N(1) | 89.45(9) |
| O(1)#1Cu(1)N(1) | 90.55(9) | N(1)#1Cu(1)N(1) | 180.00(12) |
| C(1)O(1)Cu(1) | 107.42(14) |
Таблица 3.
Основные длины связей и валентные углы в комплексе 2
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Ni(1)–N(4) | 2.057(4) | Ni(1)–N(2)#1 | 2.066(4) |
| Ni(1)–N(2) | 2.066(4) | Ni(1)–N(1) | 2.077(6) |
| Ni(1)–N(1)#1 | 2.077(6) | Ni(1)–N(3) | 2.078(5) |
| Ni(1)–N(1A)#1 | 2.100(6) | Ni(1)–N(1A) | 2.100(6) |
| Ni(2)–N(8) | 2.083(4) | Ni(2)–N(7) | 2.084(4) |
| Ni(2)–N(6)#1 | 2.089(4) | Ni(2)–N(6) | 2.089(4) |
| Ni(2)–N(9) | 2.096(5) | Ni(2)–N(5) | 2.126(6) |
| Угол | ω, град | Угол | ω, град |
| N(4)Ni(1)N(2)#1 | 87.55(15) | N(4)Ni(1)N(2) | 87.55(15) |
| N(2)#1Ni(1)N(2) | 92.4(4) | N(4)Ni(1)N(1) | 90.26(18) |
| N(2)#1Ni(1)N(1) | 78.9(3) | N(2)Ni(1)N(1) | 171.1(3) |
| N(4)Ni(1)N(1)#1 | 90.26(18) | N(2)#1Ni(1)N(1)#1 | 171.1(3) |
| N(2)Ni(1)N(1)#1 | 78.9(3) | N(1)Ni(1)N(1)#1 | 109.7(4) |
| N(4)Ni(1)N(3) | 179.49(17) | N(2)#1Ni(1)N(3) | 92.09(16) |
| N(2)Ni(1)N(3) | 92.09(16) | N(1)Ni(1)N(3) | 90.03(18) |
| N(1)#1Ni(1)N(3) | 90.03(18) | N(4)Ni(1)N(1A)#1 | 88.59(19) |
| N(2)#1Ni(1)N(1A)#1 | 168.1(3) | N(2)Ni(1)N(1A)#1 | 98.7(3) |
| N(1)Ni(1)N(1A)#1 | 89.8(3) | N(1)#1Ni(1)N(1A)#1 | 20.0(2) |
| N(3)Ni(1)N(1A)#1 | 91.8(2) | N(4)Ni(1)N(1A) | 88.59(19) |
Таблица 4.
Основные длины связей и валентные углы в комплексе 3
| Связь | d, Å | Связь | d, Å |
| Co(1)–O(1)#1 | 1.979(4) | Co(1)–O(1) | 1.979(4) |
| Co(1)–O(2) | 2.140(4) | Co(1)–O(2)#1 | 2.140(4) |
| Co(1)–N(6) | 2.252(5) | Co(1)–N(6)#1 | 2.252(5) |
| Co(2)–O(1) | 1.904(4) | Co(2)–N(4) | 1.950(4) |
| Co(2)–N(2) | 1.954(4) | Co(2)–N(1) | 1.959(4) |
| Co(2)–N(5) | 1.964(4) | Co(2)–N(3) | 1.970(4) |
| Угол | ω, град | Угол | ω, град |
| (1)#1Co(1)O(1) | 179.998(1) | O(1)#1Co(1)O(2) | 88.06(16) |
| O(1)Co(1)O(2) | 91.94(16) | O(1)#1Co(1)O(2)#1 | 91.94(16) |
| O(1)Co(1)O(2)#1 | 88.07(16) | O(2)Co(1)O(2)#1 | 179.999(2) |
| O(1)#1Co(1)N(6) | 91.07(15) | O(1)Co(1)N(6) | 88.93(15) |
| O(2)Co(1)N(6) | 90.24(16) | O(2)#1Co(1)N(6) | 89.76(16) |
| O(1)#1Co(1)N(6)#1 | 88.93(15) | O(1)Co(1)N(6)#1 | 91.08(15) |
| O(2)Co(1)N(6)#1 | 89.76(16) | O(2)#1Co(1)N(6)#1 | 90.24(16) |
| N(6)Co(1)N(6)#1 | 179.998(1) | O(1)Co(2)N(4) | 88.39(18) |
| O(1)Co(2)N(2) | 90.18(18) | N(4)Co(2)N(2) | 87.71(19) |
| O(1)Co(2)N(1) | 89.15(18) | N(4)Co(2)N(1) | 93.07(19) |
| N(2)Co(2)N(1) | 178.95(19) | O(1)Co(2)N(5) | 179.43(19) |
| N(4)Co(2)N(5) | 91.77(19) | N(2)Co(2)N(5) | 89.28(19) |
| N(1)Co(2)N(5) | 91.38(19) | O(1)Co(2)N(3) | 90.46(18) |
| N(4)Co(2)N(3) | 178.63(19) | N(2)Co(2)N(3) | 93.04(19) |
| N(1)Co(2)N(3) | 86.16(19) | N(5)Co(2)N(3) | 89.38(19) |
| Co(2)O(1)Co(1) | 146.3(2) | C(1)O(2)Co(1) | 128.8(3) |
Синтез комплексов
Синтез Cu(OOCBut)2(NH3)2 (1). К раствору 2 г (2.9 ммоль) Cu2(OOCBut)4(thf)2 в 15 мл ТГФ в течение 0.5 ч по каплям добавляли 5 мл 10%-ного раствора аммиака в воде (0.5 г, 29.4 ммоль) с 5 мл ТГФ. Полученный сине-фиолетовый раствор перемешивали 1 ч, концентрировали до объема ~10 мл, добавляли 3 мл гексана и выдерживали в холодильнике при температуре 5°С в течение суток. Образовавшиеся при этом синие монокристаллы использовали для РСА, выделяя непосредственно перед структурным экспериментом из маточного раствора. Комплекс 1 отделяли от маточного раствора декантацией, промывали последовательно холодным бензолом (5 мл), гексаном (2 × 5 мл) и сушили в токе аргона. Соединение медленно разлагается на воздухе. Выход 1.07 г (62%).
ИК-спектр (ν, см–1): 3385 ср., 3310 с., 3227 с., 3141 ср., 2955 ср., 2904 сл., 2293 сл., 1979 сл., 1652 сл., 1614 ср., 1556 с., 1591 ср., 1538 с., 1480 ср., 1456 ср., 1370 ср., 1352 с., 1252 ср., 1219 с., 1094 сл., 1033 сл., 892 ср., 794 с., 724 сл., 674 ср., 615 с., 548 сл., 464 сл.
Синтез [Ni(NH3)6](OOCBut)2 (2). К зеленому раствору полиядерного пивалата никеля(II) (получен из 2 г (8.4 ммоль) NiCl2 · 6H2O, 1.72 г (16.8 ммоль) HOOCBut, 0.94 г (1.68 ммоль) KOH в воде) в 15 мл ТГФ при перемешивании добавляли в течение 0.5 ч по каплям 5 мл 10%-ного раствора аммиака (0.5 г, 29.4 ммоль) в воде с 5 мл ТГФ. Полученный красно-фиолетовый раствор концентрировали до объема ~10 мл, добавляли 3 мл гексана и выдерживали в холодильнике при температуре 5°С в течение суток. Образовавшиеся при этом фиолетовые монокристаллы использовали для РСА, выделяя непосредственно перед структурным экспериментом из маточного раствора. Комплекс 2 отделяли от маточного раствора декантацией, промывали последовательно холодным бензолом (5 мл), гексаном (2 × 5 мл) и сушили в токе аргона. Соединение медленно разлагается на воздухе. Выход 2 г (66%).
ИК-спектр (ν, см–1): 3130 с., 3109 с., 3037 ср., 2941 сл., 2873 с., 2728 сл., 2607 сл., 2006 cл., 1664 сл., 1588ср., 1549 ср., 1480 ср., 1411 ср., 1368 сл., 1320 с., 1260 сл., 1090 с., 1033 с., 780 с., 742 с., 615 сл., 589 сл., 485 сл.
Синтез {CoII(OOCBut)2(NH3)2[(µ-OH)CoIII(NH3)5]2}4 (OOCBut)4(H2O) (3). К фиолетовому раствору пивалата кобальта(II) (получен при сплавлении 2 г (9.4 ммоль) водного ацетата кобальта и избытка пивалиновой кислоты (4 г, 39.1 мм) при 160°С в течение 3 ч) в 15 мл ТГФ при перемешивании добавляли в течение 0.5 ч по каплям 5 мл 10%-ного раствора аммиака (0.5 г, 29.4 ммоль) в воде с 5 мл ТГФ. Полученный красно-фиолетовый раствор концентрировали до объема ~10 мл, добавляли 3 мл гексана и выдерживали в холодильнике при температуре 5оС в течение суток. Образовавшиеся при этом красно-фиолетовые монокристаллы использовали для РСА, выделяя непосредственно перед структурным экспериментом из маточного раствора. Комплекс 3 отделяли от маточного раствора декантацией, промывали последовательно холодным бензолом (5 мл), гексаном (2 × 5 мл) и сушили в токе аргона. Соединение медленно разлагается на воздухе. Выход 1.56 г (47%).
| С | H | N | |
| Найдено, % (порошок): | 34.10; | 9.48; | 16.02. |
| Для C30H96Co3N12O16 | |||
| вычислено, %: | 34.06; | 9.15; | 15.89. |
ИК-спектр (ν, см–1): 3200 с., 3107 с., 3037 ср., 2989 сл., 2843 с., 2728 сл., 2606 сл., 2162 сл., 1999 сл., 1661 сл., 1594 ср., 1549 ср., 1483 ср., 1466 ср., 1369 сл., 1328 сл., 1306 с., 1267 сл., 1155 сл., 1028 с., 1009 с., 842 с., 777 с., 737 с., 661 сл., 538 сл.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
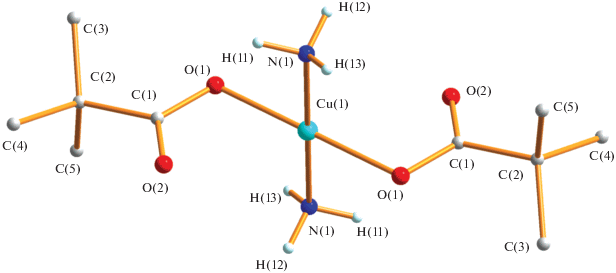
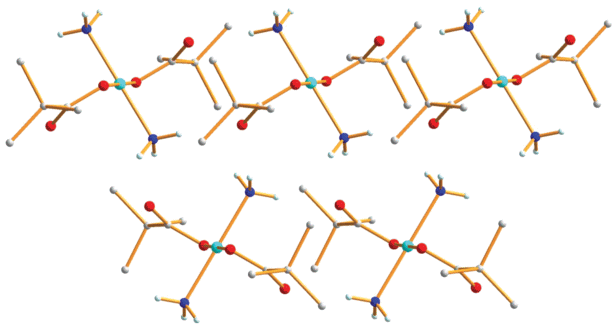
Обнаружено, что медленное добавление (по каплям) раствора аммиака в воде к биядерному аддукту пивалата меди(II) Cu2(OOCBut)4(thf)2 приводит к образованию синего моноядерного комплекса Cu(OOCBut)2(NH3)2 (1) с выходом 62%. По данным РСА соединения 1 (табл. 1, 2, рис. 1), в центросимметричной молекуле атом меди имеет типичное для Cu(II) плоскоквадратное окружение из двух атомов азота, координированных молекул NH3 (Cu(1)–N(1) 1.981(2) Å) и двух атомов кислорода пивалат-анионов (Сu(1)–O(1) 1.9693(17) Å). Оставшийся атом кислорода аниона располагается на расстоянии 2.666(2) Å от атома металла и связан водородными связями (O(2)…N 2.910–3.245 Å) с аммиаком соседних молекул, формируя в итоге цепочку слоев линейных полимеров, в которых атомы металлов находятся на одной линии и расстояния между ними равны 5.815 Å, а расстояние между атомами металлов соседних слоев составляет 5.896 Å (рис. 2).
Рис. 2.
Фрагмент упаковки молекул комплекса 1 в кристалле. Цвета атомов: медь – голубой, кислород – красный, азот – синий, углерод – серый.
Необходимо отметить, что как длины связей в комплексе, так и особенности упаковки молекул в кристалле весьма типичны для известных плоскоквадратных моноядерных комплексов би- и полидентатных карбоксилатов меди с аммиаком Cu(NH3)2An2 (An = OOCMe, Cu–N 1.977(1) Å, Cu–O 2.005(2) Å [20]; Аn = OOCMe, BF4, полимер, Cu–N 1.977(4), 1.980(4) Å, Cu–O 1.987(3), 1.991(3) Å [21]; Аn = OOC(CH2)7Et, Cu–N 1.95(2), 2.06(2) Å, Cu–O 1.985(7), 1.980(7) Å [22]; An = бидентатный, о-фталат, полимер, Cu–N 1.992(6), 1.997(8) Å, Cu–O 1.988(5), 1.971(5) Å [23]; An = бидентатный, 2,3,5,6-тетраметилбензол-1,4-дикарбоксилат, полимер, Cu–N 1.971(2), 1.959(2) Å, Cu–O 1.998(1), 1.992(1) Å [24]; An = 1,2,4,5-тетракарбоксилатбензол, полимер, Cu–N 1.976(2), 1.999(2) Å, Cu–O 1.996(2), 1.992(1) Å [25].
В итоге все комплексы независимо от дентатности и природы карбоксилат-анионов, содержащие, как и комплекс 1, плоскоквадратный координационный узел {Cu(NH3)2O2}, имеют близкую геометрию.
Кроме того, известны комплексы с плоским координационным узлом {Cu(NH3)4}An (An = = этоксиацетат, Cu–N 2.048(4), 2.021(3) Å [25]; An = 4-нитробензоат, Cu–N 2.013(3), 2.032(3) Å [26]), а также получен необычный биядерный димер-фонарик с четырьмя индолкарбоксилатными мостиками, в котором аммиак находится в аксиальной позиции (Cu–N 2.188(2) Å) [27].
Заметим, что большинство комплексов и полимеров было получено исходя из нитрата или водного ацетата меди в реакциях лигандного обмена с соответствующими карбоновыми кислотами и аммиачной водой в полярных растворителях [20–27].
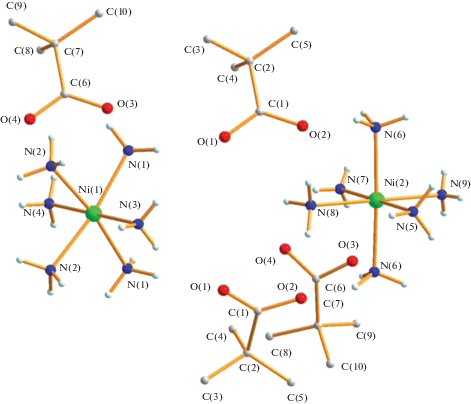
Аналогичная реакция полиядерного пивалата никеля(II), растворенного в ТГФ, с раствором аммиака в воде приводит к образованию ионного комплекса [Ni(NH3)6](OOCBut)2 (2) с выходом 66%. Хотя реакции карбоксилатов никеля с аммиаком не исследованы, реакция пивалата приводит к выходу анионов во внешнюю сферу, а атом металла оказывается связанным с шестью молекулами аммиака. В итоге, по данным РСА (табл. 1, 3, рис. 3), в двух независимых молекулах каждый атом металла находится в искаженном октаэдрическом окружении и длины связей Ni–${{{\text{N}}}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$ составляют 2.057(4)–2.126(6) Å, что типично для октаэдрических комплексов ${\text{Ni}}({\text{N}}{{{\text{H}}}_{{\text{3}}}})_{{\text{6}}}^{{{\text{2}} + }}{\text{2}}{{{\text{Х}}}^{--}}$ (Х = = [2,2'-bipy-6,6'-CSO3]2–, Ni–N 2.1057(14)–2.1483(16) Å [28]; X = [S(O)C=C(CN)]2–, Ni–N 2.11(2)–2.17(2) Å [29]; X = ${\text{C}}_{{{\text{6}}0}}^{{{\text{2}}--}},$ Ni–N 2.115(3)–2.154 Å (3) [30]; X = [1,1-динитроамино-5,5-битетразолат]2–, Ni–N 2.098(4)–2.154(4) Å [31]). Необходимо отметить, что типичным способом получения таких соединений является взаимодействие нитрата или ацетата никеля с солями анионов с щелочными металлами и их последующая реакция с нашатырным спиртом или непосредственно с NH3.
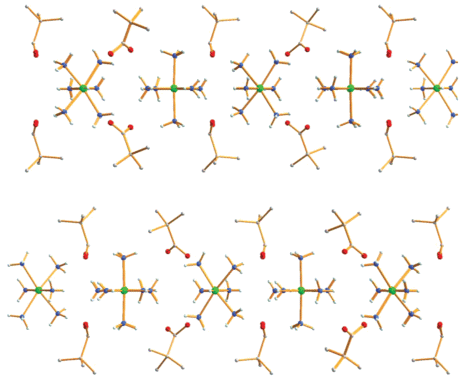
В кристаллической ячейке комплекса 2 молекулы располагаются слоями с расстояниями Ni…Ni 8.335 Å, а атомы кислорода карбоксилат-анионов образуют водородные связи с координированными молекулами NH3 (O…N 2.637–3.006 Å) (рис. 4).
Рис. 4.
Фрагмент упаковки молекул 2 в кристалле. Цвета атомов: никель – зеленый, кислород – красный, азот – синий, углерод – серый.
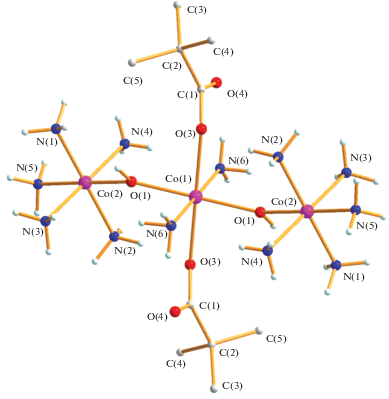
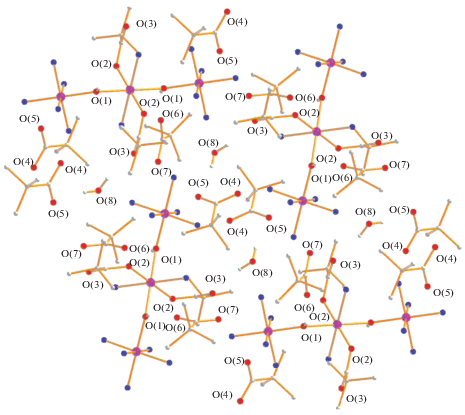
Наконец, реакция фиолетового раствора полиядерного пивалата кобальта(II) в ТГФ с водным раствором аммиака приводит к образованию трехъядерного красно-фиолетового смешановалентного комплекса{CoII(OOCBut)2(NH3)2[(µ-OH)CoIII(NH3)5]2}4(OOCBut)4(H2O) (3) с выходом 47%. Отметим, что ранее из раствора пивалата кобальта в ТГФ были выделены монокристаллы Co3(µ3-OH)(µ-OOCBut)4(OOCBut)(thf)4, который, возможно, и вступает в реакцию с NH3 [32]. В трехъядерном комплексе 3, по данным РСА (табл. 1, 3, рис. 5), центральный атом металла (позиция 0.5 1 0.5) со степенью окисления +2 связан с двумя анионами (Co(1)–O(2) 2.140(4) Å) двумя координированными молекулами аммиака и имеет искаженное октаэдрическое окружение, дополненное атомами кислорода мостиковых гидроксильных групп, соединяющих его с двумя периферийными фрагментами CoIII(NH3)5 (Co(1)…Co(2) 3.7162(8) Å). Заметим, что длины связей CoII–µ-OH–CoIII (Co(1)–O(1) 1.979(4) Å, Co(2)–O(1) 1.904(4) Å) заметно различаются, что подтверждает увеличение кислотности Льюиса для периферийных атомов кобальта(III). Аналогичная тенденция сохраняется и для координированных молекул аммиака (Co(2)–N 1.950(4)–1.970(4) Å), в отличие от длин связей Co(1)–N(6) 2.252(5) Å. В кристаллической ячейке комплекса присутствуют четыре карбоксилат-аниона (рис. 6) и сольватная молекула воды, атомы кислорода которых образуют водородные связи с координированными молекулами NH3: O(3)…O(8) 2.785 Å, O(3)…N(5) 3.054 Å, O(3)…N(6) 2.709 Å; O(4)…N(1) 2.824 Å, O(4)…N(4) 2.871 Å; O(5)…O(8) 2.718 Å, O(5)…N(2) 2.984 Å, O(5)…N(4) 2.943 Å; O(6)…O(1) 2.856 Å, O(6)…N(3) 3.035 Å, O(6)…N(6) 2.845 Å; O(7)…N(1) 2.869 Å, O(7)…N(3) 3.009 Å, O(7)…N(5) 2.892 Å.
Рис. 6.
Фрагмент упаковки комплекса 3 в кристалле. Цвета атомов: кобальт – фиолетовый, кислород – красный, азот – синий, углерод – серый.
В настоящее время получены лишь биядерные гидроксокомплексы [${\text{Co}}_{{\text{2}}}^{{{\text{III}}}}$(µ-OH)(µ-X)(µ-OOCR) (NH3)6]Q (R = Me, X = OH, Q = 3Br–, Co…Co 2.804(6) Å, Co–N 1.941(6)–1.947(6) Å [33]; R = Me, X = NH2, Q = ${\text{NH}}_{{\text{4}}}^{ + },$ ${\text{4HSO}}_{{\text{4}}}^{--}$, Co…Co 2.837(2) Å, Co–N 1.972(6)–1.985(6) Å [34]; R = Me, X = OH, Q = ${\text{3NO}}_{{\text{3}}}^{--}$, Co…Co 2.801(6) Å, Co–N 1.933(7)–1.952(7) Å [2]; R = Me, X = OOCMe, Q = ${\text{3NO}}_{{\text{3}}}^{--}$, Co…Co 3.286(4) Å, Co–N 1.935(5)–1.954(5) Å [2]; R = ${{{\text{C}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{H}}_{{\text{4}}}^{ + },$ X = OH, Q = $4{\text{ClO}}_{4}^{ - }$, Co…Co 2.794(8) Å, Co–N 1.915(7)–1.936(6) Å [35].
Были предприняты попытки получения комплексов, содержащих аммиак и связанный с металлом карбоксилат-анион: синтезированы соединения [CoIII(NH3)5(OOCMe)](Cl)(ClO4) (Co–N 1.975(7)–1.981(7) Å) [36] и [CoIII(NH3)4 (OOCMe)2](ClO4) (Co–N 1.928(8)–1.964(8) Å) [37]. Отметим, что в представленных комплексах кобальта(III) длины связей металл–азот вполне соответствуют длинам связей в периферийных фрагментах комплекса 3.
Другим возможным способом введения карбоксилатов в координационную сферу аммиакатов кобальта является реакция Co(NH3)6Cl3 с HOOCC6H4COOK и NaOOCPh, однако она приводит лишь к частичной замене анионов хлора и карбоксилаты остаются внешнесферными при сохранении фрагмента Co(NH3)6 [38].
ЗАКЛЮЧЕНИЕ
В ходе проведенных исследований показано, что исходные соединения с анионами слабой пивалиновой кислоты (сильное основание) в прямой реакции с раствором аммиака в воде (одинаковые условия, близкая концентрация реагентов) дают в зависимости от природы металла комплексы с координированными молекулами NH3, причем если для никеля(II) анионы оказываются во внешней сфере, то для меди(II) и кобальта(II, III) они входят в состав полученных молекул. При этом для кобальта образуется необычный смешановалентный трехъядерный карбоксилат, ранее неизвестный в координационной химии аммиака. Следует отметить, что в этом комплексе, как и в исходном, для одного из металлов сохраняется степень окисления +2, что подтверждается заметным различием в длинах связей MII–O(N) и MIII–O(N). В то же время, согласно данным ССDС, в большинстве комплексов кобальта, содержащих координированный аммиак, атомы металла находятся в степени окисления +3 [39].
Список литературы
Werner A. // Z. Anorg. Chem. 1893. B. 3. S. 267.
Blacque Ol., Berke H. // Chimi. 2014. V. 68. P. 299. https://doi.org/10.2533/chimia.2014.299
Appl M. // Ammonia. 1999. Weinheim: Wiley-VCH, 1999. P. 304. https://doi.org/10.1002/9783527613885
Гордон А., Форд Р. // Спутник химика / Пер. с англ. Розенберга Е.Л., Коппель С.И. М.: Мир, 1976. 544 с.
Умаров М.М., Кураков А.В., Степанов А.Л. // Микробиологическая трансформация азота в почве. М.: ГЕОС, 2007. ISBN 5-89118-315-7
Lippard S.J., Berg J.M. // Principles of Bioinorganic Chemistry. University Science Books, 1994. P. 199.
Kanady J.S., Tsui E.Y., Day M.W., Agapie T. // Science. 2011. V. 333. P. 733. https://doi.org/10.1126/science.1206036
Amel'chenkova E.V., Denisova T.O., Nefedov S.E. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1218. https://doi.org/10.1134/S0036023606080110
Mikuriya M., Azuma H., Nukada R., Handa M. // Chem. Lett. 1999. V. 28. P. 57. https://doi.org/10.1246/cl.1999.57
Eremenko I.L., Nefedov S.E., Sidorov A.A. et al. // Inorg. Chem. 1999. V. 38. P. 3764. https://doi.org/10.1021/ic981292w
Nefedov S.E., Denisova T.O., Dobrokhotova Zh.V. et al. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1587. https://doi.org/10.1134/S0036023606100135
Uvarova M.A., Nefedov S.E. // Russ. J. Coord. Chem. 2020. V. 46. P. 330. https://doi.org/10.1134/S1070328420050085
Denisova T.O., Amel’chenkova E.V., Pruss I.V. et al. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1020. https://doi.org/10.1134/S0036023606070084
Eremenko I.L., Golubnichaya M.A., Nefedov S.E. et al. // Russ. Chem. Bull. 1998. V. 47. P. 704. https://doi.org/10.1007/BF02495984
Golubichnaya M.A., Sidorov A.A., Fomina I.G. et al. // Russ. Chem. Bull. 1999. V. 59. P. 1773.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
SAINT. Area-Detector Integration Sofware. Madison (WI, USA). Bruker AXS Inc., 2012.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr., Sect. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Euler H., Kutzke H., Barbier B., Kirfel A. // Z. Kristallogr.-New Cryst. Struct. 2009. V. 224. P. 725. https://doi.org/10.1524/ncrs.2009.0320
Cronin L., Harper M., Walton P.H., Lindsay C. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 1998. V. 54. P. 1255. https://doi.org/10.1107/S0108270198004594
Petric M., Leban I., Segedin P. // Polyhedron. 1996. V. 15. P. 4277. https://doi.org/10.1016/0277-5387(96)00135-0
Cingi M.B., Guastini C., Musatti A., Nardelli M. // Acta Crystallogr., Sect. B: Struct. Crystallogr. Cryst. Chem. 1970. V. 26. P. 1836. https://doi.org/10.1107/S056774087000497
Xu X.B., Lan F.-F., Yang Sh.-Y. et al. // J. Chem. Crystallogr. 2010. V. 40. P. 551. https://doi.org/10.1007/s10870-010-9695-9
Karabach Y.Y., Kirillov A.M., Haukka M. et al. // Cryst. Growth Des. 2008. V. 8. P. 4100. https://doi.org/10.1021/cg8005597
Qu Y., Peng J.-J. // Acta Crystallogr., Sect. E: Struct. Rep. 2006. V. 62. P. m952. https://doi.org/10.1107/S1600536806011081
Morzyk-Ociepa B., Rozycka-Sokolowska E. // J. Mol. Struct. 2006. V. 784. P. 69. https://doi.org/10.1016/j.molstruc.2005.06.053
Oelkers B. // Eur. J. Inorg. Chem. 2014. P. 5838. https://doi.org/10.1002/ejic.201402736
Hummel H.-U., Beiler F. // Z. Anorg. Allg. Chem. 1988. V. 565. P. 147. https://doi.org/0.1002/zaac.19885650116
Himmel K., Jansen M. // Chem. Commun. 1998. P. 1205. https://doi.org/10.1039/a801862f
Szimhardt N., Bolter M.F., Born M. et al. // Dalton Trans. 2017. V. 46. P. 5033. https://doi.org/10.1039/C7DT00536A
Nefedov S.E., Denisova T.O. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1404. https://doi.org/10.1134/S0036023606090063
Mandel G.S., Marsh R.E., Schaefer W.P. et al. // Acta Crystallogr., Sect. B: Struct. Crystallogr. Cryst. Chem. 1977. V. 33. P. 3185. https://doi.org/10.1107/S0567740877010504
Schaefer W.P. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 1983. V. 39. P. 1610. https://doi.org/10.1107/S0108270183009452
Maas G. // Z. Anorg. Allg. Chem. 1977. V. 432. P. 203. https://doi.org/10.1002/zaac.19774320128
Fleischer E.B., Frost R. // J. Am. Chem. Soc. 1965. V. 87. P. 3998. https://doi.org/10.1021/ja01095a049
Shields K.G., Kennard C.H.L. // Cryst. Struct. Commun. 1974. V. 3. P. 357.
Sharma R.P., Bala R., Sharma R. et al. // J. Mol. Struct. 2005. V. 748. P. 143. https://doi.org/10.1016/j.molstruc.2005.03.028
CSD version 5.42 (November 2020).
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии