Журнал неорганической химии, 2021, T. 66, № 9, стр. 1255-1279
Координационные соединения цинка(II) и кадмия(II) с кластерными анионами бора: классификация соединений в зависимости от силы взаимодействия металл–борный фрагмент, анализ структурных данных (обзор)
С. Е. Короленко a, *, В. В. Авдеева a, Е. А. Малинина a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: korolencko0110@yandex.ru
Поступила в редакцию 26.02.2021
После доработки 15.04.2021
Принята к публикации 20.04.2021
Аннотация
Обобщены и систематизированы имеющиеся на данный момент сведения о синтезе и строении комплексных соединений Zn(II) и Cd(II) с кластерными анионами бора [BnHn]2– (n = 6, 10, 12), их замещенными производными, а также c аналогами – карборанами и металлоборанами в присутствии конкурентоспособных органических лигандов. Обсуждается синтез и особенности строения полученных соединений, изомерный состав соединений, влияние условий проведения реакций на состав и строение конечных продуктов. Приводится классификация соединений в зависимости от силы взаимодействия металл–борный остов.
ВВЕДЕНИЕ
Атомы бора образуют большое число разнообразных по составу и строению комплексных соединений с кластерными анионами бора [BnHn]2– (n = 6, 10, 12). В первую очередь это касается металлов, которые являются “мягкими” кислотами по Пирсону, таких как медь(I), серебро(I), свинец(II) [1–8], тогда как в случае металлов, которые являются “жесткими” кислотами (Fe(III), Co(III)), кластерные анионы бора восстанавливают металлы до более низких степеней окисления (Fe(II), Co(II)) и выступают в качестве противоионов [9, 10].
Комплексные соединения металлов, занимающих промежуточное положение между “жесткими” и “мягкими” кислотами по Пирсону, широко и систематически не исследовались. В литературе имеются разрозненные сведения о комплексообразовании Zn(II) и Cd(II) в присутствии кластерных анионов бора. Остаются малоизученными реакционная способность и способ координации клозо-бороводородных анионов, изомерный состав, поведение кластерных анионов бора в реакциях комплексообразования цинка(II) и кадмия(II) в присутствии конкурентоспособных органических лигандов, наличие вторичных взаимодействий в комплексах с окружающими электроположительными атомами. Между тем среди физико-химических параметров, влияющих на ход реакций комплексообразования, следует подчеркнуть варьирование условий реакций: природы растворителя, температуры процесса, порядка смешивания реагентов, соотношения компонентов реакций и др.). Указанные характеристики способны оказывать влияние на ход сопутствующих реакций и строение конечных координационных соединений.
В настоящем обзоре обобщены и систематизированы имеющиеся сведения о синтезе и строении комплексных соединений металлов-кислот промежуточной группы по Пирсону на примере Zn(II) и Cd(II) с кластерными анионами бора и их производными в присутствии конкурентоспособных органических лигандов. Имеющийся в настоящее время материал проанализирован с позиции силы взаимодействия металл–борный остов. Необходимо отметить, что предложенная в обзоре систематизация в силу сложного строения обсуждаемых в работе координационных соединений носит условный характер.
СОЕДИНЕНИЯ, В КОТОРЫХ МЕТАЛЛ ЯВЛЯЕТСЯ СОСТАВНОЙ ЧАСТЬЮ МЕТАЛЛОБОРАНОВОГО ИЛИ МЕТАЛЛАКАРБОРАНОВОГО ОСТОВА
Одними из первых соединений подобного рода, которые стали известны еще в 1960-е гг., являются молекулярные комплексы общей формулы [L2M(B10H12)] (L – эфирный растворитель, M = = Zn(II) [11], Cd(II) [12]), содержащие нидо-бороводородный анион. Указанные соединения образуются при взаимодействии цинкорганических и кадмийорганических соединений типа Et2Zn или Et2Cd с декабораном в диэтиловом эфире при комнатной температуре. Дальнейшая ионизация полученных соединений в водных или спиртовых растворах приводит к выделению дианионов [M(B10H12)2]2–, где М = Cd(II), Zn(II). Идентификация топологии данных соединений проводилась на основании ИК-, УФ- и ЯМР-спектров. Следует отметить, что данные комплексные соединения являются первыми примерами молекул, содержащих прямые связи Zn–B и Cd–B.
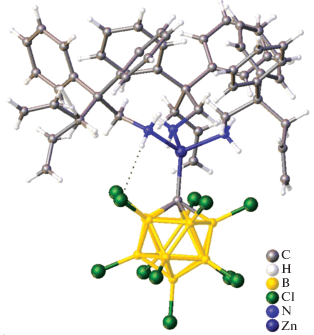
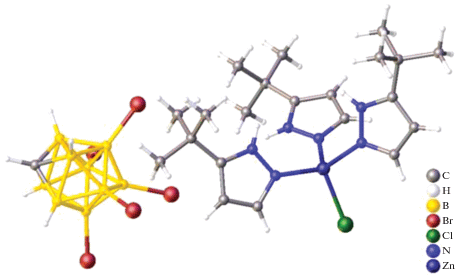
Спустя 10 лет Гринвуд с соавт. определили структуры комплексных соединений [Ph3MeP]2[Zn(B10H12)2] [13] и [(Et2O)2Cd(B10H12)]2 [14]. Согласно данным РСА, в комплексе [Ph3MeP]2[Zn(B10H12)2] два аналогичных кластера можно рассматривать как бидентатный лиганд (B10H12)2–, координированный атомом Zn(II) (рис. 1).
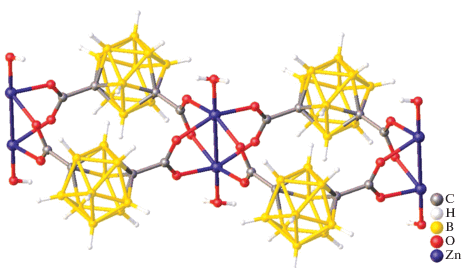
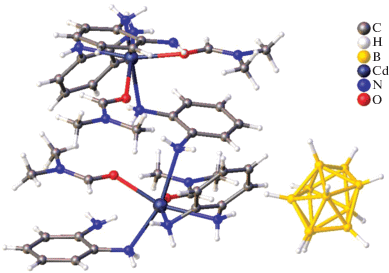
В димере [(Et2O)2Cd(B10H12)]2 каждый атом кадмия(II) связан с двумя ионами (B10H12)2– трехцентровыми связями. Координационное окружение каждого атома кадмия(II) дополняется двумя эфирными лигандами (рис. 2). Два аниона (B10H12)2– выступают в качестве мостиков между двумя атомами металла, поэтому можно считать, что данное соединение получено из декаборана путем замены двух мостиковых атомов водорода на атомы кадмия(II). Топология комплексных анионов [Cd(B10H12)2]2– (а), [Zn(B10H12)2]2– (б) (рис. 3).
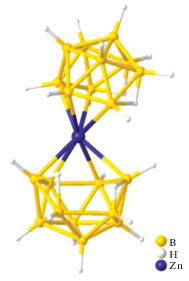
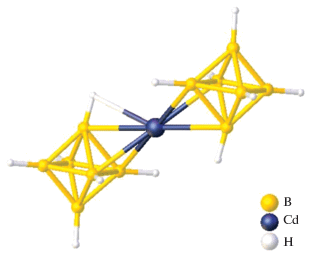
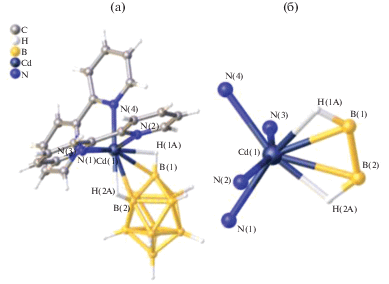
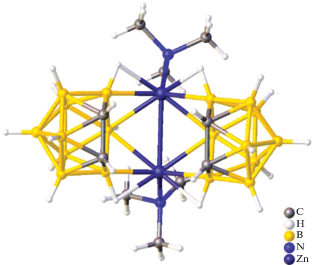
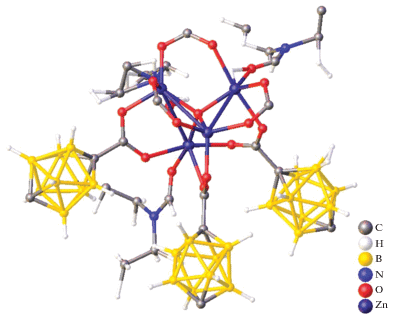
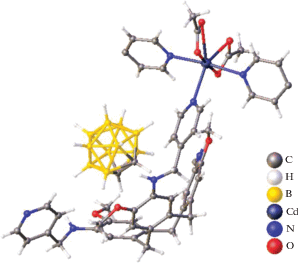
Еще один пример металлоборана, в котором два борных кластера связаны одним атомом металла – атомом кадмия(II) – описан в работе [15]. Комплекс [K(18-краун-6)]2[Cd(B9H13)2] получен при добавлении суспензии CdCl2 в THF к раствору K2(B9H13) в том же растворителе при –78°C с последующим добавлением 18-краун-6 и диэтилового эфира. Методом РСА установлено, что два нидо-6-кадмийдекаборановых кластера объединены общим атомом кадмия(II) (рис. 4). Данная структура интересна тем, что в ней проявляется нетипичная для нидо‑6-металлдекаборанов асимметрия, обусловленная тем, что расстояния Cd–B неэквивалентны (Cd(1)–B(2, 12) = 2.287 Å, а Cd(1)–B(5, 7, 15, 17) = 2.581 Å).
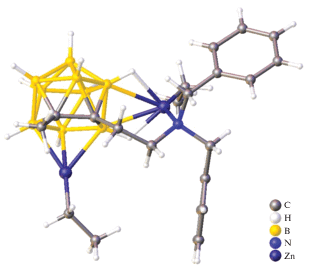
Дикарболлилы цинкоцена [(η3-C2B9H10)2Zn][(η1-NMe2)ZnEt]2 и полуцинкоцена [(η3-MeC2B9H9)ZnEt][(η1-NBn2)ZnEt], содержащие катионные N-координированные фрагменты этилцинка, получены при взаимодействии дикарболлиламиновых лигандов с тремя эквивалентами ZnEt2 в толуоле [16]. Согласно данным РСА, в дикарболлиле цинкоцена атом Zn1 располагается в кристаллографическом инверсионном центре, координационное окружение цинка(II) является октаэдрическим по отношению к плоскости C2B3 карболлидного лиганда (Zn1–C2B3 = = 1.656 Å) (рис. 5). Лиганд C2B3 несимметрично координирован атомом Zn1 с короткими расстояниями Zn–B, но длинными расстояниями Zn–C.
Кристаллографический анализ полуцинкоцена показал, что атом Zn1 занимает апикальную вершину икосаэдра (рис. 6), а также участвует в π-координации с дикарболлидными кольцами. Как и в случае цинкоцена, проявляется заметное удлинение расстояния Zn1–C2B3 (1.616 Å), что указывает на несимметричную связь между атомом Zn1 и атомами углерода и бора на открытой грани C2B3.
СОЕДИНЕНИЯ С σ-СВЯЗЬЮ С–М И Sn–Cd
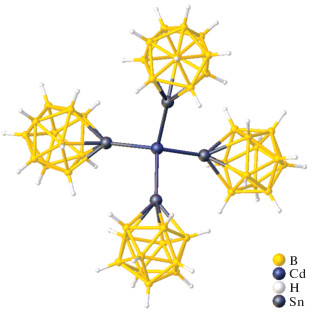
В работе [17] описывается кадмиевое соединение станна‑клозо-додекабората – универсального лиганда с нуклеофильными свойствами в координационной химии переходных металлов [18]. Комплекс [Et3NH]6[Cd[SnB11H11]4] получен при взаимодействии CdBr2 с [Et4N]2[SnB11H11] в соотношении 1 : 4 в ацетонитриле. Согласно данным РСА, указанное соединение кристаллизуется в моноклинной пр. гр. C2/c. Тетраэдрическое координационное окружение атома кадмия(II) слегка искажено, углы SnCdSn составляют около 98.840(11)° и 119.108(6)° (рис. 7).
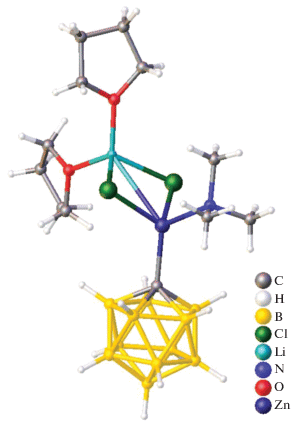
Среди большого числа производных бороводородных анионов особое место занимают карбораны – борорганические соединения, в которых часть атомов бора заменена на углерод. В работе [19] впервые выделен и полностью охарактеризован дианион [CB11H11]2– в виде цинката [ZnCB11H11(Me3N)Cl2(THF)2Li]–. Данное соединение получено путем литирования [CB11H12]2– в диэтиловом эфире с последующим трансметаллированием ZnCl2 в смеси диэтилового эфира и тетрагидрофурана при 20°C. Методом РСА установлено, что данная соль состоит из катиона [Li(THF)4]+ и карборанилцинкатного аниона. Координационное окружение атома цинка(II) образовано атомом углерода кластера, триметиламиновым лигандом и двумя хлоридами, выполняющими роль мостиковых лигандов по отношению к звену Li(THF)2 (рис. 8). Расстояние C1–Zn1 составляет 2.032(7) Å, Zn1–N1 – 2.094(8) Å, Zn1–Cl1 – 2.327(2) Å, Zn1–Cl1 – 2.320(2) Å. Использование цинксвязанного карборана сделало возможным эффективное и селективное замещение [CB11H12]– различными производными для дальнейшего применения.
СОЕДИНЕНИЯ С КООРДИНАЦИЕЙ МЕТАЛЛА К БОРНОМУ ОСТОВУ СВЯЗЯМИ В–Х (Х = H, Cl, S)
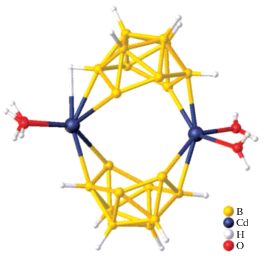
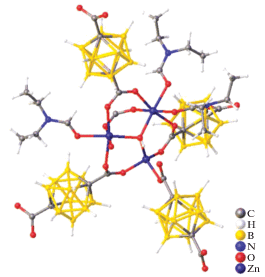
Среди комплексных соединений цинка(II) и кадмия(II) с кластерными анионами бора, находящимися во внутренней координационной сфере, известен комплекс (Bu4N)2[Cd[η3-B6H6]2] ⋅ ⋅ 2CH2Cl2 [20]. Данное соединение является комплексом “сэндвичевого” типа, в котором атом кадмия(II) координирует два гексагидро-клозо-гексаборатных аниона посредством трехцентровых двухэлектронных связей (3c2e) (рис. 9).
В работе [21] систематизированы данные о синтезе и строении моноядерных смешанолигандных комплексов цинка(II) и кадмия(II) с азагетероциклическими лигандами и декагидро-клозо-декаборатным анионом, непосредственно координированным атомом металла, общей формулы [М(L)2[B10H10]] (L = Bipy (2,2'-бипиридил), Phen (1,10-фенантролин), BPA (2,2'-дипиридиламин)). Селективное образование смешанолигандного комплекса кадмия(II) [Cd(Bipy)2[B10H10]] наблюдается в CH3CN или DMF при взаимодействии нитрата кадмия(II) с декагидро-клозо-декаборатом триэтиламмония независимо от соотношения реагентов M : L. В случае цинка(II) проведение аналогичной реакции комплексообразования в CH3CN при соотношении M : L, равном 1 : 1 или 1 : 2, приводит к образованию комплекса [Zn(Bipy)2[B10H10]].
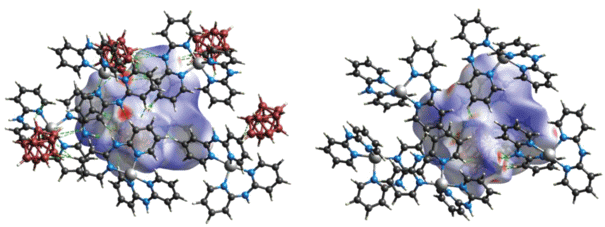
В структуре [Cd(Bipy)2[B10H10]] ⋅ DMF (рис. 10а) атом Cd(II) находится в квазиоктаэдрическом окружении, образованном ребром декагидро-клозо-декаборатного аниона и четырьмя атомами N двух молекул Bipy. Анион [B10Н10]2– координирован апикальным ребром к атому металла за счет образования двух трехцентровых двухэлектронных связей МНВ (рис. 10б). Длины связей Cd–B(Н) составляют 2.537(8) и 2.584(8) Å, а длины связей Cd–H(B) – 2.01(2) и 2.19(2) Å. Углы CdHB равны 95° и 103°. Длины связей Cd–N в комплексе лежат в диапазоне 2.318(5)–2.343(5) Å. В обсуждаемой структуре наблюдаются слабые межмолекулярные диводородные взаимодействия между анионом [B10Н10]2– и лигандом Bipy (рис. 11). Длина контактов H…H лежит в диапазоне 2.34–2.47 Å. Разупорядоченные молекулы растворителя располагаются в каналах, образованных комплексными молекулами (рис. 12).
Рис. 11.
Поверхность Хиршфельда, отображенная с помощью dnorm, для визуализации взаимодействий в [Cd(Bipy)2[B10H10]] ⋅ DMF. Пунктирными линиями обозначены межмолекулярные взаимодействия C–H…H–B.
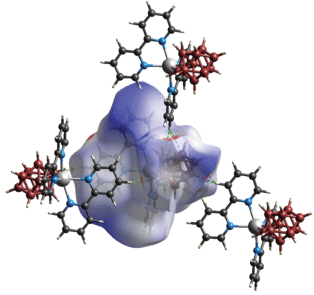
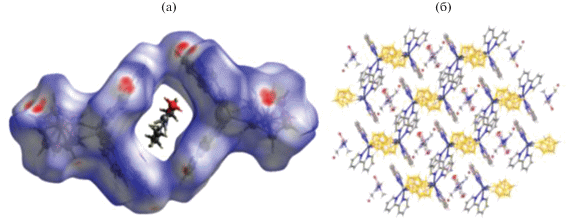
Рис. 12.
Поверхность Хиршфельда, отображенная с помощью dnorm для визуализации пустот в соединении [Cd(Bipy)2[B10H10]] ⋅ DMF (a), кристаллическая упаковка данного комплекса (б).
Ход реакций комплексообразования в присутствии Phen принципиально отличается от процессов, рассмотренных выше, и описан в [21]. Так, в случае цинка(II) при проведении реакции комплексообразования из декагидро-клозо-декабората триэтиламмония в DMF в результате фракционной кристаллизации во времени в качестве второй фракции выделен смешанолигандный комплекс [Zn(Phen)2[B10H10]]. Образование того же соединения в качестве основного продукта наблюдается в CH3CN. Использование в реакции комплексообразования комплекса [Zn(DMF)6][B10H10] в качестве прекурсора независимо от соотношения реагентов M : L также приводит к селективному образованию комплекса [Zn(Phen)2[B10H10]].
Авторами [21] установлено, что в случае кадмия(II) на ход реакции комплексообразования помимо природы растворителя существенное влияние оказывает соотношение реагентов Cd : Phen. Так, в CH3CN при взаимодействии нитрата кадмия(II) с декагидро-клозо-декаборатом триэтиламмония в присутствии Phen при соотношении M : L, равном 1 : 2, селективно образуется смешанолигандный комплекс [Cd(Phen)2[B10H10]]. Проведение аналогичной реакции при соотношении Cd : Phen = = 1 : 3 приводит к образованию комплекса [Cd(Phen)2[B10H10]] в качестве первой фракции.
В случае BPA условия образования смешанолигандного комплекса [Cd(BPA)2[B10H10]] аналогичны описанным для Bipy, однако комплекс [Zn(BPA)2[B10H10]] может быть получен только при взаимодействии предварительно полученного прекурсора [Zn(DMF)6][B10H10] с BPA в CH3CN.
Пригодные для РСА монокристаллы соединения [Zn(BPA)2[B10H10]] получены из реакционного раствора в результате изотермического упаривания на воздухе. В комплексе [Zn(BPA)2[B10H10]] (рис. 13a) атом Zn(II) находится в квазиоктаэдрическом окружении (рис. 13б), образованном апикальным ребром декагидро-клозо‑декаборатного аниона и четырьмя атомами N двух молекул BPA. Длины связей Zn–B(Н) составляют 2.650(2) и 2.743(2) Å, а длины связей Zn–H(B) – 2.07(2) и 2.41(2) Å. Углы ZnHB равны 95° и 107°. Длины связей Zn–N в комплексе лежат в диапазоне 2.076(2)–2.079(2) Å. Атомы Н анионов [В10Н10]2– образуют межмолекулярные контакты (рис. 14) с атомами водорода СH- и NH-групп BPA. Длина контактов наиболее сильных взаимодействий BН…НN составляет 1.94 и 2.05 Å.
Рис. 14.
Поверхность Хиршфельда, отображенная с помощью dnorm для визуализации взаимодействий в комплексе [Zn(BPA)2[B10H10]]. Пунктирными линиями обозначены межмолекулярные взаимодействия N–H…H–B и C–H…H–B.
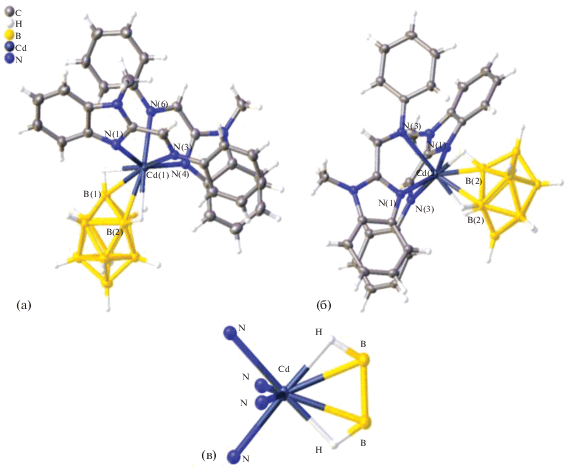
В работе [22] проведено исследование реакции комплексообразования нитрата кадмия(II) с производными бензимидазола L1 = 1-метилбензимидазо-2-ил-метиленанилин) и L2 (1-этил-2-(4-метоксифенил)азобензимидазол). При взаимодействии декагидро-клозо-декабората триэтиламмония (Et3NH)2[B10H10], нитрата кадмия(II) и L2 в CH3CN образуется смешанолигандный комплекс [Cd(L2)2(CH3CN)[B10H10]]. В случае лиганда L1 из реакционной смеси одновременно выделены смешанолигандные комплексы 1,2 [Cd(L1)2[B10H10]] ⋅ 1.5CH3CN и 2,6 [Cd(L1)2[B10H10]] с различным расположением атомов металла вокруг борного кластера, которые разделяли механически. В структурах 1,2 ([Cd(L1)2[B10H10]] ⋅ ⋅ 1.5CH3CN, рис. 15а) и 2,6 ([Cd(L1)2[B10H10]], рис. 15б) атом Cd(II) находится в квазиоктаэдрическом окружении, образованном ребром декагидро-клозо-декаборатного аниона и четырьмя атомами N двух молекул L1. Анион [B10Н10]2– координируется атомом металла за счет образования двух трехцентровых двухэлектронных связей (МНВ) (рис. 15в). В комплексе [Cd(L1)2[B10H10]] · · 1.5CH3CN длины связей Cd–B(Н) составляют 2.492(3) и 2.555(3) Å, а в [Cd(L1)2[B10H10]] – 2.591(3) Å; расстояния Cd–H(В) в комплексах равны 2.27(3), 2.25(3) и 2.12(3) Å, углы CdНВ составляют 88.3°, 92.0° и 99.9° соответственно.
Рис. 15.
Структура комплексов 1,2 [Cd(L1)2[B10H10]] ⋅ 1.5CH3CN (а) и 2,6 [Cd(L1)2[B10H10]] (б) и окружение металла в комплексах (в).
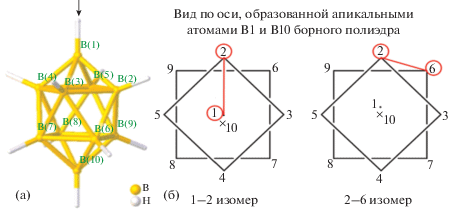
Комплексы [Cd(L1)2[B10H10]] · 1.5CH3CN и [Cd(L1)2[B10H10]] являются позиционными изомерами, в которых анион [B10Н10]2– координируется атомом металла апикальным ребром или ребром, соединяющим два экваториальных пояса, соответственно. Схематическое изображение полученных изомеров и нумерация атомов бора в декагидро-клозо-декаборатном анионе в соответствии с правилами IUPAC показаны на рис. 16.
Рис. 16.
Нумерация атомов бора в 10-вершинном кластере бора согласно правилам IUPAC (а) и схематическое изображение 1–2 и 2–6 позиционных изомеров с апикальной или экваториальной координацией кластера (б).
В работе [22] описано взаимодействие комплексов-прекурсоров [M(DMF)6][B10H10] (M = = Zn(II), Cd(II)) с лигандом L2 в ацетонитриле. В ходе реакции выделены смешанолигандные комплексы общей формулы [M(L2)2(CH3CN)[B10H10]] (M = Zn(II), Cd(II)). На основании данных РФА и ИК-спектроскопии авторы полагают, что полученные комплексы изоструктурны. Согласно данным РСА, для комплекса [Cd(L2)2(CH3CN)[B10H10]] установлено, что анион [B10H10]2– координируется атомом металла через апикальное ребро 1–2. Атом Cd(II) в комплексе имеет искаженное тетраэдрическое координационное окружение (рис. 17). Углы NCdN изменяются в пределах 92.86(6)°–132.31(6)°. Декагидро-клозо-декаборатный анион η2-координирован атомом металла апикальным ребром B(1)–B(2). Длины связей Cd–B(1) и Cd–B(2) сильно различаются (2.482(2) и 2.730(2) Å), поскольку атомы B(1) и B(2) имеют четыре и пять соседних атома бора в кластере [B10H10]2–. Атомы азота N(14) и N(24) образуют укороченные межмолекулярные контакты с атомом Cd(II) (2.71 и 2.80 Å) в направлениях, совпадающих с неподеленными электронными парами атомов азота. Координационное окружение центрального атома авторы рассматривают как 4 + 2. Длины связей B–B, образованных апикальными атомами B(1) и B(10), на ~0.15 Å короче длин связей, образованных атомами бора экваториального пояса (1.691(3)–1.721(3) Å по сравнению с 1.803(3)–1.869(3) Å). Интересно, что координация атома Cd(II) не оказывает серьезного влияния на расстояние B(1)–B(2), равное 1.707(3) Å. Тем не менее связи B(1)–H и B(2)–H являются самыми длинными среди связей B–H (1.14(2) и 1.11(2) Å по сравнению с 1.06(2)–1.10(2) Å).
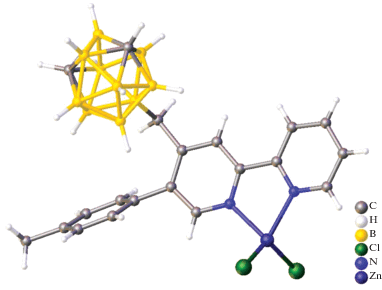
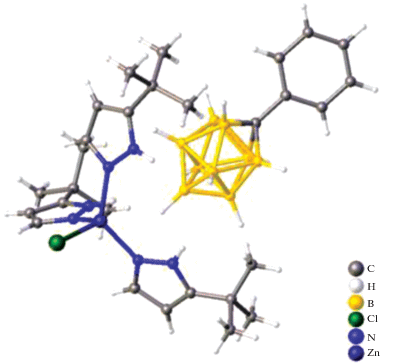
Первым кристаллографически охарактеризованным бензольным комплексом цинка(II) с производным карборана является комплекс [EtZn(η3-C6H6)][CHB11Cl11] [23], полученный путем отщепления β-водорода и сопутствующего отщепления этена от Et2Zn с помощью третичной соли [Ph3C][CHB11Cl11] в смеси бензол/гексан при комнатной температуре в виде бесцветного кристаллического твердого вещества. Согласно данным РСА, структура полученного комплексного соединения состоит из тесной ионной пары, в которой два донорных атома хлора карборанового аниона (один из мета-пояса, другой из пара-положения) и три атома углерода из молекулы бензола η3-координированы к атому цинка(II) (рис. 18). Полученная ионоподобная частица проявляет каталитическую активность в реакциях гидросилилирования и внутримолекулярного гидроаминирования, с помощью которого авторами [23] был выделен аминный аддукт {CH2CHCH2C(Ph2)CH2NH2}3ZnCB11Cl11, в котором присутствует редкая σ-связь переходный металл–карборан (рис. 19).
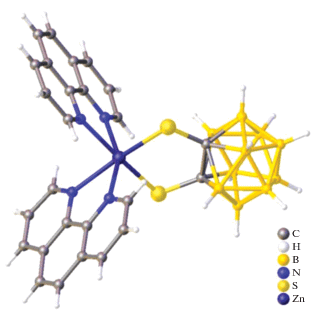
В работе [24] описана кристаллическая структура моноядерного комплекса цинка(II) с 1,2-дитиолато-1,2-дикарба-клозо-додекабораном. Данное соединение получено при добавлении Zn(OAc)2 · 4H2O к суспензии 1,2-(Hs)2-1,2-C2B10H10 и Phen в дихлорметане с последующим перемешиванием в течение 6 ч в атмосфере сухого азота. Кристаллографический анализ показал, что атом цинка(II) является шестикоординированным: две позиции занимают атомы серы, четыре – атомы азота двух 1,10-фенантролиновых лигандов (рис. 20). Длины связей Zn1–S1 и Zn1–S2 составляют 2.413 и 2.411 Å соответственно, Zn1–N1, Zn1–N2, Zn1–N3 и Zn1–N4 – 2.253, 2.233, 2.235 и 2.223 Å соответственно.
Рис. 20.
Структура (1,2-дикарба-клозо-додекаборан-1,2-дитиолато-κ2S,S')-бис(1,10-фенантролин-κ2N,N') цинка(II).
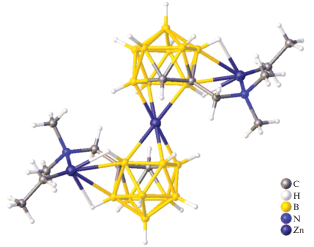
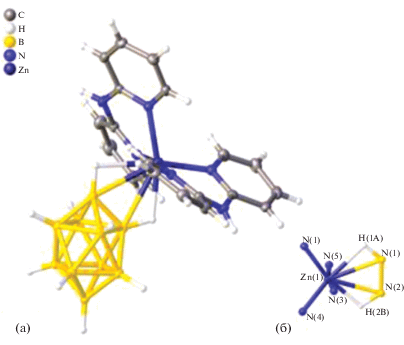
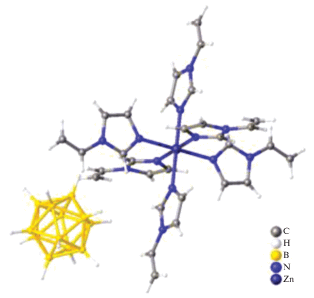
Молекулярная структура димерного комплекса цинка(II) с нидо‑карборановыми анионами получена в 1998 г. В работе [25] описаны синтез и структурные характеристики комплекса [(нидо-C2B9H11)ZnNMe3]2. В данном соединении два фрагмента нидо-C2B9H11 связаны атомами бора нидо-карборановых остатков и фрагментами Me3NZnZnNMe3, в которых атомы Zn(II) находятся на расстоянии 2.800(1) Å (рис. 21). Атомы бора и цинка(II) связаны в плоскую ромбовидную кольцевую систему Zn2B2. Помимо данного кольца координация каждого атома Zn(II) дополняется одним лигандом NMe3 и взаимодействием двух связей B–H с каждым атомом металла.
СОЕДИНЕНИЯ С КООРДИНАЦИЕЙ МЕТАЛЛА ЧЕРЕЗ ЗАМЕСТИТЕЛЬ БОРНОГО КЛАСТЕРА
В работе [26] описаны структурные характеристики и фотофизические свойства цинкового комплекса с бипиридиновыми производными м-карборана, полученными по реакции Дильса–Альдера между 1,2,4-триазинами и 9-аллил-м-карбораном. Монокристаллы комплекса цинка(II) с карборанилметилбипиридином, пригодные для РСА, получены медленным упариванием из насыщенного раствора ацетонитрила. Согласно данным РСА, атом цинка(II) в полученном комплексе имеет искаженную тетраэдрическую координацию. Бипиридиновый фрагмент является практически плоским, торсионный угол между пиридиновыми кольцами составляет 1.7° (рис. 22). В данном соединении присутствуют внутримолекулярные водородные связи C–H…Cl. Авторы отмечают, что именно благодаря образованию комплексов Zn(II) происходит значительное усиление интенсивности флуоресценции 3- и 4-(м-карборан-9-илметил)-2,2'-бипиридинов.
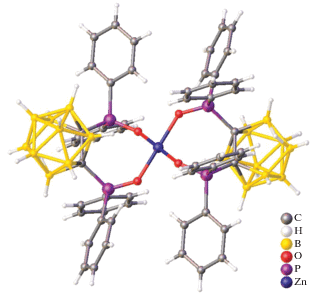
При взаимодействии хлорида цинка(II) и 1,2-(PCy2)2-1,2-C2B10H10 в хлорметане в атмосфере азота авторами [27] получены монокристаллы ди-µ-хлоридо-бис[1,2-бис(дициклогексилфосфино)-1,2-дикарба-клозо-додекаборана-κ2P,P'] цинка(II) (рис. 23).
Рис. 23.
Строение ди-µ-хлоридо-бис[1,2-бис(дициклогексилфосфино)-1,2-дикарба-клозо-додекаборан-κ2P,P'] цинка(II).
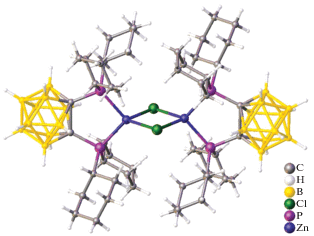
В работе [28] сообщается о металлорганическом каркасе (MOF), собранном из ионов цинка, 1,4-бензолдикарбоксилата и гидрофобного линкера на основе карборана. Подобная кристаллическая поверхность может переключаться между гидрофобной и супергидрофильной путем химической обработки. Монокристаллы соединения [Zn4(μ4-bdc)2(μ2-o-CB-L)2(μ3-O)2(DMF)2] · 4DMF получены при взаимодействии Zn(NO3)2 · 6H2O, 1,4‑бензолдикарбоксилата (bdc), 1,2-бис{(пиридин-3-ил)метанол}-1,2-дикарба-клозо-додекарборана (o-CB-L) и 2-метилимидазола в смеси EtOH : DMF (1 : 1) при температуре 85°C в течение 48 ч. Согласно данным РСА, элементарной ячейкой комплекса является тетраядерный кластер [Zn4(O)2(OOC)4], образованный двумя кристаллографически независимыми ионами Zn1 и Zn2. Оба иона Zn2 октаэдрически координируют две карбоксилатные группы линкеров bdc, один пиридиновый фрагмент μ2-o-CB-L, два атома μ3-O и молекулу DMF (рис. 24). Две карбоксилатные группы линкеров bdc, один пиридиновый фрагмент μ2-o-CB-L и атом μ3-O тетраэдрически координированы к обоим ионам Zn1. Каждая карбоксилатная группа линкера bdc связывает два иона Zn(II) в одном звене Zn4, затем два звена Zn4 соединяются, образуя квадратные сеточные слои Zn4(bdc)2. Данные слои дополнительно соединяются опорными линкерами μ2-o-CB-L, создавая трехмерную структуру, содержащую одномерные каналы.
Пористый координационный полимер цинка(II) с производным карборана описан в работе [29]. Комплекс [Zn4OL3(DEF)3] (L = 1,10‑дикарбокси-1,10-дикарба-клозо-декаборан, DEF = = N,N-диэтилформамид) (рис. 25) получен путем стандартной сольвотермической реакции в смеси растворителей на основе амида. Аналогично комплексу, описанному в [28], основой построения супрамолекулярной конструкции полученного комплексного соединения является [Zn4O(COO)6].
В работе [30] описывается MOF на основе комплекса цинка(II) с депротонированной формой 1,12‑дигидроксикарбонил-1,12-дикарба-клозо-додекаборана (п-CDC), который может использоваться для целей бор-нейтронозахватной терапии, молекулярной доставки в биомедицине и в качестве молекулярного двигателя. Рентгеноструктурный анализ данного соединения показал, что монокристалл комплекса [Zn3(OH)(п-CDC)2.5(DEF)4]n состоит из трех ионов цинка(II), два из которых координируют две молекулы диэтилформамида (DEF), причем каждая в октаэдрической геометрии. Кроме того, один из дикарбоксилатных лигандов связан с цинком(II) только через один атом кислорода. Далее атомы цинка(II) соединяются тройным мостиковым гидроксидным ионом (рис. 26).
Координационные полимеры цинка(II) с 1,7-бис{(пиридин-4-ил)метанол}-1,7-дикарба-клозо-додекабораном (L), 1,3,5-бензолтрикарбоксильной кислотой (H3BTB) и 1,2,4,5-тетракис(4-карбоксифенил)бензолом (H4TCPB) описаны в работе [31]. Данные соединения получены при взаимодействии нитрата цинка(II) с лигандом L и H3BTB или H4TCPB в смеси DMF/этанол/H2O. Согласно данным РСА, основной строительной единицей комплекса [Zn4(BTB)2(L)(OH)2(H2O)2] · · 5H2O · 4DMF является кластер [Zn4O2(COO)6N2] (рис. 27а), в котором четыре иона Zn(II) связаны шестью лигандами BTB и двумя лигандами L. Атом Zn(1) координирует четыре атома кислорода трех различных лигандов BTB и два атома кислорода двух групп OH. Атом Zn(2) координирует один лиганд L, три атома кислорода трех лигандов BTB, одну группу OH и одну молекулу воды. Металлические центры Zn(3) и Zn(4) координируют два атома кислорода двух лигандов BTB, одну группу OH и один лиганд L в случае Zn(3) или одну молекулу воды в случае Zn(4). В данном комплексе лиганды L соединяют две тетраядерные частицы Zn(II) с расстоянием N–N 12.20 Å, создавая зигзагообразные цепи (рис. 27б).
Рис. 27.
Координационное окружение Zn(II) в тетраядерной комплексной частице [Zn4O2(COO)6N2] (а), два тетраядерных атома Zn(II), связанных лигандом L (б).
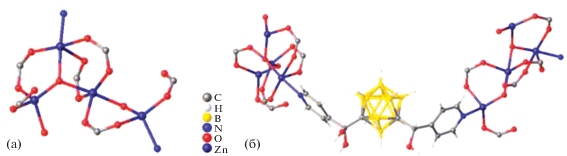
Строительной единицей комплекса [Zn2(TCPB)(L)] · 2DMF является кластер [Zn2(COO)4N2] (рис. 28а) [31]. Оба атома Zn(II) координируют четыре атома кислорода четырех разных линкеров TCPB и один атом азота лиганда L с расстоянием Zn–N 2.030(4) Å. В данной структуре каждый лиганд TCPB полностью депротонирован и бидентатно координирует четыре единицы [Zn2(COO)4N2], выполняя роль мостиков и создавая 2D слои (рис. 28б). Эти слои дополнительно пронизываются линкерами L с расстоянием N–N 12.04 Å, в результате чего образуется трехмерный двукратно взаимопроникающий каркас (рис. 28в).
Рис. 28.
Строение кластера [Zn2(COO)4N2] (а), 2D слой комплекса [Zn2(TCPB)(L)] (б), трехмерная структура (в).
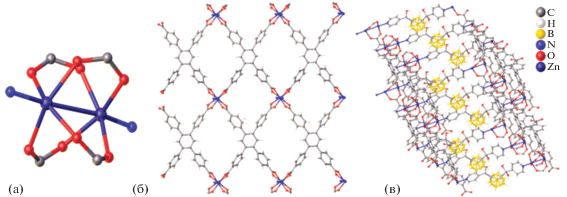
В работе [32] описаны синтез и свойства пористых 2D и 3D открытых металлорганических каркасных структур (MOF) на основе цинковых солей и производных п-карборана, которые потенциально могут использоваться при разделении газов. Оба пористых полимера получены при взаимодействии гексагидрата нитрата цинка(II) с соответствующим производным п-карборана в результате сольвотермического синтеза. Кристаллографический анализ показал, что 3D MOF представляет собой открытый каркас с повторяющимися строительными единицами, состоящими из металлических кластеров [Zn4(OH)2(DMF)4] (рис. 29), при этом лиганд соединяет атомы Zn(II). Асимметричная частица 3D MOF состоит из четырех ионов Zn(II), трех лигандов – производных п-карборана, двух гидроксильных групп и четырех фрагментов DMF. Один из трех лигандов связывает четыре иона Zn(II) и два соседних кластера [Zn4(OH)2(DMF)4]. Остальные два независимых фрагмента соединяют три металлических центра с двумя соседними узлами [Zn4(OH)2(DMF)4]. Гидроксильные группы соединяют три металлических центра в одном кластере, а молекулы DMF завершают координационную сферу октаэдрических металлических центров.
В отличие от 3D, 2D цинковый пористый координационный полимер представляет собой каркас, состоящий из одномерных слоев [32]. Данный MOF состоит из двухъядерных кластеров [Zn2(H2O)(EtOH)], связанных между собой с четырьмя дианионными лигандами с образованием бесконечного 2D слоя (рис. 30). Оба центра Zn(II) являются пентакоординированными в искаженной квадратно-пирамидальной геометрии внутри кластера на основе Zn2. Авторы отмечают, что координированные растворители стабилизируют структуру за счет водородных связей и ван-дер-ваальсовых взаимодействий.
Олигомерная соль цинка(II) c м-карборандикарбоновой кислотой (MCA), которая выполняет роль тетрадентатного мостикового лиганда, описана в работе [33]. Данное соединение получено при взаимодействии MCA с оксидом цинка(II) в эквимолярных соотношениях при перемешивании при 60–80°С в течение 2–6 ч. Монокристаллы комплекса Zn(II) с MCA, пригодные для РСА, получены непосредственно из реакционной смеси. Согласно результатам кристаллографического анализа, данный комплекс представляет собой линейный полимер с бесконечной цепью, в которой фрагменты [Zn2(COO)4(H2O)2] чередуются c мета-карборановыми остовами, ковалентно связанными с карбоксильными группами (рис. 31). Каждый остаток OOC–(м-C2B10H10)–COO представляет собой тетрадентатный лиганд, координирующий четыре катиона металла. Каждый атом металла находится в тетрагонально-пирамидальном окружении и координирует четыре различных фрагмента COO и одну молекулу воды. Расстояние между атомами цинка(II) в структуре олигосоли составляет 2.957(1) Å, что соответствует укороченному ван-дер-ваальсовому контакту.
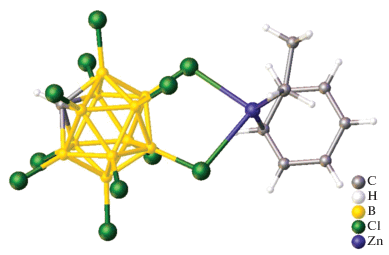
1D координационные полимеры Zn(II) и Cd(II) с карборанилфосфинатным лигандом описаны в работе [34]. Они получены при взаимодействии соли Na[1-OPH(O)-1,7-клозо-C2B10H11] с хлоридом соответствующего металла в метаноле или этаноле. Методом РСА авторам удалось установить структуру 1D координационного полимера кадмия(II) (рис. 32). Каркас данного полимера является строго неорганическим и состоит из атомов Cd(II), карборанилфосфината, хлорида и воды, которые образуют спиральную 1D цепь. В структуре представлены два различных искаженных гексакоординированных иона Cd(II) (Cd(1) и Cd(2)). Атом Cd(1) связан с двумя соседними ионами Cd(2) через два хлоридных и два син-анти-карборанилфосфинатных лиганда; два атома кислорода двух лигандов воды завершают октаэдрическую геометрию Cd(1). В свою очередь, атом Cd(2) связан с атомами Cd(1) и Cd(2). Оба атома Cd(2) удерживаются вместе двумя анти-анти-карборанилфосфинатными мостиками, а октаэдрическая геометрия Cd(2) завершается двумя лигандами H2O и двумя мостиковыми лигандами, через которые Cd(2) связывается с Cd(1), хлоридным лигандом и одним атомом кислорода карборанилфосфинатного лиганда. Расстояние Cd(2)–Cd(2) составляет 5.810 Å, а Cd(2)–Cd(1) – 4.098 Å. Подобное различие авторы связывают с пространственно ограниченной природой хлорлигандных мостиков.
На основании данных физико-химических методов анализа (ESI-MS, ИК-спектроскопия, РФА, ЯМР) авторы предположили, что структура аналогичного 1D координационного полимера цинка(II) аналогична структуре кадмиевого полимера [34].
При взаимодействии хлорида цинка(II) с 1,2-(PPh2)2-1,2-C2B10H10 в этаноле на воздухе авторами [35] получен комплекс цинка(II) c бис(фосфорил)-нидо-карбораном. Согласно данным РСА, атом Zn(II) координирует четыре атома кислорода двух бидентатно координированных лигандов [7,8-(OPPh2)2-7,8-C2B9H10]–. Два карборановых аниона находятся с противоположных сторон в транс-конформации (рис. 33).
В последнее время карборанилзамещенные порфирины признаны в качестве перспективных агентов для бор-нейтронозахватной терапии злокачественных опухолей. В серии работ [36–39] описывается ряд цинковых комплексов различных производных карборанилпорфиринов. Авторами отмечается, что именно водорастворимые нидо-карборанилпорфирины и их цинковые комплексы, полученные из соответствующих высокогидрофобных клозо-карборанилпорфиринов, могут доставлять терапевтические концентрации бора в опухолевую ткань с относительно низкой токсичностью. Согласно кристаллографическим данным, во всех полученных структурах макроцикл порфирина является практически плоским; длины связей Zn–N находятся в пределах диапазона, типичного для порфиринов цинка(II). Авторы [36–39] сообщают, что структуры цинк-порфиринов обычно либо четырехкоординированные, либо содержат один или два аксиальных лиганда, связанных неподеленной парой азота или кислорода.
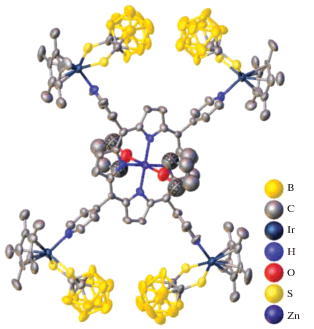
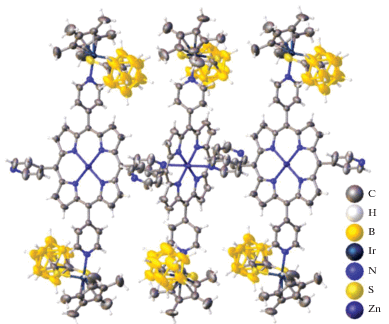
Три порфиринкарборановых органометаллических ансамбля, основанных на комбинации “псевдоароматического” полусэндвичевого комплекса [Cp*Ir{S2C2(B10H10)}], 2-дикарба-клозо-додекаборана и порфириновых лигандов, описаны в работе [40]. Взаимодействие тетра-(4-пиридил)порфирина цинка(II) с четырьмя эквивалентами [Cp*Ir{S2C2(B10H10)}] в THF привело к образованию комплекса {(ZnTPyP)[Cp*Ir {S2C2(B10H10)}]4(THF)2}, строение которого приведено на рис. 34. Согласно данным РСА, полученный комплекс состоит из четырех фрагментов [Cp*Ir{S2C2(B10H10)}], связанных атомами азота ZnTPyP. Авторы отмечают, что особенностью данной структуры является то, что фрагменты [Cp*Ir{S2C2(B10H10)}] находятся в комбинации “хвост–хвост”, а не “голова–хвост”, несмотря на большое стерическое отталкивание между двумя карборановыми лигандами. Две молекулы THF образуют слабые взаимодействия с атомом Zn(II) в центре комплекса через атомы кислорода, длина связи Zn–O составляет 2.436(19) Å. Пары этих слабых взаимодействий приводят к образованию центросимметрично связанных тетрамеров.
При проведении аналогичной реакции комплексообразования с двумя эквивалентами [Cp*Ir{S2C2(B10H10)}] в CHCl3 при комнатной температуре образуется полимер {(ZnTPyP) [Cp*Ir{S2C2(B10H10)}]2 ⋅ 6(CHCl3)}n [40]. Кристаллографический анализ показал, что в данном соединении присутствуют слоистые структуры с аналогичными строительными блоками с одинаковой последовательностью упаковки. Координационная геометрия вокруг каждого иона цинка октаэдрическая (рис. 35). Экваториальные позиции, расположенные в плоскости порфирина, заняты четырьмя донорными атомами N четырех пиррольных фрагментов порфинового лиганда (Zn–N = 2.048(7)–2.062(7) Å). В аксиальных позициях находятся два атома азота пиридинов двух соседних молекул порфина с одинаковыми длинами связей Zn–N, равными 2.489(9) Å. Все соседние порфирины взаимно перпендикулярны друг другу, что приводит к появлению двумерного рисунка, подобного “гребному” колесу. Два металлорганических кластера [Cp*Ir{S2C2(B10H10)}] расположены на конце “лопасти”.
Авторы отмечают, что фотохимические и фотофизические исследования полученных соединений показывают, что сильная люминесценция порфирина цинка(II) полностью тушится, это может быть связано с внутримолекулярным переносом электрона между порфирином и связывающим кластером [Cp*Ir{S2C2(B10H10)}] в фотовозбужденном синглетном состоянии [40].
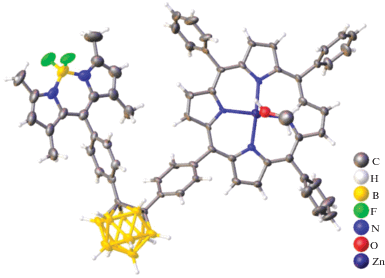
Аналогичное уменьшение интенсивности излучения флуоресценции триады порфиринцинка(II)-о-карборан-BODIPY (рис. 36), в которых и порфирин, и BODIPY ковалентно связаны с о-карбораном, описано в работе [41]. Авторы связывают подобное явление с тушащим действием самого о-карборана. В [41] изучены окислительно-восстановительные свойства данного соединения с помощью циклической вольтамперометрии. Электрохимические свойства показывают, что введение о-карборана увеличивает восстановительный потенциал вместе с катодным сдвигом.
СОЕДИНЕНИЯ, В КОТОРЫХ БОРНЫЙ КЛАСТЕР НЕ ВХОДИТ В КООРДИНАЦИОННУЮ СФЕРУ МЕТАЛЛА
Для металлов М(II) промежуточной группы по Пирсону получено большое число аквакомплексов с кластерными клозо-боратными анионами состава [M(H2O)6][B10H10] ⋅ 2H2O (M = Mn, Fe, Co, Ni, Zn) [42], [Cd(H2O)6][B12H12] [43], [M(H2O)6][B12H12]2 ⋅ nH2O и смешанокатионных аквакомплексов (H3O)2[M(H2O)6][B12H12]2 ⋅ 6H2O (M = Mn, Fe, Co, Ni, Cu, Zn) [44]. В данных семействах соединений кластерные анионы бора являются противоинами. Катионы переходных металлов имеют октаэдрическое окружение, состоящее из атомов кислорода шести молекул воды. Стабилизация кристаллической решетки соединений происходит благодаря наличию водородных связей В–Н…Н–О с бороводородными анионами, находящимися во внешней сфере комплексов.
В работе [45] описаны комплексы состава [М(solv)6][BnHn], где M = Zn(II), Cd(II); solv = = DMF, DMSO; n = 10, 12. Комплексы [M(solv)6][B10H10] и [М(DMSO)6][B12H12] образуются при взаимодействии клозо-боратов алкиламмония с нитратами цинка(II) и кадмия(II) в DMF или DMSO. Комплексы [М(DMF)6][B12H12] получены в результате обмена лигандов при перекристаллизации предварительно синтезированных соответствующих гексааквакомплексов [M(H2O)6][B12H12] (M = Zn(II), Cd(II)) в DMF.
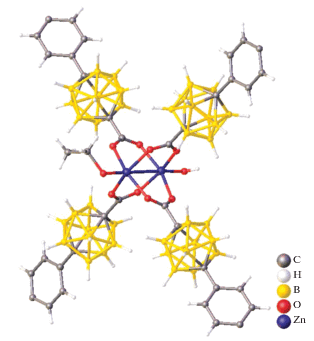
Согласно данным РСА, соединения [М(solv)6][B10H10] построены из комплексных катионов [M(solv)6]2+ и анионов [B10H10]2– (рис. 37). Координационное октаэдрическое окружение атомов металлов М(II) образовано шестью атомами кислорода соответствующих молекул DMF или DMSO. В структурах [М(solv)6][B10H10] кластерные анионы бора образуют специфические контакты BH…HC с атомами водорода метильных групп молекул DMF или DMSO, длины контактов находятся в диапазоне 2.23–2.70 Å.
В работе [46] описан твердофазный синтез трис-хелатных комплексов цинка(II) и кадмия(II) [ML3][B10H10]. В качестве прекурсоров использовали N,N-диметилформамидные комплексы [M(DMF)6][B10H10] (M = Zn(II), Cd(II)). В результате механоактивации в течение 1 ч наблюдали полное замещение молекул DMF на молекулы азагетероциклических лигандов L (L = Bipy, Phen, BPA), процесс сопровождался образованием жидкой фазы и изменением окраски реакционной смеси. Полноту протекания реакции и состав образующихся соединений оценивали на основании данных элементного анализа, ИК-спектроскопии и РФА. Во всех полученных комплексах кластерный анион бора [B10H10]2– выступает в роли противоиона.
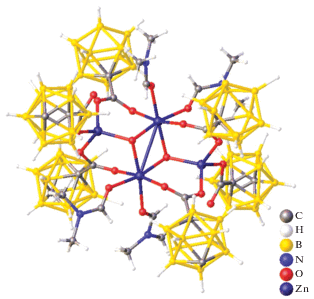
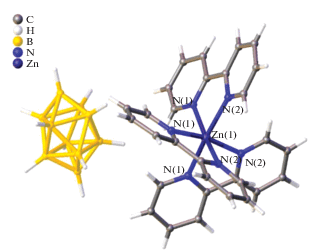
Трис-хелатный комплекс [Zn(Bipy)3][B10H10] [46] селективно образуется и в CH3CN при взаимодействии декагидро-клозо-декабората триэтиламмония с нитратом цинка(II) и Bipy при соотношении Zn : Bipy = 1 : 3 независимо от соотношения исходных реагентов в CH3CN при использовании в качестве прекурсора комплекса [Zn(DMF)6][B10H10] [21]. Монокристаллы комплекса [Zn(Bipy)3][B10H10] (рис. 38) построены из комплексных катионов [Zn(Bipy)3]2+ и анионов [В10Н10]2–, которые расположены на поворотной оси третьего порядка. В окружение атома Zn(II) входят шесть атомов азота трех молекул бипиридила. Октаэдры атомов металлов немного искажены. Длины связей Zn1–N1 и Zn1–N2 составляют 2.132(3) и 2.166(3) Å, углы N1Zn1N2, N1Zn1N21, N2Zn1N21 и N1Zn1N11 равны 76.08(11)°, 92.55(11)°, 94.65(9)° и 97.63(11)° соответственно. Атомы Н анионов [В10Н10]2– образуют межмолекулярные контакты с атомами водорода СH-групп молекул Bipy, которые лежат в диапазоне 2.05–2.48 Å. Красные точки на поверхности графика dnorm указывают на межмолекулярные контакты с участием водородных связей (рис. 39).
Рис. 39.
Поверхность Хиршфельда, отображенная с помощью dnorm для визуализации взаимодействий в соединении [Zn(Bipy)3][B10H10]. Пунктирными линиями обозначены межмолекулярные взаимодействия C–H…H–B.
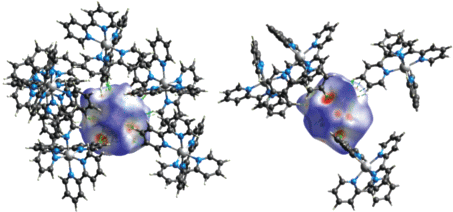
Образование трис-хелатных комплексов [М(Phen)3][B10H10] (M = Cd(II), Zn(II)) [46] обнаружено при взаимодействии декабората триэтиламмония с нитратом соответствующего металла и Phen в DMF. Искомые соединения образуются селективно из реакционного раствора или в ходе фракционной кристаллизации в случае Cd(II) и Zn(II) соответственно.
Проведение вышеописанной реакции комплексообразования в присутствии BPA в CH3CN привело к выделению в качестве второй фракции комплекса [Zn(BPA)2(NO3)]2[B10H10] ⋅ 2CH3CN [46]. Комплекс кристаллизуется в моноклинной сингонии (пр. гр. C2/с). В кристаллографически независимую часть элементарной ячейки входит один катион [Zn(BPA)2NO3]+, половина аниона [B10H10]2– и молекула ацетонитрила. Атом Zn(II) находится в сильно искаженном тригонально-бипирамидальном окружении (рис. 40), если принять, что η2-координированный нитрат-ион занимает одно координационное место. Апикальные позиции при этом заняты двумя атомами N двух разных лигандов. Атомы Н анионов [В10Н10]2– образуют межмолекулярные контакты с атомами Н СH-групп и одной из NH-групп катиона [Zn(BPA)2NO3]+, вторая аминогруппа образует слабую водородную связь с атомом кислорода соседнего катиона. Красные точки на поверхности графика dnorm указывают на межмолекулярные контакты с участием водородных связей (рис. 41).
Рис. 40.
Структура комплекса [Zn(BPA)2(NO3)]2[B10H10] ⋅ 2CH3CN (а) и координационное окружение Zn(II) (б).

Рис. 41.
Поверхность Хиршфельда, отображенная с помощью dnorm, для визуализации взаимодействий в соединении [Zn(BPA)2(NO3)]2[B10H10] ⋅ 2CH3CN. Пунктирными линиями обозначены межмолекулярные взаимодействия C–H…H–B и N–H…H–B.
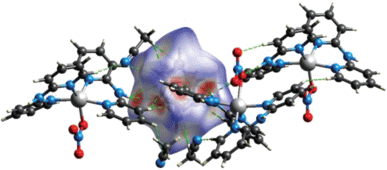
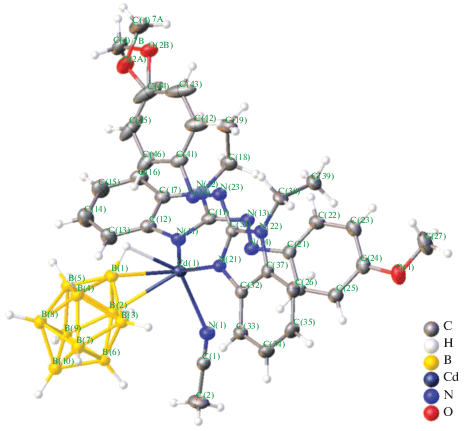
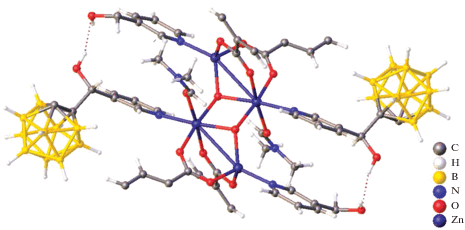
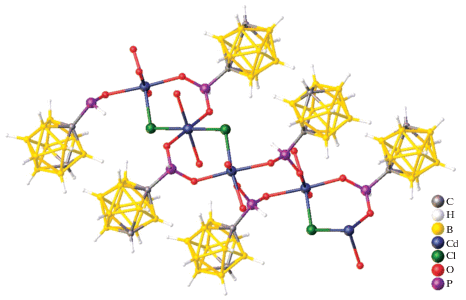
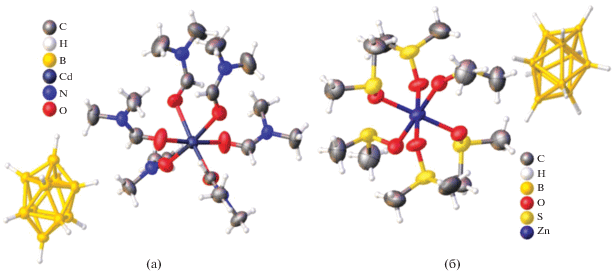
В работе [47] описан биядерный комплекс [Cd2(о-1,2-(NH2)2C6H4)5(DMF)4][B10H10]2, полученный при взаимодействии раствора аквакомплекса Cd(II) в DMF с раствором лиганда ДАБ (ДАБ – орто-фенилендиамин 1,2-(NH2)2C6H4) в ацетонитриле при соотношении металл : анион : лиганд = = 1 : 1 : 3. Методом РСА установлено, что монокристаллы данного соединения построены из димерных комплексных катионов [Cd2(о-1,2-(NH2)2C6H4)5(DMF)4]4+ (рис. 42) и клозо-декаборатных анионов [B10H10]2–, находящихся во внешней сфере и участвующих в специфических взаимодействиях N–H…B, N–H…H–B с аминогруппами молекул ДАБ, а также в водородных связях N–H…O, N–H…N. Атом кадмия(II) находится в октаэдрическом окружении, сформированном четырьмя атомами азота трех молекул ДАБ и двумя атомами кислорода молекул диметилформамида. В данном комплексе три независимые молекулы диаминобензола Ph(NH2)2 выполняют три различные функции: одна связана с атомом Cd(II) монодентатно атомом N(3), другая хелатирует его, образуя пятичленный хелатный цикл N(1)C(1)C(2)N(2)Cd(1), а третья формирует две симметричные эквивалентные связи Cd(1)–N(7), образуя димер и выполняя роль мостика между двумя атомами кадмия(II).
При создании веществ, применяемых в качестве ракетного топлива и присадок, обладающих высокой плотностью и температурой разложения, в работе [48] исследованы комплексы цинка(II) с анионом [B12H12]2– и производными имидазола. В результате добавления 1-винилимидазола или 1-аллилимидазола к водному раствору додекагидро-клозо-додекабората натрия Na2[B12H12] c Zn(NO3)2 ⋅ 6H2O и последующего медленного упаривания из раствора CH3CN при 2°С авторами выделены бесцветные кристаллы комплексов [Zn(C5H6N2)6][B12H12] и [Zn(C6H8N2)4] [B12H12] соответственно. Кристаллографический анализ комплекса [Zn(C5H6N2)6][B12H12] показал, что атом цинка(II) является симметрично шестикоординированным, углы NZnN равны 90°. Расстояния Zn–N составляют 2.181(12)–2.181(12) Å. Додекагидро-клозо-додекаборатный анион не координирован атомом металла и находится во внешней сфере комплексного соединения (рис. 43). Согласно данным ИК-спектроскопии и ESI-MS, в комплексе [Zn(C6H8N2)4][B12H12] координационное число цинка(II) равно 4, геометрия отличается от структуры комплекса [Zn(C5H6N2)6][B12H12]. Авторы объясняют подобное различие между комплексами разной длиной алкильной цепи органического лиганда, входящего в состав комплексных соединений.
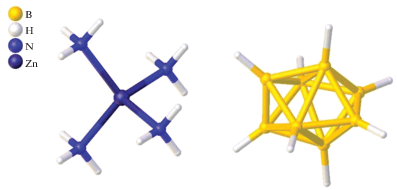
Аналогичная геометрия цинка(II) с КЧ = 4 встречается в работе [49], где описано строение комплекса [Zn(NH3)4][B8H8], кристаллическая структура которого состоит из тетраамминцинковых катионов [Zn(NH3)4]2+ и анионов [B8H8]2–(рис. 44). Расстояние Zn–N составляет 2.05(1) Å.
В работе [50] описаны карборановые соли [ZnCl(HpztBu)3]+, где HpztBu = 5-трет-бутилпиразол. Авторы отмечают, что подобные соединения дополняют ряд известных чашеобразных акцепторов для трехмерных кластеров и могут быть полезны для целей инженерии кристаллов. Данные соединения получены при добавлении к раствору ZnCl2 с HpztBu в метаноле раствора предварительно полученной соли соответствующего производного карборана в том же растворителе. Согласно РСА, катионы в [ZnCl(HpztBu)3]An (An = [Co(C2B9H11)2]– или [1-Ph-клозо-1-CB9H9]–) в кристалле объединяются за счет водородных связей в димеры, имеющие чашеобразную полость, в которую могут упаковываться карборановые анионы. В комплексе [ZnCl(HpztBu)3] [1-Ph-клозо-1-CB9H9] N–H-группы пиразольного лиганда находятся в тесном контакте с B–H-группой клозо-аниона (рис. 45). Катионы в [ZnCl(HpztBu)3] [6,7,8,9,10-Br5-клозо-1-CB9H5] связаны друг с другом водородными связями в одномерный полимер. Молекула воды связывает третий катион с атомом брома Br(41) при атоме B(10) кластерного аниона бора (рис. 46).
2D координационный полимер [Cd(L)(OAc)2 (o-C2B10H12)] · 2H2O, образованный в результате взаимодействия Cd(OAc)2 и трис(4-пиридилметиламино)циклотригваяцилена (L) в присутствии о-карборана, и трехъядерный комплекс Cd(II), полученный из раствора в отсутствие объемного карборана, описаны в работе [51]. В полимерном комплексе атом Cd(II) координирует два ацетатных иона и три пиридильные группы трех отдельных лигандов L (рис. 47). о-Карборан находится внутри полости лиганда L. Каждая пиридильная группа лиганда L связывает ионы Cd(II), эквивалентные, разной симметрии, следовательно, лиганд является 3-связывающим. Соответственно, Cd(II) также является 3-связывающим и комплекс распространяется в виде 3-связанного 2D координационного полимера, в котором двумерные координационные сетки объединены между собой водородными связями Oацетат …(H2O)…(H2O)…Oацетат.
Авторы [51] сообщают, что проведение аналогичной реакции комплексообразования в отсутствие о-карборана приводит к получению трехъядерного комплекса [Cd3(L)(OAc)6], предполагаемая структура которого установлена с помощью ПМР-спектроскопии и электроспрей-масс-спектрометрии (ES-MS). Анализ литературных источников показал, что комплексные соединения цинка(II) и кадмия(II) с карборанами и их производными имеют широкое практическое значение, например, для создания координационных полимеров с заданным набором физико-химических свойств, которые являются перспективными материалами для технологического и биомедицинского применения.
ЗАКЛЮЧЕНИЕ
Клозо-бороводородные анионы [BnHn]2–, их замещенные производные и аналоги (металлобораны, металлакарбораны) являются уникальным классом полидентатных лигандов в координационной химии. Благодаря высокой кинетической и термической устойчивости они весьма перспективны для использования в синтетической координационной химии.
В настоящее время актуально получение и исследование координационных соединений с лигандами, обладающими ценными функциональными свойствами, поэтому на сегодняшний день химия кластерных анионов бора направлена на практическое применение. Использование сочетанных свойств металлов-комплексообразователей и кластерных анионов бора позволяет получать широкий спектр соединений, имеющих разнообразное практическое применение: от потребностей медицины до спейсеров в химии высокопористых координационных полимеров. Так, для создания веществ, применяемых в качестве ракетного топлива и присадок, обладающих высокой плотностью и температурой разложения, предложены комплексы цинка(II) с анионом [B12H12]2– и производными имидазола. Комплексные соединения цинка(II) и кадмия(II) с карборанами и их производными имеют широкое практическое значение для создания координационных полимеров с заданным набором физико-химических свойств, которые являются перспективными материалами для технологического и биомедицинского применения. В последнее время карборанилзамещенные порфирины рассматриваются в качестве перспективных агентов для бор-нейтронозахватной терапии злокачественных опухолей.
В настоящей работе проанализированы особенности строения комплексов цинка(II) и кадмия(II) с кластерными анионами бора [BnHn]2– (n = 6, 10, 12), их замещенными производными и аналогами (металлобораны, металлакарбораны), рассмотрено влияние условий реакций на состав и строение конечных продуктов.
Список литературы
Кузнецов Н.Т., Ионов С.П., Солнцев К.А. Развитие концепции ароматичности: полиэдрические структуры. М.: Наука, 2009. 488 с.
Sivaev I.B. // Chem. Heterocycl. Comp. 2017. V. 53. P. 638. https://doi.org/10.1007/s10593-017-2106-9
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1021/cr050548u
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. P. 679. https://doi.org/10.1135/cccc20020679
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. № 5. P. 60. https://doi.org/10.3390/cryst6050060
Avdeeva V.V., Malinina E.A., Goeva L.V., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2148. https://doi.org/10.1134/S0036023610140032
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 514. https://doi.org/10.1134/S0036023620040026
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 335. https://doi.org/10.1134/S003602362003002X
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Korolenko S.E., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 5. P. 297. https://doi.org/10.1134/S1070328420050024
Greenwood N.N. // J. Chem. Soc. A. 1968. P. 15. https://doi.org/10.1039/J19680000015
Greenwood N.N., Travers N.F. // J. Chem. Soc. A. 1967. P. 880. https://doi.org/10.1039/J19670000880
Greenwood N.N., McGinnety J.A., Owen J.D. // J. Chem. Soc. A. 1971. P. 809. https://doi.org/10.1039/J19710000809
Greenwood N.N., McGinnety J.A., Owen J.D. // J. Chem. Soc., Dalton Trans. 1972. P. 989. https://doi.org/10.1039/DT9720000989
Littger R., Englich U., Spencer J.T. // Inorg. Chem. 1997. V. 36. P. 6434. https://doi.org/10.1021/ic970190n
Lee J.-D., Han W.-S., Kim T.-J. et al. // Chem. Commun. 2011. V. 47. P. 1018. https://doi.org/10.1039/C0CC03787G
Kirchmann M., Eichele K., Wesemann L. // Inorg. Chem. 2008. V. 47. P. 5988. https://doi.org/10.1021/ic800357z
Gädt T., Wesemann L. // Organometallics. 2007. V. 26. P. 2474. https://doi.org/10.1021/om061042k
Dontha R., Zhu T.-Ch., Shen Y. et al. // Angew. Chem. Int. Ed. 2019. V. 58. P. 19007. https://doi.org/10.1002/anie.201910568
Schaper T., Preetz W. // Inorg. Chem. 1998. V. 37. P. 363. https://doi.org/10.1021/ic971039g
Korolenko S.E., Kubasov S.E., Goeva L.V. et al. // Inorg. Chim. Acta. 2021. V. 520. P. 120315. https://doi.org/10.1016/j.ica.2021.120315
Korolenko S.E., Malinina E.A., Avdeeva V.V. et al. // Polyhedron. 2021. V. 194. P. 114902. https://doi.org/10.1016/j.poly.2020.114902
Wehmschulte R.J., Wojtas L. // Inorg. Chem. 2011. V. 50. P. 11300. https://doi.org/10.1021/ic201921d
Liguo Y., Xin W., Yongsheng N. et al. // Z. Kristallogr. NCS. 2019. V. 234. P. 295. https://doi.org/10.1515/ncrs-2018-0353
Goeta A.E., Howard J.A.K., Hughes A.K. et al. // Chem. Commun. 1998. P. 1713. https://doi.org/10.1039/A804305A
Prokhorov A.M., Slepukhin P.A., Rusinov V.L. et al. // Tetrahedron Lett. 2008. V. 49. P. 3785. https://doi.org/10.1016/j.tetlet.2008.04.008
Xin W., Liguo Y., Qianqian G., Yuqiang D. // Z. Kristallogr. NCS. 2016. Open Access. https://doi.org/10.1515/ncrs-2016-0155
Rodriguez-Hermida S., Tsang M.Y., Vignatti C. et al. // Angew. Chem. Int. Ed. 2016. V. 55. P. 1. https://doi.org/10.1002/anie.201609295
Boldog I., Bereciartua P.J., Bulánek R. et al. // CrystEngComm. 2016. V. 18. P. 2036. https://doi.org/10.1039/C5CE02501J
Farha K.O., Spokoyny A.M., Mulfort K.L. et al. // J. Am. Chem. Soc. 2007. V. 129. P. 12680. https://doi.org/10.1021/ja076167a
Tsang M.Y., Rodriguez-Hermida S., Stylianou K.C. et al. // Cryst. Growth Des. 2017. V. 17. P. 846. https://doi.org/10.1021/acs.cgd.6b01682
Spokoyny A.M., Farha K.O., Mulfort K.L. et al. // Inorg. Chim. Acta. 2010. V. 364. P. 266. https://doi.org/10.1016/j.ica.2010.08.007
Surikova M.A., Baryshnikova E.A., Bekasova N.I. et al. // Polymer Science, Ser. C. 2009. V. 51. P. 74. https://doi.org/10.1134/S1811238209010123
Oleshkevich E., Romero I., Teixidor F., Viñas C. // Dalton Trans. 2018. V. 47. P. 14785. https://doi.org/10.1039/C8DT03264E
Dou J., Zhang D., Li D., Wang D. // Eur. J. Inorg. Chem. 2007. P. 53. https://doi.org/10.1002/ejic.200600679
Vicente M.G.H., Nurco D.J., Shetty Sh.J. et al. // Chem. Commun. 2001. P. 483. https://doi.org/10.1039/B100231G
Vicente M.G.H., Nurco D.J., Shetty Sh.J. // J. Photochem. Photobiol., B. 2002. V. 68. P. 123. https://doi.org/10.1016/S1011-1344(02)00383-4
Vicente M.G.H., Wickramasinghe A., Nurco D.J. et al. // Bioorg. Med. Chem. 2003. V. 11. P. 3101. https://doi.org/10.1016/S0968-0896(03)00240-2
Clark J.C., Fronczek Fr.R., Vicente M.G.H. // Tetrahedron Lett. 2005. V. 46. P. 2365. https://doi.org/10.1016/j.tetlet.2005.02.077
Wang J.-Q., Ren Ch.-X., Weng L.-H. et al. // Chem. Commun. 2006. P. 162. https://doi.org/10.1039/B512416F
Berksun E., Atsay A., Özçeşmeci I. et al. // Inorg. Chem. Front. 2018. V. 5. P. 200. https://doi.org/10.1039/C7QI00608J
Zimmermann L.W., Schleid T. // Z. Kristallogr. 2013. V. 228. P. 558. https://doi.org/10.1524/zkri.2013.1634
Tiritiris I., Schield T. // Z. Anorg. Allg. Chem. 2005. V. 631. P. 1593. https://doi.org/10.1002/zaac.200500093
Nguyen Duc Van // New salt-like dodecahydro-closo-dodecaborates and efforts for the partial hydroxylation of [B12H12]2– anions. Institut fur anorganische Chemie der Universitat, Stuttgart, 2009.
Короленко С.Е., Гоева Л.В., Кубасов А.С. и др. // Журн. неорган. химии. 2020. Т. 65. № 6. С. 778. [Korolenko S.E., Goeva L.V., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 846. https://doi.org/10.1134/S0036023620060091]
Малинина Е.А., Короленко С.Е., Гоева Л.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1543. [Malinina E.A., Korolenko S.E., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1552. https://doi.org/10.1134/S0044457X18120140]
Малинина Е.А., Дроздова В.В., Гоева Л.В и др. // Журн. неорган. химии. 2007. Т. 52. С. 922. [Malinina E.A., Drozdova V.V., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2007. V. 52. P. 854. https://doi.org/10.1134/S003602360706006X]
Zhang Z., Zhang Y., Li Zh. et al. // Eur. J. Inorg. Chem. 2018. V. 8. P. 981. https://doi.org/10.1002/ejic.201701206
Guggenberger L.J. // Inorg. Chem. 1969. V. 8. P. 2771. https://doi.org/10.1021/ic50082a046
Renard S.L., Franken A., Kilner C.A. et al. // New J. Chem. 2002. V. 26. P. 1634. https://doi.org/10.1039/B207966F
Carruthers Ch., Fisher J., Harding L.P., Hardie M.J. // Dalton Trans. 2010. V. 39. P. 355. https://doi.org/10.1039/B914285A
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии