Журнал неорганической химии, 2021, T. 66, № 9, стр. 1176-1184
Возможности фиксации молекулярного азота карбонильными кластерами платиновых металлов в низших степенях окисления (обзор)
И. В. Федосеев a, *, В. В. Васекин a, А. В. Шевельков b
a Акционерное общество “Научно-производственный комплекс “Суперметалл” им. Е.И. Рытвина”
115184 Москва, Озерковская наб., 22/24, корп. 2, Россия
b Химический факультет, Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: prof.igor.fedoseev@gmail.com
Поступила в редакцию 25.03.2021
После доработки 05.04.2021
Принята к публикации 07.04.2021
Аннотация
Вниманию читателей предлагается миниобзор, в котором представлены результаты, показывающие возможность фиксации молекулярного азота карбонильными кластерными соединениями платиновых металлов при комнатной температуре и атмосферном давлении с получением аммиака или его производных. Хотя основное внимание уделено процессам с участием производных платины и палладия, показано, что процесс фиксации молекулярного азота характерен для всех платиновых металлов, кроме осмия.
ВВЕДЕНИЕ
Термин “фиксация азота” фигурирует в химической литературе уже несколько десятилетий. Его определение дано академиком А.Е. Шиловым: “под фиксацией азота мы понимаем процесс, связанный с полным или частичным разрывом связи N≡N. Этот процесс может быть окислением или восстановлением азота в зависимости от того, больше или меньше, чем у азота, электроотрицательность атомов, образующих с ним связь. … Однако большинство известных в настоящее время реакций с азотом, которые происходят, можно назвать восстановительными” [1].
Фиксация азота может быть как единичным актом, так и процессом, который можно представить схемой 1 , детали которой могут различаться, например, в циклах Чатта и Шрока [2]:
Схема 1 .
Единичный акт фиксации азота заканчивается образованием его соединения с той или иной величиной формального заряда атома N и комплекса(ΙΙΙ). Для протекания процесса фиксации N2 необходима регенерация комплекса(ΙΙΙ) в исходное соединение – комплекс(Ι), т.е. протекание каталитического процесса. В обоих случаях для фиксации азота должны быть выполнены два условия: необходимое – образование комплекса, содержащего N2-лиганд, и достаточное – возможность у комплекса с N2-лигандом к восстановительному или окислительному действию по отношению к N2-лиганду.
Первое сообщение о возможности связывания молекулярного азота в мягких условиях было сделано отечественными химиками в 1964 г. [3], а в 1965 г. был впервые получен комплекс, содержащий N2-лиганд [4].
Эти сообщения вызвали большой интерес международного химического сообщества, и исследования в этом направлении начали интенсивно проводиться как в нашей стране, так и за рубежом. В частности, в Англии эти исследования проводились под руководством Чатта. Одним из направлений в этих исследованиях были попытки химического моделирования природного процесса фиксации атмосферного азота под действием нитрогеназы.
Первые результаты исследований по синтезу комплексных соединений переходных металлов, содержащих N2-лиганды, вызвали большой оптимизм, который выразили авторы работы [5]: “Сейчас, когда мы начинаем понимать природу связи переходного металла с N2, можно быть уверенным, что гомогенно-каталитическое превращение азота в аммиак в промышленных масштабах – дело недалекого будущего”.
Однако многолетние работы многих исследователей в разных сферах не дали положительного результата в этом направлении. Подробный анализ сложившейся негативной ситуации в фиксации азота в мягких условиях был дан в работе [6], которую автор озаглавил “All quiet on the N2 front”, но завершил ее словами “But things are most certainly happening, and it is not unreasonable to hope that a renaissance of N2 chemistry is on the horizon”.
В то же время исследования по фиксации азота привели к большим успехам в развитии химии комплексных соединений, содержащих N2-лиганды, что было отражено в обзорных статьях [1, 2, 7, 8].
Новый этап в развитии работ по фиксации молекулярного азота открыла статья Яндулова и Шрока [9], в которой впервые была показана возможность прохождения полного цикла фиксации и восстановления молекулярного азота с образованием аммиака при использовании комплексов молибдена в качестве катализаторов. При этом все реакции протекали в гомогенной системе при атмосферном давлении и комнатной температуре, но в сильно восстановительных условиях.
Дальнейшее развитие работ Шрока заключалoсь в переходе от аминокомплексов молибдена к тридентатным “пинцетным” PNP-лигандам, где символ PNP указывает на два атома фосфора и один атом азота, предоставляемые каждым лигандом для связи с молибденом. В работах Нишибаяши показано, что с использованием таких комплексов реакция с молекулярным азотом происходит при атмосферном давлении и комнатной температуре и приводит к выделению аммиака с большой эффективностью [10–13].
Связывание молекулярного азота комплексами других переходных металлов также исследовалось. В числе исследованных металлов отмечены элементы первого переходного ряда от ванадия до никеля, вольфрам как аналог молибдена, а также рений. Однако эффективность каталитических процессов, приводящих к получению аммиака или его производных, оказалась невысокой [14–18]. Удивительно, но в литературе практически отсутствует упоминание о каталитической активности комплексов платиновых металлов в реакциях фиксации молекулярного азота и его превращения в аммиак.
Многие работы по связыванию молекулярного азота основаны на копировании биологических процессов, где фиксация молекулярного азота и его превращение в аммонийные производные происходят на нитрогеназе – природном ферменте, содержащем комплексные соединения железа-молибдена. И хотя полный механизм природного процесса не известен и, очевидно, очень сложен, поскольку включает несколько действующих веществ, включая АТФ, много статей публикуется и в настоящее время; они посвящены разработке новых комплексов, имитирующих работу нитрогеназы. Эти исследования затрагивают получение новых железосодержащих комплексов, исследование механизма реакций с молекулярным азотом, включая аспекты электрохимических процессов, и кинетики образования и разрушения комплексов, исследование особенностей химической связи в новых соединениях и влияния природы лигандов на каталитическую активность комплексов, а также расчеты молекулярных постоянных и энергии связи [19–21].
Кроме того, в последние годы в литературе стали появляться статьи, посвященные другим методам фиксации молекулярного азота. В качестве альтернативных катализаторов восстановления молекулярного азота рассматриваются гетерополисоединения вольфрама [22] и даже комплексы актинидов [23, 24]. Разумеется, последние могут не найти применения из-за радиоактивности. Кроме того, в качестве альтернативных методик рассматривается восстановление азота соединениями непереходных элементов, например бора и углерода [25, 26].
В настоящем миниобзоре суммируются результаты работ, посвященных исследованию процесса преобразования молекулярного азота в аммиак с использованием карбонильных производных платиновых металлов, с целью привлечь внимание к перспективному и мало разработанному методу низкотемпературного синтеза аммиака.
НЕКОТОРЫЕ ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ ПРОЦЕССА ФИКСАЦИИ АЗОТА
Для вхождения во внутреннюю сферу комплекса молекулы N2 необходимо наличие в этом комплексе вакантного места либо образование такового в результате лабильности уже имеющихся лигандов.
В ряде исследований было показано, что весьма высокой лабильностью обладают СО-лиганды в плоскоквадратных карбонилхлоридных комплексах Rh(Ι), Ir(Ι), Pt(ΙΙ) [27–31].
В то же время ряд карбонильных комплексов платиновых металлов в низших степенях окисления являются кластерами и олигомерами [32, 33], т.е. представляют собой системы, имеющие высоколабильные СО-лиганды и обладающие электронной достаточностью для акта восстановления с участием шести электронов, необходимых для фиксации N2 до 2NH3. Этому процессу способствует активация молекулы N2 при eе переходе из свободного состояния в лигандное, что проявляется в значительном снижении частот колебаний νNN, которые лежат в области 1922–2220 см–1 для биядерных комплексов, в то время как для хемосорбированного на платине азота найдено значение νNN = 2238 ± 1 см–1 [34].
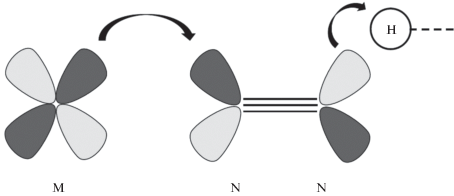
С точки зрения орбитальных взаимодействий образование комплекса с молекулярным азотом включает прямое σ-донорное взаимодействие ${\text{M}} \leftarrow {\text{N}}{\kern 1pt} \equiv {\kern 1pt} {\text{N}}$ и обратное донирование по π-системе ${\text{M}} \to {\text{N}}{\kern 1pt} \equiv {\kern 1pt} {\text{N}}$ (схема 2 ). В результате происходит уменьшение прочности и поляризация связи азот–азот, благодаря чему повышается вероятность взаимодействия атомов азота и водорода [35].
Схема 2 .
Фиксация азота с участием 6e– может протекать по реакции:
(1)
${{{\text{N}}}_{{\text{2}}}} + {\text{6}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{6}}{{e}^{--}} \to {\text{2N}}{{{\text{H}}}_{{\text{3}}}} + {\text{6O}}{{{\text{H}}}^{--}}.$Реакция (1) требует значительно более слабого восстановителя, чем восстановление до гидразина [1]. Известно, что лигандные молекулы СО находятся в активированном состоянии и могут участвовать во внутрисферном гидролитическом редокс-процессе:
(2)
${\text{CO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}^{ + }} + {\text{2}}{{e}^{--}}.$Возможно, что при наличии в одном комплексе CO- и N2-лигандов реакции (1) и (2) будут протекать одновременно, что можно выразить общим уравнением:
(3)
${\text{3СО}} + {{{\text{N}}}_{{\text{2}}}} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{2N}}{{{\text{H}}}_{{\text{3}}}} + {\text{3C}}{{{\text{O}}}_{{\text{2}}}}.$Термодинамически реакция (3) возможна, так как для нее ΔG° = –89.14 кДж/моль.
Реакцию (3) можно рассматривать как моделирующую природный процесс фиксации азота с участием нитрогеназы, что можно выразить уравнением:
(4)
${\text{3С}}{\kern 1pt} * + \,\,{{{\text{N}}}_{{\text{2}}}} + \frac{3}{2}{{{\text{O}}}_{{\text{2}}}} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{2N}}{{{\text{H}}}_{{\text{3}}}} + {\text{3C}}{{{\text{O}}}_{{\text{2}}}},$Наличие в ряде карбонильных комплексов платиновых металлов кластерного металлоостова Mx(CO)y с низшей или нулевой степенью окисления металла (например, Pdx(CO)yClz, где z < x и степень окисления Pd(+1)) и лабильными СО-лигандами создает необходимые и достаточные условия для внутрисферной восстановительной фиксации азота в мягких условиях.
В то же время наличие активных молекул СО-лигандов в таких системах делает возможным процесс окислительной фиксации азота за счет следующих реакций:
1. Окисление СО-лигандов кислородом воздуха:
(5)
${\text{СО}} + {{{\text{О}}}_{{\text{2}}}} = {\text{С}}{{{\text{О}}}_{{\text{2}}}} + {\text{О}}.$2. Окисление N2 атомарным кислородом:
Сочетание реакций (5) и (6) дает
(8)
${\text{CO}} + {{{\text{N}}}_{{\text{2}}}} + {{{\text{O}}}_{{\text{2}}}} = {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{N}}}_{{\text{2}}}}{\text{O}},$Реакции (8) и (9) термодинамически возможны – величины ΔG° для них составляют соответственно –156.6 и –139.9 кДж/моль. Однако здесь возможна и такая реакция:
для которой ΔG° = –197.9 кДж/моль.РЕЗУЛЬТАТЫ НЕКОТОРЫХ ЭКСПЕРИМЕНТОВ
Систематические исследования по карбонильным комплексам платиновых металлов (ПМ) на кафедре неорганической химии химического факультета МГУ им. М.В. Ломоносова в 1963 г. начались под руководством академика В.И. Спицина.
Были изучены кинетика и механизм образования карбонилхлоридных комплексов при взаимодействии монооксида углерода СО с кристаллическими хлоридами платиновых металлов и растворами их хлорокомплексов, а также некоторые свойства этих соединений и возможности их технологического применения. Полученные результаты были опубликованы в ряде статей и суммированы в монографиях [36, 37].
Синтез карбонильных комплексов ПМ проводили действием монооксида углерода (СО) как на кристаллические хлориды ПМ, так и на растворы их хлорокомплексов. Первоначально происходит образование карбонильных комплексов без изменения степени окисления металла, но в присутствии Н2О или ее паров протекают внутрисферные редокс-процессы, приводящие к окислению СО до СО2 и восстановлению металла до низшей или нулевой степени окисления.
Монооксид углерода получали действием муравьиной кислоты на горячую серную кислоту и собирали СО в газометр.
В экспериментах использовали азот, полученный химическим путем по известным методикам, а также химически чистый азот из баллона.
Палладий
При обработке сухой соли PdCl2 или раствора H2PdCl4 монооксидом углерода при атмосферном давлении первоначально протекают следующие реакции:
(11)
${\text{PdC}}{{{\text{l}}}_{{\text{2}}}} + {\text{СО}} \to {\text{PdСОC}}{{{\text{l}}}_{{\text{2}}}},$Под действием воды или ее паров протекают редокс-процессы, приводящие к восстановлению Pd2+ до нулевой степени окисления и выделению ее в форме Pd-черни:
(13)
${\text{PdCOC}}{{{\text{l}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Pd}} + {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{2HCl,}}$(14)
${\text{PdCOCl}}_{3}^{ - } + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Pd}} + {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{2HCl}} + {\text{C}}{{{\text{l}}}^{--}}.$В обоих случаях восстановление Pd2+ → Pd0 протекает через ряд промежуточных стадий с образованием кластерных карбонильных комплексов общего состава Pdx(CO)yClz со степенями окисления Pd ≤ (+1). Подобные соединения описаны в работе [38]. Как показали наши исследования, Pd-чернь не является чистым металлом, она содержит также аморфные углеродные фазы [39].
Присутствие кластерной структуры с атомами палладия в низшей степени окисления и лабильных СО-лигандов обусловливает способность этих комплексов присоединять молекулы N2 в качестве лигандов, а затем реализовывать акт восстановительной фиксации азота с образованием NH3 и нового комплекса, в котором атомы Pd имеют степень окисления >(+1).
Такие комплексы способны присоединять молекулы СО, после чего за счет внутрисферного редокс-процесса в присутствии воды переходить в исходное состояние, где степень окисления Pd ≤ (+1).
Обобщение уравнений (13) и (14) дает общее уравнение образования Pd-черни при обработке раствора H2PdCl4 монооксидами углерода:
(15)
${{{\text{H}}}_{{\text{2}}}}{\text{PdC}}{{{\text{l}}}_{{\text{4}}}} + {\text{CO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Pd}} + {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{4HCl}}.$Реакция (15) имеет некоторый период индукции τинд – время от начала обработки раствора до появления черни.
Нами была обнаружена способность азота задерживать скорость протекания реакции (15) при обработке раствора H2PdCl4 газовой смесью СО + N2. В эксперименте два одинаковых по составу раствора H2PdCl4 обрабатывали в одинаковых условиях: один раствор газовой смесью СО + + СО2, а другой – газовой смесью СО + N2 и определяли τинд для каждого раствора и степень извлечения палладия в виде Pd-черни.
Условия проведения эксперимента и полученные результаты приведены в табл. 1. Видно, что с повышением содержания азота в газовой смеси N2 + СО происходит заметное уменьшение скорости восстановления палладия и снижение степени его осаждения в виде Pd-черни по сравнению с этими же параметрами, полученными при исследовании смеси СО + СО2 с одинаковой величиной РСО.
Таблица 1.
Результаты обработки растворов H2PdCl4 смесью газов СО + СО2 (Ι) и СО + N2 (ΙΙ). Состав растворов: Pd(II) – 175 мг/л, HCl – 2 М, NaCl – 5 г/л, t = 50°C, атмосферное давление, интенсивное перемешивание, время обработки 3 ч
| рСО, об. % | 100 | 70 | 50 | 33 | 16 | 8 | 4.5 | 3.8 | |
|---|---|---|---|---|---|---|---|---|---|
| τинд, с | τI | 62 | 62 | 64 | 66 | 69 | 76 | 122 | – |
| τII | 62 | 62 | 65 | 67.5 | 70.5 | 135 | 148 | 232 | |
| Извлечение в осадок Pd, % для газовых смесей I и II | |||||||||
| I | 99.2 | 99.3 | – | 97.6 | 97.0 | 93.9 | 86.2 | – | |
| II | 99.2 | 98.6 | 98.0 | 96.8 | 89.7 | 83.2 | – | – | |
Такое влияние азота на процесс восстановления Pd(II) → Pd(0) при действии СО на раствор H2PdCl4 должно быть связано с участием молекулы N2 в редокс-процессе карбонилхлоридного нанокластера ${\text{P}}{{{\text{d}}}_{x}}{{({\text{CO}})}_{y}}{\text{Cl}}_{z}^{{n--}},$ что приводит к увеличению степени окисления атомов Pd в металлоостове Pdx(CO)y и восстановлению N2-лигандов с фиксацией азота в форме аммиака.
Возможность протекания такого процесса была подтверждена экспериментально. Через раствор H2PdCl4 в 2 М HCl при Pd(II) = 10 г/л барботировали при интенсивном перемешивании смесь СО + N2 в объемном соотношении 5 : 8 при комнатной температуре. Через 3.5 мин начиналось помутнение раствора, но развивалось оно медленно – даже через 30 мин раствор оставался окрашенным. Через 1 ч 20 мин подача смеси СО + N2 была прекращена. Раствор имел желтую окраску, что характерно для карбонилхлоридных растворов палладия в низших степенях окисления. Затем этот раствор обрабатывали СО при комнатной температуре в течение 15 мин. Происходило выделение Pd-черни и обесцвечивание раствора. После фильтрации был получен бесцветный раствор. При его упаривании досуха был получен белый с желтоватым оттенком кристаллический осадок массой 5.0 мг. При добавлении к нему раствора H2PtCl6 сразу же образовывался желтый кристаллический осадок (NH4)2PtCl6.
В другом эксперименте использовали раствор 137 мг PdCl2 (получен растворением Pd-черни в HCl действием Cl2) в 50 мл 1 М HCl, через который барботировали при интенсивном перемешивании при комнатной температуре газовую смесь СО + N2 в объемном соотношении 1 : 1 в течение 1 ч 45 мин. Раствор становился мутным, но не черным. Затем раствор обрабатывали СО в тех же условиях в течение 15 мин и наблюдали выделение Pd-черни и обесцвечивание раствора. При его упаривании до малого объема раствор становился желтым, а после упаривания досуха был получен кристаллический желто-коричневый осадок, который обрабатывали раствором H2PtCl6 – сразу образовывались желтые кристаллы (NH4)2PtCl6.
Полученные результаты подтверждают протекание процесса фиксации азота с образованием аммиака в системе H2PdCl4–HCl–H2O–(CO + N2).
Платина
При обработке раствора H2PtCl6 монооксидом углерода при атмосферном давлении и t ≤ 80°C происходит восстановление Pt(ΙV) до Pt(0) и выделение осадка олигомерного дикарбонила платины [Pt(CO)2]n, где n кратно трем. Кинетика и механизм образования карбонила платины (КП) описаны в работе [40].
По данным [41], молекулы этого олигомера представляют собой треугольные структуры с атомами Pt в вершинах, где длина связи Pt–Pt составляет 3.222 Å. В свою очередь, эти треугольные структуры соединены между собой связями Pt–Pt длиной 3.263 Å, в то время как в металле длина связи Pt–Pt составляет 2.775 Å [42]. Молекулы СО представлены концевыми и μ2-СО состояниями с длинами связей С–О 1.13 и 1.29 Å соответственно [41].
В наших экспериментах образцы карбонила платины [Pt(CO)2]n были получены обработкой растворов H2PtCl6 в 2 М HCl монооксидом углерода при атмосферном давлении, интенсивном перемешивании и t = 60°C в течение 4 ч, что обеспечивало практически полное осаждение Pt в форме КП, который отделяли фильтрацией при пониженном давлении в атмосфере СО и хранили в атмосфере СО.
Для одного из таких образцов КП были сняты ИК-спектры сразу же после извлечения из атмосферы СО и затем после контакта с воздухом в течение определенного времени.
Из табл. 2 видно, что контакт с воздухом приводит к быстрому изменению ИК-спектра образца КП, что может быть следствием высокой лабильности СО-лигандов, а также окислением последних до СО2. Этот процесс интенсивно протекает на сухом КП, что приводит к образованию Pt-губки, которая разогревается до белого каления.
Таблица 2.
ИК-спектры карбонила платины [Pt(СО)2]n до и после контакта с воздухом
| № образца | Образец КП | ν, см–1 |
|---|---|---|
| 1 | КП – данные [17] | 2050, 1865, 445–450 |
| 2 | Синтезированный КП при хранении в атмосфере СО | 2060, 1865, 470 |
| 3 | Синтезированный КП, отфильтрован на воздухе из кислой среды. Время контакта с воздухом, мин: |
|
| 10 | 2060, 1885, 1815, 1635, 470 | |
| 35 | 2060, 1885, 1815, 1635, 470 | |
| 55 | 2060, 1885, 1815, 470 | |
| 75 | 2060, 1885 оч. сл, 1815, 470 | |
| 100 | 2060 сл. | |
| 145 | 2060 оч. сл |
Изменение ИК-спектра КП может быть связано также с изменением элементарного состава КП в результате замены CO- на N2-лиганды, что проявляется в появлении частоты ν = 1815 см–1.
Некоторые детали термолиза КП на воздухе приведены в нашей работе [43], где показано, что даже при прокаливании на воздухе образца КП в нем помимо Pt присутствует углерод.
При хранении суспензии КП в 2 М НCl наблюдалось окрашивание бесцветного раствора в желтый цвет, что характерно для карбонилхлоридных комплексов Pt в низших степенях окисления [44], в частности, для раствора ${\text{PtСОCl}}_{3}^{ - }.$ Последний разлагается под действием щелочи по реакции:
Эти же реакции наблюдались при обработке желтого раствора, отделенного от КП после контакта с воздухом, щелочью и СО.
Другой образец суспензии КП в 2 М НCl хранили в течение 20 ч в атмосфере N2. Здесь также наблюдалось образование желтого раствора, из которого действием СО осаждали КП, и после фильтрации был получен бесцветный раствор. При добавлении к нему раствора H2PtCl6 осаждались желтые кристаллы (NH4)2[PtCl6].
Образование аммиака при контакте пульпы КП в 2 М НCl с азотом возможно в результате следующих процессов:
1. Внедрение молекулы N2 во внутреннюю сферу КП в результате лигандного обмена:
(16)
${\text{P}}{{{\text{t}}}_{n}}{{({\text{СО}})}_{{{\text{2}}n}}} + {{{\text{N}}}_{{\text{2}}}} \to {\text{P}}{{{\text{t}}}_{n}}{{({\text{СО}})}_{{{\text{2}}n{\text{ }}--{\text{ 1}}}}}{{{\text{N}}}_{{\text{2}}}} + {\text{CO}}.$2. Фиксация молекулы N2 за счет шести электронов кластера Ptn:
(17)
$\begin{gathered} {\text{P}}{{{\text{t}}}_{n}}{{\left( {{\text{СО}}} \right)}_{{2n - 1}}}{{{\text{N}}}_{{\text{2}}}} + {\text{6}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to \\ \to {\text{P}}{{{\text{t}}}_{{n - 3}}}{{\left( {{\text{СО}}} \right)}_{{2n - 1}}} + {\text{3P}}{{{\text{t}}}^{{{\text{2}} + }}} + {\text{2N}}{{{\text{H}}}_{{\text{3}}}} + {\text{6О}}{{{\text{Н}}}^{--}}. \\ \end{gathered} $3. Регенерация исходного КП:
(18)
$\begin{gathered} {\text{P}}{{{\text{t}}}_{{n - 3}}}{{\left( {{\text{СО}}} \right)}_{{2n - 1}}} + {\text{3P}}{{{\text{t}}}^{{{\text{2}} + }}} + {\text{4СО}} + {\text{3}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to \\ \to {\text{P}}{{{\text{t}}}_{n}}{{\left( {{\text{СО}}} \right)}_{{2n}}} + {\text{3С}}{{{\text{О}}}_{{\text{2}}}} + {\text{6}}{{{\text{Н}}}^{ + }}. \\ \end{gathered} $В результате реакции (15) система способна к повторению реакций (16), (17), (18), т.е. протекает процесс фиксации N2, где катализатором служит олигомерный карбонил платины [Ptn(СО)2n].
Суммируя реакции (13)–(15), получаем уравнение, которое описывает процесс фиксации атмосферного азота с образованием аммиака в мягких условиях, катализатором которой служит олигомерный карбонил платины:
(19)
${\text{3СО}} + {\text{3}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {{{\text{N}}}_{{\text{2}}}}~\xrightarrow{{[{\text{P}}{{{\text{t}}}_{n}}{{{({\text{CO)}}}}_{{2n}}}]}}{\text{2N}}{{{\text{H}}}_{{\text{3}}}} + {\text{3С}}{{{\text{О}}}_{{\text{2}}}}.$Реакцию (19) можно рассматривать как химическое моделирование природного процесса, протекающего в мягких условиях под действием нитрогеназы.
В другом эксперименте был использован раствор [Pt(СО)2]n в 5 М NaOH при [Pt(0)] ≈ 5 г/л, через который барботировали смесь СО + воздух в разных соотношениях. По окончании времени обработки определяли содержание окисленных форм азота (нитраты, нитриты) в щелочном растворе по методу Кьельдаля. Условия проведения экспериментов и полученные данные приведены в табл. 3. Видно, что увеличение содержания СО в смеси с воздухом приводит к снижению количества окисленного азота, что, возможно, является результатом восстановления этих форм азота под действием СО в соответствии с реакцией (10).
Таблица 3.
Условия обработки раствора [Pt(СО)2]n в 5 М NaOH газовой смесью СО + воздух и найденное количество связанного азота, [Pt(0)] ≈ 5 г/л
| № п/п | Условия обработки | Найдено окисленных форм азота в расчете на выделенный NH3, мг | ||
|---|---|---|---|---|
| соотношение СО : воздух, об. % | t, °С | время, мин | ||
| 1 | 1 : 10 | 20 | 60 | 80 |
| 2 | 1 : 5 | 70–80 | 70 | 52 |
| 3 | 10 : 1 | 20 | 70 | 2 |
Редкие платиновые металлы – родий, рутений, иридий
При обработке солянокислых растворов хлорокомплексов Rh(III), Ru(ΙV) и Ir(ΙV) (H2RhCl6, H2RuCl6 и H2IrCl6 соответственно) монооксидом углерода при атмосферном давлении и t = 60–90°C происходит превращение хлорокомплексов в карбонилхлоридные комплексы и восстановление металлов: Rh(III) → Rh(I) $\left( {{\text{Rh}}{{{\left( {{\text{СО}}} \right)}}_{{\text{2}}}}{\text{Cl}}_{2}^{ - }} \right),$ Ru(IV) → Ru(II) $\left( {{\text{Ru}}{{{\left( {{\text{СО}}} \right)}}_{{\text{2}}}}{\text{Cl}}_{4}^{{2 - }}} \right)$ и Ir(IV) → Ir(I) $\left( {{\text{Ir}}{{{\left( {{\text{СО}}} \right)}}_{{\text{2}}}}{\text{Cl}}_{2}^{ - }} \right).$ Это сопровождается переходом исходных окрасок красных тонов в бледно-желтые и уменьшением исходных значений соответствующих окислительно-восстановительных потенциалов до отрицательных величин по хлорсеребряному электроду.
При обработке растворов карбонилхлоридных комплексов Rh(Ι), Ru(ΙΙ) и Ir(Ι) воздухом при нагревании происходило изменение окраски до розовых тонов и увеличение окислительно-восстановительных потенциалов. Аналогичное явление наблюдалось и при обработке этих растворов азотом.
При обработке солянокислых растворов H3RhCl6 в 1 M HCl монооксидом углерода при атмосферном давлении и t = 80°C происходит восстановление Rh(III) → Rh(0) и выделение черни, в которой, по данным растровой электронной микроскопии, помимо родия содержится углерод. При действии СО на кристаллогидрат RhCl3 · Н2О первоначально происходит восстановление Rh(III) → Rh(I) и образование димерного карбонилхлорида [Rh(СО)2Cl]2 [45]. Дальнейшая обработка этого комплекса увлажненным СО приводит к образованию черни общего состава Rhх(СО)уClz, где степень окисления Rh ≤ (+1). Этот продукт помещали в трубчатую печь, через которую пропускали газовую смесь СО + N2 + Н2О + НCl в соотношении СО : N2 ~ 1 : 1 при t = 215°C в течение 5 ч. Отходящие газы барботировали через воду, которую меняли через каждый час обработки и упаривали до малого объема, куда вводили раствор H2PtCl6. Каждый раз наблюдали образование небольшого количества желтых кристаллов (NH4)2[PtCl6].
После окончания эксперимента продукт представлял собой черный порошок, частично растворимый в воде с появлением желтой окраски, что характерно для карбонилхлоридных комплексов Rh(I). ИК-спектр этого продукта показал наличие полос при ν = 2082 (острый, но не сильный пик) и 840 см–1 (широкая, но слабая полоса).
В работе [46] была использована система, полученная обработкой раствора ${\text{Rh}}{{({\text{CO}})}_{{\text{2}}}}{\text{Cl}}_{2}^{ - }$ + + ${\text{Ru}}{{({\text{CO}})}_{{\text{2}}}}{\text{Cl}}_{4}^{{2 - }}$ и ${\text{Ir}}{{({\text{CO}})}_{{\text{2}}}}{\text{Cl}}_{2}^{ - }$ в NaOH до величины pH 12. Через этот раствор при атмосферном давлении и t = 70–80°C барботировали газовую смесь CO + N2 при объемном содержании N2 от 20 до 44%. Отходящие газы барботировали через 0.1 M HCl с последующим титрованием. В зависимости от времени обработки, скорости подачи газовой смеси и ее состава выход NH3 от объема пропущенного через раствор N2 составил от 0.31 до 0.71%.
Следует отметить, что в щелочной среде карбонилхлоридные комплексы претерпевают изменения с уменьшением степени окисления металла. Так, ранее [46] было показано, что карбонилхлорид Rh(Ι) претерпевает следующие превращения:
Здесь в качестве исходного использовали раствор [Rh(CO)2Cl]2 в органических растворителях в присутствии воды.
ЗАКЛЮЧЕНИЕ
Современное производство аммиака исчисляется миллионами тонн, его производство в процессе Боша–Габера является чрезвычайно энергозатратным, на него расходуется ~3% всей используемой мировой энергии [47]. Этим обусловлены поиски новых методов синтеза аммиака из азота, которые можно было бы использовать в промышленном масштабе с принципиально меньшими энергетическими затратами.
За исключением отдельных высокотемпературных технологий, использующих холодную плазму [48], почти все разрабатываемые подходы основаны на реакциях связывания молекулярного азота при комнатной температуре и нормальном давлении с помощью различных комплексов переходных металлов. Любопытно, что имеющиеся в литературе примеры получения аммиака фиксацией молекулярного азота карбонильными производными платиновых металлов остаются практически незамеченными, они не обсуждаются в современной литературе, а важный этапный обзор 2013 г. их даже не упоминает [2].
Тем не менее очевидно, что фиксация молекулярного азота карбонильными соединениями платиновых металлов в низших степенях окисления имеет перспективы. К достоинствам метода относятся в первую очередь простота реализации процесса и его 100%-ная воспроизводимость. Необходимость использования платиновых металлов не может служить препятствием, поскольку в альтернативных низкотемпературных процессах, как правило, используются комплексы с дорогостоящими лигандами, причем сроки жизни катализаторов составляют всего несколько циклов.
В настоящем миниобзоре показано, что почти все платиновые металлы (кроме осмия) в форме карбонильных комплексов различной природы способны к фиксации молекулярного азота при комнатной температуре и нормальном давлении с получением аммиака. Это свойство платиновых металлов основано на способности образовывать непрочные комплексы с молекулярным азотом, в которых платиновый металл образует кластерный металлоостов различной нуклеарности, что создает предпосылки для шестиэлектронного восстановления молекулы N2 с образованием аммиака.
На сегодня механизмы таких реакций детально не изучены, выход аммиака подробно не исследован, преимущества и недостатки того или иного металла платиновой группы не установлены. Все эти вопросы требуют детального исследования, поскольку, как показали кратко обсужденные в настоящей работе результаты, перспективы использования карбонильных производных платиновых металлов в процессе фиксации молекулярного азота несомненны.
Список литературы
Шилов А.Е. // Успехи химии. 1974. Т. 43. С. 863. [Shilov A.E. // Russ. Chem. Rev. 1974. V. 43. P. 378.] https://doi.org/10.1070/RC1974v043n05ABEH001811
Tanabe Y., Nishibayashi Y. // Coord. Chem. Rev. 2013. V. 257. P. 2551. https://doi.org/10.1016/j.ccr.2013.02.010
Вольпин М.Е., Шур В.Б. // Докл. АН СССР. 1964. Т. 156. № 5. С. 1102.
Allen A.D., Senaff C.V. // Chem. Commun. 1965. P. 621. https://doi.org/10.1039/C19650000621
Allen A.D., Bottomley F. // Acc. Chem. Res. 1968. V. 1. № 12. P. 360. https://doi.org/10.1021/ar50012a002
Leigh G.J. // Chem. Britain. 2001. V. 37. № 5. P. 23.
Chatt J., Jeigh G.J. // Chem. Soc. Rev. 1972. V. 1. P. 121. https://doi.org/10.1039/CS9720100121
Вольпин М.Е., Шур В.Б. // Журн. ВХО им. Д.И. Менделеева. 1967. Т. 12. № 1. С. 31.
Yandulov D.V., Schrock R.R. // Science. 2003. V. 301. P. 76. https://doi.org/10.1126/science.1085326
Egi A., Tanaka H., Konomi A. et al. // Eur. J. Inorg. Chem. 2020. № 15–16. P. 1490. https://doi.org/10.1002/ejic.201901160
Ashida Y., Kondo S., Arashiba K. et al. // Synthesis. 2019. V. 51. P. 3792. https://doi.org/10.1055/s-0039-1690151
Ashida Y., Arashiba K., Tanaka H. et al. // Inorg. Chem. 2019. V. 58. P. 8927. https://doi.org/10.1021/acs.inorgchem.9b01340
Arashiba K., Itabashi T., Nakajima K., Nishibayashi Y. // Chem. Lett. 2019. V. 48. P. 693. https://doi.org/10.1246/cl.190193
Saeidi N., Esrafili M.D., Sardroodi J.J. // ChemistrySelect. 2019. V. 4. P. 12216. https://doi.org/10.1002/slct.201903206
Riyaz M., Goel N. // ChemPhysChem. 2019. V. 20. P. 1954. https://doi.org/10.1002/cphc.201900519
Wang Yu., Chen X.-M., Zhang L.-L., Liu C.G. // Inorg. Chem. 2019. V. 58. P. 7852. https://doi.org/10.1021/acs.inorgchem.9b00537
Weiss C.J., Egbert J.D., Chen S. et al. // Organometallics. 2014. V. 33. № 9. P. 2189. https://doi.org/10.1021/om401127v
Kireev № V., Filippov O.A., Pavlov A.A. et al. // Inorg. Chem. 2018. V. 57. № 3. P. 1656. https://doi.org/10.1021/acs.inorgchem.7b03027
Jiang Y.-F., Ma X.-L., Lu J.-B. et al. // Small Methods. 2019. V. 3. Art. 1800340. https://doi.org/10.1002/smtd.201800340
Creutz S.E., Peters J.C. // J. Am. Chem. Soc. 2014. V. 136. P. 1105. https://doi.org/10.1021/ja4114962
Vyas N., Pandey B., Ojha A., Grover A. // Int. J. Quantum Chem. 2019. V. 119. Art. e26025. https://doi.org/10.1002/qua.26025
Wang Y., Chen X.-M., Zhang L.-L., Liu C.-G. // Inorg. Chem. 2019. V. 58. P. 7852. https://doi.org/10.1021/acs.inorgchem.9b00537
Lu J.-B., Ma X.-L., Wang J.-Q. et al. // Inorg. Chem. 2019. V. 58. P. 7433. https://doi.org/10.1021/acs.inorgchem.9b00598
Arnold P.L., Ochiai T., Lam F.Y.T. et al. // Nat. Chem. 2020. V. 12. P. 654. https://doi.org/10.1038/s41557-020-0457-9
Li L., Wu Z., Zhu H. et al. // J. Am. Chem. Soc. 2020. V. 142. P. 6244. https://doi.org/10.1021/jacs.0c00409
Bhattacharyya K., Datta A. // Phys. Chem. Chem. Phys. 2019. V. 21. P. 12346. https://doi.org/10.1039/c9cp00997c
Bacchi A., Balordi M., Pelagatti P., Pelizzi C. // J. Organomet. Chem. 2009. V. 694. P. 3281. https://doi.org/10.1016/j.jorganchem.2009.06.008
Brault H.T., Thorsteinson E.M., Basolo F. // Inorg. Chem. 1964. V. 3. P. 770. https://doi.org/10.1021/ic50015a038
Wojcicki A., Basolo F. // J. Am. Chem. Soc. 1961. V. 83. P. 525. https://doi.org/10.1021/ja01464a004
Paularokiadoss F., Sekar A., Jeyakumar T.C. // Compt. Theor. Chem. 2020. V. 1177. Art. 112750. https://doi.org/10.1016/j.comptc.2020.112750
Han J., Aceña J.L., Yasuda N. et al. // Inorg. Chim. Acta. 2015. V. 433. P. 3. https://doi.org/10.1016/j.ica.2015.04.029
Berti B., Bortoluzzi M., Ceriotti A. et al. // Inorg. Chim. Acta. 2020. V. 512. Art. 119904. https://doi.org/10.1016/j.ica.2020.119904
Шишилов О.Н., Ахмадуллина Н.С., Флид В.Р. // Изв. АН. Сер. хим. 2020. № 2. С. 229. [Shishilov O.N., Akhmadullina N.S., Flid V.R. // Russ. Chem. Bull. 2020. V. 69. P. 229.] https://doi.org/10.1007/s11172-020-2750-6
Shigeshi R.A., King X.A. // Surf. Sci. 1977. V. 62. № 2. P. 379. https://doi.org/10.1016/0039-6028(77)90089-9
Shanahan J.P., Szymczak N.K. // J. Am. Chem. Soc. 2019. V. 141. P. 8550. https://doi.org/10.1021/jacs.9b02288
Спицын В.И., Федосеев И.В. Карбонильные комплексы платиновых металлов. М.: Наука, 1980. 200 с.
Федосеев И.В. Гидрокарбонильные процессы в технологии платиновых металлов. М.: Руда и металлы, 2011. 127 с.
Кушников Ю.А., Бейлина Ф.З., Воздвиженский В.Ф. // Журн. неорган. химии. 1971. Т. 16. № 2. С. 416.
Федосеев И.В., Шевельков А.В., Васекин В.В. и др. // Журн. неорган. химии. 2020. Т. 65. № 2. С. 162. [Fedoseev I.V., Shevelkov A.V., Vasekin V.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 2. P. 161]. https://doi.org/10.1134/S0036023620020035
Спицын В.И., Федосеев И.В. // Докл. АН СССР. 1977. Т. 236. № 6. С. 1415.
Chatt J., Chini P. // J. Chem. Soc. 1970. V. 9. P. 1538. https://doi.org/10.1039/J19700001538
Edwards J.W., Speiser R., Johnston H.L. // J. Appl. Phys. 1951. V. 22. P. 424. https://doi.org/10.1063/1.1699977
Федосеев И.В., Шевельков А.В., Поярков К.Б. и др. // Журн. неорган. химии. 2021. Т. 66. № 3. С. 344. [Fedoseev I.V., Shevelkov A.V., Poyarkov K.B. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 3. P. 348.] https://doi.org/10.1134/S0036023621030086
Mahgoub A., Lu H., Thorman R.M. et al. // Beilstein J. Nanotechnol. 2020. V. 11. P. 1789. https://doi.org/10.3762/bjnano.11.161
Jang K., Kim H.J., Son S.U. // Chem. Mater. 2010. V. 22. P. 1273. https://doi.org/10.1021/cm902948v
Федосеев И.В., Соловьев Н.В. // Журн. неорган. химии. 2007. Т. 52. № 7. С. 1070. [Fedoseev I.V., Solov’ev N.V. // Russ. J. Inorg. Chem. 2007. V. 52. № 7. P. 994.] https://doi.org/10.1134/S0036023607070030
Valera-Medina A., Amer-Hatem F., Azad A.K. et al. // Energy Fuels. 2021. https://doi.org/10.1021/acs.energyfuels.0c03685
Hollevoet L., Jardali F., Gorbanev Y. et al. // Chem. Eur. J. 2021. V. 27. P. 2131. https://doi.org/10.1002/chem.202004357
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии