Журнал неорганической химии, 2021, T. 66, № 8, стр. 1108-1113
Влияние дополнительного допирования твердого раствора Cu–Mn–Ce–O на каталитические свойства
a Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский пр-т, 49, Россия
* E-mail: igorscience@gmail.com
Поступила в редакцию 28.01.2021
После доработки 09.03.2021
Принята к публикации 10.03.2021
Аннотация
Для разработки эффективных катализаторов окисления CO методом соосаждения приготовлена серия твердых растворов на основе диоксида церия (Cu0.08Mn0.02M0.1Ce0.8O2). Основные характеристики совместно допированных образцов изучены различными физико-химическими методами. Окисление CO выбрано в качестве модельной реакции для оценки каталитических характеристик этих образцов. Установлено, что твердые растворы имеют развитую увеличенную площадь поверхности и повышенную подвижность кислорода. Показано влияние природы допирующих ионов на каталитическую активность материалов: имеется как положительный, так и отрицательный эффект. Катализатор Cu0.08Mn0.02Nd0.1Ce0.8O2 показал самую высокую окислительную активность среди исследованных образцов. Это объясняется сильным синергетическим взаимодействием между легирующими добавками и церием и разупорядоченностью кристаллической решетки, повлиявшими на поверхностно-активные формы кислорода и кислородные вакансии, задействованные в процессе окисления СО.
ВВЕДЕНИЕ
В настоящее время особое внимание уделяется защите окружающей среды от воздействия вредных веществ. Неполное сгорание топлива, отходящих газов и др. приводит к образованию вредных веществ, таких как CO, CxHy, NOx, частицы сажи, канцерогенные органические соединения. Для предотвращения загрязнения воздуха используют различные катализаторы, поэтому проблема создания эффективных катализаторов, способных нейтрализовать вредные вещества, очень актуальна [1]. Исследования показывают, что катализаторы на основе диоксида церия способны решить эту проблему. Церий имеет два стабильных состояния (+4 и +3), и относительная простота перехода между ними является важным фактором его каталитической активности. Быстрое изменение степени окисления связано с его способностью накапливать и выделять кислород (OSC), а структура типа флюорита сохраняет стабильность до точки плавления. Таким образом, CeO2 может действовать как эффективный кислородный буфер [2–4].
Для регулирования свойств диоксида церия, таких как каталитическая активность, электропроводность и термостойкость, его легируют оксидами других металлов (в различных степенях окисления). Твердые растворы на основе CeO2 являются наиболее перспективными системами. Важным эффектом катионного допирования является увеличение количества дефектов кристаллической решетки, за счет чего увеличивается число кислородных вакансий. Это позволяет создавать материалы с более высокой способностью аккумулировать кислород. Гетеровалентные ионы увеличивают кислородную емкость за счет создания дефектов в кристаллической решетке диоксида церия, а изовалентные ионы влияют на окислительно-восстановительные свойства диоксида церия, увеличивая как общее, так и кинетическое накопление кислорода [5–9]. При добавлении оксидов металлов к диоксиду церия происходит увеличение каталитической активности – синергетический эффект. Наиболее значительный синергетический эффект наблюдается при добавлении оксидов марганца или меди в количестве до 10 мол. % металла в катализаторе (происходит предельное замещение церия медью и/или марганцем в решетке диоксида церия, затем образование дополнительной фазы оксида меди и/или марганца, приводящее к уменьшению активности). В последнее время все больший интерес вызывает использование диоксида церия двух- или трехкратного легирования, особенно Cu–Mn–Ce–O. В связи с этим марганец и медь перспективны для этих целей как недорогие компоненты легирующих примесей, обладающих высокой активностью. Такие оксиды обладают гораздо более высокой каталитической активностью, чем бинарные системы, благодаря синергетическому взаимодействию [10–13]. Таким образом, в настоящей работе предлагается допирование твердого раствора Cu0.08Mn0.02Ce0.9O2 третьим элементом (как показано ранее [14], это оптимальное соотношение Cu/Mn), синтез твердых растворов Cu0.08Mn0.02M0.1Ce0.8O2 и рассмотрение каталитических свойств данных систем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез твердого раствора проводили методом соосаждения с одновременной ультразвуковой (УЗ) обработкой [14, 15]. Соответствующие количества нитратов церия(III), марганца (II), меди(II), цирконила, самария, неодима, висмута(III), а также хлориды титана и олова(II) (Acros Organics) растворяли в концентрированной азотной кислоте (суммарная концентрация солей по металлам 0.667 M), затем полученный раствор добавляли к дистиллированной воде (концентрация солей по металлам 0.1 M). Соосаждение проводили 2.5 М раствором KOH до pH 11. УЗ-обработка (частота 35 кГц, мощность 150 Вт, Сапфир УЗВ-4.0) и перемешивание были на всех этапах. Полученный осадок отфильтровывали, промывали водно-спиртовым раствором (H2O/C2H5OH = 9 об.), сушили при 150°С в течение 12 ч и прокаливали при нагревании со скоростью 4 град/мин до температуры 500°С с выдержкой в течение 1 ч в муфельной печи.
Структуру всех полученных катализаторов контролировали методом рентгенофазового анализа (ДРОН-3М, CuKα-излучение), удельную поверхность и распределение пор по размерам определяли методом низкотемпературной адсорбции азота (TriStar 3000 Micromeritics, БЭТ-БДХ), морфологию – методом ПЭМ (Omega Leo-912AB). Термическую стабильность образцов исследовали методом термогравиметрии (Netzsch STA449F3, нагревание до 1350°С со скоростью 10 град/мин в потоке воздуха). Каталитическую активность синтезированных образцов в реакции окисления СО определяли проточным методом при атмосферном давлении. Использованная модельная газовая смесь имела следующий состав (об. %): СО – 1; О2 – 2; N2 – 97. Испытания проводили при расходе газовой смеси 60 мл/мин в интервале температур 20–500°С. Для испытания брали 0.3 г порошка. Состав газовой смеси контролировали на выходе из реактора газохроматографическим методом (Varian 450GC с детектором по теплопроводности).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 представлены основные характеристики синтезированных порошков. Анализ дифрактограмм (рис. 1) показал, что все образцы имеют пики, характерные для кубической флюоритной структуры диоксида церия. Фазы MnOx, CuOx и другие оксиды не обнаружены, что указывает на образование твердого раствора Cu–Mn–M–Ce–O. Средний размер кристаллитов для всех образцов составляет ~8 нм и не зависит от дополнительного допанта. Согласно результатам ПЭМ (рис. 2), все порошки состоят из агрегатов частиц. Размер отдельных частиц составляет ~5–10 нм, что соответствует размеру кристаллитов, рассчитанному по уравнению Селякова–Шеррера. Электронограммы (дифракция электронов выполнена на ПЭМ, не показано) также подтвердили только фазу твердого раствора с кристаллической структурой флюорита.
Таблица 1.
Основные характеристики синтезированных порошков
| № образца | Образец | Размер кристаллитов, нм | Параметр решетки а, Å | Удельная поверхность, м2/г | Объем пор, см3/г |
|---|---|---|---|---|---|
| 0 | Cu0.08Mn0.02Ce0.9O2 | 9 | 5.4064 | 79 | 0.213 |
| 1 | Cu0.08Mn0.02Zr0.1Ce0.8O2 | 8 | 5.3845 | 31 | 0.087 |
| 2 | Cu0.08Mn0.02Ti0.1Ce0.8O2 | 8 | 5.3918 | 100 | 0.205 |
| 3 | Cu0.08Mn0.02Sn0.1Ce0.8O2 | 5 | 5.3883 | 87 | 0.110 |
| 4 | Cu0.08Mn0.02Sm0.1Ce0.8O2 | 8 | 5.4061 | 96 | 0.247 |
| 5 | Cu0.08Mn0.02Nd0.1Ce0.8O2 | 7 | 5.4209 | 103 | 0.170 |
| 6 | Cu0.08Mn0.02Bi0.1Ce0.8O2 | 7 | 5.4184 | 96 | 0.120 |
Рис. 1.
Дифрактограммы порошков (а, только фаза твердого раствора на основе СеО2 с соответствующими кристаллографическими плоскостями) и кривые распределения пор по размерам (б, номера на рисунках соответствуют номерам образцов в табл. 1).
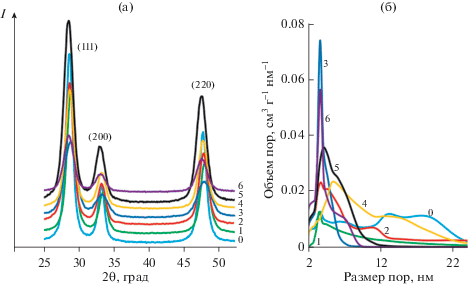
Образование твердого раствора приводит к тому, что расстояние между плоскостями решетки изменяется и дифракционные пики сдвигаются в новые позиции 2θ. Этот сдвиг указывает на изменение параметра решетки (табл. 1): если радиус иона больше радиуса церия, то сдвиг происходит в сторону меньшего угла 2θ, в противном случае – в сторону увеличения 2θ. Ионные радиусы допантов следующие (поскольку медь и марганец присутствуют во всех системах в одном и том же количестве, их условно можно не учитывать, т.е. рассматривать относительно образца 0; радиусы Шеннона в координации 8 в структуре флюорита): Ce4+ (0.97 Å), Zr4+ (0.84 Å), Ti4+ (0.74 Å), Sn4+ (0.81 Å), Sm3+ (1.079 Å), Nd3+ (1.109 Å), Bi3+ (1.17 Å). Это приводит к уменьшению параметра решетки a в случае меньшего радиуса или к увеличению в случае большего ионного радиуса, чем у Ce4+. Однако прямая корреляция между параметром решетки, ионным радиусом и количеством допанта, как правило, встречается редко (правило Вегарда), особенно в наноматериалах на основе диоксида церия. Причинами могут являться: а) добавление дополнительных катионов, которое может способствовать восстановлению катиона Ce4+ до Ce3+ (1.143 Å), радиус которого больше, чем у Ce4+; б) возможное уменьшение гибридизации O 2p–Ce 4f [16, 17]. Таким образом, предложены следующие подходы: в первой модели на элементарную ячейку влияет образование кислородных вакансий в наночастицах, что приводит к изменению степени окисления составляющего катиона, вторая модель объясняет изменение поверхностным напряжением, возникающим из-за разницы в координации между атомами на поверхности и в объеме. Этот эффект становится более выраженным при уменьшении размера частиц, т.е. при увеличении вклада поверхностных атомов в структурные характеристики [18].
Стабильность сложных твердых растворов оценена с помощью ТГ–ДТА метода. Так, отмечено, что образец 0 стабилен до 1300°С [19], в то время как усложнение приводит к распаду такой структуры уже при 1000°С: остается твердый раствор, и происходит в основном образование моноклинной фазы CuO, а также различных сложных оксидов с участием меди/марганца с третьим допантом, при этом массовая доля дополнительных фаз составляет ~10%.
Материалы с развитой удельной поверхностью обладают высокой пористостью (табл. 1). Все образцы имеют кривые адсорбции IV типа с петлей гистерезиса, что указывает на присутствие мезопор в системах. Наблюдается увеличение удельной поверхности при введении дополнительного элемента, исключение составляет добавление циркония. Петли гистерезиса соответствуют типу H2. Это указывает на возможное присутствие отдельных и/или связанных цилиндрических и/или бутылкообразных пор. Наличие таких пор подтверждается их распределением по размерам, представленным на рис. 1. Так, если в образце 0 содержатся поры диаметром 2–25 нм, то для других образцов положение и высота дифференциальной кривой распределения пор по размерам претерпевают изменения, приводя преимущественно к порам диаметром 2–8 нм, образованным малоугловыми границами частиц. Исключением опять является образец 1 с цирконием – петля гистерезиса типа Н3, что характерно для высокоагрегированных систем с клиновидными и щелевидными порами, имеющих меньшую удельную поверхность.
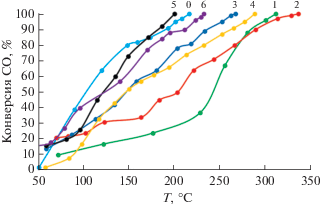
Далее свежие прокаленные порошки были испытаны в качестве катализаторов окисления СО в модельной смеси (рис. 3). Окисление СО широко используют как способ оценки окислительно-восстановительных свойств и подвижности ионов кислорода в решетке диоксида церия. Конверсия монооксида углерода увеличивается с повышением температуры, кривые имеют S-образный вид. Исследование процесса окисления СО показало, что дополнительная добавка оказывает существенное влияние на каталитическую активность: в основном происходит снижение активности, связанное, по-видимому, с “разбавлением” приповерхностных слоев более активных меди и марганца третьим допантом. Исключение составляет образец 5 с неодимом, а рост каталитической активности обусловлен увеличением разупорядоченности кристаллической решетки вследствие значительного различия ионных радиусов [9, 20]. Известно, что цирконий является высокотемпературным стабилизатором решетки диоксида церия (T > 800°C). При высоких рабочих температурах катализаторов эта легирующая добавка проявит себя, и такие катализаторы будут более стабильными [21]. Меньшая активность с титаном связана с более низкой активностью TiO2 по сравнению с CeO2 (разница в температурах полного окисления СО может различаться в два раза). Системы с оловом и висмутом несколько уступают исходному катализатору 0, но значительно лучше проявляют окислительные способности по сравнению с самарием. Это объясняется протекающими редокс-превращениями: Sn2+ ↔ Sn4+, Bi3+ ↔ Bi5+, что, в свою очередь, положительным образом сказывается на каталитической активности, но такая способность меньше, чем у меди и марганца (Cu+ ↔ Cu2+, Mn2+ ↔ Mn3+ ↔ Mn4+) [14, 22], это связано с энергией связи кислорода на поверхности оксидов металлов. В целом, необходимо сочетание как более разупорядоченной структуры, так и катионов с разными степенями окисления для быстрого перехода в окислительно-восстановительных условиях, т.е. введение переходных металлов и/или РЗЭ с многовалентными степенями окисления, которые позволяют материалу легко отдавать решеточный кислород для реакции с адсорбированными молекулами (каталитическая поверхность впоследствии повторно окисляется кислородом газовой фазы), а также наличие синергетического взаимодействия между допантами и церием [23]. Таким образом, использование катализаторов на основе твердого раствора диоксида церия обусловливает протекание реакции окисления СО по механизму Марса–ван Кревелена, согласно которому молекулы окисляются за счет потребления решеточного кислорода оксидного катализатора, который, в свою очередь, повторно окисляется кислородом газовой фазы. В результате диоксид церия с гетеровалентной примесью продемонстрировал превосходные каталитические характеристики в отношении реакций окисления по сравнению с изовалентной примесью.
Сравнение полученных катализаторов с другими катализаторами на основе диоксида церия, описанными ранее [24, 25], при испытаниях в близких условиях показывает, что каталитическая активность разработанных катализаторов выше (температура полного окисления СО ниже на 50–100°С).
ЗАКЛЮЧЕНИЕ
В настоящей работе продемонстрировано содопирование диоксида церия переходными и редкоземельными ионами. Сложные твердые растворы Cu0.08Mn0.02M0.1Ce0.8O2 синтезированы методом соосаждения. Предпринята попытка корреляции между физико-химическими свойствами и каталитическими характеристиками этих образцов для модельной реакции окисления CO. Из этого исследования можно сделать следующие выводы:
1. Совместное допирование приводит к большей площади поверхности по сравнению с чистым CeO2, что может обеспечить больше активных центров для окисления CO [26].
2. Хотя предложенный катализатор Cu0.08Mn0.02Ce0.9O2 уже показывал перспективные каталитические свойства [14], улучшение таких свойств является необходимым условием, однако при этом происходит снижение активности, связанное, по-видимому, с “разбавлением” приповерхностных слоев более активных меди и марганца третьим допантом.
3. Превосходные структурные, текстурные и окислительно-восстановительные свойства катализатора Cu0.08Mn0.02Nd0.1Ce0.8O2 объясняются сильным синергетическим взаимодействием между легирующими добавками и церием, а также увеличением разупорядоченности кристаллической решетки вследствие значительного различия ионных радиусов [27].
Список литературы
Mukherjee D., Reddy B.M. // Emiss. Control Sci. Technol. 2020. V. 6. P. 381. https://doi.org/10.1007/s40825-020-00170-2
Xie S., Wang Z., Cheng F. et al. // Nano Energy. 2017. V. 37. P. 313. https://doi.org/10.1016/j.nanoen.2017.02.029
Trovarelli A., Llorca J. // ACS Catal. 2017. V. 7. P. 4716. https://doi.org/10.1021/acscatal.7b01246
Kim H.J., Jang M.G., Shin D. et al. // ChemCatChem. 2020. V. 12. P. 11. https://doi.org/10.1002/cctc.201901787
Schmitt R., Nenning A., Kraynis O. et al. // Chem. Soc. Rev. 2020. V. 49. P. 554. https://doi.org/10.1039/c9cs00588a
Su Y.-Q., Zhang L., Muravev V. et al. // Chin. J. Catal. 2020. V. 41. P. 977. https://doi.org/10.1016/S1872-2067(19)63468-6
Fadzil N.A.M., Ab. Rahim M.H. et al. // Mater. Res. Express. 2018. V. 5. Art. 085019. https://doi.org/10.1088/2053-1591/aad2b5
Knoblauch N., Simon H., Dörrer L. et al. // Inorganics. 2017. V. 5. Art. 76. https://doi.org/10.3390/inorganics5040076
Devaiah D., Tsuzuki T., Boningari T. et al. // RSC Adv. 2015. V. 5. P. 30275. https://doi.org/10.1039/c5ra00557d
Zhao F., Gong M., Zhang G. et al. // J. Rare Earth. 2015. V. 33. P. 604. https://doi.org/10.1016/S1002-0721(14)60460-9
Li C., Li Z., Oh H.Y. et al. // Catal. Today. 2018. V. 307. P. 237. https://doi.org/10.1016/j.cattod.2017.01.034
Lu H., Kong X., Huang H. et al. // J. Environ. Sci. 2015. V. 32. P. 102. https://doi.org/10.1016/j.jes.2014.11.015
Dosa M., Piumetti M., Bensaid S. et al. // Catal. Lett. 2018. V. 148. P. 298. https://doi.org/10.1007/s10562-017-2226-y
Zagaynov I.V., Naumkin A.V., Grigoriev Yu.V. // Appl. Cat. B. 2018. V. 236. P. 171. https://doi.org/10.1016/j.apcatb.2018.05.027
Zagaynov I.V., Konovalov A.A., Koneva E.A. // Lett. Mater. 2018. V. 8. P. 135. https://doi.org/10.22226/2410-3535-2018-2-135-139
Prieur D., Bonani W., Popa K. et al. // Inorg. Chem. 2020. V. 59. P. 5760. https://doi.org/10.1021/acs.inorgchem.0c00506
Campbell C.T., Peden C.H.F. // Science. 2005. V. 309. P. 713. https://doi.org/10.1126/science.1113955
Tsunekawa S., Ito S., Kawazoe Y. // Appl. Phys. Lett. 2004. V. 85. P. 3845. https://doi.org/10.1063/1.1811771
Zagaynov I.V., Fedorov S.V., Goldberg M.A. // Process. Appl. Ceram. 2019. V. 13. P. 244. https://doi.org/10.2298/PAC1903244Z
Reddy B.M., Thrimurthulu G., Katta L. // Catal. Lett. 2011. V. 141. P. 572. https://doi.org/10.1007/s10562-010-0484-z
Vasiliev A.A., Lagutin A.S., Nabiev S.S. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1948. https://doi.org/10.1134/S0036023620120190
Zagaynov I.V., Shelepin I.V., Konovalov A.A. et al. // Ceram. Int. 2021. V. 47. P. 8142. https://doi.org/10.1016/j.ceramint.2020.11.170
Burbano M., Nadin S., Marrocchelli D. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 8320. https://doi.org/10.1039/c4cp00856a
Mukherjee D., Rao B.G., Reddy B.M. // Appl. Catal., B. 2016. V. 197. P. 105. https://doi.org/10.1016/j.apcatb.2016.03.042
Devaiah D., Tsuzuki T., Aniz C.U. et al. // Catal. Lett. 2015. V. 145. P. 1206. https://doi.org/10.1007/s10562-015-1507-6
Zagaynov I.V., Liberman E.Yu., Naumkin A.V. // Surf. Sci. 2015. V. 642. P. L11. https://doi.org/10.1016/j.susc.2015.06.023
Ikuma Y., Shimada E., Okamura N. // J. Am. Ceram. Soc. 2005. V. 88. P. 419. https://doi.org/10.1111/j.1551-2916.2005.00076.x
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии