Журнал неорганической химии, 2021, T. 66, № 8, стр. 951-957
Церийсодержащие гидроксиапатиты с люминесцентными свойствами
Ю. О. Никитина a, *, Н. В. Петракова a, **, А. Ю. Демина b, С. А. Козюхин c, А. С. Лысенков a, С. М. Баринов a, В. С. Комлев a, ***
a Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский пр-т, 49, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
c Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: nyo.94@yandex.ru
** E-mail: petrakova.nv@mail.ru
*** E-mail: komlev@mail.ru
Поступила в редакцию 03.02.2021
После доработки 17.03.2021
Принята к публикации 18.03.2021
Аннотация
Получены порошки церийсодержащих гидроксиапатитов (Се–ГА) с расчетной концентрацией церия до 0.5 мол. %. Исследовано фазообразование и люминесцентные свойства соединений после температурной обработки в окислительной и восстановительной средах. Показано, что достичь высокой интенсивности люминесценции ГА можно путем предотвращения перехода церий(III) → церий(IV) в восстановительной атмосфере при температурах 900–1200°С, а также путем совместного замещения ионов Ca2+ на ионы Се3+ и Li+ для компенсации избыточного заряда добавки. Показана зависимость интенсивности люминесценции материалов от температуры обработки и концентрации церия.
ВВЕДЕНИЕ
Материалам на основе фосфатов кальция (ФК) уделяется особое внимание благодаря их близости по химическому составу к минеральной компоненте костной ткани. Многообразие химических составов фосфатов кальция, подходящих для медицинского использования, позволило расширить спектр подходов к замещению костных дефектов синтетическими материалами. Регулирование физико-химических характеристик ФК позволяет контролировать процессы, способствующие качественному образованию костной ткани в месте дефекта. Модифицирование структуры ФК путем катионного замещения является эффективным способом придания материалам специфических свойств. В случае гидроксиапатита было изучено замещение ионов кальция на ионы элементов из ряда жизненно-важных для организма человека (Mg, Na, K, Li), элементов, несущих антибактериальные свойства (Ag, Cu, Zn, Fe), а также элементов, способствующих остеоинтеграции (Sr, In, Bi) и др. [1–3]. Развивающимся направлением в изучении катионного замещения ФК является использование редкоземельных элементов (РЗЭ) [4–6]. Ионы РЗЭ обладают уникальными оптическими, магнитными и каталитическими свойствами, что делает их перспективными для применения в медицине, в том числе в терапии, визуализации и диагностике [7–10].
Известно, что ионы РЗЭ и Са2+ имеют близкие размеры ионных радиусов и координационные числа (КЧ), поэтому ионы РЗЭ способны замещать ионы Са2+ в структуре ГА [1, 3, 11]. Ионный радиус РЗЭ уменьшается в ряду от лантана к лютецию от 1.22 до 0.86 Å для КЧ = 6–9, а ионный радиус Cа2+ для тех же чисел составляет 1.00–1.18 Å [12–14]. Тем не менее включение ионов РЗЭ в структуру ГА является сложным процессом, требующим учитывать не только значения ионных радиусов и КЧ, но и механизм замещения, пространственное размещение, валентность. РЗЭ образуют трехвалентные положительные ионы. В этом ряду несколько элементов образуют соединения с аномальной валентностью: церий, празеодим и тербий – IV; самарий, европий и иттербий – II. Исследование гетеровалентных замещений в структуре ГА представляет интерес с точки зрения фазообразования, влияния на структурные особенности и специфические свойства.
В настоящей работе внимание уделяется замещению ионов кальция на ионы церия, поскольку он проявляет комплекс важных для медицинского применения свойств. В литературе упоминается совместное нахождение церия и кальция в природных соединениях, например, в апатитах [15]. В биологическом аспекте тенденция к образованию совместных осажденных солей церия и кальция в условиях организма демонстрирует сродство церия к минеральной компоненте кости [16, 17]. Предполагается, что церий может участвовать в кальцийзависимых реакциях, стимулировать метаболизм, а также накапливаться в небольших количествах в костной ткани [18, 19]. Бактериостатическое действие соединений церия было показано уже в конце XIX в., что привело к их использованию в качестве местных антисептиков в медицине человека и ветеринарии [15, 20]. Во многих источниках отмечается противоопухолевый эффект соединений церия, в частности оксида церия(IV), их потенциал в качестве антиоксидантов и радиопротекторов для лечения онкологических заболеваний [21–23]. В настоящее время РЗЭ, в том числе церий, являются перспективными визуализирующими агентами в области биоимиждинга для диагностики и лечения поврежденных органов и тканей [24, 25]. На сегодняшний день существует ряд ограничений в этой области, связанных с низкой глубиной проникновения ультрафиолетового (УФ) и видимого возбуждения/излучения в биологических тканях, их повреждения, токсического действия контрастного материала и др. Включение визуализирующих агентов в состав биосовместимых материалов позволит избежать указанных недостатков. В последнее время фосфаты кальция, широко используемые в инженерии костной ткани, привлекают внимание в качестве матрицы, несущей функциональные компоненты, действие которых направлено на доставку лекарственного средства, усиление регенеративных процессов и проявление люминесцентных свойств [26]. Так, ионы церия характеризуются люминесценцией в УФ-области света. Это свойство обусловлено электронным переходом внутри оболочки 4f или 4f → 5d в ионизированном атоме [27–30]. Переход электрона между энергетическими уровнями в стабильном Се3+ сопровождается быстрым и ярким свечением, в Се4+ люминесценция значительно слабее и медленнее [31, 32]. Интенсивность люминесценции церийсодержащего материала зависит от количественного содержания ионов Се3+, присутствия примесей различной природы и характеристик частиц материала [33, 34]. Следует отметить, что церий присутствует в соединениях в смешанном виде (Се3+ и Се4+), что обусловлено средой внешнего воздействия на материал [35, 36]. Оценить валентное соотношение Ce3+/Ce4+ можно косвенными методами, например, с помощью анализа люминесцентных свойств материала, при этом усиление интенсивности люминесценции свидетельствует об изменении кислородной стехиометрии и наличии ионов Ce3+ в структуре [29]. Прямые методы оценки включают рентгеновскую фотоэлектронную спектроскопию и спектроскопию энергетических потерь электронов в условиях вакуума, которые, однако, приводят к частичному восстановлению Ce(IV) до Се(III) [37–39] и др. Возможно применение химических методов анализа [40].
Настоящая работа направлена на получение церийсодержащих порошков гидроксиапатита и изучение фазообразования и люминесцентных свойств. Основной целью работы являлось предотвращение перехода церий(III) → церий(IV) при использовании метода горячего прессования для осуществления восстановительной среды при нагреве, а также за счет введения ионов лития в качестве компенсации заряда при катионном замещении по схеме: Li+ + Ce3+ = 2Ca2+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порошки церийсодержащих ГА (Се–ГА) были синтезированы методом осаждения из растворов солей согласно реакциям получения гидроксиапатита с учетом замещения ионов кальция на ионы церия (реакция (1)), а также ионов кальция на ионы церия и лития (реакция (2)).
(1)
$\begin{gathered} \left( {10--х} \right){\text{Ca}}{{({\text{N}}{{{\text{O}}}_{3}})}_{2}} + {\text{ }}\left( {2х{\text{/}}3} \right){\text{Ce}}{{({\text{N}}{{{\text{О}}}_{3}})}_{3}} + \\ + \,\,6{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{HP}}{{{\text{O}}}_{4}} + 8{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} \to \\ \to {\text{C}}{{{\text{a}}}_{{\left( {10{\text{ }}--х} \right)}}}{\text{C}}{{{\text{e}}}_{{\left( {2х/3} \right)}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{(OH)}}}_{2}} + \\ + \,\,26{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{0N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH,}} \\ \end{gathered} $(2)
$\begin{gathered} \left( {10--х} \right){\text{Ca(N}}{{{\text{O}}}_{3}}{{)}_{2}} + \left( {х{\text{/}}2} \right){\text{Ce(N}}{{{\text{О}}}_{3}}{{)}_{3}} + \\ + \,\,\left( {х{\text{/}}2} \right){\text{Li(N}}{{{\text{O}}}_{{\text{3}}}}) + 6{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{HP}}{{{\text{O}}}_{4}} + 8{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} \to \\ \to {\text{C}}{{{\text{a}}}_{{\left( {10{\text{ }}--х} \right)}}}{\text{L}}{{{\text{i}}}_{{\left( {х/2} \right)}}}{\text{C}}{{{\text{e}}}_{{\left( {х/2} \right)}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{6}}}}{{{\text{(OH}})}_{2}} + \\ + \,\,26{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 20{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}},\,\,\,\,х = 0,0.1,0.25{\text{ и }}0.5. \\ \end{gathered} $Водный раствор нитрата кальция (0.5 М) смешивали с водными растворами нитратов соответствующих металлов (нитрата церия (0.1 М) или/и нитрата лития (0.1 М)), затем по каплям добавляли раствор гидрофосфата аммония (0.5 М) при постоянном перемешивании. Добавлением водного 25%-ного раствора аммиака поддерживали значение рН 11.0 ± 0.5. Полученные осадки оставляли на старение в течение 24 ч при комнатной температуре. Осадки отфильтровывали от маточного раствора, промывали дистиллированной водой и сушили при температуре 80°С, затем просеивали через капроновую сетку с размером ячейки 100 мкм. Полученные порошки Се–ГА имели желтоватый оттенок, в отличие от белого порошка ГА. В табл. 1 приведена номенклатура и представлено расчетное содержание добавок в ГА.
Таблица 1.
Номенклатура и расчетные составы церийсодержащих ГА
| Название состава | Расчетное содержание | Формула соединения | |
|---|---|---|---|
| мол. % | мас. % | ||
| ГА–0 | 0 | 0 | Ca10 (PO4)6(OH)2 |
| Се–ГА(0.1) | 0.10 | 0.09 | Ca9.990Ce0.0066(PO4)6(OH)2 |
| Се–ГА(0.25) | 0.25 | 0.23 | Ca9.975Ce0.0166(PO4)6(OH)2 |
| Се–ГА(0.5) | 0.50 | 0.46 | Ca9.950Ce0.033(PO4)6(OH)2 |
| Li–Се–ГА(0.25–0.25) | 0.25–0.25 | 0.01–0.35 | Ca9.950Li0.025Ce0.025(PO4)6(OH)2 |
| Li–Се–ГА(0.5–0.5) | 0.50–0.50 | 0.02–0.70 | Ca9.900Li0.05Ce0.05(PO4)6(OH)2 |
Из синтезированных порошков готовили образцы методом двустороннего прессования без введения связки в стальной пресс-форме диаметром и высотой 10 × 4 мм2 на гидравлическом ручном прессе при комнатной температуре. Давление прессования составляло 100 МПа. Обжиг заготовок проводили в окислительной среде (воздух) в печи с SiC-нагревателями при нагреве с постоянной скоростью 10 град/мин до 1300°С и выдержкой в течение 60 мин для получения керамических образцов с целью дальнейшей регистрации спектров люминесценции.
Горячее прессование порошков проводили в печи горячего прессования Thermal technology Inc HP 250-3560-20 в углеродной пресс-форме в атмосфере азота при давлении 30 МПа и температурах 900, 1000, 1100 и1200°С с выдержкой 60 мин.
Изучение фазового состава материалов проводили на приборе Shimadzu XRD-6000 на предварительно измельченных в порошок образцах при монохроматизированном CuKα-излучении (λ = = 1.5418 Å) в диапазоне углов 2θ 10°–60° с шагом 0.02° при скорости движения счетчика 2 град/мин.
Спектры возбуждения и люминесценции керамических образцов регистрировали при комнатной температуре с помощью спектрометра Perkin Elmer LS55 с диапазоном возбуждения (λexc) 200–800 нм, диапазоном эмиссии (λem) 300–800 нм с разрешением 0.5 нм и спектрофлуориметра Horiba Fluorolog 3D, λexc = 200–850 ± 0.5 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Се-содержащие ГА, окислительная среда
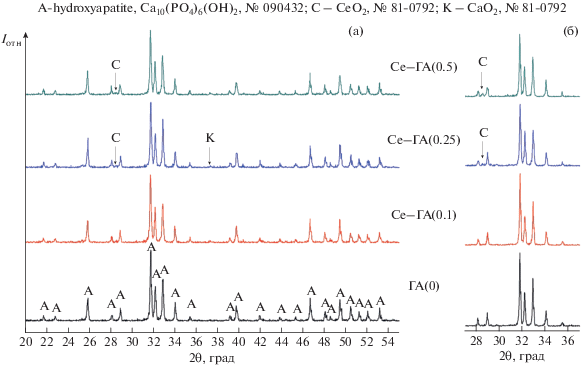
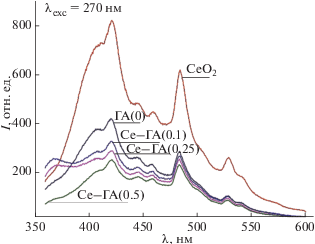
После синтеза и термообработки при 1000°С в окислительной среде церийсодержащие ГА соответствуют структуре гидроксиапатита со следовым содержанием оксида церия(IV) в соединениях Се–ГА(0.25) и Се–ГА(0.5) (рис. 1). Увеличение температуры обработки до 1300°С приводит к повышению степени закристаллизованности материалов, о чем свидетельствует сужение рефлексов на дифрактограммах и увеличение их интенсивности, в том числе для фазы СеО2 (2θ = 28.5°, № 81-0792 JCPDS). Известно, что при изменении валентности церия (III → IV) снижается размер его ионного радиуса, что может внести вклад в процессы перераспределения фаз [35]. По данным РФА установлено, что в процессе синтеза Се3+ не полностью входит в структуру ГА, и при термической обработке в условиях окислительной среды сегрегируется в отдельную фазу СеО2. Это подтверждают спектры люминесценции, полученные для ряда материалов: СеО2, чистого ГА и Се-содержащих ГА (рис. 2). При возбуждении λ = 270 нм для СеО2 наблюдаются полосы люминесценции при 420 и 485 нм, подобные описанным в [29]. Все полученные спектры плохо разрешены и имеют сложный вид. Таким образом, полученные обжигом в окислительной среде церийсодержащие ГА не люминесцируют при УФ-облучении (λexc = 270 нм), так как добавка сосредоточена в отдельной примесной фазе оксида церия(IV) с низким уровнем свечения.
Се-содержащие ГА, полученные в восстановительной среде
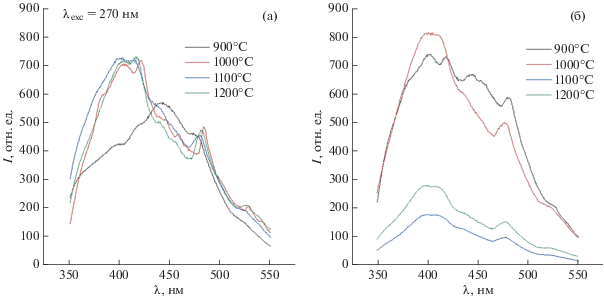
Для создания восстановительной среды обжига материалов на основе ГА был использован метод горячего прессования (ГП) образцов в углеродной пресс-форме в защитной атмосфере азота. Согласно данным РФА, основной фазой материалов Се–ГА(0.25) и Се–ГА(0.5), полученных в условиях ГП при температурах 900, 1000, 1100 и 1200°С, является ГА; повышение температуры от 1100 до 1200°С приводит к образованию фазы СаО до 2 мас. %. Церийсодержащие фазы не обнаружены. Полученные после обжига материалы обладают значительным свечением, зависящим от температуры обработки и концентрации вводимого при синтезе церия (рис. 3). В связи с высокой интенсивностью свечения регистрацию проводили при сниженных значениях спектральной ширины щели. Так, для состава Се–ГА(0.25) интенсивность люминесценции была значительной и повышалась с ростом температуры обработки от 900 до 1000°С, при дальнейшем увеличении температуры до 1200°С она оставалась почти неизменной (рис. 3а). Это может быть обусловлено как влиянием размеров частиц, слагающих материал, так и процессами, сопровождающими включение ионов Се3+ в структуру ГА. Состав Се–ГА(0.5) обладает более низкой интенсивностью люминесценции по сравнению с Се–ГА(0.25), что, вероятно, обусловлено эффектом концентрационного гашения (рис. 3б). Во всех спектрах присутствует пик при 485 нм подобно пику для фазы СеО2 на рис. 2, который может быть отнесен к наличию ионов Се4+. Можно предположить, что в условиях ГП при нагреве выше 900°С происходит совместно частичное восстановление Се(IV) → Се(III), перераспределение ионов церия в кристаллической решетке ГА за счет процессов массопереноса при обжиге, также церий частично остается в состоянии Се(IV), но в решетке матрицы ГА. Это можно соотнести с появлением побочной фазы СаО при температурах выше 1100°С, что объясняется вытеснением избытка ионов кальция при замещении на ионы церия в структуре ГА. Повышение температуры способствует вхождению добавки и ее равномерному распределению в кристаллической решетке ГА, что приводит к снижению интенсивности люминесценции материалов в виде эффекта концентрационного гашения.
Двойное замещение Li–Ce–ГА
Для изучения влияния замещения ионов кальция на ионы лития и церия на процессы формирования фаз и распределения церия в ГА была синтезирована серия составов: ГА, Li–ГА(0.25), Ce–ГА(0.25), Li–Ce–ГА(0.25–0.25), Li–Ce–ГА(0.5–0.5). Согласно данным РФА проб материалов после термообработки при 1300°С в воздушной среде, составы ГА и Li–ГА полностью соответствуют ГА; полученные Li–Ce–ГА представляют собой ГА с примесью α-ТКФ до 10 мас. %. Отмечается присутствие фазы СеО2 в следовом количестве.
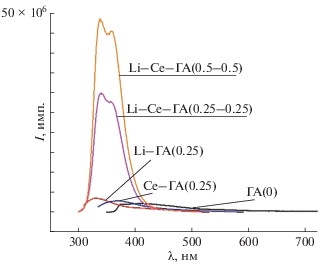
Был проведен спектрально-люминесцентный анализ с помощью прибора Horiba Fluorolog 3D (рис. 4). Образец Li–ГА демонстрировал максимальную интенсивность свечения при возбуждении λexc = 280 нм, максимум интенсивности находился в области 330 нм. Для составов Li–Се–ГА максимальная интенсивность люминесценции была в области 340 нм при возбуждении λexс = = 267–270 нм. Отмечено, что интенсивность люминесценции Li–ГА выше, чем чистого ГА, предположительно, за счет рекомбинационного излучения, связанного с литием. Обнаружено, что материалы с двойным замещением Li–Се–ГА (0.25–0.25) проявляют интенсивное свечение, превышающее в 15 раз свечение Се–ГА (0.25). Увеличение вдвое концентрации добавок приводит к усилению интенсивности люминесценции материалов почти в два раза. Это обусловлено особенностями гетеровалентного замещения в решетке гидроксиапатита по схеме: Li+ + Ce3+ = 2Ca2+. В [41] указано, что при замещении ионов кальция в структуре ГА на трехвалентные ионы дисбаланс заряда компенсируется либо образованием свободных катионных позиций, либо потерей протона в ОН-группах. Важным фактором для формирования оптических и других свойств в соединениях с РЗЭ является образование кислородных вакансий и захват ими электронов [31]. Мы предполагаем, что вводимые в процессе синтеза методом осаждения из растворов ионы Се3+ и Li+ встроились в структуру ГА на катионные позиции. В дальнейшем в процессах массопереноса в условиях термической активации со вкладом высокой подвижности ионов лития церий более равномерно распределяется в решетке матрицы ГА и, вероятно, остается в структуре в исходной степени окисления. С другой стороны, вклад лития сопровождается усилением эффекта образования кислородных вакансий в анионной подрешетке, которые имеют значение для формирования люминесцентных центров различных типов. Установление механизма замещения требует дальнейших более глубоких исследований свойств и уточнения полученных структур.
ЗАКЛЮЧЕНИЕ
Церийсодержащие гидроксиапатиты (Се–ГА) получены осаждением из водных растворов нитратов кальция и церия(III) и гидрофосфата аммония. Количество вводимого церия составляло 0.1, 0.25, 0.5 мол. %. Установлено, что во время термообработки Се–ГА в окислительной среде (воздух) церий окисляется с переходом Ce(III) → Ce(IV) и сегрегируется в отдельную фазу – CеO2. Такие материалы характеризуются отсутствием люминесценции при УФ-облучении. Создание восстановительной атмосферы термообработки посредством горячего прессования образцов Се–ГА препятствует окислению церия, формированию ГА с включением Се3+ в структуру, что выражается в значительной интенсивности люминесценции таких материалов, зависящей от температуры обработки и концентрации вводимого при синтезе церия. Значительное увеличение интенсивности люминесценции Се–ГА было также достигнуто совместным включением в структуру ГА добавок Се3+ и Li+, при этом свечение материалов усиливалось с увеличением концентрации добавок.
Список литературы
Tite T., Popa A.-C., Balescu L.M. et al. // Materials. 2018. V. 11. № 11. P. 1. https://doi.org/10.3390/ma11112081
Šupová M. // Ceram. Int. 2015. V. 41. № 8. P. 9203. https://doi.org/10.1016/j.ceramint.2015.03.316
Yilmaz B., Alshemary A.Z., Evis Z. // Microchem. J. 2019. V. 144. P. 443. https://doi.org/10.1016/j.microc.2018.10.007
Uskoković V. // Ceram. Int. 2020. V. 46. № 8. P. 11443. https://doi.org/10.1016/j.ceramint.2020.02.001
Mondal S., Nguyen V.T., Park S. et al. // Ceram. Int. 2020. V. 46. № 18. P. 29249. https://doi.org/10.1016/j.ceramint.2020.08.099
Yasukawa A., Gotoh K., Tanaka H. et al. // Colloids Surf., A: Physicochem. Eng. Asp. 2012. V. 393. P. 53. https://doi.org/10.1016/j.colsurfa.2011.10.024
Graeve O.A., Kanakala R., Madadi A. et al. // Biomaterials. 2010. V. 31. P. 4259. https://doi.org/10.1016/j.biomaterials.2010.02.009
Doat A., Fanjul M., Pellé F. et al. // Biomaterials. 2003. V. 24. P. 3365. https://doi.org/10.1016/S0142-9612(03)00169-8
Sun R., Chen K., Wu X. et al. // CrystEngComm. 2013. V. 15. P. 3442. https://doi.org/10.1039/C3CE26973F
Steblevskaya N.I., Belobeletskaya M.V., Ustinov A.Y. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 179. https://doi.org/10.1134/S0044457X19020211
Alexandroaei M., Ignat M., Sandu I.G. // Revista de Chimie. 2013. V. 64. № 10. P. 1100.
Серебренников В.В. Химия редкоземельных элементов, Томск. 1959. 531 с.
Спицына В.И., Мартыненко Л.И. Координационная химия редкоземельных элементов. М.: Изд-во Моск. ун-та, 1974. 21 с.
Evans C.H. Biochemistry of the Lanthanides. N.Y.: Springer Science + Business Media, 2013. 444 p. https://doi.org/10.1007/978-1-4684-8748-0
Jakupec M.A., Unfried P., Keppler B.K. // Rev. Physiol., Biochem. Pharmacol. 2005. V. 153. P. 101. https://doi.org/10.1007/s10254-004-0024-6
Jowsey J., Rowland R.E., Marshall J.H. // Radiat. Res. 1958. V. 8. № 6. P. 490. https://doi.org/10.2307/3570441
Ewaldsson B., Magnusson G. et al. // Acta Radiol. Ther. Phys. Biol. 1964. V. 2. P. 65. https://doi.org/10.3109/00016926109175132
Furie B.C., Mann K.G., Furie B. // J. Biol. Chem. 1976. V. 251. P. 3235.
Wang S., Huang T.D., Yan R. et al. // Earth Sci. 2020. https://doi.org/10.3389/feart.2020.00230
Qi M., Li W., Zheng X. et al. // Frontiers in Materials. 2020. V. 7. P. 213. https://doi.org/10.3389/fmats.2020.00213
Kamrava M.R., Michener C.M., Kohn E.C. // Pharm News. 2002. V. 9. № 6. P. 435.
Clark A., Zhu A., Sun K. et al. // J. Nanopart. Res. 2011. V. 13. № 10. P. 5547. https://doi.org/10.1007/s11051-011-0544-3
Baskar G., Lalitha K., Aiswarya R. et al. // Indian J. Eng. Mater. Sci. 2018. V. 25. № 93. P. 809. https://doi.org/10.1016/j.msec.2018.08.051
Lu Y., Wang E. // Rare Earth Coord. Chem.: Fundamentals and Applications. 2010. P. 193. https://doi.org/10.1002/9780470824870.ch5
Mondal S., Nguyen V.T., Park S. et al. // Ceram. Int. 2020. V. 46. № 10. P. 16020. https://doi.org/10.1016/j.ceramint.2020.03.152
Игнатов А.В., Гетьман Е.И., Лобода С.Н. // Наукові праці Донецького національного технічного університету. Сер.: Хімія і хімічна технологія. 2011. № 17. С. 71.
Chen F., Huang P., Zhu Y.-J. et al. // Biomaterials. 2012. V. 33. P. 6447. https://doi.org/10.1016/j.biomaterials.2012.05.059
Victor S.P., Paul W., Vineeth V.M. et al. // Colloids Surf., B. 2016. V. 145. P. 539. https://doi.org/10.1016/j.colsurfb.2016.05.067
Бажукова И.Н., Мышкина А.В., Соковнин С.Ю. и др. // Физика твердого тела. 2019. Т. 61. В. 5. С. 975.
Bazin H., Préaudat M., Trinquet E. et al. // Spectrochim. Acta, Part A: Mol. Biomol. Spectrosc. 2001. V. 57. № 11. P. 2197. https://doi.org/10.1016/s1386-1425(01)00493-0
Окрушко Е.Н., Семинько В.В., Максимчук П.О. и др. // Физика низких температур. 2017. Т. 43. № 5. С. 795.
Jia M., Wen J., Luo W. et al. // J. Lumin. 2020. V. 221. P. 117063. https://doi.org/10.1016/j.jlumin.2020.117063
Tiseanu C., Parvulescu V.I., Sanchez-Dominguez M. et al. // J. Appl. Phys. 2012. V. 112. P. 013521.
Maksimchuk P.O., Seminko V.V., Bespalova I.I. et al. // Functional Mater. 2014. V. 3. P. 255. https://doi.org/10.15407/fm22.03.255
Ciobanu G., Bargan A.M., Luca C. // Ceram. Int. 2015. V. 41. P. 12192. https://doi.org/10.1016/j.ceramint.2015.06.040
Masalov A., Viagin O., Maksimchuk P. et al. // J. Lumin. 2014. V. 145. P. 61. https://doi.org/10.1016/j.jlumin.2013.07.020
Lijun Wu, Wiesmann H.J., Moodenbaugh A.R. et al. // Phys. Rev. 2004. V. 69. P. 125415. https://doi.org/10.1103/PhysRevB.69.125415
Allahgholi A., Flege J.I., Thieß S. et al. // ChemPhys-Chem. 2015. V. 16. P. 1083. https://doi.org/10.1002/cphc.201402729
Tsunekawa S., Sivamohan R., Ito S. et al. // Antioxidants. 2018. V. 7. № 8. P. 141. https://doi.org/10.3390/antiox7080097
Стоянов А.О., Иванов В.К., Щербаков А.Б. и др. // Журн. неорган. химии. 2014. Т. 59. № 2. С. 139. https://doi.org/10.7868/S0044457X14020196
Cawthray J.F., Creagh A.L., Haynes C.A. et al. // Inorg. Chem. 2015. V. 54. № 4. P. 1440. https://doi.org/10.1021/ic502425e
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии