Журнал неорганической химии, 2021, T. 66, № 8, стр. 958-963
Влияние шероховатости поверхности на свойства титановых материалов для костных имплантатов
О. К. Камынина a, *, К. С. Кравчук b, М. А. Лазов c, С. М. Пестов c
a Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова РАН
142432 Черноголовка, ул. Академика Осипьяна, Россия
b Технологический институт сверхтвердых и новых углеродных материалов
108840 Троицк, ул. Центральная, 7а, Россия
c МИРЭА – Российский технологический университет
119571 Москва, пр-т Вернадского, 78, Россия
* E-mail: sci-secretary@ism.ac.ru
Поступила в редакцию 05.02.2021
После доработки 18.03.2021
Принята к публикации 19.03.2021
Аннотация
Недавние исследования показали, что использование наноструктурированных поверхностей металлов, особенно титана и титановых сплавов, способствует росту костной ткани. Учитывая эти результаты, в настоящей работе проведена оценка возможности создания заданной шероховатости поверхности образцов титановых материалов (титана Grade 4 и сплава титана Ti6Al7Nb) для костных имплантатов методами ионно-кластерной технологии (gas cluster ion beam (GCIB) treatment). Результаты воздействия различных режимов ионно-кластерной обработки (GCIB treatment) на модификацию поверхности оценивали методами атомно-силовой, сканирующей электронной и рентгеновской фотоэлектронной микроскопии. Определение токсичности образцов из титана и титанового сплава проводили на основании исследования жизнеспособности и роста субстратзависимых клеток-предшественников костной ткани на поверхности данных материалов. Показана перспективность использования методов ионно-кластерной технологии для получения заданной шероховатости материалов на основе титана Grade 4 и титанового сплава Ti6Al7Nb для костных имплантатов.
ВВЕДЕНИЕ
На сегодняшний день в медицине используется широкий спектр материалов на основе титана и титановых сплавов: медицинские и хирургические инструменты, имплантаты для ортопедии и стоматологии, стенты и искусственные клапаны для кардиологии и т.д. [1–3]. В зависимости от назначения материалы на основе титана различаются по химическому составу, механическим и физическим параметрам [3]. Известно, что для повышения остеоинтеграции биоматериалов, улучшения соединения кость–имплантат существуют разнообразные подходы: анодная оксидация и механическая обработка, увеличивающие толщину природного слоя оксида, пескоструйная обработка или кислотное травление, создающие шероховатость поверхности и способствующие улучшению адгезии и выживанию клеток [4–6]. Альтернативным подходом является использование биохимических методик: покрытие поверхности коллагеном I типа [7], альгинатом гидрогелей [8], получение материалов с заданной пористой структурой [9] и т.п. В последнее время основополагающим подходом к повышению остеоинтегративных свойств имплантатов является активная модификация поверхности имплантата, создание микро- и наномасштабной шероховатости, которая обеспечивает максимальную площадь контакта с прилежащей костной тканью и одновременно обладает остеокондуктивным эффектом [10, 11]. За счет придания поверхности имплантата высокой степени шероховатости, определенной пористости, развитой морфологии и структурной гетерогенности достигаются условия высокой степени адгезии, скорости роста (пролиферации) клеток ткани и интеграции с костной тканью, создавая прочное закрепление имплантатов в организме и, следовательно, скорейшее возвращение пациента к активной жизни [11–13]. Недавние исследования показали, что использование наноструктурированных поверхностей металлов, особенно из титана и титановых сплавов, способствует росту костной ткани, поскольку такие поверхности лучше имитируют характерные размеры компонентов кости [14]. В результате имитации естественной наноструктуры кости уменьшается инфицирование, воспаление и увеличивается способность к остеоинтеграции [15], что улучшает долговечность ортопедических имплантатов. Технически шероховатость достигается созданием трехмерной пористой поверхности различными методами: пескоструйной обработкой, спеканием, осаждением, электродуговым или плазменным напылением, микровзрывной техникой, коррозированием и др., а также комбинацией этих методов [5, 16–20]. В качестве поверхностного слоя (покрытия) могут выступать оксиды титана, тантала, кальций-фосфатные или полимерные материалы, углерод [21, 22].
Целью данной работы является определение возможности получения заданной шероховатости поверхности титановых материалов (титана Grade 4 и сплава титана Ti6Al7Nb) для костных имплантатов методом ионно-кластерной технологии.
К настоящему времени накоплен значительный массив экспериментальных данных, свидетельствующий о том, что на основе процессов взаимодействия ускоренных кластерных пучков с поверхностью разнообразных материалов могут быть созданы технологии для различного вида наноструктурирования этих поверхностей [23–26]. Особенностью данного метода обработки поверхности является минимальная глубина нарушенного поверхностного слоя по сравнению с другими методами модификации поверхности [24]. Однако подбор оптимальных режимов в случае любого нового материала требует проведения многочисленных экспериментов, что связано со значительными затратами времени и материальных ресурсов. Это обусловлено как новизной данных технологий (история ионно-кластерной технологии насчитывает всего тридцать лет) [23, 24], так и достаточно узкой направленностью посвященных им теоретических исследований (например, ионно-кластерная технология первоначально была ориентирована прежде всего на обработку материалов для микроэлектроники: кремния, меди и т.д.).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследований использовали образцы изделий, изготовленных из титана Grade 4 (стандарт ASTM F67) и титанового сплава Ti6Al7Nb (стандарт ASTM F1295) в виде дисков толщиной 2 мм и диаметром 8 мм. Обработку поверхности проводили ионно-кластерными пучками из аргона. Параметры обработки: ускоряющее напряжение 20 кВ, среднее число атомов аргона в кластере 2500, поток аргона через сопло 200 мл/с, плотность тока пучка кластерных ионов 4 мкА/см2.
Исследование топологии образцов проводили в сканирующей зондовой лаборатории Интегра Прима (НТ-МДТ, Россия). Сканирование осуществляли в полуконтактной моде. Использовали кантилеверы HA_NC (ScanSens, резонансная частота 235 кГц, радиус заострения острия не более 10 нм, скорость сканирования 0.5 Гц). Пост-обработка включала вычитание наклонной плоскости. Вычисление статистических параметров проводили с помощью программного обеспечения Gwyddon.
Рельеф поверхности образцов исследовали методом атомно-силовой микроскопии (АСМ), структуру образцов – сканирующей электронной микроскопии (СЭМ). СЭМ-изображения получены на сканирующем электронном микроскопе FEI Quanta 3D FEG с термополевым катодом.
Исследование электронной структуры и валентных состояний образцов проводили методом рентгеновской фотоэлектронной спектроскопии (РФЭС) на электронном спектрометре Escalab MK2 (VG Scientific) с немонохроматизированным рентгеновским источником MgKα (Е = 1253.6 эВ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование топологии поверхности образцов выполнено методом атомно-силовой микроскопии. Классическими параметрами, используемыми для характеристики шероховатости поверхности, являются Sq (среднеквадратичная шероховатость), Sa (среднеарифметическая шероховатость) и Sz (максимальная высота рельефа поверхности, определяемая как разность высот между самой высокой и самой низкой точками поверхности на выборочной площади). Результаты изменения шероховатости поверхности образцов приведены на рис. 1.
Рис. 1.
Шероховатость образцов (нм), исследованная методом АСМ. 1 – Ti Grade 4 (режим 1); 2 – Ti Grade 4 (режим 2); 3 – Ti Grade 4 (режим 3); 4 – Ti Grade 4 (режим 4); 5 – Ti6Al7Nb (режим 1); 6 – Ti6Al7Nb (режим 2); 7 – Ti6Al7Nb (режим 3).
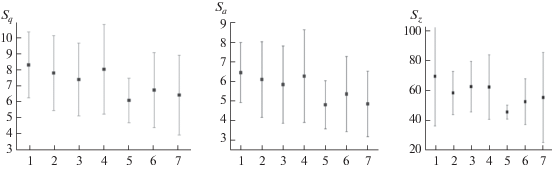
Один и тот же режим обработки поверхности, например режим 1 (табл. 1), приводит к увеличению шероховатости образцов из титана и уменьшает шероховатость поверхности титановых сплавов Ti6Al7Nb. Увеличение дозы кластерно-пучковой обработки приводит к снижению шероховатости образцов из титана и увеличению шероховатости поверхности образцов из титановых сплавов Ti6Al7Nb (табл. 2).
Таблица 1.
Режимы пучково-кластерной обработки поверхности объектов исследования
| Режим | Доза (атом/см2) | Вид пучка | Дополнительная обработка поверхности |
|---|---|---|---|
| 1 | 5 × 1016 | ИКП* | Ионная очистка |
| 2 | 1 × 1017 | ИКП | |
| 3 | 2 × 1017 | ИКП | Создание микрошероховатости |
| 4 | 1 × 1017 | АКП** |
Таблица 2.
Средние значения шероховатости поверхности образцов при выбранных режимах кластерно-пучковой обработки
| Образец | Режим обработки | Sq, нм | Sa, нм | Sz, нм |
|---|---|---|---|---|
| Ti Grade 4 | 1 | 8.33 ± 2.03 | 6.45 ± 1.51 | 69.52 ± 33.29 |
| Ti Grade 4 | 3 | 7.43 ± 2.24 | 5.86 ± 1.94 | 62.56 ± 17.02 |
| Ti6Al7Nb | 1 | 6.15 ± 1.37 | 4.84 ± 1.21 | 45.55 ± 14.66 |
| Ti6Al7Nb | 3 | 6.47 ± 2.45 | 4.87 ± 1.65 | 55.29 ± 30.22 |
Несмотря на то, что средние значения шероховатости поверхности образцов титана и титанового сплава близки, исследование микроструктуры поверхности образцов показало различие в топологических характеристиках данных материалов (рис. 2, 3). Сравнение микроструктуры образцов из титана Grade 4 и титанового сплава Ti6Al7Nb до и после пучково-кластерной обработки показало, что в обоих случаях после обработки формируется волнообразный рельеф с характерными размерами 150–500 нм. Однако в случае образца из титана более четко выражен характер неоднородностей и расстояние между высотами больше, чем на поверхности образца из титанового сплава.
Рис. 2.
Поверхность образца из титана Grade 4 до облучения (а) и после кластерной обработки в режиме 3 (б), увеличение ×50000.

Рис. 3.
Поверхность образца из титанового сплава Ti6Al7Nb до облучения (а) и после кластерной обработки в режиме 3 (б), увеличение ×50000.

Для определения качественного состава поверхности измеряли обзорный спектр в диапазоне энергий связи 0–1200 эВ с шириной полосы пропускания анализатора 50 эВ и шагом измерения 0.5 эВ. В обзорных спектрах образцов титана присутствуют пики, соответствующие углероду (линия C1s, по которой происходила нормировка энергии связи, и оже-пики), кислороду (O1s и оже-пики), титану (Ti2p, Ti2s, Ti3p, Ti3s). В некоторых случаях при измерении образцов без предварительной очистки обнаружены пики, соответствующие азоту (N1s) и кремнию (Si2p, Si2s), что свидетельствует о загрязнении поверхности образца титана поверхностно-активными веществами, используемыми при очистке поверхности (рис. 4).
Рис. 4.
РФЭС-спектры образца из титана Grade 4 до обработки (а) и после кластерной обработки в режиме 3 (б).
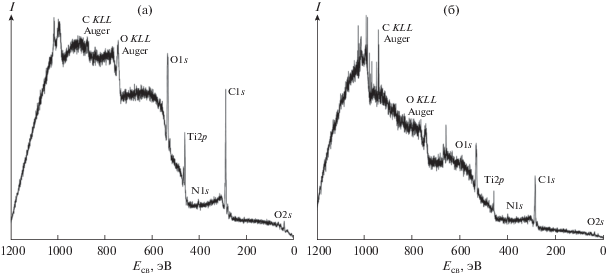
Результаты измерений показали, что образец почти не заряжается, изменение энергии может соответствовать недостаточной калибровке спектрометра. Почти полное отсутствие зарядки можно объяснить малой толщиной оксидной пленки TiO2, которая превышает аналитическую глубину (~3 СДСП), но не препятствует стеканию заряда с поверхности. Таким образом, толщина слоя TiO2 на поверхности превышает 5.3 нм. При рассмотрении тонкой структуры линии Ti2p определено содержание оксидных форм титана. Тонкая пленка поверхности у всех образцов содержала 95–100% диоксида титана и 0–5% металлического титана, это подтверждено значениями энергии связи главного пика (458.59 и 459.1 эВ, что значительно больше энергии связи металла и низших оксидов), а также спин-орбитальным расщеплением пиков в дублете (5.84 и 5.62 эВ при 5.7 эВ для высшего оксида и 6.15 для металлического титана). Показано, что ионно-кластерная обработка снижает содержание углерода, азота и кремния в поверхностном слое титановых образцов по сравнению с необработанными.
Оценку токсичности образцов из титана и титанового сплава проводили на основе исследования жизнеспособности и роста субстратзависимых клеток-предшественников костной ткани на поверхности данных материалов.
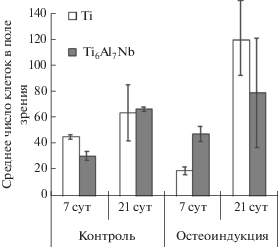
Экспериментальное исследование остеодифференцировки проводили на клетках линии Th27, культивированных на образцах из титана Grade4 и сплава Ti6Al7Nb с разными режимами кластерно-пучковой обработки. Экспериментальные клетки культивировали в индукционной среде в течение 7 и 21 сут и исследовали на каждом сроке; контролем для опыта служили клетки, культивированные в неиндукционной среде. Согласно отработанной методике, окрашивание клеток проводили антителами против остеокальцина и Runx2 по стандартному протоколу двойного окрашивания и при разведении антител.
При длительном культивировании на экспериментальных образцах наблюдали активную пролиферацию клеток и образование плотного монослоя. Значительных различий в количестве клеток при культивировании на экспериментальных образцах из титана Grade 4 и сплава Ti6Al7Nb выявлено не было (рис. 5). Численность клеток заметно варьировали между отдельными образцами в группах образцов из титана и титанового сплава, и выделить тенденцию по стабильному увеличению количества клеток на каком-либо образце было трудно. На 7 сутки культивирования в остеогенной среде выявлено больше клеток на сплаве, чем на титане, но на 21 сутки наблюдалась противоположная картина.
ЗАКЛЮЧЕНИЕ
Данные экспериментального исследования показали перспективность использования методов ионно-кластерной технологии для получения заданной шероховатости материалов на основе титана Grade 4 и титанового сплава Ti6Al7Nb. Показано, что ионно-кластерная обработка приводит к снижению содержания углерода, азота и кремния на поверхности титановых образцов по сравнению с необработанными материалами. Учитывая общие механизмы адгезии субстратзависимых клеток, можно утверждать, что выбор эффективных режимов кластерно-пучковой обработки поверхности имплантатов обеспечивает увеличение остеоинтегративных свойств поверхности материалов для костных имплантатов.
Список литературы
Titanium alloys – Towards achieving enhanced properties for diversified applications / Ed. Nurul Amin A.K.M. Rijeka: InTech, 2012. 238 p. ISBN: 978-953-51-0354-7
Chen Q., Thouas G.A. // Mater. Sci. Eng., R. 2015. V. 87. P. 1. https://doi.org/10.1016/j.mser.2014.10.001
Balazic M., Kopac J., Jackson M.J., Ahmed W. // Int. J. Nano and Biomater. 2007. V. 1. № 1. P. 3. https://doi.org/10.1504/IJNBM.2007.016517
Liua X., Chub P.K., Ding Ch. // Mater. Sci. Eng., R. 2004. V. 47. P. 49. https://doi.org/10.1016/j.mser.2004.11.001
Yang H., Yu M., Wang R. et al. // Acta Biomater. 2020. V. 116. P. 400. https://doi.org/10.1016/j.actbio.2020.09.005
Gittens R.A., Scheideler L., Rupp F. et al. // Acta Biomater. 2014. V. 10. P. 2907. https://doi.org/10.1016/j.actbio.2014.03.032
Morra M., Cassinelli C., Cascardo G. et al. // J. Biomed. Mater. Res. A. 2011. V. 96. P. 449. https://doi.org/10.1002/jbm.a.32948
Pullisaar H., Tiainen H., Landin M.A. et al. // J. Tissue Eng. 2013. https://doi.org/10.1177/2041731413515670
Papynov E.K., Shichalin O.O., Buravlev I.Yu. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 2. P. 263. https://doi.org/10.1134/S0036023620020138
Zhao G., Schwartz Z., Wieland M. et al. // J. Biomed. Mater. Res. A. 2005. V. 74. P. 49. https://doi.org/10.1002/jbm.a.30320
Karazis D., Petronis S., Agheli H. et al. // Acta Biomater. 2017. V. 53. P. 559. https://doi.org/10.1016/j.actbio.2017.02.026
Herrero-Climent M., Lázaro P., Vicente Rios J. et al. // J. Mater. Sci. Mater. Med. 2013. V. 24. P. 2047. https://doi.org/10.1007/s10856-013-4935-0
Souza J.C.M., Sordi M.B., Kanazawa M. et al. // Acta Biomater. 2019. V. 94. P. 112. https://doi.org/10.1016/j.actbio.2019.05.045
Webster T.J., Ejiofor J.U. // Biomaterials. 2004. V. 25. P. 4731. https://doi.org/10.1016/j.biomaterials.2003.12.002
Liu H., Webster T.J. // Biomaterials. 2007. V. 28. P. 354. https://doi.org/10.1016/j.biomaterials.2006.08.049
Tang D., Yang L.Y., Ou K.L. et al. // Front. Bioeng. Biotechnol. 2017. V. 5. P. 77. https://doi.org/10.3389/fbioe.2017.00077
Chrcanovic B.R., Martins M.D. // Materials Res. 2014. V. 17. № 2. P. 373. https://doi.org/10.1590/S1516-14392014005000042
Lan G., Li M., Tan Y. et al. // J. Mater. Sci. Technol. 2015. V. 31. P. 182. https://doi.org/10.1016/j.jmst.2014.08.007
Huang Y., Zha G., Luo Q. et al. // Sci. Rep. 2014. № 4. P. 6172. https://doi.org/10.1038/srep06172
Priyadarshini B., Rama M., Vijayalakshmi C. et al. // J. Asian Cer. Soc. 2019. V. 7. № 4. P. 397. https://doi.org/10.1080/21870764.2019.1669861
Grishchenko D.N., Slobodyuk A.B., Kuryavyi V.G. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1606. https://doi.org/10.1134/S0036023620100083
Asri R.I.M., Harun W.S.W., Samykano M. et al. // Mater. Sci. Eng. C. 2017. V. 77. P. 1261. https://doi.org/10.1016/j.msec.2017.04.102
Ieshkin A., Ermakov Y., Chernysh V. et al. // Nucl. Instrum. Methods. A. 2015. V. 795. P. 395. https://doi.org/10.1016/j.nima.2015.06.026
Yamada I. // Curr. Opin. Solid. State Mater. Sci. 2015. V. 19. P. 12. https://doi.org/10.1016/j.cossms.2014.11.002
Kirkpatrick A., Kirkpatrick S., Walsh M. et al. // Nucl. Instrum. Methods, B. 2013. V. 307. P. 281. https://doi.org/10.1016/j.nimb.2012.11.084
De Vido M., Ertel K., Jonathan Ph.P. et al. // Optic. Mater. Expr. 2017. V. 7. № 9. P. 3303. https://doi.org/10.1364/OME.7.003303
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии