Журнал неорганической химии, 2021, T. 66, № 8, стр. 1077-1085
УСЛОВИЯ АЗОТИРОВАНИЯ СМЕШАННЫХ КСЕРОГЕЛЕЙ ИЗ АЛКОКСИДОВ КРЕМНИЯ И АЛЮМИНИЯ
С. Н. Ивичева a, *, А. А. Климашин a, Н. А. Овсянников a, А. С. Лысенков a, Ю. Ф. Каргин a
a Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: ivitcheva@mail.ru
Поступила в редакцию 27.01.2021
После доработки 05.03.2021
Принята к публикации 09.03.2021
Аннотация
Установлены условия образования β-SiAlON в процессе реакционного взаимодействия при 1600–1700°С высокодисперсных смешанных ксерогелей из алкоксидов кремния и алюминия с молекулярным азотом. Показано, что процессы азотирования смешанных ксерогелей происходят за счет каталитического пиролитического разложения в атмосфере азота продуктов гидролиза алкоксидов кремния и алюминия, а именно смеси спиртов, адсорбированных и хемосорбированных на поверхности частиц алюмосиликатных ксерогелей. Пиролиз спиртов в атмосфере азота идет при каталитическом действии высокодисперсного глинозема с образованием водорода и угарного газа, которые активируют процессы азотирования и влияют на фазовый состав образцов и изменение стехиометрии сиалона от β-Si3Al3O3N5 до 15R-политипа.
ВВЕДЕНИЕ
В системе Si–Al–O–N изучены особенности синтеза сиалонов, полученных спеканием при 1600–1750°С в атмосфере азота высокодисперсных смешанных ксерогелей из алкоксидов кремния и алюминия. Образование сиалона из смешанного ксерогеля подразумевает взаимодействие аморфного водного алюмосиликата с молекулярным азотом. Однако молекула азота крайне прочна, и диссоциация молекул азота для реакций азотирования водных оксидов даже при температурах эксперимента 1600–1750°С без специальных активирующих процесс добавок теоретически невозможна. Азот при высоких температурах реагирует только с металлами и металлоидами. Нитриды и оксинитриды образуются при взаимодействии азота с оксидом только в присутствии восстановителя, например углерода (реакция Серпека) [1], который существенно загрязняет конечный продукт.
Возможность синтеза сиалонов с использованием активных высокодисперсных оксидов кремния и алюминия, полученных при варьировании условий гидролиза алкоголятов алюминия и кремния в атмосфере азота, показана в работах [2–5]. Установлено, что азотирование оксидов, полученных золь-гель методом, может происходить за счет пиролитического разложения органических продуктов гидролиза алкоксидов металлов [2] без дополнительного введения восстановителей.
Образование устойчивого высокодисперсного смешанного оксида Si/Al, связано с близостью размеров геометрически подобных алюминат-иона ${\text{Al}}({\text{OH}})_{4}^{ - }$ и Si(OH)4, одинаковым координационным числом (4 или 6) по отношению к кислороду и близостью размеров атомов Si и Al [6]. Предполагается, что азотирование высокодисперсных смешанных оксидов позволит получить сиалоны высокой степени чистоты и однородности.
В настоящее время методы на основе пиролиза смесей органических и неорганических исходных веществ, органических солей и растворов используются при получении высокодисперсных порошков γ-Al2O3 [7], стекол [8] и упорядоченных композитов [9]. Термическое разложение органической составляющей способствует интенсификации гетерогенных реакций, увеличению удельной поверхности частиц, активации молекул реагентов на поверхности раздела и фазовым превращениям.
Цель настоящей работы – изучение особенностей синтеза сиалона в процессе реакционного взаимодействия высокодисперсных смешанных ксерогелей, полученных в результате гидролиза алкоксидов кремния и алюминия, с молекулярным азотом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Золь-гель процесс с участием двух алкоксидов тетраэтоксисилана Si(OC2H5)4 и втор-бутоксида алюминия Al(OR)3, где OR – алкоксогруппа, может рассматриваться как двухстадийная неорганическая полимеризация. Процесс инициируется гидролизом алкоксогруппы, что приводит к образованию смеси спиртов (C2H5OH, C3H8OH, С4H9OH и др.) и гидроксилированных металлических центров. Затем происходит трехмерное распространение этого процесса и образование смешанных оксополимеров кремния или алюминия (рентгеноаморфных аллофанов). Si(OR)4 и Al(OR)3 обладают хорошей реакционной способностью в процессах гидролиза. Поликонденсацию промежуточных продуктов можно контролировать подбором рН среды, концентрацией золя, растворителя и температурой. Составы смешанных золей из исходных алкоксидов алюминия и кремния приведены исходя из расчетного состава Si3Al3O3N5 (β-сиалон).
Для приготовления золей использовали алкоголяты кремния и алюминия: тетраэтоксисилан чистотой >98% фирмы Мerck и свежеприготовленный втор-бутоксид алюминия, полученный взаимодействием металлического алюминия с бутиловым спиртом в присутствии катализатора (соединения галлия), дистиллированную воду, этиловый и изопропиловый спирты. Скорость полимеризации смешанных ксерогелей контролировали кислотными катализаторами (азотной кислотой), регулирующими процесс поликонденсации и образование смешанного гидроксида 3SiO2 · 1.5Al2O3 · nH2O, в результате чего получали высокодисперсные порошки гидратированных смешанных оксидов или полимеры с трехмерной сетчатой структурой, образующие прозрачный монолитный ксерогель. На рис. 1 показана фотография монолитного образца ксерогеля (полимерного стекла) состава 3SiO2 · 1.5Al2O3 · nH2O.
Рис. 1.
Фотография монолитного образца ксерогеля (полимерного стекла) состава 3SiO2 · 1.5Al2O3 · nH2O.

Условия фазовых превращений при синтезе сиалонов из смешанных ксерогелей определяли по данным термогравиметрического анализа (ДТА–ТГ) в атмосфере азота. Предполагаемые процессы азотирования регистрировали по изменению массы образцов на ТГ-кривых. Эксперименты проводили в корундовых тиглях со скоростью нагревания 10 град/мин до температуры 1450°С в токе азота с расходом 50 мл/мин. Фазовые превращения в аморфных ксерогелях исследовали методом рентгенофазового анализа (РФА, дифрактометр XRD 6000 Shimadzu, CuKα-излучение, λ = 1.54184 Å). Фазовый анализ образцов проводили с использованием базы данных JCPDS–ICDD (2003) [10]. Морфологические особенности образцов изучали с помощью сканирующей электронной микроскопии на микроскопе Tescan Vega II SBU c микроанализатором фирмы Oxford Instruments для локального рентгеноспектрального анализа (ЛРСА). Исследование летучих компонентов десорбции и химических превращений продуктов гидролиза в результате термообработки образца в атмосфере азота проводили с помощью газовой хроматографии на хроматографе Кристаллюкс-4000М.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из работ [11, 12] известно, что спирты могут разлагаться в атмосфере азота по-разному:
1) под влиянием металлов (цинка, железа, латуни и др.) и оксидов, которые выступают в качестве катализатора, с образованием альдегида или кетона и водорода:
2) под влиянием глинозема и глины с образованием предельных и непредельных углеводородов и воды, например, этиловый спирт разлагается с образованием этилена и воды:
Отмечено, что при разложении этилового спирта в присутствии оксида алюминия в атмосфере азота происходит образование бутадиена [13]. Кроме того, еще в начале XX в. была высказана гипотеза о каталитических действиях глинозема в отношении дегидратации спиртов [14]. При этом анализ газовых продуктов реакции разложения этилового спирта в азоте [12] показал, что более 30% газовой фазы относится к СО, более 5% составляет водород и более 17% − газообразный непредельный углеводород CnH2n + 2. На основании этих исследований сделан вывод, что одним из лучших катализаторов обезвоживания спиртов в атмосфере азота, в частности этанола до этилена, является γ-глинозем. При высокотемпературном (от 400−900°С) разложении спиртов в присутствии глинозема в качестве продуктов реакции указываются альдегид и водород, альдегид впоследствии разлагается на более простые газы: этилен, метан, СО (окись углерода) и водород. Разложение вторичных спиртов происходит также по двум направлениям: в первом случае изопропанол разлагается в атмосфере азота на ацетон и водород, во втором – на пропилен и воду. Все это обусловило применение обжига полимерных гелей без удаления продуктов гидролиза алкоголятов кремния и алюминия и дисперсионных жидкостей золей, представленных в основном смесью спиртов, в атмосфере азота для синтеза сиалонов.
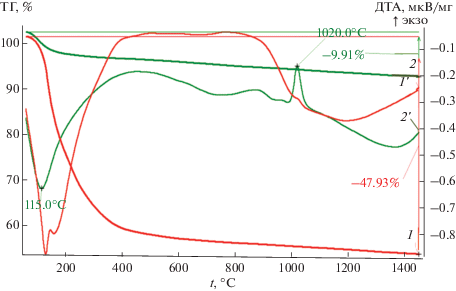
Термический анализ исходных гелей проводили в атмосфере азота после разных этапов обработки: 1 − после полимеризации и старения золей при комнатной температуре на воздухе, при этом потери массы при ТГ-анализе могли составлять до 60%; 2 − после неизотермической термообработки (сушки) при 600°С в атмосфере азота также с целью снижения летучих продуктов гидролиза (воды, спиртов и др.) и их пиролитического разложения в атмосфере азота, после чего основные потери при ДТА не превышали 10%. На рис. 2 показаны кривые ТГ-анализа образцов смешанных ксерогелей, высушенных при комнатной температуре и предварительно отожженных при 600°С в атмосфере азота. На кривой ТГ-2 в низкотемпературном диапазоне (до 200°С) отчетливо видны существенные потери массы, связанные с удалением легколетучих компонентов, даже после предварительного неизотермического температурного обжига при 600°С. На основании этого можно заключить, что выделение газообразных продуктов пиролиза органической составляющей происходит и после неизотермического отжига в азоте после 600°С. На кривых ТГ (линии 1 и 2) отмечены экзотермические эффекты в диапазоне 800–1100°С (более отчетливо проявляющиеся в предварительно отожженных образцах), очевидно, связанные с кристаллизацией алюмосиликатов. Однако прироста массы смешанных ксерогелей за счет азотирования на термограммах до 1450°С отмечено не было, это может свидетельствовать о более высоких температурах их взаимодействия с азотом.
Рис. 2.
Результат термического анализа смешанных ксерогелей в атмосфере азота после старения золя при Тк (1 и 1') и после неизотермического отжига в атмосфере азота при 600°С (1, 2 − кривые изменения массы, 1' и 2' − ДТА-кривые).
Следует отметить, что для смешанных ксерогелей при термогравиметрии, совмещенной с масс-спектральным анализом, в атмосфере азота наблюдался высокий ионный ток водорода (M.м. = 2), а также радикалов с M.м. = 28, а при температурах 500–600°С фиксировались радикалы, которые можно было отнести к разным летучим компонентам разложения спиртов и дисперсионных жидкостей, включая минеральные кислоты. Например, радикал с M.м. = 44 можно отнести не только к С3H8+ (изопропиловый спирт присутствовал в смешанных золях в качестве дисперсионной жидкости), СO2+, N2O+ (азотная кислота выступала в качестве катализатора полимеризации золя, отжиг в азоте), но и к SiO+. Однозначно выделить составляющую радикала CO+, который также имеет молекулярную массу 28, в атмосфере азота проблематично, поскольку молекулярный азот имеет такую же массу.
Для идентификации превращений адсорбированных и хемисорбированных продуктов гидролиза в атмосфере азота на смешанном ксерогеле из втор-бутоксида алюминия и тетраэтоксисилана применена газовая хроматография – метод разделения летучих компонентов. Анализ проводили на двух адсорбентах.
Для хроматографических исследований в U-образный кварцевый реактор загружали 1 г порошка смешанного геля 3SiO2 · 1.5Al2O3 · nH2O, высушенного при Тк. Предполагаемые каталитические превращения адсорбированных продуктов гидролиза проводили в атмосфере азота при объемной скорости подачи азота 20 мл/мин в интервале температур от комнатной до 950°С. Температуру в реакционной зоне реактора определяли с помощью термопары, расположенной в центре слоя порошка из смешанного геля.
Для анализа газов использовали детектор по теплопроводности, в качестве газа-носителя – гелий, адсорбентом в разделительных колонках служили цеолиты 5А на основе алюмосиликатов. Характерной особенностью цеолитов является строго регулярная система пор со среднегеометрическими размерами от 3 до 10 Å. Цеолит 5А обладает большой удельной поверхностью и может эффективно поглощать из газообразных продуктов ряд компонентов (например, H2O, CO2 и др.) и с трудом “отдавать” ряд сконцентрированных примесей, но он легко разделяет неорганические газы (H2, O2, N2, CO) и легкие углеводороды (CH4), которые могут образоваться при пиролитическом разложении продуктов гидролиза алкоксидов в атмосфере азота, если таковые процессы будут происходить. Компонентный состав вычисляли методом предварительной калибровки. Все значимые компоненты или группы компонентов, подлежащие определению в газовой пробе, физически разделяются методом газовой хроматографии, и их молярная (количественная) доля измеряется посредством сравнения с данными градуировки, полученными при тех же условиях. Поэтому градуировочные газы и газовую пробу анализировали с помощью той же самой системы измерений и при тех же условиях.
Идентификацию газов, выделившихся в смеси, осуществляли по изменению сигнала во времени. В качестве градуировочных эталонов использовали не индивидуальные газы, которые могли образоваться в результате пиролитических превращений (H2, O2, N2, CO), а сертифицированную газовую смесь, состоящую из 2.5% кислорода (O2), 5% метана (CH4) и 92.5% азота (N2), в которую были добавлены индивидуальные газы водород (H2) и монооксид углерода (CO) в количестве 5 и 10% соответственно. Такую эталонную смесь использовали потому, что в смесях газы могут показывать другие области проявления сигнала по сравнению с индивидуальными газами. На рис. 3 показаны хроматограммы эталонной газовой смеси и, например, газовой смеси, зафиксированной при обработке образца смешанного ксерогеля при 650°С в атмосфере азота.
Рис. 3.
Хроматограммы эталонной смеси газов (а) и газовой смеси, выделившейся при термической обработке образца смешанного ксерогеля в атмосфере азота при 650°С (б).
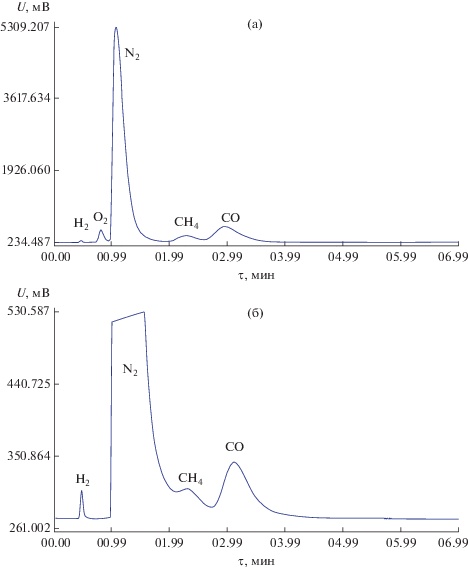
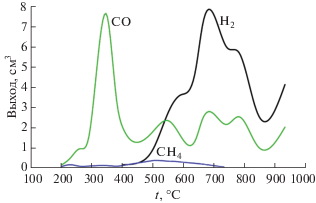
Поскольку отбор газов для исследования проводили в проточной (открытой) системе, говорить о корректной количественной оценке выхода тех или иных газов не представляется возможным. Однако качественное определение и пересчет с учетом градуировки позволили оценить температурные интервалы образования и порядок выделения газообразных продуктов пиролиза адсорбированных на поверхности 1 г ксерогеля органических веществ, показанных на рис. 4. Следует отметить, что начало выделения газообразных продуктов пиролиза зафиксировано начиная с 200°С, при этом отмечали только метан и угарный газ, который выделялся во всем температурном интервале экперимента. Около 400°С впервые зафиксирован водород, максимальное количество которого регистрировалось при 600–700°С и оставалось довольно высоким в температурном диапазоне эксперимента. Максимальное количество метана фиксировали при ~500°С. На твердом носителе Paropak Q в атмосфере азота фиксировали выделение CO2 (до 250°С).
Рис. 4.
Температурные интервалы образования и выделения газообразных продуктов пиролиза спиртов в атмосфере азота, адсорбированных на поверхности 1 г ксерогеля 3SiO2 · 1.5Al2O3 · nH2O.
Для синтеза сиалона обжиг высокодисперсных смешанных Al/Si-ксерогелей проводили в корундовых тиглях в печи с графитовым нагревателем в атмосфере азота при температурах 1600, 1650 и 1700°С. При 1600 и 1650°С образуется β-сиалон с небольшим количеством корунда, т.е. фиксируется недостаток кремния в стехиометрическом составе. При увеличении температуры спекания до 1700°С образуется политип R15 (SiAl4O2N4 [53-1012], Si–Al–O–N [32-0026]) или смеси сиалонов.
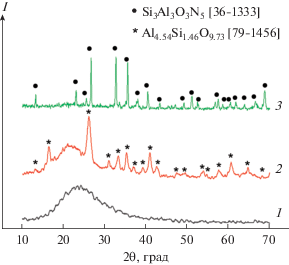
На рис. 5 показана последовательность фазовых превращений высокодисперсного смешанного ксерогеля 3SiO2 · 1.5Al2O3 · nH2O после различных режимов обжига в атмосфере азота. После низкотемпературного обжига при 600°С в смешанных ксерогелях фиксируется гало, указывающее на рентгеноаморфность образца. Гало имеет несимметричную форму, смещенную относительно центра тяжести кристобаллита в область больших углов, которая свидетельствует о том, что эта переходная форма отвечает образованию смешанного Al/Si-оксида (алюмосиликата). После обжига при 1100°С в атмосфере азота на фоне гало фиксируются широкие рефлексы алюмосиликата, рефлексы которого оказались ближе всего к Al4.54Si1.46O9.73 [79-1456], при этом центр тяжести гало сдвигается ближе к кристобаллиту, т.е. часть диоксида кремния еще остается в рентгеноаморфном состоянии. При различной выдержке при температуре выше 1000°С отмечали формирование алюмосиликатов со структурой муллита (3Al2O3 · 2SiO2) и силлиманнита (Al2SiO5), в которых нет четкого соотношения Al2O3/SiO2. После 1450°С не исключалось и формирование оксонитридов кремния и алюминия, т.е. начало процесса азотирования с формированием промежуточной фазы Si6Al10O21N4 [36-0832].
Рис. 5.
Изменение фазового состава порошков смешанных ксерогелей 3SiO2 · 1.5Al2O3 · nH2O после обжига в атмосфере азота при 600 (1), 1100 (2) и 1650°С (3).
На рис. 6 показана морфология наночастиц исходного высокодисперсного смешанного ксерогеля 3SiO2 · 1.5Al2O3 · nH2O, высушенного при комнатной температуре, и частиц сиалона, полученных при различных режимах обжига в атмосфере азота. Исходный порошок (рис. 6а) состоял из наночастиц округлой формы размером от 20 до 50 нм, образующих более крупные агломераты. Площадь удельной поверхности синтезированного порошка смешанного ксерогеля, оцененная по данным BET, составила ~200 м2/г. На рис. 6б–6г отчетливо видна трансформация сферических наночастиц в прочные агломераты из сросшихся хорошо ограненных кристаллов при разных температурах обжига. После обжига при 1600°С агломераты сложены кристаллическими стержнями среднего сечения 1 мкм и длиной 2−4 мкм с квадратным или шестигранным сечением (рис. 6б). В образце, отожженном при 1650°С, в общей массе припекшихся частиц видна большая доля кристаллов стержневидной формы. На рис. 6г и 7а видно, что при 1700°С из смешанного ксерогеля в атмосфере азота помимо призматических кристаллов образуются нитевидные кристаллы ограненной и трубчатой формы, на кончиках некоторых имеются характерные капли. Можно предположить, что рост нитевидных кристаллов происходит по механизму пар–жидкость–кристалл. На диаграмме (рис. 7г) показано содержание элементов в призматических кристаллитах сиалона.
Рис. 6.
Морфология частиц исходного порошка 3SiO2 · 1.5Al2O3 · nH2O (a) и сиалонов после обжига при температурах 1600 (б) 1650 (в) и 1700°С (г).

Рис. 7.
Элементный состав сиалона, полученного обжигом при 1700°С в атмосфере азота смешанного ксерогеля 3SiO2 · 1.5Al2O3 · nH2O по данным ЛРСА. Пример области исследования (а, б), 1 – призматический кристалл, 2 – трубчатый вискер, 3 – ограненный нитевидный кристалл сиалона. Количественные результаты исследования элементного состава призматических кристаллов сиалона: в – спектр характеристического рентгеновского излучения с использованием энергодисперсионного (EDS) детектора; г – диаграмма элементного состава сиалона.
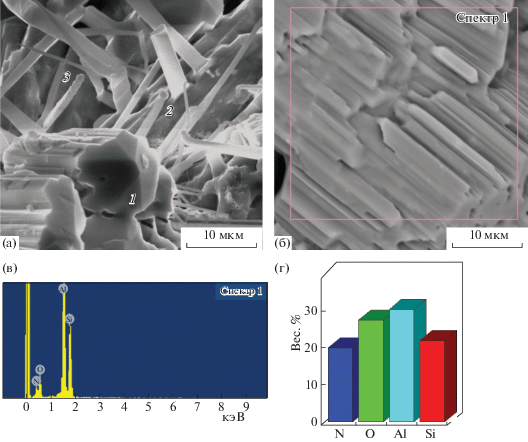
Сравнительное содержание элементов (по данным элементного анализа и ЛРСА) в образцах сиалона, полученных термообработкой аморфного смешанного ксерогеля при 1700°С в атмосфере азота, показано в табл. 1. Приведены также данные по элементному составу ограненных нитевидных кристаллов и трубчатых вискеров с каплями. В ряде капель, расположенных на концах нитевидных кристаллов, по данным ЛРСА, отмечено большее содержание кремния и в единичном образце зафиксировано железо. Поскольку для приготовления золей использовали особо чистые химреактивы, появление Fe можно считать артефактом, что требует дополнительного исследования источника загрязнения.
Таблица 1.
Элементный состав сиалонов, полученных обжигом при 1700°С в атмосфере азота смешанного ксерогеля 3SiO2 · 1.5Al2O3 · nH2O по данным ЛРСА
| Образец | Элемент, вес. % | ||||
|---|---|---|---|---|---|
| N | O | Al | Si | Fe | |
| Призматические кристаллы 1 SiALON* (рис. 7а-1, 7б) | 20.0 | 27.5 | 30.5 | 22.0 | – |
| Трубчатый кристалл (вискер с каплей 2) (рис. 7а) | 19.1 | 26.8 | 26.8 | 20.7 | 6.6 (?) |
| Трубчатый кристалл (вискер с каплей 2) | 18.5 | 19.2 | 32.6 | 29.7 | – |
| Ограненный кристаллический нитевидный кристалл (рис. 7а-3) |
5.9 | 12.5 | 47.9 | 33.7 | – |
Исходя из результатов химических исследований, схемы превращений в реакционных смесях с участием смешанных ксерогелей можно представить в виде классического процесса карботермического восстановления-азотирования с участием углерода, который может образоваться при каталитическом последовательном пиролизе спиртов или с участием газообразных участников окислительно-восстановительных превращений, таких как угарный газ и водород:
При этом следует учитывать, что водород и угарный газ могут участвовать и в других окислительно-восстановительных процессах, например, восстанавливать SiO2 до газообразного SiO; косвенным подтверждением этого факта является недостаток в соотношении Si/Al, который изменяет стехиометрию β-Si3Al3O3N5, образуя 15R-политип сиалона (методом РФА фиксировались Si–Al–O–N [32-0026] и SiAl4O2N4 [53-1012]) с меньшим соотношением Si/Al. Кроме того, в условиях эксперимента в исходных смешанных ксерогелях при каталитическом пиролизе спиртов в присутствии высокодисперсного оксида алюминия не исключается восстановление части оксида кремния до кремния, активирующего не только процесс азотирования, что также объясняет рост нитевидных кристаллов сиалона по механизму пар–жидкость–кристалл (рис. 6, 7).
ЗАКЛЮЧЕНИЕ
Химические превращения смешанных ксерогелей на основе алкоксидов кремния и алюминия связаны не только с реакциями разложения гидратированных оксидов, но и с восстановительными процессами в гидратированных гелях за счет пиролитического разложения спиртов в атмосфере азота с выделением водорода, окиси углерода и метана, образование которых доказано газовой хроматографией. Взаимодействие между смешанным ксерогелем, полученным на основе алкоксидов кремния и алюминия, и молекулярным азотом относится к реакциям восстановления–азотирования, в которых инициаторами окислительно-восстановительных превращений являются органические продукты гидролиза алкоксидов кремния и алюминия и их пиролитического разложения в атмосфере азота, которые активизируют процесс азотирования молекулярным азотом и синтез сиалонов.
Список литературы
Serpec O. Brit Patent. № 13579.1906.
Ивичева С.Н., Овсянников Н.А., Лысенков А.С. и др. // Журн. неорган. химии. 2020. Т. 65. № 12. С. 1614. [Ivicheva S.N., Ovsyannikov N.A., Lysenkov A.S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 12. P. 1820.] https://doi.org/10.1134/S0036023620120050
Ivicheva S.N., Lysenkov A.S., Ovsyannikov N.A. et al. // IOP Conference Series: Materials Science and Engineering. 2018. V. 347. Art. 012046. https://doi.org/10.1088/1757-899X/347/1/012046
Ivicheva S.N., Lysenkov A.S., Ovsyannikov et al. // IOP Conference Series: Materials Science and Engineering. 2019. V. 525. № 1. Art. 012084. https://doi.org/10.1088/1757-899X/525/1/012084
Ягодин В.В., Ищенко А.В., Ивичева С.Н. и др. // Проблемы спектроскопии и спектрометрии. 2018. Т. 40. С. 87.
Айлер Р.К. Химия кремнезема: пер. с англ. М.: Мир, 1982. Ч. 1, 2. 712 с.
Панасюк Г.П., Козерожец И.В., Семенов И.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1286. [Panasyuk G.P., Kozerozhets I.V., Semenov E.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1303.] https://doi.org/10.1134/S0036023618100157
Кириленко И.А., Панасюк Г.П., Азарова Л.А. и др. // Журн. неорган. химии. 2019. Т. 64. № 7. С. 782. [Kirilenko I.A., Panasyuk G.P., Azarova L.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 941.] https://doi.org/10.1134/S0036023619070106
Ивичева С.Н., Каргин Ю.Ф., Сахаров С.Г. // Журн. неорган. химии. 2014. Т. 59. № 10. С. 1312. [Ivicheva S.N., Kargin Y.F., Sakharov S.G. // Russ. J. Inorg. Chem. 2014. V. 59. № 10. P. 1077.] https://doi.org/10.1134/S0036023614100088
JCPDS-International Centre for Diffraction Data. All rights reserved PCPDFWIN. 2003. V. 2.4.
Ipatiew W. // J. Prakt. Chem. 1903. V. 67. P. 420.
Ипатьев В.Н. Каталитические реакции при высоких температурах и давлениях. М.: Изд-во АН СССР, 1936. 779 с.
Горин Ю.А. // Академик Сергей Васильевич Лебедев. М.: Изд-во АН СССР, 1954. С. 213.
Ипатьев В.Н., Орлов Н.А.,Петров А.Д. Глинозем как катализатор в органической химии. Л., 1927.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


