Журнал неорганической химии, 2021, T. 66, № 7, стр. 863-868
Сольвотермальный подход к синтезу иодидных и бромидных треугольных кластерных комплексов Re(III)
М. А. Михайлов a, *, Т. С. Сухих a, М. Н. Соколов a, b, c
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
c Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Республика Татарстан, Россия
* E-mail: mikhajlovmaks@yandex.ru
Поступила в редакцию 03.02.2021
После доработки 11.03.2021
Принята к публикации 12.03.2021
Аннотация
Кристаллический Re3I9 (1) получен с количественным выходом по гидротермальной реакции NaReO4 c концентрированной кислотой HI при 200°С. Установлено, что реакция Re3I9 c концентрированной кислотой HBr при 200°С приводит к полному замещению иодидных лигандов на бромидные с сохранением кластерного ядра, а при добавлении в реакционную смесь пиридина кристаллизуется пиридиниевая соль (PyH)2[Re3Br11(H2O)] · 4H2O (2). В присутствии фосфорной кислоты выделены комплексы (PyH)2[Re3Br9(PO4H)] · H2O (3) и (Et4N)2[Re3Br9(PO4H)] · 2H2O (4). Кристаллические структуры соединений 2–4 определены методом рентгеноструктурного анализа. Комплексы 1 и 4 охарактеризованы с помощью рентгенофазового анализа, соотношение Re/галоген для соединений 1–4 определено методом энергодисперсионной спектроскопии. Данные элементного анализа и 31P ЯМР-спектроскопии получены для соединения 4, спектры колебательной спектроскопии записаны для 1 (дальняя ИК-область) и 4 (ближняя ИК-область). Данные термической стабильности в инертной атмосфере получены для 1.
ВВЕДЕНИЕ
Тригалогениды рения были получены вскоре после открытия этого элемента в начале 1930-х гг. [1], но их кластерная природа установлена лишь в 1960-е гг. По данным рентгеноструктурного анализа (РСА), ReX3 (X = Cl, Br, I) содержат треугольные кластерные группировки {Re3(μ2-X)3}6+, связанные галогенидными мостиками в слои (хлорид, бромид) или зигзагообразные цепочки (иодид), и более адекватно описываются утроенной формулой Re3X9 [2–4]. Интерпретация коротких расстояний рений–рений как результат образования двойной связи между атомами металла явилась важной вехой в становлении концепции кластеров как отдельного класса химических соединений. Эта необычная связевая ситуация (три двойные связи металл–металл в трехчленном цикле) по-разному интерпретируется теоретиками: либо как пример системы с высокой степенью ароматичности [5], либо как система с полностью локализованными π-связями Re–Re [6]. Химические свойства кластерных тригалогенидов рения активно изучались в 60–80-е гг., при этом были найдены примеры как реакций замещения лигандов без изменения кластерного ядра, так и реакций, ведущих к трансформации кластера [7]. Позднее было показано, что тригалогениды Re3X9 являются удобными строительными блоками и/или стартовыми соединениями для получения халькогенидных и пниктидных кластеров рения [8–11]. Тем не менее, на наш взгляд, химические свойства и синтетический потенциал этого интересного класса соединений изучены недостаточно. Это во многом связано с отсутствием удобных способов получения Re3X9 в больших количествах. Анализ опубликованных методов синтеза показывает, что самым доступным из тригалогенидов является наименее изученный Re3I9, а получение хлорида и бромида требует нескольких стадий [12]. Прямым синтезом из простых веществ может быть получен лишь Re3Br9, однако экспериментальные условия (многодневное нагревание при 600°С в запаянной ампуле) создают опасность взрыва ампулы и не позволяют нарабатывать большие количества продукта [13]. В настоящей работе предложена оптимизированная методика синтеза кристаллического Re3I9 и его превращения в бромид и его производные с количественным выходом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерчески доступные реактивы (NaReO4, HI, HBr, H3PO4, Et4NBr, пиридин) со степенью чистоты не ниже “ч. д. а.”. ИК-спектры регистрировали на Фурье-спектрометрах Scimitar FTS 2000 (4000–400 см–1) и Vertex 80 (600–100 см–1). Энергодисперсионную рентгеновскую спектроскопию выполняли на спектрометре Hitachi Tabletop Microscope TM-3000, снабженном системой Quantax 70. Спектр 31P ЯМР записывали на спектрометре Bruker Avance 500 при комнатной температуре c H3PO4 в качестве внутреннего стандарта. Рентгенофазовый анализ (РФА) проводили на порошковом дифрактометре Shimadzu XRD-7000 (CuKα-излучение, OneSight линейный детектор) в интервале углов 3° < 2θ < < 60° с шагом 0.0143° при комнатной температуре, толщина слоя образца составляла 100 мкм. Теоретическая дифрактограмма для Re3I9 была рассчитана из опубликованных данных по структуре монокристалла [4]. Термогравиметрический анализ выполняли на термоанализаторе Netzsch STA 449 F1 Jupiter. Измерения проводили в гелиево-водородной атмосфере (10 об. % H2) в области температур 30–800°C, скорость потока 30 мл/мин, открытый корундовый тигель, скорость нагревания 10 град/мин. Экспериментальные данные обрабатывали с помощью стандартного программного пакета Proteus Analysis [14].
Рентгеноструктурный анализ соединений 2–4 (табл. 1) проводили по стандартной методике на автоматическом четырехкружном дифрактометре Bruker Apex DUO, оснащенном двухкоординатным CCD-детектором, с использованием излучения MoKα (λ = 0.71073 Å) и графитового монохроматора. Интенсивности отражений измерены методом φ- и ω-сканирования узких (0.5°) фреймов. Поглощение для 4 учтено по программе SADABS [15]. Структуры расшифрованы прямым методом и уточнены полноматричным МНК по комплексу программ SHELXT [16] и SHELXL [17] с использованием программной оболочки Olex2 [18]. Для соединений 2 и 3 с помощью построения реконструкций обратного пространства обнаружено по два кристаллических домена с разной ориентацией; других особенностей (в том числе диффузного рассеяния) не обнаружено. Проведено интегрирование массивов с учетом двух доменов, поглощение учтено по программе TWINABS (TWINABS-2012/1, Bruker, 2012). Это позволило решить проблему высокой остаточной электронной плотности, но не в полной мере. Данную плотность также не удалось описать разупорядочением кластерных фрагментов из-за отсутствия локализованных пиков. Тем не менее предложенные структурные модели имеют разумную геометрию и показывают достаточно хорошее согласие с экспериментом. В соединениях 2 и 3 атомы водорода групп OH размещены вдоль линии водородных связей; соответствующие фрагменты OH и H2O уточнены в приближении жесткого тела и в модели “наездника”. В случае комплекса 4 для молекул H2O акцепторы водородных связей на подходящих расстояниях не найдены, поэтому атомы H не локализованы, но включены в формулу соединения. Данные РСА депонированы в Кембриджском банке структурных данных (КБСД, 2031220–2031222) и могут быть получены у авторов или по адресу: http://www.ccdc.cam.ac.uk/conts/retrieving.html
Таблица 1.
Кристаллографические данные и детали эксперимента для соединений 2–4
| Параметр | 2 | 3 | 4 |
|---|---|---|---|
| Брутто-формула | C10H22Br11N2O5Re3 | C10H15Br9N2O5PRe3 | C16H45Br9N2O6PRe3 |
| М | 1687.90 | 1552.00 | 1671.27 |
| Т, K | 150(2) | 150(2) | 150(2) |
| Пр. гр. | P21/m | P1 | P21/c |
| a, Å | 9.7270(8) | 10.7577(8) | 13.3239(8) |
| b, Å | 15.6405(17) | 15.8421(12) | 18.4877(10) |
| c, Å | 10.7004(13) | 17.4628(13) | 15.2231(6) |
| α, град | 90 | 72.175(2) | 90 |
| β, град | 112.794(3) | 79.496(2) | 95.561(2) |
| γ, град | 90 | 82.186(3) | 90 |
| V, Å3 | 1500.8(3) | 2775.5(4) | 3732.2(3) |
| Z | 2 | 4 | 4 |
| ρвыч, г/см3 | 3.735 | 3.714 | 2.965 |
| μ, мм–1 | 26.737 | 26.090 | 19.415 |
| F(000) | 1492.0 | 2736.0 | 3016.0 |
| Диапазон сбора данных по 2θ, град | 4.128–59.232 | 2.478–2.934 | 3.78–51.364 |
| Диапазоны h, k, l | –13 ≤ h ≤ 12, 0 ≤ k ≤ 21, 0 ≤ l ≤ 14 | –12 ≤ h ≤ 13, –19 ≤ k ≤ 19, –21 ≤ l ≤ 21 | –16 ≤ h ≤ 16, –22 ≤ k ≤ 22, –18 ≤ l ≤ 18 |
| Число измеренных рефлексов | 12 441 | 38 817 | 25 486 |
| Число независимых рефлексов [Rint, Rσ] | 8447 [0.0821, 0.1081] | 17188 [0.0575, 0.0782] | 7091 [0.0634, 0.0753] |
| Число ограничений/ уточняемых параметров | 5/164 | 6/510 | 26/351 |
| GOOF по F2 | 1.035 | 1.044 | 1.003 |
| R-фактор (I > 2σ(I)) | R1 = 0.0642, wR2 = 0.1670 | R1 = 0.0683, wR2 = 0.1710 | R1 = 0.0385, wR2 = 0.0674 |
| R-фактор (все данные) | R1 = 0.1013, wR2 = 0.1895 | R1 = 0.0989, wR2 = 0.1930 | R1 = 0.0732, wR2 = 0.0755 |
| ∆ρmax/∆ρmin, e/Å3 | 4.98/–4.01 | 6.52/–4.20 | 1.37/–1.31 |
Синтез Re3I9 (1). Навеску 0.80 г NaReO4 (2.92 ммоль) помещали в тефлоновый реактор (общий объем 32 мл) и добавляли 20 мл 55%-ной HI. Реактор герметизировали и помещали в металлический автоклав, который выдерживали в печи при 200°C в течение 10 ч. После охлаждения реактор открывали и образовавшийся мелкокристаллический черный осадок собирали на мелкопористом стеклянном фильтре (P4, 16 мкм), промывали до бесцветных вытяжек этанолом, затем диэтиловым эфиром и сушили на воздухе. Выход 1.47 г (89%). По данным РФА, продукт содержит Re3I9 в качестве единственной кристаллической фазы. По данным энергодисперсионного анализа, атомное отношение Re : I = 3.0 : 9.0. ИК-спектр (600−100 cм−1, KBr): 225 ср, 186 ср, 174 сл, 163 сл. Термогравиметрический анализ показал, что порошок Re3I9 стабилен при нагревании в инертной атмосфере до 300°С, разлагается на простые вещества в одну стадию при повышенных температурах с максимальной скоростью при 425°С.
Синтез (PyH)2[Re3Br11(H2O)] · 4H2O (2). Навеску 200 мг (117 ммоль) порошка Re3I9 помещали в тефлоновый реактор (V = 32 мл), приливали 20 мл концентрированной HBr и барботировали суспензию аргоном в течение 10 мин. Герметизированный реактор помещали в металлический автоклав и выдерживали в печи при 200°С в течение 15 ч. После охлаждения до комнатной температуры красно-коричневый раствор (твердая фаза отсутствовала) переносили в стеклянный стакан. В полученный раствор был добавлен пиридин (100 мкл, 1.24 мкмоль), что привело к образованию в течение нескольких дней кристаллического вещества, из которого были отобраны монокристаллы, пригодные для РСА. Выход 26%. По данным энергодисперсионного анализа, атомное отношение Re : Br = 3.0 : 11.0. Рассчитанный структурный состав монокристалла – (PyH)2[Re3Br11(H2O)] · 4H2O.
Синтез (PyH)2[Re3Br9(PO4H)] · H2O (3). Навеску 200 мг (117 ммоль) порошка Re3I9 помещали в тефлоновый реактор c концентрированной HBr, как описано выше, и добавляли 3 мл H3PO4, после чего суспензию барботировали аргоном в течение 10 мин. Герметизированный реактор помещали в металлический автоклав и выдерживали в печи при 200°С в течение 15 ч. После охлаждения до комнатной температуры красно-коричневый раствор (твердая фаза отсутствовала) переносили в стеклянный стакан. В раствор был добавлен пиридин (100 мкл, 1.24 мкмоль), что привело к образованию в течение нескольких дней кристаллического вещества, из которого были отобраны монокристаллы, пригодные для РСА. Рассчитанный структурный состав монокристалла – (PyH)2[Re3Br9(PO4H)] · H2O. Добавление избытка пиридина к кислотному раствору не приводит к увеличению содержания фазы (PyH)2[Re3Br9(PO4H)] · H2O, а по мере упаривания раствора образуется густое красно-коричневое масло с вкрапленными в него редкими монокристаллами целевого соединения. Выход 20%. По данным энергодисперсионного анализа, атомное отношение Re : Br = 3.0 : 9.0.
Синтез (Et4N)2[Re3Br9(PO4H)] · 2H2O (4). Сольвотермальный синтез проводили аналогично синтезу соединения 3. Вместо пиридина в предварительно упаренный до объема ~5 мл и остывший красно-коричневый реакционный раствор добавляли раствор Et4NBr (1 г, 4.78 ммоль, в 5 мл HBr). Полученную взвесь помещали в холодильник на 12 ч для максимально полного осаждения продукта. Выпавший осадок малинового цвета отфильтровывали на стеклянном фильтре и сушили в токе воздуха. Выход 150 мг (77%). Пригодные для РСА кристаллы были получены медленным насыщением парами диэтилового эфира раствора отфильтрованного продукта в ацетонитриле. Рассчитанный структурный состав монокристалла – (Et4N)2[Re3Br9(PO4H)] · 2H2O. Фазовая чистота массы вещества была определена методом РФА. Данные энергодисперсионного анализа: атомное отношение Re : Br = 3.0 : 9.0.
Спектр ЯМР 31P (C6D6; δ, м.д.): 19.8. ИК-спектр (см–1): 3005 сл, 2980 ср, 1458 с, 1398 ср, 1371 сл, 1304 ср, 1182 с, 1076 с, 1051 с, 1032 с, 1003 с, 976 ср, 901 с, 785 с, 596 с, 571 ср, 494 с, 467 с.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для получения Re3I9 (1) была использована реакция, рекомендованная Малатеста [19], а именно – восстановление перрената в концентрированном водном растворе HI. Мы упростили методику, взяв NaReO4 вместо HReO4 и используя HI в качестве источника иода и восстановителя (вместо этанола). В гидротермальных условиях кристаллический однофазный безводный продукт образуется почти с количественным выходом. Дифрактограмма продукта (рис. S1 ) соответствует рассчитанной исходя из опубликованных структурных данных для монокристалла Re3I9 [4]. Термогравиметрический анализ подтверждает состав Re3I9. Разложение происходит в одну стадию при нагревании выше 300°C в восстановительной (H2/He) атмосфере, причем единственным твердым продуктом разложения является металлический рений (рис. S2 ). Количественное образование Re3I9 в указанных условиях указывает на то, что при достаточно высоких температурах (и в кислых средах) иодид-ион способен восстанавливать Re(VII) до Re(III). Это подтверждается сообщением Кохеля, согласно которому Re(V) (в виде [Re2OCl10]4–) был восстановлен до Re(III) иодидом в аналогичных условиях (200°C, 20 ч). Из-за присутствия HCl в системе конечный продукт был выделен в виде смешанной соли (4,4'-bipyH2)[Re3I3Cl8(H2O)] · 2H2O. Выход продукта не сообщается [20]. Здесь, как и в нашем случае, I– действует одновременно как восстановитель и способствует образованию кластеров, формируя ядро {Re3(µ2-I)3}6+.
Для реакции полного замещения всех иодидных лигандов в Re3I9 на бромидные без разрушения кластерного ядра мы использовали реакцию с концентрированной кислотой HBr в гидротермальных условиях. Действительно, при нагревании в течение 15 ч при 200°C происходит полное превращение кластерного ядра {Re3(µ2-I)3}6+ в {Re3(µ2-Br)3}6+, в результате которого в среде HBrконц образуется набор комплексов [{Re(µ2-Br)3Br6}(H2O)xBr3 –x]–(3 –x). При добавлении пиридина в реакционный раствор образуются темно-красные кристаллы (PyH)2[Re3Br11(H2O)] · 4H2O (2). В литературе описано несколько примеров подобного лигандного обмена: превращение Re3Cl9 в Re3I9 под действием BI3 при 310°С [21], а также превращение Re3Cl9 в [Re3(NCS)12]3–, [Re3(CH3)9], [Re3(iPrO)9] в реакциях с роданидом, CH3MgI или изопропилатом натрия соответственно [22–24]. Описан также ряд бромидных кластерных комплексов рения, выделенных из растворов Re3Br9 в HBr. Анионный комплекс [Re3Br11(H2O)]2–, наряду с нейтральными молекулами [Re3Br9(H2O)3], присутствует в структуре аддукта (NMe4)2[Re3Br11(H2O)][Re3Br9(H2O)3] · · 2H2O [25]. Попытка дальнейшего восстановления рения при проведении реакции Re3I9 с концентрированной HBr в присутствии H3PO2 привела к образованию фосфатного комплекса [Re3Br9(PO4H)]2–, который также образуется при непосредственном введении фосфорной кислоты в реакционную смесь и был выделен в виде солей с катионами пиридиния (3) и тетраэтиламмония (4). Аналогичный фосфатный комплекс (Me4N)2(H7O3)[Re3Cl9(PO4)] был получен ранее [26].
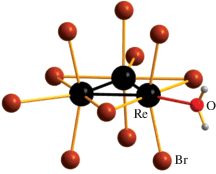
По данным РСА, (PyH)2[Re3Br11(H2O)] · 4H2O (2) изоструктурен ранее описанному хлоридному комплексу (PyH)2[Re3Cl11(H2O)] · 4H2O [27]. Все три мостиковые позиции, шесть терминальных внеплоскостных позиций (аксиальные позиции, а) и две терминальные позиции в плоскости кластерного ядра {Re3(μ2-Br3)}6+ (экваториальные позиции, е) заняты бромидными лигандами, а оставшуюся терминальную позицию в плоскости кластерного ядра занимает координированная молекула воды (Re–O 2.248(14) Å; в хлоридном аналоге 2.226 Å), рис. 1. Длины связей Re–Br строго дифференцированы в зависимости от занимаемой позиции и увеличиваются в ряду: терминальные аксиальные (2.459(8) Å) < мостиковые (2.56(1) Å) < терминальные экваториальные (2.76(3) Å) (приведены средние длины связей из табл. 2). Расстояние Re–Re (2.48(1) Å) несколько длиннее, чем в изоструктурном хлоридном комплексе, что может быть связано с “матричным” эффектом бóльших по размеру мостиковых атомов брома. В целом все геометрические характеристики кластера 2 типичны для этого семейства треугольных галогенидных кластерных комплексов рения. Следует отметить, что, несмотря на разницу в длинах связей, терминальные аксиальные лиганды (не говоря уже об экваториальных) более лабильны, чем мостиковые [22]. Следующим этапом организации кристаллической структуры является формирование единых ионно-молекулярных нейтральных ассоциатов {[Re3Br11(H2O)](H2O)4(pyH)2}, в которых координированная к кластерному аниону молекула воды связана водородной связью с двумя молекулами кристаллизационной воды, каждая из которых, в свою очередь, связана с дополнительной молекулой воды, связанной с пиридиниевым катионом. Ассоциаты упаковываются таким образом, что кластерные анионы и катионы пиридиния образуют чередующиеся слои параллельно плоскости (100).
Таблица 2.
Средние межатомные расстояния в соединениях 2–4. В скобках приведены среднеквадратич-ные отклонения по выборке из соответствующих независимых расстояний для каждой структуры
| Структура | 2 | 3 | 4 |
|---|---|---|---|
| Re–Re | 2.48(1) | 2.474(2) | 2.478(8) |
| Re–Br(term)a | 2.459(8) | 2.431(6) | 2.440(4) |
| Re–Br(term)e | 2.76(3) | 2.66(2) | 2.66(2) |
| Re–Br(br) | 2.56(1) | 2.538(7) | 2.55(1) |
| Re–O | 2.248(14) | 2.05(1) | 2.04(1) |
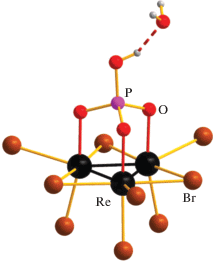
Координация фосфата в кластерном анионе [Re3Br9(PO4H)]2– в структурах 3 и 4 аналогична наблюдавшейся в (Me4N)2(H7O3)[Re3Сl9(PO4)] (монокристаллы последнего были получены перекристаллизацией продукта реакции Ag3PO4 c Re3Cl9 в ацетоне из смеси HCl/EtOH в присутствии Me4NCl) [26]. Три атома кислорода фосфатного лиганда замещают три аксиальных бромидных лиганда в гипотетическом анионе [Re3Br12]3–. При этом расстояния Re–Re и Re–Br для мостиковых и аксиальных бромидных лигандов в 3 и 4 несущественно отличаются от таковых в структуре 2, в то время как для экваториальных бромидных лигандов расстояния Re–Br в 3 и 4 укорачиваются примерно на 0.1 Å по сравнению с 2, хотя и остаются существенно длиннее, чем для двух других типов бромидных лигандов (табл. 2). Расстояния Re–${{{\text{O}}}_{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}}}$ в соединениях 3 и 4 немного длиннее, чем в [Re3Cl9(PO4)]3– (2.01–2.04 Å). В обеих структурах наблюдаются короткие контакты P–O…O: для соединения 3 они составляют 2.43(3) и 2.47(2) Å для двух независимых кластеров, для соединения 4 – 2.496(15) и 2.501(14) Å для разупорядоченных молекул воды (рис. 2). На расстоянии 2.729(17) и 2.607(15) Å имеется еще один атом O, соответствующий кристаллизационной молекуле воды. Из-за относительно низкого качества данных РСА для 3 и 4 и наличия разупорядочения нельзя локализовать соответствующие протоны. Можно предположить, что происходит делокализация протона между фосфатным лигандом и ближайшей молекулой H2O, которую можно описать двумя предельными вариантами: [Re3Br9O3PO]3–···H3O+ и [Re3Br9O3POH]2–···H2O.
Список литературы
Друце И. Рений / Пер. с англ. Хмельницкого Л.И., под ред. Лапицкого А.В., М.: Изд-во иностр. литер., 1951. 116 с.
Cotton F.A., Mague J.T. // Inorg. Chem. 1964. V. 3. № 10. P. 1402.
Cotton F.A., Lippard S.J. // Inorg. Chem. 1965. V. 4. № 1. P. 59.
Bennett M.J., Cotton F.A., Foxman B.M. // Inorg. Chem. 1968. V. 7. № 8. P. 1563.
Alvarado-Soto L., Schott V.E., Zarate X. et al. // Chem. Phys. Lett. 2012. V. 545. P. 50.
Sergeeva A.P., Boldyrev A.I. // Comment. Inorg. Chem. 2010. V. 31. P. 2.
Cotton F.A., Walton R.A. Multiple bonds between metal atoms. Oxford: Clarendon Press, 1993. 787 p.
Sokolov M.N., Naumov N.G., Samoylov P.P., Fedin V.P. // Comprehensive Inorganic Chemistry II, Oxford: Elsevier Ltd., 2013. P. 271.
Pronin A.S., Smolentsev A.I., Mironov Y.V. // Russ. Chem. Bull. 2019. V. 68. № 4. P. 777. [Пронин А.С., Смоленцев А.И., Миронов Ю.В. // Изв. АН. Сер. химическая. 2019. Т. 68. № 4. С. 777.]
Pronin A.S., Smolentsev A.I., Kozlova S.G. et al. // Inorg. Chem. 2019. V. 58. № 11. P. 7368.
Pronin A.S., Gaifulin Y.M., Smolentsev A.I. et al. // J. Cluster. Sci. 2019. V. 30. P. 1253.
Брауэр Г. Руководство по неорганическому синтезу. М.: Мир, 1985. С. 1612–1716.
Колбин Н.И., Овчинников К.В. // Журн. неорган. химии. 1968. Т. 13. С. 1190.
NETZSCH Proteus Thermal Analysis v.6.1.0–NETZSCH-Gerätebau GmbH–Selb/Bayern, Germany. 2013.
Bruker AXS Inc. APEX2 (Version 2.0), SAINT (Version 8.18c), SADABS (Version 2.11), Bruker Advanced X-ray Solutions. Madison, Wisconsin, USA, 2000–2012.
Sheldrick G.M. // Acta Crystallogr., Sect. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr., Sect. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Malatesta L. // Inorg. Synth. 1963. V. 7. P. 1850.
Kochel A. // Inorg. Chem. Commun. 2007. V. 10. P. 1440.
Bush M.A., Druce P.M., Lappert M.F. // J. Chem. Soc., Dalton Trans. 1973. P. 500.
Robinson B.H., Fergusson J.E. // J. Chem. Soc. 1964. P. 5683.
Masters A.F., Mertis, K., Gibson G.F., Wilkinson G. // New. J. Chem. 1977. V. 1. P. 389.
Hoffman D.M., Lappas D., Wierda D.A. // J. Am. Chem. Soc. 1989. V. 111. P. 1531.
Moller A., Meyer G. // Z. Anorg. Allg. Chem. 1993. V. 619. P. 1655.
Irmler M., Meyer G. // Z. Anorg. Allg. Chem. 1990. V. 587. P. 197.
Irmler M., Meyer G. // J. Less-Common Metals. 1987. V. 127. P. 133.
Дополнительные материалы
- скачать EMS.docx
- Рис. S1. Дифрактограмма Re3I9 (обозначена черным цветом), теоретически рассчитанная показана красным цветом.
Рис. S2. Данные термогравиметрического анализа Re3I9.
Инструменты
Журнал неорганической химии