Журнал неорганической химии, 2021, T. 66, № 7, стр. 921-924
Изучение растворимости системы Ca(ClO3)2–[90% C2H5OH + 10% C10H11ClN4]–H2O
Ж. Ш. Бобожонов a, *, Ж. С. Шукуров a, А. С. Тогашаров a, М. Х. Ахмаджонова a
a Институт общей и неорганической химии АН РУз
100170 Ташкент, ул. Мирзо Улугбека, 77-а, Узбекистан
* E-mail: jamshid_chem@mail.ru
Поступила в редакцию 12.01.2021
После доработки 02.03.2021
Принята к публикации 03.03.2021
Аннотация
Визуально-политермическим методом исследована растворимость компонентов в системе Ca(ClO3)2–[90% C2H5OH + 10% C10H11ClN4]–H2O в интервале температур от –43.6 до +50.0°С. На фазовой диаграмме разграничены поля кристаллизации льда, Ca(ClO3)2 · 6Н2О, Ca(ClO3)2 · 4Н2О, Ca(ClO3)2 · 2Н2О и ацетамиприда. Изучено изменение физико-химических свойств растворов, обладающих инсектицидной активностью, в зависимости от соотношения компонентов. Компоненты систем сохраняют свою индивидуальность при совместном присутствии. Результаты исследования систем указывают на возможность получения жидкого дефолианта с инсектицидной активностью.
ВВЕДЕНИЕ
Среди многочисленных химических препаратов наиболее перспективными являются хлоратсодержащие неорганические соединения, которые являются малотоксичными и относительно быстро разлагаются в почве [1–3]. Они положительно влияют на семена урожая и его качество.
Осенью, в период раскрытия коробочек, хлопковая тля может нанести посевам хлопчатника большой ущерб [4–7]. Тля загрязняет волокна хлопка-сырца клейкими сахаристыми выделениями. Такое волокно в процессе хранения загнивает. Выход волокна из загрязненного сырца снижается, затрудняется работа перерабатывающего оборудования, загрязненное волокно обладает меньшей прочностью. Вышеизложенное обусловливает необходимость создания малотоксичных эффективных дефолиантов, обладающих инсектицидной активностью [8, 9].
Ацетамиприд применяется в качестве инсектицида в борьбе против сосущих вредителей хлопчатника [10, 11], этанол – в качестве растворителя ацетамиприда [12], а также в качестве этиленпродуцента [13, 14]. Проникая в растения, этанол легко превращается в этилен под действием обезвоживающих реагентов и тем самым способствует повышению уровня этилена в растительном организме [15, 16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования – хлорат кальция, этанол и ацетамиприд. Хлорат кальция получали по обменной реакции плавленого хлористого кальция с хлоратом натрия в среде ацетона по методике [17]. Использовали ацетамиприд марки “х. ч.” с наименованием (Е)-N1-[(6-хлор-3-пиридил)метил]-N2-циано-N1-метилацетамидин согласно номенклатуре IUPAC [18].
Cодержание кальция определяли объемным комплексонометрическим методом [19], содержание хлорат-иона – объемным перманганатометрическим методом (ГОСТ 10483-77), элементный анализ на углерод, азот, водород проводили c помощью аналитических детекторов электронного сканирующего микроскопа (Zeiss EVO MA10) [20].
В работе применяли визуально-политермический [21] (стеклянный ртутный термометр ТН-6 с диапазоном измерения от –30 до +60°С и спиртовой стеклянный термометр ТЛ-15 с диапазоном измерения от –100 до +20°С) и пикнометрический [22] методы. Вязкость растворов определяли с помощью вискозиметра ВПЖ, рН растворов – на pH-метре FE20 Mettler Toledo, показатель преломления – на рефрактометре ИРФ 454 модели БМ.
Для физико-химического обоснования процесса получения нового класса дефолианта [23], обладающего инсектицидно-активным свойством [24], нами изучена растворимость компонентов в системе Ca(ClO3)2–[90% C2H5OH + 10% C10H11ClN4]–H2O визуально-политермическим методом в широком температурном интервале.
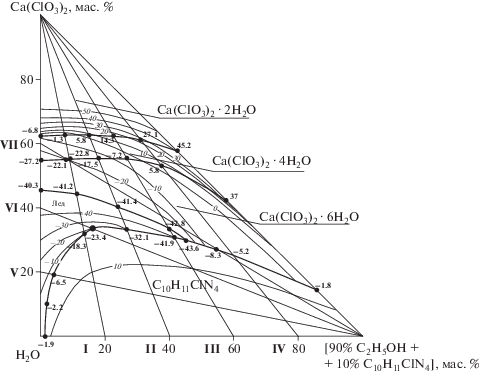
Растворимость компонентов в системе Ca(ClO3)2–[90% C2H5OH + 10% C10H11ClN4]–H2O изучена с помощью семи внутренних разрезов (рис. 1), из которых разрезы I–IV исследованы со стороны [90% C2H5OH + 10% C10H11ClN4]–H2O к вершине Ca(ClO3)2, разрезы V–VII – со стороны Ca(ClO3)2–H2O к вершине [90% C2H5OH + 10% C10H11ClN4].
На основе политерм растворимости бинарных систем и внутренних разрезов построена политермическая диаграмма растворимости от эвтектической точки замерзания –43.6 до +50.0°С, которая характеризуется наличием областей кристаллизации льда, Ca(ClO3)2 · 6Н2О, Ca(ClO3)2 · 4Н2О, Ca(ClO3)2 · 2Н2О и ацетамиприда. Эвтектическая точка системы соответствует 30.2% Ca(ClO3)2, 44.0% [90% C2H5OH + 10% C10H11ClN4] и 25.8% H2O при –43.6°С.
Поля кристаллизации льда, Ca(ClO3)2 · 6Н2О и C10H11ClN4 сходятся в одной тройной нонвариантной точке (–43.6°С) системы. Как видно из рис. 1, основная фигуративная точка соответствует –23.4°C. Установлены химические составы равновесных растворов [25] и соответствующие им температуры кристаллизации (табл. 1).
Таблица 1.
Двойные и тройные узловые точки системы Ca(ClO3)2–[90% C2H5OH + 10% C5H11ClN4]–H2O
| Состав жидкой фазы, % | tкр, °С | Твердая фаза | ||
|---|---|---|---|---|
| Ca(ClO3)2 | [90% C2H5OH + + 10% C5H11ClN4] | Н2О | ||
| 62.4 | – | 37.6 | –6.8 | Ca(ClO3)2 · 2Н2О + Ca(ClO3)2 · 4Н2О |
| 63.2 | 7.6 | 29.2 | –1.3 | » |
| 63.2 | 14.8 | 22.0 | 6.8 | » |
| 62.4 | 22.4 | 15.2 | 14.3 | » |
| 61.2 | 31.2 | 7.6 | 27.1 | » |
| 58.4 | 41.6 | – | 45.2 | » |
| 54.8 | – | 45.2 | –27.2 | Ca(ClO3)2 · 4Н2О + Ca(ClO3)2 · 6Н2О |
| 55.2 | 8.0 | 36.8 | 22.1 | » |
| 55.2 | 8.8 | 36.0 | –22.8 | » |
| 54.8 | 18.0 | 27.2 | –17.5 | » |
| 54.0 | 27.6 | 18.4 | –7.2 | » |
| 52.0 | 38.8 | 9.2 | 5.2 | » |
| 42.0 | 58.0 | – | 37.0 | » |
| 45.6 | – | 54.4 | –40.3 | Лед + Ca(ClO3)2 · 6Н2О |
| 44.4 | 11.0 | 44.6 | –41.2 | » |
| 40.4 | 24.0 | 35.6 | –41.4 | » |
| 32.4 | 40.4 | 27.2 | –42.8 | » |
| 30.2 | 44.0 | 25.8 | –43.6 | Лед + Ca(ClO3)2 · 6Н2О + [90% C2H5OH + + 10% C5H11ClN4] |
| – | 1.6 | 98.4 | –1.9 | Лед + [90% C2H5OH + 10% C5H11ClN4] |
| 10.0 | 1.8 | 88.2 | –2.2 | » |
| 19.2 | 3.8 | 77.0 | –6.5 | » |
| 31.6 | 13.6 | 54.8 | –18.3 | » |
| 33.0 | 17.6 | 49.4 | –23.4 | » |
| 33.0 | 27.0 | 40.0 | –32.1 | » |
| 30.8 | 41.6 | 27.6 | –41.9 | » |
| 27.2 | 54.6 | 18.2 | –8.3 | Ca(ClO3)2 · 6Н2О + [90% C2H5OH + + 10% C5H11ClN4] |
| 25.6 | 60.0 | 14.4 | –5.2 | » |
| 14.4 | 85.6 | – | 1.8 | » |
На политермическую диаграмму состояния нанесены изотермы через каждые 10°С. Построены проекции политермических кривых растворимости на боковые стороны системы Ca(ClO3)2–H2O и [90% C2H5OH + 10% C10H11ClN4]–H2O.
Изменение температуры и концентрации компонентов в системе не оказывает существенного влияния на взаимную растворимость. В системе не происходит образования новых химических соединений, компоненты сохраняют свою индивидуальность.
С целью обоснования процесса получения растворов с участием хлората кальция, этанола и ацетамиприда изучено взаимодействие компонентов и физико-химические свойства растворов в системе [40% Ca(ClO3)2 + 60% H2O]–[90% C2H5OH + + 10% C10H11ClN4]. Определены температура кристаллизации, рН, плотность, вязкость и показатель преломления растворов данной системы в зависимости от содержания компонентов при температуре 25°С (табл. 2).
Таблица 2.
Физико-химические и реологические свойства системы [40% Ca(ClO3)2 + 60% H2O]–[90% C2H5OH + + 10% C10H11ClN4] при температуре 25°С
| Содержание компонентов, % | рН | Плотность ρ, г/см3 |
Показатель преломления света, nD | tкр, °С | Вязкость η, мм2/с | |
|---|---|---|---|---|---|---|
| 40% Ca(ClO3)2 + + 60% H2O | 90% C2H5OH + + 10% C10H11ClN4 | |||||
| 100.0 | – | 7.13 | 1.306 | 1.3798 | –18.4 | 1.180 |
| 95.2 | 4.8 | 7.11 | 1.302 | 1.3807 | –19.6 | 1.225 |
| 88.0 | 12.0 | 7.06 | 1.294 | 1.3820 | –21.6 | 1.285 |
| 82.4 | 17.6 | 7.02 | 1.288 | 1.3829 | –23.4 | 1.335 |
| 76.8 | 23.2 | 7.10 | 1.281 | 1.3829 | –20.1 | 1.370 |
| 72.0 | 28.0 | 7.15 | 1.276 | 1.3828 | –17.4 | 1.405 |
| 64.0 | 36.0 | 7.23 | 1.264 | 1.3827 | –13.6 | 1.450 |
| 59.2 | 40.8 | 7.28 | 1.260 | 1.3826 | –11.7 | 1.453 |
| 51.6 | 48.4 | 7.34 | 1.250 | 1.3825 | –8.8 | 1.530 |
| 44.8 | 55.2 | 7.41 | 1.240 | 1.3824 | –6.7 | 1.575 |
| 39.0 | 61.0 | 7.46 | 1.232 | 1.3822 | –5.2 | 1.610 |
| 33.6 | 66.4 | 7.50 | 1.223 | 1.3820 | –3.8 | 1.645 |
| 29.0 | 71.0 | 7.54 | 1.221 | 1.3819 | –2.5 | 1.670 |
| 24.7 | 75.3 | 7.57 | 1.224 | 1.3818 | –1.8 | 1.695 |
| 20.0 | 80,0 | 7.61 | 1.208 | 1.3816 | –1.0 | 1.715 |
Согласно приведенным данным состав–температура кристаллизации, рассматриваемая система характеризуется наличием двух ветвей кристаллизации с явными изломами на кривых растворимости. Кристаллизация льда продолжается до температуры –23.4°С и содержания 10%-ного спиртового раствора ацетамиприда, составляющего 17.6%. При температуре кристаллизации выше –20.1°С и концентрации 10%-ного спиртового раствора ацетамиприда выше 23.2% в системе кристаллизуется чистый ацетамиприд.
Анализ диаграммы состав–рН системы [40% Ca(ClO3)2 + 60% H2O]–[90% C2H5OH + + 10% C10H11ClN4] показывает, что с увеличением концентрации 10%-ного спиртового раствора ацетамиприда величина рН растворов уменьшается до 7.02 в двойных точках, отвечающих совместному существованию льда с ацетамипридом. Увеличение концентрации 10%-ного спиртового раствора ацетамиприда >17.6% приводит к постепенному повышению рН.
Плотность исследуемой системы монотонно уменьшается от 1.306 до 1.208 г/см3, а вязкость увеличивается от 1.18 до 1.715 мм2/с.
Анализ диаграммы состав–показатель преломления показывает, что показатель преломления системы повышается до 1.3829 в двойных точках, отвечающих совместному существованию льда с ацетамипридом. Дальнейшее увеличение концентрации 10%-ного спиртового раствора ацетамиприда приводит к постепенному уменьшению показателя преломления.
ЗАКЛЮЧЕНИЕ
Таким образом, установлено, что в изученной системе не происходит химического взаимодействия между компонентами. Изученная система является системой простого эвтонического типа. Показано, что путем растворения 10%-ного спиртового раствора ацетамиприда в водном растворе хлората кальция можно получить жидкий дефолиант с инсектицидной активностью.
Список литературы
Toghasharov A.S., Askarova M.K., Tukhtaev S. // East Europ. Sci. J. Wschodnioeur. Czasop. Nauk. 2016. V. 3. № 8. P. 56.
Тогашаров А.С., Шукуров Ж.С., Тухтаев С. Новые дефолианты на основе хлоратов и техногенных отходов хлопкоочистительных заводов. Ташкент: Навруз, 2019.
Хамдамова Ш.Ш., Тухтаев С., Дадамухамедова Н. // Universum: техн. науки. 2018. Т. 55. № 10. С. 42. https://7universum.com/ru/tech/archive/item/6412
Singh R., Singh G. // Aphids. Singapore: Springer, 2021. https://doi.org/10.1007/978-981-15-8075-8_3
El-Sherbeni A.E.-H.E.-D., Khaleid M.S. et al. // Bull. Natl. Res. Cent. 2019. V. 63. P. 57. https://doi.org/10.1186/s42269-019-0103-0
Shera P.S., Kumar V., Jindal V. // Sucking Pests of Crops. Singapore: Springer, 2020. https://doi.org/10.1007/978-981-15-6149-8_8
Rajendran T.P., Birah A., Burange P.S. // Pests and Their Management. Singapore: Springer, 2018. https://doi.org/10.1007/978-981-10-8687-8_11
Шукуров Ж.С., Тогашаров А.С., Аскарова М.К. и др. Комплексно действующие дефолианты, обладающие физиологически активными и инсектицидными свойствами. Ташкент: Навруз, 2019.
Shukurov Z.S., Askarova M.K., Tukhtaev S. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. P. 275. [Шукуров Ж.С., Аскарова М.К., Тухтаев С. // Журн. неорган. химии. 2018. Т. 63. № 2. С. 261.] https://doi.org/10.1134/S0036023618020201
Basit M. // Phytoparasitica. 2018. V. 46. P. 183. https://doi.org/10.1007/s12600-018-0659-5
Anees M., Shad S.A. // Cotton Production and Uses. Singapore: Springer, 2020. https://doi.org/10.1007/978-981-15-1472-2_11
Xi Zhao, Ali Farajtabar, Hongkun Zhao et al. // J. Chem. Eng. 2019. V. 64. № 8. P. 3505. https://doi.org/10.1021/acs.jced.9b00294
Veselova S.V., Burkhanova G.F., Nuzhnaya T.V. // Russ. J. Plant. Physiol. 2016. V. 63. P. 609. https://doi.org/10.1134/S1021443716050150
Noreen S., Mahmood S., Faiz S. et al. // Cotton Production and Uses / Eds. Ahmad S., Hasanuzzaman M. Singapore: Springer, 2020. https://doi.org/10.1007/978-981-15-1472-2_8
Zemlyanskaya E.V., Omelyanchuk N.A., Erma-kov A.A. et al. // Russ. J. Gen. Appl. Res. 2017. № 7. P. 335. https://doi.org/10.1134/S2079059717030169
Шарипов С.Я. Получение дефолиантов на основе хлоратов, 2-бутин-1,4-диола, моноэтаноламина и этилового спирта. Дис. … канд. тех. наук. Ташкент, 2007.
Набиев М.Н., Шаммасов Р., Тухтаев С. и др. Способ получения хлорат-хлорид кальциевого дефолианта А.с. 1143691 СССР // Открытия. Изобретения. 1985. № 9. С. 84.
Мельников Н.Н., Новожилов К.В., Белан С.Р. и др. Справочник по пестицидам. М.: Химия, 1985.
Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия, 1970.
Климова В.А. Основные микрометоды анализа органических соединений М.: Химия, 1975.
Трунин А.С., Петрова Д.Г. Визуально-политермический метод. Куйбышев: Куйбышевский политех. ин-т, 1977.
Здановский А.Б. Галлургия. Л.: Химия, 1972.
Умаров А.А., Кутянин Л.И. Новые дефолианты: поиск, свойства, применения. М.: Химия, 2000.
Адилов З.Х. Химия и технология получения хлоратсодержащих дефолиантов, обладающих инсектицидными свойствами. Автореф. дис… канд. тех. наук. Ташкент, 2010.
Boyd C.E. // Water Quality. Springer, Cham. 2020. https://doi.org/10.1007/978-3-030-23335-8_4
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии