Журнал неорганической химии, 2021, T. 66, № 6, стр. 767-773
ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ПИВАЛАТА ЛИТИЯ ПО ДАННЫМ ВЫСОКОТЕМПЕРАТУРНОЙ МАСС-СПЕКТРОМЕТРИИ
Д. Б. Каюмова a, И. П. Малкерова a, М. А. Кискин a, А. С. Алиханян a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: alikhan@igic.ras.ru
Поступила в редакцию 25.12.2020
После доработки 21.01.2021
Принята к публикации 22.01.2021
Аннотация
Эффузионным методом Кнудсена с масс-спектральным анализом газовой фазы исследован процесс парообразования пивалата лития (СН3)3ССOOLi (LiPiv). Насыщенный пар состоит из полиядерных молекул (LiPiv)n, среди которых преобладают молекулы (LiPiv)2 и (LiPiv)4. Рассчитаны абсолютные величины парциальных давлений этих молекул и их зависимость от температуры. Определены стандартные энтальпии сублимации основных компонентов насыщенного пара: ${{\Delta }_{s}}H_{{298}}^{^\circ }$(LiPiv)2 = 174.2 ± 6.6 кДж/моль, ${{\Delta }_{s}}H_{{298}}^{^\circ }$(LiPiv)4 = 195.7 ± 4.5 кДж/моль. По 2-му и 3-му законам термодинамики рассчитаны значения энтальпий диссоциации димерных молекул на мономерные и тетрамерных молекул на димерные, средние значения которых равны ${{\Delta }_{D}}H_{{298}}^{^\circ }$(LiPiv)2 = 175.8 ± ± 13.5 кДж/моль и ${{\Delta }_{D}}H_{{298}}^{^\circ }$(LiPiv)4 = 155.2 ± 10.0 кДж/моль. По известным термодинамическим характеристикам ацетата лития, радикалов уксусной и пивалевой кислот оценены стандартные энтальпии образования LiPiv в конденсированной и газовой фазах: ${{\Delta }_{f}}H_{{298}}^{^\circ }$(LiPiv(тв)) ≤ –804 кДж/моль, ${{\Delta }_{f}}H_{{298.15}}^{^\circ }$(LiPiv(г)) ≤ –627 кДж/моль, ${{\Delta }_{f}}H_{{298.15}}^{^\circ }$((LiPiv)2(г)) ≤ –1430 кДж/моль, ${{\Delta }_{f}}H_{{298.15}}^{^\circ }$((LiPiv)4(г)) ≤ ≤ –3017 кДж/моль.
ВВЕДЕНИЕ
Одной из главных причин интереса к летучим координационным соединениям лития является разработка тонкопленочных литий-ионных аккумуляторов [1–4], в которых в качестве анода используется пленка лития, а в качестве катода – двумерные слоистые оксиды LiCoO2, LiNiO2, LiMnO2 и LiV2O5 [5–7], нанесенные на токопроводящие подложки. Электролитом может служить твердая пленка литированного оксинитрида фосфора LiPON, полученная магнетронным напылением мишени Li3PO4 в атмосфере азота [8, 9]. В настоящее время существует два основных подхода к получению тонкопленочных оксидных материалов с помощью соответствующих прекурсоров. Первый подход связан с газофазными процессами. Это термическое осаждение (thermal deposition, TD), распыление (sputtering), плазменное лазерное напыление (pulsed-laser deposition, PLD), нанесение атомного слоя (atomic layer deposition, ALD), химическое осаждение из газовой фазы (chemical vapor deposition, CVD), химическое осаждение из газовой фазы металлорганических соединений (metal-organic chemical vapor deposition, МО CVD). Второй подход основан на использовании растворов: вращательное покрытие (spin-coating), распыление на подложку жидкой фазы (spray coating) и так называемая печать (printing) – одновременное осаждение и формирование плотного материала. “Растворный” подход, как и газофазный, часто связан с высокими температурами (до 1400°С), так как для получения необходимых свойств материал, полученный из раствора, часто должен подвергаться длительному высокотемпературному отжигу. Таким образом, практически все методики получения оксидных функциональных материалов связаны с использованием высоких температур и требуют знаний основных термодинамических характеристик используемых прекурсоров или получаемых оксидных материалов. Одним из допирующих агентов при получении оксидных тонких пленок методом МО CVD могут быть соли триметилуксусной кислоты (пивалаты), в частности, пивалат лития. Эти соединения достаточно устойчивы в газовой и конденсированной фазах, характеризуются высокой летучестью, стабильностью на воздухе, хорошей растворимостью в органических растворителях и т.д. Но данные по термодинамике процесса парообразования, необходимые для синтеза оксидных пленок на основе оксида лития, неполны и противоречивы [10–13]. В связи с этим целью настоящей работы стало исследование процесса парообразования пивалата лития LiPiv.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Навеску 0.9 г (0.012 моль) карбоната лития марки “ч. д. а.” растворяли в 10 мл дистиллированной воды, к раствору добавляли стехиометрическое количество (2.48 г, 0.024 моль) кристаллической пивалевой кислоты (99%, Acros Organic), после чего нагревали до 80°С, помешивая, до прекращения выделения газа. Полученный раствор упаривали и сушили на воздухе до постоянной массы. В результате получен белый порошок семигидрата пивалата лития (2.45 г, 0.021 моль) с выходом 86%.
Состав полученного продукта LiPiv · 0.5H2O подтверждали CHN-анализом, выполненным в ЦКП ИОНХ РАН на CHN-анализаторе “Евровектор 300”. На основании данных работы [14] можно предположить, что полностью безводный пивалат лития будет значительно полимеризован, поэтому дальнейшее осушение образца не проводили. Заметим, что ранее при масс-спектральном исследовании пивалата кадмия полимерного строения [15] было установлено, что парообразование подобного соединения сопровождается его полным термическим разложением.
Термодинамику парообразования LiPiv исследовали эффузионным методом Кнудсена с масс-спектральным анализом состава газовой фазы на приборе МС 1301 в интервале температур 490–550 K. Подробное описание методики и прибора приведено в [16]. В работе использовали изготовленные из молибдена камеры Кнудсена с отношением площади испарения к площади эффузии ~600. Температуру измеряли Pt/Pt-Rh-термопарой и поддерживали постоянной с точностью ±1°.
Масс-спектр насыщенного пара над пивалатом лития приведен в табл. 1, из которой видно, что в газовой фазе присутствует значительное количество олигомерных молекул (LiPiv)n (n > 9). Не исключено, что в насыщенном паре в незначительных количествах существуют и более полимеризованные молекулы, молярные массы которых находятся за пределами возможности регистрации прибором. Для определения качественного состава газовой фазы был получен масс-спектр при энергии ионизирующих электронов 15 эВ (табл. 1). В таких условиях в масс-спектре остаются только осколочные ионы [Li2Piv]+ и [Li4Piv3]+, соответствующие с большой вероятностью молекулам димера (LiPiv)2 и тетрамера (LiPiv)4. Данный эксперимент показывает, что эти молекулы и являются основными компонентами насыщенного пара. Присутствие в паре других олигомерных молекул (LiPiv)n не превышает 1–4 мол. %.
Таблица 1.
Масс-спектр* газовой фазы над LiPiv, Т = = 543 K
| Ион | Относительная интенсивность | |
|---|---|---|
| Uиониз = 70 В | Uиониз = 15 В | |
| Li+ | 5.6 | – |
| LiPiv+ | 0.8 | – |
| [Li2Piv]+ | 100 | 100 |
| [Li3Piv2]+ | 17.3 | – |
| [Li4Piv3]+ | 56.1 | 99 |
| [Li5Piv4]+ | 7.6 | – |
| [Li6Piv5]+ | 8.2 | – |
| [Li7Piv6]+ | 4.4 | – |
| [Li8Piv7]+ | 4.8 | – |
| [Li9Piv8]+ | 0.5 | – |
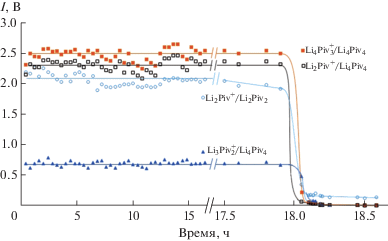
Для расшифровки масс-спектра и определения абсолютных величин парциальных давлений были выполнены эксперименты по полной изотермической сублимации фиксированной навески LiPiv (рис. 1). Первоначальные постоянные интенсивности всех ионных токов (величин парциальных давлений) соответствуют конгруэнтной сублимации LiPiv. Последующее относительно быстрое уменьшение всех интенсивностей связано с выгоранием исследуемой навески. В течение этого непродолжительного периода происходит изменение состава газовой фазы над LiPiv, что позволяет выполнить расшифровку масс-спектра методом, основанным на независимости константы равновесия газофазной реакции от давления при постоянной температуре [17]:
Результаты расчета показали, что коэффициент масс-спектра ${{a}_{{{{{{{{\text{[L}}{{{\text{i}}}_{{\text{2}}}}{\text{Piv]}}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{{\text{[L}}{{{\text{i}}}_{{\text{2}}}}{\text{Piv]}}}}^{ + }}} {{{{{\text{(LiPiv)}}}}_{{\text{4}}}}}}} \right. \kern-0em} {{{{{\text{(LiPiv)}}}}_{{\text{4}}}}}}}}}$ = 0.93 ± 0.65, т.е. ионизация тетрамерных молекул сопровождается процессом диссоциативной ионизации с образованием ионов [Li2Piv]+ и [Li4Piv3]+ практически в равных соотношениях. Анализ интенсивностей ионных токов при выгорании навески пивалата лития показал, что изменения ионных токов [Li4Piv3]+ и [Li3Piv2]+ протекают симбатно (рис. 1). Установленный факт свидетельствует о том, что ион [Li3Piv2]+ образован только при диссоциативной ионизации тетрамерных молекул (LiPiv)4. Малая интенсивность иона Li+ не позволила однозначно отнести его образование к определенной молекуле, поэтому приняли, что он равновероятно образуется при диссоциативной ионизации как димерных, так и тетрамерных молекул. Приняли также, что ионизация олигомерных молекул (LiPiv)n (n > 4) сопровождается образованием в равных количествах ионов только двух типов: [LinPivn– 1]+ и [Lin– 1Pivn –2]+. На основании этих данных были получены индивидуальные масс-спектры основных молекул газовой фазы (табл. 2).
Таблица 2.
Индивидуальные масс-спектры молекул, Uиониз = 70 В
| Молекула | Относительная интенсивность | |||
|---|---|---|---|---|
| Li+ | Li2L+ | ${\text{L}}{{{\text{i}}}_{{\text{3}}}}{\text{L}}_{{\text{2}}}^{{\text{ + }}}$ | ${\text{L}}{{{\text{i}}}_{{\text{4}}}}{\text{L}}_{{\text{3}}}^{{\text{ + }}}$ | |
| (LiPiv)2 | 5 | 100 | – | – |
| (LiPiv))4 | 5 | 93 | 30 | 100 |
Расчет абсолютных величин парциальных давлений компонентов насыщенного пара был выполнен на основании экспериментов по полной изотермической сублимации известной навески LiPiv (рис. 1).
Экспериментальные данные по полной изотермической сублимации и результаты расшифровки позволили записать уравнения Герца–Кнудсена для сложного состава насыщенного пара [18], состоящего из пяти полимерных молекул (LiPiv)n (n = 2, 4, 6, 8, 10):
(2)
$\begin{gathered} {{q}_{{{\text{LiPiv}}}}} = \frac{{{{S}_{{{\text{эф}}}}}}}{{{{{\left( {2\pi RT} \right)}}^{{0.5}}}}}~\,\, \times \\ \times \,\,\int\limits_0^t {\left( {\frac{{{{p}_{2}}}}{{M_{2}^{{0.5}}}} + \frac{{{{p}_{4}}}}{{M_{4}^{{0.5}}}} + \frac{{{{p}_{6}}}}{{M_{6}^{{0.5}}}} + \frac{{{{p}_{8}}}}{{M_{8}^{{0.5}}}} + \frac{{{{p}_{{10}}}}}{{M_{{10}}^{{0.5}}}}} \right)dt} , \\ \end{gathered} $Учитывая, что
уравнение (2) можно представить в следующем виде:(4)
${{q}_{{{\text{LiPiv}}}}} = \,\,B\frac{k}{{{{\sigma }_{2}}}}~\int\limits_0^t {\left( {\frac{{{{I}_{2}}}}{{M_{2}^{{0.5}}}} + \frac{{{{I}_{4}}{{\sigma }_{2}}}}{{{{\sigma }_{4}}M_{4}^{{0.5}}}}} \right.} + \left. {\frac{{{{I}_{6}}{{\sigma }_{2}}}}{{{{\sigma }_{6}}M_{6}^{{0.5}}}} + \frac{{{{I}_{8}}{{\sigma }_{2}}}}{{{{\sigma }_{8}}M_{8}^{{0.5}}}} + \frac{{{{I}_{{10}}}{{\sigma }_{2}}}}{{{{\sigma }_{{10}}}M_{{10}}^{{0.5}}}}} \right)dt,$Используя уточненное правило аддитивности [19] сечений ионизации [20, 21], по уравнениям (4) и (3) были рассчитаны коэффициент k и абсолютные величины парциальных давлений насыщенного пара (табл. 3). Следует отметить, что величины парциальных давлений молекул (LiPiv)6, (LiPiv)8 и (LiPiv)10 являются оценочными.
Таблица 3.
Абсолютные величины парциальных давлений компонентов насыщенного пара [Па] при Т = 543 K
| Компонент пара | (LiPiv)2 | (LiPiv)4 | (LiPiv)6 | (LiPiv)8 | (LiPiv)10 |
|---|---|---|---|---|---|
| Парциальное давление | 4.13 × 10–2 | 9.32 × 10–2 | 9.7 × 10–3 | 1.2 × 10–3 | 2.0 × 10–4 |
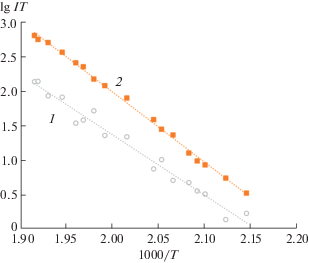
Из исследования температурных зависимостей интенсивностей ионных токов по уравнению Клаузиуса–Клапейрона методом наименьших квадратов рассчитали энтальпии сублимации димерных и тетрамерных молекул (табл. 4). Как видно из этой таблицы, величины, рассчитанные по интенсивностям ионных токов [Li3Piv2]+ и [Li4Piv3]+, хорошо согласуются друг с другом, что является прямым доказательством высказанного нами утверждения, что ионы [Li3Piv2]+ обязаны своим происхождением только молекулам (LiPiv)4. В этой же таблице приведена температурная зависимость нерасшифрованного (общего) ионного тока [Li2Piv]+, из которой видно, что значение энтальпии, рассчитанное по указанному ионному току, заметно отличается от величины, полученной по расшифрованному ионному току. На рис. 2 в качестве примера приведены температурные зависимости интенсивностей расшифрованного ионного тока [Li2Piv]+ и ионного тока [Li4Piv3]+, образованного из димерной и тетрамерной молекул соответственно. Несколько бóльшая неопределенность в величинах энтальпии сублимации молекул (LiPiv)2 связана с расшифровкой масс-спектра. Исследуемая интенсивность ионного тока ${{I}_{{{{{{\text{[L}}{{{\text{i}}}_{2}}{\text{(Piv)]}}}}^{{\text{ + }}}}}}}$ от температуры является разницей двух экспериментальных величин: ${{I}_{{{{{{\text{[L}}{{{\text{i}}}_{{\text{2}}}}{\text{Piv]}}}}^{{\text{ + }}}}\left( {{\text{общий}}} \right)}}}$ – ${{a}_{{{{{{{{\text{[L}}{{{\text{i}}}_{{\text{2}}}}{\text{Piv]}}}}^{{\text{ + }}}}} \mathord{\left/ {\vphantom {{{{{{\text{[L}}{{{\text{i}}}_{{\text{2}}}}{\text{Piv]}}}}^{{\text{ + }}}}} {{{{{\text{(LiPiv)}}}}_{4}}}}} \right. \kern-0em} {{{{{\text{(LiPiv)}}}}_{4}}}}}}}$ × ${{I}_{{{{{{\text{[L}}{{{\text{i}}}_{{\text{4}}}}{\text{Pi}}{{{\text{v}}}_{{\text{3}}}}{\text{]}}}}^{{\text{ + }}}}}}}$. Рекомендованное значение ∆sH°((LiPiv)2) = 174.2 ± ± 6.6 кДж/моль получено как среднее арифметическое из пяти, а значение ∆sH°((LiPiv)4) = 195.7 ± ± 4.5 кДж/моль – из 10 независимых измерений.
Таблица 4.
Значения энтальпий сублимации молекул пивалата лития в интервале температур 490–550 K (кДж/моль)
| № | ∆sH°(T) | |||
|---|---|---|---|---|
| [Li2Piv]+ Общий |
[Li2Piv]+ | [Li3Piv2]+ | [Li4Piv3]+ | |
| 1 | 179.8 ± 6.0 | 176.0 ± 8.9 | 196.9 ± 5.9 | 197.3 ± 2.6 |
| 2 | 181.2 ± 4.1 | 180.8 ± 8.3 | 194.2 ± 3.3 | 190.9 ± 2.9 |
| 3 | 190.5 ± 2.0 | 167.2 ± 3.5 | 197.5 ± 5.7 | 197.8 ± 9.0 |
| 4 | 182.5 ± 5.3 | 180 ± 12 | 198.7 ± 3.4 | 191.9 ± 1.9 |
| 5 | 187.3 ± 1.5 | 167.2 ± 6.7 | 197.4 ± 2.3 | 194.4 ± 2.7 |
| Среднее | 184.2 ± 6.5 | 174.2 ± 8.9 | 196.9 ± 4.4 | 194.4 ± 4.9 |
Рис. 2.
Температурные зависимости интенсивностей ионных токов: 1 – Li2Piv+/Li2Piv2, 2 – ${\text{L}}{{{\text{i}}}_{{\text{4}}}}{\text{Piv}}_{{\text{3}}}^{{\text{ + }}}$.
Пересчет стандартных энтальпий сублимации к температуре 298.15 K выполняли по изменению теплоемкости реакций сублимации димерных и тетрамерных молекул оксида молибдена [22]. Рассчитанные таким образом величины равны ∆sH°((LiPiv)2, 298.15 K) = 177.5 ± 7.0 кДж/моль и ∆sH°((LiPiv)4, 298.15 K) = 198.2 ± 5.0 кДж/моль. Согласно этим величинам, значение стандартной энтальпии реакции диссоциации (1) равно ∆DH°((1), 298.15 K) = 156.8 ± 11.1 кДж/моль. Энтальпия этой реакции также была рассчитана по 3-му закону термодинамики по величинам парциальных давлений молекул (LiPiv)2 и (LiPiv)4 при Т = 543 K (табл. 3).
В расчетах принимали ${{\Delta }_{r}}S_{T}^{^\circ }$ = 146.4 ± ± 13.0 Дж/(моль K), это значение соответствует газовым реакциям, протекающим с изменением числа молей, равным единице. Полученная величина, пересчитанная к температуре 298.15 (∆DH°((1), 298.15) = 153.6 ± 8.5 кДж/моль), хорошо согласуется со значением, рассчитанным по 2-му закону термодинамики, это служит подтверждением правильности расшифровки масс-спектра и определения абсолютных величин парциальных давлений. Здесь также можно отметить, что приведенное значение энтальпии согласуется с аналогичной величиной ∆DH°((1), 298.15) = 145.7 ± ± 25.0 кДж/моль, полученной при исследовании системы LiPiv–CdPiv2 [23].
Значение парциального давления мономерной молекулы LiPiv в насыщенном паре при Т = 543 K оценено в настоящей работе по величине предела чувствительности масс-спектрометра рLiPiv = 5.0 × × 10–5 Па. Знание этой величины и парциального давления молекул Li2Piv2 дало возможность рассчитать по 3-му закону термодинамики энтальпию реакции
(5)
${{({\text{LiPiv}})}_{{{\text{2}}\left( {\text{г}} \right)}}} = {{{\text{2}}}_{{\text{ }}}}{\text{LiPi}}{{{\text{v}}}_{{\left( {\text{г}} \right)}}}{\text{.}}$Найденная величина, пересчитанная к температуре 298.15 K, равна ∆DH°((5), 298.15) = 175.8 ± ± 13.5 кДж/моль, что позволило по закону Гесса и стандартной энтальпии сублимации димерных молекул определить энтальпию сублимации молекул LiPiv: ∆sH°(298.15) = 176.7 ± 13.5 кДж/моль.
В работе [24] приведена стандартная энтальпия образования радикала триметилуксусной (пивалевой) кислоты ∆fH°((СH3)3CCОО˙, 298.15 K) = = –265 кДж/моль, значение которой позволяет рассчитать стандартные энтальпии образования пивалата лития в конденсированной и газовой фазах в виде мономерных, димерных и тетрамерных молекул. Расчет был выполнен в предположении близости величин энтальпий разложения ацетата и пивалата лития по реакции:
(6)
${\text{Li}}{{{\text{L}}}_{{\left( {{\text{тв}}} \right){\text{ }}}}} = {\text{L}}_{{\left( г \right)}}^{\centerdot } + {\text{L}}{{{\text{i}}}_{{\left( {{\text{тв}}} \right)}}},$где L˙ – СН3СОО˙ ((СH3)3CCОО˙).
Принятое нами предположение вполне оправдано, различие в энтальпиях этих реакций зависит главным образом от разницы в величинах энтальпий сублимации и реакции диссоциации
(7)
${\text{Li}}{{{\text{L}}}_{{\left( {\text{г}} \right)}}} = {{{\text{L}}}^{\centerdot }}_{{\left( {\text{г}} \right)}} + {\text{L}}{{{\text{i}}}_{{\left( {\text{г}} \right)}}}{\text{\;}}$ацетатного и пивалатного комплексов лития в газовой фазе. Однако величины энтальпий реакций (7) для рассматриваемых карбоксилатных комплексов должны быть практически одинаковые, из чего следует, что разница в значениях энтальпий реакции (6) зависит только от разницы в величинах энтальпий сублимации ацетата и пивалата лития. Энтальпия реакции (6) ∆rH°((6), 298.15) = 537.7 кДж/моль рассчитывается по известным термодинамическим характеристикам ацетата лития: ∆fH°(LiОАс, 298.15 K) = –746.9 кДж/моль [25] и ∆fH°(ОАс˙, 298.15 K) = –209.2 кДж/моль [26]. В силу того, что структура конденсированной фазы ацетата лития представляет собой 3D-полимер [27], а фаза триметилуксусной (пивалевой) кислоты подобна пропионату и является 1D- и 2D-полимером [28], величина энтальпии реакции (6) для пивалатного комплекса должна быть несколько ниже (10–15 кДж/моль). С учетом этой возможной разницы были рассчитаны нижние пределы стандартных энтальпий образования конденсированного пивалата лития и молекул в газовой фазе (табл. 5).
Таблица 5.
Стандартные энтальпии образования пивалатов лития
| Соединение | $--{{\Delta }_{f}}H_{{298.15}}^{^\circ }$, кДж/моль |
|---|---|
| LiPiv(тв) | ≤804 |
| LiPiv(г) | ≤627 |
| (LiPiv)2(г) | ≤1430 |
| (LiPiv)4(г) | ≤3017 |
По абсолютной величине парциального давления при Т = 543 K и энтальпии сублимации димера и тетрамера пивалата лития установили уравнение зависимости давления (Па) молекул (LiPiv)2 и (LiPiv)4 от температуры:
(8)
${\text{lg}}{{p}_{{{{{\left( {{\text{LiPiv}}} \right)}}_{2}}}}} = {{--\left( {{\text{91}}00{\text{ }} \pm ~{\text{ 4}}00} \right)} \mathord{\left/ {\vphantom {{--\left( {{\text{91}}00{\text{ }} \pm ~{\text{ 4}}00} \right)} {Т + {\text{15}}.{\text{5}}~{\text{ }} \pm ~{\text{ }}0.{\text{1,}}}}} \right. \kern-0em} {Т + {\text{15}}.{\text{5}}~{\text{ }} \pm ~{\text{ }}0.{\text{1,}}}}$(9)
$\begin{gathered} {\text{lg}}{{p}_{{{{{\left( {{\text{LiPiv}}} \right)}}_{{\text{4}}}}}}} = {{--\left( {{\text{1}}0\,{\text{16}}0{\text{ }} \pm ~{\text{ 16}}0} \right)} \mathord{\left/ {\vphantom {{--\left( {{\text{1}}0\,{\text{16}}0{\text{ }} \pm ~{\text{ 16}}0} \right)} {Т + {\text{17}}.{\text{7}}~{\text{ }} \pm ~{\text{ }}0.{\text{1}},}}} \right. \kern-0em} {Т + {\text{17}}.{\text{7}}~{\text{ }} \pm ~{\text{ }}0.{\text{1}},}} \\ {\text{49}}0 \leqslant T \leqslant {\text{55}}0{\text{ K}}. \\ \end{gathered} $ЗАКЛЮЧЕНИЕ
К сожалению, детально сравнить полученные в данном исследовании термодинамические характеристики пивалата лития с литературными данными затруднительно, так как в литературе имеется всего одна работа [10] по изучаемой теме и три качественных исследования по анализу газовой фазы над карбоксилатами лития методом масс-спектрометрии [11–13]. В работе [10], посвященной исследованию процессов парообразования пивалатов щелочных металлов, приведен масс-спектр газовой фазы комплекса лития, который практически не отличается от масс-спектра, полученного в настоящей работе, кроме отсутствия в нем ионов Li+ и [LiPiv]+. Отсутствие этих ионов можно объяснить высокой дискриминацией по массам у используемого прибора МИ 1201. В этой же работе приведено оценочное значение энтальпии сублимации молекул (LiPiv)2 (${{\Delta }_{s}}H_{Т}^{^\circ }$ = = 205.0 ± 6.0 кДж/моль), полученное по нерасшифрованному ионному току ${{I}_{{{{{\left[ {{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{Piv}}} \right]}}^{{\text{ + }}}}}}}$ и не противоречащее значению, найденному в настоящей работе. В работах [11–13] исследовали процессы ионизации электронным ударом, химической ионизацией, десорбционной ионизацией в поле, ионизацией в поле газовой фазы над карбоксилатами щелочных металлов на квадрупольном масс-спектрометре. На основании полученных масс-спектров авторы пришли к выводу, что карбоксилаты щелочных металлов – это легколетучие соединения. Газовая фаза над ними состоит из полимерных молекул вплоть до октамерных молекул в случае пивалата лития. Необходимо заметить, что эксперимент в работах [11–13] был поставлен таким образом, что исследованию подвергали ненасыщенный пар, степень полимеризации которого была значительно ниже насыщенного. Таким образом, можно отметить, что имеющиеся в литературе данные находятся в полном согласии с выполненным исследованием.
Найденные термодинамические характеристики парообразования пивалата лития позволяют рекомендовать его в качестве прекурсора в методе МО CVD для получения оксидных пленок или покрытий. Это соединение обладает относительно простым составом насыщенного пара, высокой летучестью, простотой синтеза и устойчивостью на воздухе.
Список литературы
Dudney N.J. // Interface (The Electrochemical Society). 2008. V. 17. № 3. P. 44.
Nishide H., Oyaizu K. // Science. 2008. V. 319. P. 737. https://doi.org/10.1126/1151831
Choi W.-G., Yoon S.-G. // J. Power Sources. 2004. V. 125. P. 236. https://doi.org/10.1016/j.jpowsour.2003.08.014
Кулова Т.Л., Скундин А.М. // Электрохимическая энергетика. 2009. Т. 9. № 2. С. 57.
Wang B., Bates J.B., Hart F.X. et al. // J. Electrochem. Soc. 1996. V. 143. № 10. P. 3203. https://doi.org/10.1149/1.1837188
Bates J.B., Dudney N.J., Neudecker B.J. et al. // Solid State Ionics. 2000. V. 135. P. 33. https://doi.org/10.1016/S0167-2738(00)00327-1
Bates J.B., Dudney N.J., Neudecker B.J. et al. // J. Electrochem. Soc. 2000. V. 147. P. 59. https://doi.org/10.1149/1.1393157
Bates J.B., Dudney N.J., Gruzalski G.R. et al. // J. Power Sources. 1993. V. 43. № 1–3. P. 103. https://doi.org/10.1016/0378-7753(93)80106-Y
Yu X., Bates J.B., Jellison G.E. et al. // J. Electrochem. Soc. 1997. V. 144. № 2. P. 524. https://doi.org/10.1149/1.1837443
Хоретоненко Н.М. Структурные и термодинамические исследования пивалатов некоторых непереходных металлов. Автореф. … канд. хим. наук. М., 1998. 22 с.
Edward White V. // Org. Mass Spectrometry. 1978. V. 13. № 9. P. 495. https://doi.org/10.1002/oms.1210130903
Matsumoto K., Kosugi Y., Yanagisawa M. et al. // Org. Mass Spectrometry. 1980. V. 15. № 12. P. 606. https://doi.org/10.1002/oms.1210151203
Cao Y., Busch K.L. // J. Inorg. Chem. 1994. V. 33. P. 3970. https://doi.org/10.1021/ic00096a022
Zorina-Tikhonova E.N., Yambulatov D.S., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 2. P. 75. https://doi.org/10.1134/S1070328420020104
Kayumova D.B., Malkerova I.P., Shmelev M.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 125. https://doi.org/10.1134/S0036023619010121
Gribchenkova N.A., Alikhanyan A.S. // J. Alloys Compd. 2019. V. 778. P. 77. https://doi.org/10.1016/j.jallcom.2018.11.136
Горохов Л.Н. // Вестн. Моск. ун-та. Сер. матем., мех., физ. химия. 1958. С. 231.
Сидоров Л.Н., Коробов М.В., Журавлева Л.В. Масс-спектральные термодинамические исследования. М.: Изд-во МГУ, 1985. 208 с.
Otvose J.W., Stevenson D.P. // J. Am. Chem. Soc. 1956. V. 78. P. 546. https://doi.org/10.1021/ja01584a009
Guido M., Gigli G. // High Temp. Sci. 1975. V. 7. № 2. P. 122.
Meyer R.T., Lynch A.W. // High Temp. Sci. 1973. V. 5. № 3. P. 192.
Термодинамические свойства индивидуальных веществ. Справочное издание. М.: Наука, 1982. Т. 4. Кн. 2.
Gogoleva N.V., Kuznetsova G.N., Shmelev M.A. et al. // J. Solid State Chem. 2020. https://doi.org/10.1016/j.jssc.2020.121842
Lukyanova V.A., Papina T.S., Didenko K.V. et al. // J. Therm Anal. Calorim. 2008. V. 92. P. 743. https://doi.org/10.1007/s10973-008-9019-x
Рудницкий Л.А. // Журн. физ. химии. 1961. Т. 35. С. 1853.
Gray P., Thynne J.C.J. // Nature (Engl.). 1961. № 191. P. 1357. https://doi.org/10.1038/1911357a0
Martínez Casado F.J., Ramos Riesco M., Redondo M.I. et al. // Cryst. Growth Des. 2011. № 11. P. 1021. https://doi.org/10.1021/cg1010133
Martínez Casado F.J., Ramos Riesco M., Garcıa Perez M.V. et al. // J. Phys. Chem. B. 2009. V. 113. № 39. P. 12896. https://doi.org/10.1021/jp9047715
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии