Журнал неорганической химии, 2021, T. 66, № 6, стр. 760-766
ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ ГАФНАТА ТЕРБИЯ
А. В. Гуськов a, *, П. Г. Гагарин a, В. Н. Гуськов a, А. В. Тюрин a, А. В. Хорошилов a, К. С. Гавричев a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: a.gus@igic.ras.ru
Поступила в редакцию 26.01.2021
После доработки 27.01.2021
Принята к публикации 27.01.2021
Аннотация
Методами релаксационной и адиабатической калориметрии измерена моляльная теплоемкость гафната тербия со структурой пирохлора. По сглаженным значениям теплоемкости рассчитаны термодинамические функции при температурах 6–330 K. Определен общий вид аномалии Шоттки.
ВВЕДЕНИЕ
Гафнат тербия – представитель двойных высокотемпературных оксидов Ln2Hf2O7 (Ln = La–Tb), имеющих структуру пирохлора (Fd3m). Гафнат тербия кристаллизуется в области непрерывного ряда твердых растворов (1–x)TbO1.5 ‧ xHfO2 (x ≈ ≈ 0.45–1.0) со структурой разупорядоченного флюорита (Fm3m) на основе кубического диоксида гафния. Tb2Hf2O7 не имеет структурных превращений вплоть до температуры ~2500 K – перехода в структуру разупорядоченного флюорита [1–3]. Как и другие двойные оксиды со структурой пирохлора, образованные лантаноидами и металлами IVb группы, гафнат тербия имеет широкие перспективы практического использования в качестве ионных проводников, полупроводников, сцинтилляторов, материалов атомной промышленности, а также веществ для создания термобарьерных (TBC и EBC) керамических покрытий [4, 5]. Изучение структурных и электрических свойств гафната тербия выполнено в работе [6]. Оптическая керамика высокой прозрачности получена в [7], а в работе [8] исследованы ее магнитно-оптические свойства. Особое внимание вызывает образование нанокристаллического гафната тербия и его превращение в кристаллическую керамику нормальной размерности структурного типа пирохлора [5, 9–11]. Наиболее интересным исследованием комплекса физических свойств пирохлора Tb2Hf2O7 в области 1.8–300 K является работа [12], в которой были изучены магнитные свойства, измерена молярная теплоемкость и проведен анализ приращения теплоемкости за счет взаимодействия кристаллического поля и 4f-электронов гафната тербия (аномалия Шоттки). К сожалению, температурная зависимость теплоемкости и аномалия Шоттки приведены в работе [12] только в графическом виде, исключающем использование этих результатов в расчетных целях, в то время как теплоемкость и рассчитанные на основе ее термодинамические функции являются важной характеристикой вещества. Цель настоящего исследования – измерение молярной теплоемкости в области температур до 330 K и расчет термодинамических функций – энтропии, энтальпии и приведенной энергии Гиббса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
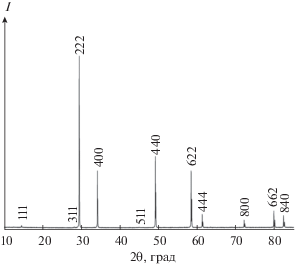
Гафнат тербия получали методом обратного осаждения. Исходными веществами служили сексвиоксид тербия (99.99 мас. %), диоксид гафния (99.99 мас. %) производства ООО “Ланхит”, соляная кислота (35–38 мас. %, ос. ч. 20-4) и раствор аммиака (25–28 мас. % NH4OH, ос. ч.) производства ООО “Химмед”. Синтез, методы измерения термического расширения, теплоемкости и обработки результатов подробно описаны в работах [13, 14]. В результате окончательного прокаливания при 1550 K в течение 4 ч получен Tb1.994Hf2.006O7.003. Такое отклонение от стехиометрии не может внести существенной погрешности в величину теплоемкости [15]. Проведенные дифракционные исследования показали, что полученный однофазный образец имеет кубическую структуру пирохлорного типа с параметром решетки a = 10.455(4) Å (рис. 1), удовлетворительно соответствующим литературным данным [12, 16]. Растровая электронная микроскопия показала (рис. 2), что образец не является наноразмерным, поэтому поправок на размерный фактор вводить не требуется. Молекулярную массу рассчитывали из атомных масс [17], она составила М.м. = 786.8265 г/моль. Измерения молярной теплоемкости методом релаксационной калориметрии проводили на автоматизированном комплексе для измерения физических свойств Quantum Design PPMS-9, измерения адиабатической калориметрии – на автоматическом низкотемпературном калориметре БКТ-3 АОЗТ “Термис”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Молярная теплоемкость гафната тербия со структурой пирохлора измерена методами релаксационной (5.8–43.9 K) и адиабатической (6.0–327.1 K) калориметрии в 38 и 120 температурных точках соответственно (табл. 1).
Таблица 1.
Экспериментальная зависимость молярной теплоемкости гафната тербия (пирохлор) от температуры, р = 101.3 кПа
| T, K | Cp, Дж моль–1 K–1 | T, K | Cp, Дж моль–1 K–1 | T, K | Cp, Дж моль–1 K–1 |
|---|---|---|---|---|---|
| Релаксационная калориметрия | |||||
| 5.753 | 2.368 | 11.66 | 3.336 | 23.89 | 12.54 |
| 6.072 | 2.320 | 12.37 | 3.578 | 25.19 | 14.05 |
| 6.413 | 2.290 | 13.02 | 3.875 | 26.61 | 15.70 |
| 6.758 | 2.265 | 13.76 | 4.259 | 28.19 | 17.45 |
| 7.133 | 2.268 | 14.53 | 4.714 | 29.76 | 19.47 |
| 7.523 | 2.273 | 15.35 | 5.239 | 31.45 | 21.50 |
| 7.950 | 2.318 | 16.21 | 5.803 | 33.23 | 23.76 |
| 8.397 | 2.361 | 17.14 | 6.475 | 35.12 | 26.16 |
| 8.868 | 2.438 | 18.11 | 7.230 | 37.12 | 28.81 |
| 9.368 | 2.547 | 19.17 | 8.113 | 39.22 | 31.76 |
| 9.894 | 2.690 | 20.17 | 9.013 | 41.47 | 34.81 |
| 10.44 | 2.854 | 21.36 | 10.12 | 43.86 | 37.91 |
| 11.04 | 3.060 | 22.59 | 11.38 | ||
| Адиабатическая калориметрия | |||||
| 6.04 | 5.44 | 67.31 | 70.57 | 155.49 | 157.3 |
| 6.84 | 2.83 | 69.09 | 72.80 | 158.98 | 160.1 |
| 7.12 | 3.43 | 70.86 | 74.98 | 162.48 | 162.8 |
| 7.46 | 2.95 | 72.83 | 77.36 | 170.24 | 168.6 |
| 7.95 | 2.85 | 75.09 | 80.03 | 174.24 | 171.5 |
| 8.33 | 2.58 | 77.31 | 82.60 | 177.77 | 174.0 |
| 8.76 | 3.21 | 79.38 | 84.11 | 181.31 | 176.5 |
| 9.68 | 2.86 | 79.52 | 85.12 | 184.83 | 178.8 |
| 10.66 | 3.24 | 81.74 | 87.60 | 188.36 | 181.2 |
| 11.98 | 3.44 | 81.88 | 88.10 | 191.90 | 183.4 |
| 13.04 | 4.22 | 83.98 | 90.06 | 195.53 | 185.7 |
| 14.25 | 4.65 | 84.21 | 88.89 | 199.11 | 187.9 |
| 15.43 | 5.42 | 86.25 | 92.53 | 203.09 | 190.2 |
| 16.73 | 5.82 | 86.41 | 92.40 | 207.48 | 192.8 |
| 18.01 | 6.45 | 88.61 | 94.78 | 211.96 | 195.3 |
| 19.29 | 8.04 | 88.64 | 95.07 | 216.39 | 197.7 |
| 20.75 | 9.60 | 90.82 | 97.95 | 220.76 | 199.9 |
| 23.52 | 11.52 | 93.05 | 99.68 | 225.14 | 201.9 |
| 25.69 | 14.00 | 94.91 | 101.6 | 229.51 | 204.0 |
| 27.81 | 16.58 | 95.36 | 102.4 | 234.05 | 206.1 |
| 29.79 | 19.10 | 97.60 | 105.1 | 238.47 | 208.2 |
| 31.75 | 21.67 | 97.65 | 104.4 | 242.89 | 210.2 |
| 33.72 | 24.37 | 99.86 | 106.6 | 247.23 | 212.2 |
| 35.66 | 26.79 | 100.06 | 106.8 | 251.58 | 214.0 |
| 37.53 | 29.62 | 103.06 | 109.9 | 255.87 | 215.7 |
| 39.38 | 32.38 | 106.69 | 113.4 | 260.16 | 217.4 |
| 41.21 | 35.06 | 107.19 | 113.9 | 264.42 | 219.0 |
| 43.04 | 37.45 | 110.29 | 117.0 | 268.67 | 220.5 |
| 44.86 | 39.85 | 111.18 | 117.8 | 272.87 | 222.0 |
| 46.66 | 42.57 | 113.90 | 120.4 | 277.04 | 223.4 |
| 48.46 | 45.24 | 114.71 | 121.2 | 281.21 | 224.7 |
| 50.26 | 47.51 | 117.50 | 123.9 | 285.30 | 226.0 |
| 52.05 | 50.02 | 118.19 | 124.5 | 289.38 | 227.3 |
| 53.95 | 52.58 | 121.68 | 127.8 | 293.45 | 228.5 |
| 56.26 | 55.82 | 129.22 | 134.8 | 297.48 | 229.7 |
| 58.31 | 58.68 | 133.23 | 138.4 | 301.39 | 230.8 |
| 60.14 | 61.18 | 136.77 | 141.5 | 305.84 | 232.0 |
| 61.99 | 63.67 | 144.50 | 148.2 | 312.25 | 234.4 |
| 63.75 | 65.99 | 148.51 | 151.6 | 319.75 | 236.4 |
| 65.54 | 68.31 | 151.99 | 154.5 | 327.08 | 239.1 |
Сглаживание экспериментальных значений теплоемкости выполнено с использованием уравнений (1) и (2) [18]:
(1)
${{C}_{p}} = \Sigma {{a}_{i}}{\text{ln}}{{\left( {T{\text{/4}}00} \right)}^{i}}\left( {{\text{6}}{\kern 1pt} --{\kern 1pt} {\text{15 K}}} \right),$(2)
$\begin{gathered} {{C}_{p}} = \\ = \,\,{{{\text{3}}R\Sigma {{a}_{i}}\left( {{{{\left( {{{\theta }_{i}}{\text{/}}T} \right)}}^{{\text{2}}}}} \right){{e}^{{\theta i/T}}}} \mathord{\left/ {\vphantom {{{\text{3}}R\Sigma {{a}_{i}}\left( {{{{\left( {{{\theta }_{i}}{\text{/}}T} \right)}}^{{\text{2}}}}} \right){{e}^{{\theta i/T}}}} {{{{\left( {{{e}^{{\theta i/T}}}--{\text{1}}} \right)}}^{{\text{2}}}}\left( {{\text{15}}{\kern 1pt} --{\kern 1pt} {\text{33}}0{\text{ K}}} \right)}}} \right. \kern-0em} {{{{\left( {{{e}^{{\theta i/T}}}--{\text{1}}} \right)}}^{{\text{2}}}}\left( {{\text{15}}{\kern 1pt} --{\kern 1pt} {\text{33}}0{\text{ K}}} \right)}}. \\ \end{gathered} $Коэффициенты уравнений (1) и (2) приведены в табл. 2.
Таблица 2.
Коэффициенты уравнений (1) и (2), аппроксимирующих температурную зависимость молярной теплоемкости гафната тербия при 6–330 K, р = = 101.3 кПа
| Cp = Σai ln(T/400)i (6–15 K) | |
|---|---|
| i | ai |
| 0 | 355.2435 |
| 1 | 261.9488 |
| 2 | 64.91673 |
| 3 | 5.368378 |
| Cp = 3RΣai((i/T)2)eθi/T/(eθi/T–1)2 (15–330 K) | |
| ai | ${{\theta }_{i}}$ |
| 0.12153 | 7.2915 |
| 1.4780 | 103.628 |
| 4.0437 | 246.615 |
| 5.7318 | 671.243 |
Зависимость теплоемкости в интервале температур 6–330 K является гладкой и не содержит структурных аномалий. Наиболее интересной является область низких температур (6–25 K, рис. 3). На кривой теплоемкости, так же как и в работе [12], при температуре ~8 K наблюдается минимум (~2 Дж моль –1 K–1). Дальнейшее понижение температуры приводит к увеличению значений теплоемкости, вызванному нисходящей ветвью магнитного превращения, которое происходит при температуре <2 K. Это явление особенно заметно в сравнении с теплоемкостью гафната лантана (рис. 3, кривая 4) [19], имеющего однотипную структуру Fd3m. Существование магнитного превращения в области 0–2 K характерно для всех соединений лантаноидов, за исключением лантана и лютеция [20]. При температурах 0–6 K теплоемкость в основном определяется магнитной составляющей, так как величина решеточной теплоемкости гафната тербия должна быть близка к значению теплоемкости гафната лантана, поскольку различие в молярных массах этих веществ не превышает ~5%. Вклад низкотемпературной магнитной компоненты теплоемкости в приращение энтальпии при 298 K, как правило, находится в пределах погрешности измерений, тогда как величина его энтропии может достигать значения ΔS = 2Rln2 ≈ 11.5 Дж моль –1 K–1 [20, 21]. Однако для более точного определения энтропии магнитного превращения требуются дополнительные эксперименты в области самых низких температур. Не имея возможности выполнить измерения теплоемкости ниже 6 K, мы рассчитали термодинамические функции гафната тербия по сглаженным значениям теплоемкости в интервале 6–330 K без учета вклада значений функций на участке 0–6 K (табл. 3).
Рис. 3.
Экспериментальная зависимость теплоемкости гафната тербия (пирохлор) в области 6–25 K: 1 – адиабатическая калориметрия; 2 – релаксационная калориметрия; 3 – сглаживающая кривая (уравнения (1) и (2)); 4 – теплоемкость гафната лантана (пирохлор) [19].
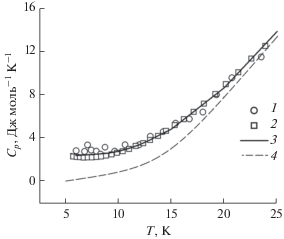
Таблица 3.
Термодинамические функции гафната тербия (пирохлор) при 6–330 K, р = 101.3 кПа
| T, K | $C_{p}^{^\circ }$, Дж моль–1 K–1 | S°(T) – S°(6 K), Дж моль–1 K–1 | H°(T) – H°(6 K), Дж моль–1 | Φ°(T) – Φ°(6 K), Дж моль–1 K–1 |
|---|---|---|---|---|
| 6 | 2.457 | 0 | 0 | 0 |
| 7 | 2.527 | 0.3853 | 2.492 | 0.0847 |
| 8 | 2.573 | 0.7266 | 5.043 | 0.193 |
| 9 | 2.669 | 1.036 | 7.663 | 0.314 |
| 10 | 2.842 | 1.326 | 10.42 | 0.439 |
| 11 | 3.103 | 1.609 | 13.39 | 0.568 |
| 12 | 3.452 | 1.894 | 16.67 | 0.699 |
| 13 | 3.886 | 2.187 | 20.34 | 0.832 |
| 14 | 4.398 | 2.494 | 24.48 | 0.967 |
| 15 | 4.733 | 2.801 | 28.93 | 0.977 |
| 20 | 8.687 | 4.661 | 61.73 | 1.272 |
| 25 | 13.87 | 7.142 | 117.8 | 1.882 |
| 30 | 19.67 | 10.18 | 201.4 | 2.750 |
| 35 | 25.99 | 13.68 | 315.4 | 3.838 |
| 40 | 32.78 | 17.58 | 462.1 | 5.117 |
| 45 | 39.88 | 21.85 | 643.6 | 6.567 |
| 50 | 47.07 | 26.43 | 861.0 | 8.169 |
| 60 | 61.06 | 36.26 | 1402 | 11.77 |
| 70 | 73.92 | 46.65 | 2078 | 15.78 |
| 80 | 85.64 | 57.30 | 2877 | 20.12 |
| 90 | 96.49 | 68.02 | 3788 | 24.67 |
| 100 | 106.8 | 78.72 | 4805 | 29.39 |
| 110 | 116.6 | 89.36 | 5922 | 34.22 |
| 120 | 126.2 | 99.92 | 7136 | 39.13 |
| 130 | 135.4 | 110.4 | 8444 | 44.09 |
| 140 | 144.2 | 120.7 | 9843 | 49.09 |
| 150 | 152.7 | 131.0 | 11 330 | 54.11 |
| 160 | 160.7 | 141.1 | 12 890 | 59.13 |
| 170 | 168.3 | 151.1 | 14 540 | 64.16 |
| 180 | 175.4 | 160.9 | 16 260 | 69.18 |
| 190 | 182.1 | 170.6 | 18 050 | 74.18 |
| 200 | 188.3 | 180.1 | 19 900 | 79.16 |
| 210 | 194.0 | 189.4 | 21 810 | 84.11 |
| 220 | 199.4 | 198.5 | 23 780 | 89.04 |
| 230 | 204.4 | 207.5 | 25 800 | 93.93 |
| 240 | 209.0 | 216.3 | 27 860 | 98.78 |
| 250 | 213.3 | 224.9 | 29 980 | 103.6 |
| 260 | 217.3 | 233.4 | 32 130 | 108.4 |
| 270 | 221.0 | 241.6 | 34 320 | 113.1 |
| 280 | 224.4 | 249.7 | 36 550 | 117.8 |
| 290 | 227.6 | 257.7 | 38 810 | 122.4 |
| 298.15 | 230.0 ± 1.2 | 264.0 ± 3.0 | 40 670 ± 220 | 126.1± 1.5 |
| 300 | 230.5 | 265.4 | 41 100 | 127.0 |
| 310 | 233.3 | 273.0 | 43 420 | 131.5 |
| 320 | 235.8 | 280.5 | 45 760 | 136.0 |
| 330 | 238.2 | 287.8 | 48 134 | 140.5 |
| 340 | 240.4 | 294.9 | 50 527 | 144.9 |
Помимо магнитных превращений, происходящих в области самых низких температур, взаимодействие электронов 4f-уровня с кристаллическим полем приводит к увеличению теплоемкости соединений лантаноидов (кроме соединений La и Lu) [20–23]. Общий вид избыточной теплоемкости может быть установлен вычитанием решеточной теплоемкости гафната тербия, которая, как отмечено выше, не слишком отличается от теплоемкости гафната лантана. В работе [12] был выполнен такой расчет с учетом увеличения молярной массы гафната тербия по сравнению с гафнатом лантана. Однако, на наш взгляд, проведение корректировки решеточной теплоемкости по массе в сторону повышения является не вполне оправданным, так как превалирующее влияние на теплоемкость оказывает лантаноидное сжатие, действующее в противоположном направлении, т.е. уменьшающее величину теплоемкости [22, 23]. На рис. 4 показана разность
(3)
$\begin{gathered} \Delta {{С}_{p}}\,\,({\text{Дж мол}}{{{\text{ь}}}^{{--{\text{1}}}}}\,{{{\text{K}}}^{{--{\text{1}}}}}) = \\ = {{C}_{p}}({\text{T}}{{{\text{b}}}_{{\text{2}}}}{\text{H}}{{{\text{f}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})--{{C}_{p}}({\text{L}}{{{\text{a}}}_{{\text{2}}}}{\text{H}}{{{\text{f}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}), \\ \end{gathered} $ЗАКЛЮЧЕНИЕ
В настоящей работе приведены результаты измерений молярной теплоемкости гафната тербия структурного типа пирохлора и результаты расчета термодинамических функций в области 6–330 K по сглаженным значениям теплоемкости. Стандартные термодинамические параметры при 298.15 K составляют: $C_{p}^{^\circ }$ (Дж моль–1 K–1) = 230.0 ± 1.2, S°(T) – S°(6 K) (Дж моль–1 K–1) = 264.0 ± 3.0, H°(T) – H°(6 K) (Дж моль–1) = 40670 ± 220, Φ°(T) – Φ°(6 K) (Дж моль–1 K–1) = 126.1 ± 1.5. Определен общий вид аномалии Шоттки.
Список литературы
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363. https://doi.org/10.1016/jeurceramsoc.2008.01.009
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов: Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Rushton M.J.D., Grimes R.W., Stanek C.R. et al. // J. Mater. Res. 2004. V. 19. P. 1603. https://doi.org/10.1557/JMR.2004.0231
Subramanian M.A., Aravamudan G., Subba Rao G.V. // Prog. Solid State Chem. 1983. V. 15. P. 55. https://doi.org/10.1016/0079-6786(83)90001-8
Kabanova V.A., Popov V.V., Zubavichus Ya.V. et al. // J. Phys.: Conf. Series. 2016. V. 712. Art. 012113. https://doi.org/10.1088/1742-6596/712/1/012113
Shlyaktina A.V., Boguslavsky M.V., Stefanovich S.Yu. et al. // Inorg. Mater. 2006. V. 42. P. 519. [Шляхтина А.В., Богуславский М.В., Стефанович С.Ю. и др. // Неорган. материалы. 2006. Т. 42. С. 579.]https://doi.org/10.1134/S002016850605013X
Aung Y.L., Ikesue A., Yasuhara R., Iwamoto Y. // J. Alloys Compd. 2020. V. 822. Art. 153564. https://doi.org/10.1016/j.jallcom.2019.153564
Yasuhara R., Ikesue A. // Optics Express. 2019. V. 27. Art. 7485. https://doi.org/10.1364/OE.27.007485
Popov V.V., Menushenkov A.P., Yaroslavtsev A.A. et al. // J. Alloys Compd. 2016. V. 689. P. 669. https://doi.org/ 101016/j.jallcom.2016.08.019
Popov V.V., Zubavichus Ya.V., Menushenkov A.P. et al. // Russ. J. Inorg. Chem. 2015. V. 60. P. 16. [Попов В.В., Зубавичус Я.В., Менушенков А.П. и др. // Журн. неорган. химии. 2015. Т. 60. С. 18.]https://doi.org/10.1134/S003602361501009X
Menushenkov A.P., Popov V.V., Zubavichus Ya.V., Yaroslavtsev A.A. // J. Struct. Chem. 2016. V. 57. P. 1450. https://doi.org/10.1134/s0022476616070210
Anand V.K., Opherden L., Xu J. et al. // Phys. Rev. B. 2008. V. 97. P. 094402. https://doi.org/10.1103/physrevb.97.094402
Ryumin M.A., Nikiforova G.E., Tyurin A.V. et al. // Inorg. Mater. 2020. V. 56. P. 97. [Рюмин М.А., Никифорова Г.Е., Тюрин А.В. и др. // Неорган. материалы. 2020. Т. 56. С. 102.]https://doi.org/10.1134/S0020168520010148
Guskov V.N., Tyurin A.V., Guskov A.V. et al. // Ceram. Int. 2020. V. 46. P. 12822. https://doi.org/10.1016/j.ceramint.2020.02.052
Gagarin P.G., Guskov A.V., Guskov V.N. et al. // Ceram. Int. 2021. V. 47. P. 2892. https://doi.org/10.1016/j.ceramint.2020.09072
Blanchard P.E.R., Lio S., Kennedy B.J. et al. // J. Phys. Chem. C. 2013. V. 117. P. 2266. https://doi.org/10.1021/jp311329q
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051. https://doi.org/10.1351/pac200678112051
Voskov A.L., Kutsenok I.B., Voronin G.F. // Calphad. 2018. V. 61. P. 50. https://doi.org/10.1016/j.calphad.2018.02.001
Guskov V.N., Gagarin P.G., Guskov A.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1436. [Гуськов В.Н., Гагарин П.Г., Гуськов А.В. и др. // Журн. неорган. химии. Т. 64. С. 1210. https://doi.org/10.1134/S0044457x19110060]https://doi.org/10.1134/S0036023619110068
Blöte H.W.J., Wielinga R.F., Huiskamp W.J. // Physica. 1969. V. 43. P. 549. https://doi.org/10.1016/0031-8914(69)90187-6
Xu J., Anand V.K., Bera A.K. et al. // Phys. Rev. 2015. V. 92. Art. 224430. https://doi.org/10.1103/PhysRevB.92.224430
Chirico R.D., Westrum E.F. Jr. // J. Chem. Thermodyn. 1980. V. 12. P. 71. https://doi.org/10.1016/0021-9614(80)90118-4
Chirico R.D., Westrum E.F. Jr. // J. Chem. Thermodyn. 1980. V. 12. P. 311. https://doi.org/10.1016/0021-9614(80)90143-3
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии