Журнал неорганической химии, 2021, T. 66, № 6, стр. 785-793
ФАЗОВЫЕ РАВНОВЕСИЯ, КРИТИЧЕСКИЕ ЯВЛЕНИЯ И ЭКСТРАКТИВНАЯ КРИСТАЛЛИЗАЦИЯ СОЛИ В ТРОЙНОЙ СИСТЕМЕ ХЛОРИД НАТРИЯ–ВОДА–ДИИЗОПРОПИЛАМИН
Д. Г. Черкасов a, *, В. В. Данилина a, К. К. Ильин a
a Саратовский национальный исследовательский государственный университет
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: dgcherkasov@mail.ru
Поступила в редакцию 25.01.2021
После доработки 09.02.2021
Принята к публикации 10.02.2021
Аннотация
Экстрактивная кристаллизация является перспективным способом получения солей из их водных растворов. Ее проведение при возможности регенерации растворителя для повторного использования является актуальным. Цель исследования состояла в нахождении оптимальных условий экстрактивной кристаллизации хлорида натрия путем изучения фазовых равновесий и критических явлений в тройной системе хлорид натрия–вода–диизопропиламин в интервале температур 10.0–90.0°C, а также в выявлении возможности применения хлорида натрия для высаливания диизопропиламина из его водных растворов. Система вода–диизопропиламин имеет нижнюю критическую температуру растворения 27.3°С. Визуально-политермическим методом определены температуры фазовых переходов и построены политермы фазовых состояний смесей компонентов тройной системы. Выявлены зависимости состава критического раствора и коэффициента распределения (Kp) диизопропиламина между водной и органической фазами монотектического состояния от температуры. Максимальное значение Kp (480) достигается при 90.0°С. Установлено, что выход кристаллов NaCl возрастает при увеличении концентрации амина в тройных смесях. Максимальный выход хлорида натрия (49%) из водно-солевого раствора, содержащего 26 мас. % соли, реализуется при 27.3оС при введении 90.0 мас. % диизопропиламина.
ВВЕДЕНИЕ
Одним из перспективных способов получения солей является экстрактивная (или антисольвентная) кристаллизация [1, 2]. Органический растворитель, называемый антирастворителем, добавляют в водный раствор соли, что приводит к значительному снижению ее растворимости и выпадению некоторой части в осадок. Одним из очевидных преимуществ данного способа по сравнению с традиционным упариванием раствора является его меньшая энергозатратность [2]. Он особенно актуален для солей, имеющих небольшой температурный коэффициент растворимости или же разлагающихся при упаривании растворов. В качестве антирастворителей предлагается использовать алифатические низкомолекулярные спирты и амины, кетоны, эфиры, спиртоэфиры [3]. Среди них наиболее перспективными являются те, которые вызывают расслаивание при введении в водные растворы солей. Это позволяет отделить органическую фазу и после осушки использовать ее повторно для проведения процесса кристаллизации.
Метод экстрактивной кристаллизации предложен для получения формиата и сульфата лития [4], сульфатов натрия [5–7], калия [6, 8], цезия [9], магния [10] и меди(II) [6], нитратов калия [11] и цезия [12], хлорида [1, 2, 7, 13, 14], бромида [15] и карбоната [1] натрия, хлорида лития [15] и иодида калия [15]. Во многих работах [2–4, 7, 14] указывается на то, что антирастворителями с наилучшим сочетанием свойств являются амины. Они эффективно понижают растворимость солей, причем их растворимость в водно-солевых растворах невелика. В литературе почти нет работ, в которых установлены оптимальные условия (природа антирастворителя и соли, их концентрация в растворе, температура) для получения каких-либо солей методом экстрактивной кристаллизации. На наш взгляд, нахождение таких условий возможно только на основе анализа фазовых диаграмм систем при различных температурах.
Ранее нами [16] изучены фазовые равновесия в тройной системе нитрат натрия–вода–дипропиламин в интервале температур 10.0–90.0°C и проведен анализ построенных изотермических фазовых диаграмм. В результате исследования показана перспективность использования дипропиламина для получения нитрата натрия путем экстрактивной кристаллизации и найдены оптимальные условия для проведения процесса с наилучшим выходом соли.
Хлорид натрия является одним из самых востребованных веществ, поскольку его применяют при производстве более чем 1500 различных веществ и материалов; его ежегодное мировое производство достигает сотен миллионов тонн [17–19]. Приводятся схемы получения хлорида натрия из его концентрированных водных растворов при действии диизопропиламина [2, 14] и диметил-изопропиламина [14]. Авторы этих работ установили, что с понижением температуры растворимость соли в водно-аминовых растворах значительно уменьшается. Поэтому они предложили проводить процесс при относительно низких температурах (0.3°С [2], 1°С [14]) и концентрации амина в смеси 90 мас. %. Процесс протекает при отсутствии расслаивания смеси, и выход соли при указанных условиях достигает 81% [2]. С целью регенерации амина из оставшегося после отделения кристаллов NaCl маточного раствора предложено его нагревать и отделять органическую фазу. Приведенные расчеты [2] для завода по производству хлорида натрия (мощность 1 млн т/год) показали возможность снижения энергозатрат на 29% при кристаллизации с антирастворителем, однако в целом затраты на основной капитал на 8–55% выше, чем при традиционном многократном упаривании раствора. В работах [2, 14] не изучено влияние температуры и концентрации добавленного амина на выход твердого хлорида натрия, не приведены фазовые диаграммы тройных систем, не определены наилучшие температуры для регенерации амина. Поэтому, на наш взгляд, полученные результаты и выводы нельзя считать оптимальными и окончательными.
Цель нашего исследования состояла в нахождении оптимальных условий экстрактивной кристаллизации хлорида натрия путем изучения фазовых равновесий и критических явлений в тройной системе хлорид натрия–вода–диизопропиламин в интервале температур 10.0–90.0°C. Кроме того, предполагалось выявить возможность применения хлорида натрия для высаливания диизопропиламина из его водных растворов.
ОБЪЕКТЫ И МЕТОДЫ
Используемые в работе воду (получали на бидистилляторе DEM-20 MERA-POLNA) и диизопропиламин (Across Organics, содержание основного вещества ≥99.0 мас. %) идентифицировали по температуре кипения, показателю преломления и плотности. Поскольку полученные значения в пределах погрешности измерений совпадали со справочными данными [19], дополнительную очистку диизопропиламина не проводили. Хлорид натрия (ч. д. а., содержание соли 99.9 мас. %, Михайловский завод химреактивов) в мелкодисперсном состоянии сушили на воздухе при 120°С и досушивали над оксидом фосфора(V) до постоянной массы. Термогравиметрический анализ полученного препарата хлорида натрия показал отсутствие в нем влаги.
В смесях компонентов тройной системы NaCl‒H2O‒(i‑C3H7)2NH фазовые равновесия изучали визуально-политермическим методом [20] в стеклянных ампулах при давлении паров в интервале температур 10–90°С. Методика исследования подробно изложена в работе [21]. Запаянные стеклянные ампулы со смесями поочередно помещали в ультратермостат Lauda A-100 с прозрачными стенками (рабочая жидкость – дистиллированная вода), в котором поддерживали температуру с точностью 0.1°С. Температуру измеряли с помощью электронного лабораторного термометра ЛТ-300-Н с точностью 0.1°С. Вблизи температуры фазового перехода нагревание и охлаждение рабочей жидкости проводили с малой скоростью (~0.5 град/мин).
Метод отношения объемов жидких фаз [22] использовали для нахождения составов смесей, отвечающих растворам в критическом состоянии. Время установления равновесия жидкость–жидкость составляло примерно 1 ч, а равновесия жидкость–твердое – около 3 ч при постоянном перемешивании смесей компонентов. Совпадение значений температуры каждого фазового перехода при повторных измерениях служило критерием установления равновесия в смесях компонентов.
Твердую фазу насыщенных растворов идентифицировали с помощью термического (дериватограф OD-102, МОМ, Венгрия) и рентгенофазового (дифрактометр ДРОН-3) анализа. Установлено, что твердой фазой во всем температурном интервале исследования являлся хлорид натрия. На основе полученных политермических данных построены изотермы фазовых состояний изученной тройной системы по методике, изложенной в [21]. С относительной погрешностью ±0.5–1.0% определены составы смесей, отвечающие определенным фазовым переходам при намеченных нами температурах.
Оценку выхода кристаллов соли, полученного графическим методом, осуществляли с помощью гравиметрического анализа. Для этого готовили ряд смесей компонентов с наличием твердой фазы и разным содержанием диизопропиламина, выдерживали их 2 ч в термостате при непрерывном перемешивании и заданной температуре. Затем при той же температуре отфильтровывали твердую фазу каждой смеси. Полученные осадки сушили до постоянной массы и взвешивали. Расхождение между расчетными и экспериментальными результатами не превышало 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
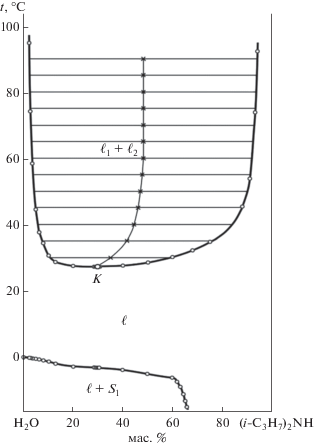
В изучаемую тройную систему хлорид натрия–вода–диизопропиламин входят три двойные системы. Кратко их охарактеризуем. Двойная жидкостная система вода–диизопропиламин характеризуется расслаиванием с нижней критической температурой растворения (НКТР), растворимость компонентов исследована в работах [2, 4, 23–25]. Фазовая диаграмма системы построена в интервале 20–60оС [4, 23, 25]. Поскольку данные разных авторов не согласуются, нами изучены растворимость и фазовые равновесия в смесях компонентов в интервале температур –20–90оС. Построена фазовая диаграмма (рис. 1), найдены состав критического раствора (28.98 мас. % диизопропиламина) и НКТР двойной системы (27.3°С) [26]. Впервые установлено, что фазовая диаграмма характеризуется пологой и протяженной по концентрации линией кристаллизации льда (S1).
Растворимость хлорида натрия в воде исследована в широком интервале температур [27, 28]. В смесях компонентов обнаружены два трехфазных нонвариантных равновесия. При 0.15°С в системе осуществляется трехфазное равновесие перитектического типа, твердыми фазами которого являются индивидуальная соль (NaCl) и кристаллогидрат (NaCl · 2H2O). При –21.2°С в системе осуществляется второе трехфазное равновесие эвтектического типа, твердыми фазами которого являются лед и кристаллогидрат хлорида натрия [28]. Соль и ее кристаллогидрат характеризуются положительными температурными коэффициентами растворимости в воде. Таким образом, в интересующем нас температурном интервале 10.0–90.0°С твердой фазой насыщенных растворов является безводный хлорид натрия.
Данных по растворимости в двойной системе хлорид натрия–диизопропиламин в литературе не обнаружено. Нами установлено, что в изученном интервале температур растворимость этой соли в диизопропиламине не превышает 0.05 мас. %.
Смеси трех компонентов по сечениям I–VII треугольника состава имели переменное содержание хлорида натрия и постоянное содержание амина в смеси с водой: 5.00 (I), 10.00 (II), 25.00 (III), 40.00 (IV), 55.00 (V), 70.00 (VI) и 85.00 (VII) мас. %. Построенные политермические фазовые диаграммы системы по указанным сечениям (рисунки не приводятся) подобны: две плавные кривые разделяют поля гомогенного состояния $\ell $, расслоения ${{\ell }_{1}}$ + ${{\ell }_{2}}$ (${{\ell }_{1}}$ – органическая, ${{\ell }_{2}}$ – водная фазы) и монотектического состояния ${{\ell }_{1}}$ + ${{\ell }_{2}}$ + + S (S – NaCl).
Смеси компонентов (сечения IX, X) имели переменное содержание амина и обладали постоянным содержанием хлорида натрия в смеси с водой: 28.00 (IX) и 60.00 (X). Найденные температуры фазовых переходов в смесях компонентов по этим сечениям (политермы фазовых состояний не приводятся) позволили определить положение предельных сторон монотектического треугольника при различных температурах. Аналогичное положение на концентрационном треугольнике имело сечение VIII (13.00 мас. % хлорида натрия), фазовые переходы в смесях компонентов которого изучали для уточнения границы поля расслоения.
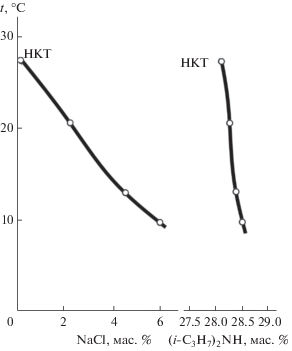
Смеси компонентов с переменным содержанием хлорида натрия и постоянным соотношением масс диизопропиламина и воды (29.71 : 70.29, 29.53 : 70.47, 30.11 : 69.89) были приготовлены для нахождения зависимости состава критического раствора равновесия жидкость–жидкость от температуры. Критические кривые (рис. 2) начинаются при 27.3°С в точке НКТ, отвечающей составу критического раствора двойной системы вода–амин, и заканчиваются при 9.8°С. Видно, что введение хлорида натрия в смесь критического состава системы вода–диизопропиламин приводит к понижению ее НКТР. Таким образом, эта соль вызывает уменьшение взаимной растворимости компонентов, т.е. хлорид натрия обладает высаливающим действием.
Рис. 2.
Зависимости содержания хлорида натрия и диизопропиламина в критических растворах от температуры в тройной системе хлорид натрия–вода–диизопропиламин.
Политермы фазовых состояний системы, критические кривые (рис. 2) и данные по растворимости двойных систем вода–диизопропиламин [26] и хлорид натрия–вода [27] применили для определения составов смесей, отвечающих точкам фазовых переходов при пяти температурах. На рис. 3 изображены изотермы фазовых состояний при 10.0, 25.0, 27.3, 40.0, 90.0°С, анализ которых позволил выявить топологическую трансформацию фазовой диаграммы тройной системы с повышением температуры. В табл. 1 представлены данные по растворимости в исследованной системе при указанных температурах.
Рис. 3.
Изотермы фазовых состояний (мас. %) тройной системы хлорид натрия–вода–диизопропиламин при 10.0, 25.0, 27.3, 40.0 и 90.0°С.
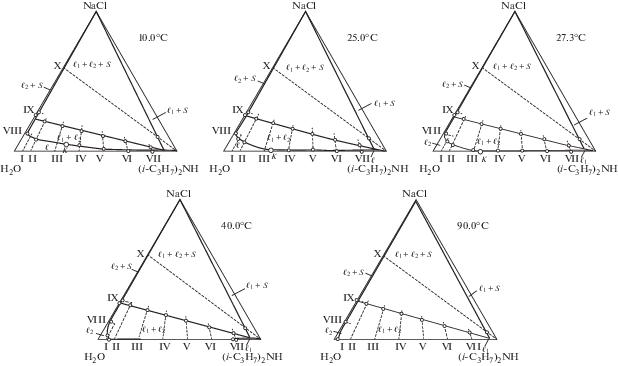
Таблица 1.
Растворимость компонентов тройной системы хлорид натрия–вода–диизопропиламин
| t, °C | Состав насыщенного раствора, мас. % | |||||
|---|---|---|---|---|---|---|
| NaCl | Н2О | (i-С3Н7)2NH | NaCl | Н2О | (i-С3Н7)2NH | |
| 10.0 | 26.3 | 73.7 | 0.0 | 5.4* | 68.5* | 29.1* |
| 12.8 | 86.0 | 1.2 | 4.2 | 57.5 | 38.3 | |
| 12.3 | 83.3 | 4.4 | 2.5 | 49.3 | 53.6 | |
| 9.2 | 81.7 | 9.1 | 1.1 | 29.7 | 69.2 | |
| 6.3 | 70.3 | 23.4 | 0.3 | 15.0 | 84.7 | |
| 25.0 | 26.4 | 73.6 | 0.0 | 1.1* | 71.2* | 27.7* |
| 12.9 | 86.4 | 0.7 | 0.5 | 60.3 | 39.2 | |
| 7.6 | 87.8 | 4.6 | 0.5 | 44.8 | 54.7 | |
| 6.4 | 84.2 | 9.4 | 0.2 | 29.9 | 69.9 | |
| 0.5 | 74.6 | 24.9 | 0.1 | 15.5 | 84.4 | |
| 27.3 | 26.4 | 73.6 | 0.0 | 0.1 | 74.9 | 25.0 |
| 12.9 | 86.5 | 0.6 | 0.0** | 72.0** | 28.0** | |
| 6.9 | 88.4 | 4.7 | 0.1 | 30.0 | 69.9 | |
| 5.6 | 85.0 | 9.4 | 0.1 | 15.0 | 84.9 | |
| 40.0 | 26.7 | 73.3 | 0.0 | 0.0 | 93.7 | 6.3 |
| 12.9 | 86.6 | 0.5 | 0.0 | 17.0 | 83.0 | |
| 2.0 | 93.1 | 4.9 | 0.1 | 15.0 | 84.9 | |
| 90.0 | 27.4 | 72.6 | 0.0 | 0.0 | 97.5 | 2.5 |
| 13.0 | 86.7 | 0.3 | 0.0 | 6.1 | 93.9 | |
Фазовая диаграмма системы в интервале температур 10.0–27.3°С отвечает высаливанию двойной гомогенной жидкостной системы: к монотектическому треугольнику ${{\ell }_{1}}$ + ${{\ell }_{2}}$ + S примыкают поля двух жидких фаз ${{\ell }_{1}}$ + ${{\ell }_{2}}$ и насыщенных растворов ${{\ell }_{1}}$ + S и ${{\ell }_{2}}$ + S. Повышение температуры приводит к приближению поля расслоения ${{\ell }_{1}}$ + ${{\ell }_{2}}$ к стороне H2O–(i-C3H7)2NH треугольника состава (рис. 3). При 27.3°С оно касается критической точкой указанной стороны в точке К, которая отвечает составу критического раствора двойной жидкостной системы. При более высоких температурах (40.0 и 90.0°С) фазовая диаграмма тройной системы характеризуется высаливанием гомогенных и гетерогенных смесей воды и амина (рис. 3). Качественных изменений на диаграмме не происходит; с повышением температуры уменьшается площадь монотектического треугольника, а площадь поля расслоения увеличивается.
Построенные при восьми температурах треугольники монотектического состояния позволили графически определить составы равновесных жидких фаз этого состояния (табл. 2). Количественная оценка эффекта высаливания диизопропиламина из водных растворов под действием введенного NaCl определяется значением коэффициента распределения Kр, который рассчитывали как отношение концентрации диизопропиламина в равновесных жидких фазах монотектики при данной температуре. Анализ полученных данных показывает, что во всем температурном интервале исследования органическая фаза содержит значительно больше амина по сравнению с водной фазой.
Таблица 2.
Составы жидких фаз монотектического состояния и коэффициенты распределения Kр диизопропиламина в тройной системе хлорид натрия–вода–диизопропиламин
| t, °C | Составы жидких фаз, находящихся в равновесии с твердым NaCl, мас. % | Kр | |||||
|---|---|---|---|---|---|---|---|
| водная фаза | органическая фаза | ||||||
| NaCl | Н2О | (i-С3Н7)2NH | NaCl | Н2О | (i-С3Н7)2NH | ||
| 10.0 | 23.3 | 75.9 | 0.8 | 1.5 | 7.9 | 90.6 | 113 |
| 15.0 | 24.2 | 75.1 | 0.7 | 1.5 | 7.5 | 91.0 | 130 |
| 20.0 | 24.5 | 74.9 | 0.6 | 1.4 | 7.2 | 91.4 | 152 |
| 25.0 | 25.0 | 74.5 | 0.5 | 1.3 | 7.1 | 91.6 | 182 |
| 27.3 | 25.0 | 74.5 | 0.5 | 1.2 | 7.1 | 91.7 | 184 |
| 30.0 | 25.7 | 73.9 | 0.4 | 1.0 | 6.6 | 92.6 | 231 |
| 40.0 | 26.5 | 73.2 | 0.3 | 0.8 | 6.0 | 93.2 | 310 |
| 90.0 | 28.5 | 71.3 | 0.2 | 0.2 | 3.8 | 96.0 | 480 |
Повышение температуры является причиной разрушения гидратов амина и небольшого повышения концентрации соли в водной фазе монотектики. Действие этих двух факторов приводит к возрастанию коэффициента распределения диизопропиламина с температурой (табл. 2). Ранее сделанный вывод об эффективности хлорида натрия как высаливателя амина из его водных растворов подтверждается высокими значения Kр во всем температурном интервале исследования.
Для оценки эффективности экстрактивной кристаллизации хлорида натрия под действием диизопропиламина в изучаемой тройной системе нами проведен расчет массы твердой фазы NaCl, находящейся в равновесии с двумя жидкими фазами монотектики, с использованием правила центра тяжести треугольника. Расчет проводили при помощи разработанного рабочего документа компьютерной программы “Mathcad” (версия 15.0) для ненасыщенных растворов с заранее заданной концентрацией хлорида натрия 25.00 и 26.00 мас. % (табл. 3). При концентрации хлорида натрия в водном растворе ниже 24.0 мас. % выпадение этой соли в осадок при добавлении амина вообще не происходит. Установлено, что при любой температуре увеличение концентрации диизопропиламина, вводимого в водно-солевые растворы, приводит к увеличению выхода кристаллов хлорида натрия.
Таблица 3.
Зависимость выхода кристаллов хлорида натрия от содержания диизопропиламина, введенного в водно-солевые растворы, при различных температурах
| t, °С | Выход кристаллов NaCl (%) в зависимости от концентрации диизопропиламина (мас. % ) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 10.0 | 20.0 | 30.0 | 40.0 | 50.0 | 60.0 | 70.0 | 80.0 | 90.0 | |
| 25 мас. %-ный водный раствор NaCl | |||||||||
| 10.0 | 8.3 | 8.9 | 9.6 | 10.6 | 12.0 | 14.0 | 17.4 | 24.2 | 44.7 |
| 15.0 | 3.8 | 4.3 | 5.0 | 6.0 | 7.3 | 9.4 | 12.7 | 19.4 | 39.6 |
| 20.0 | 2.3 | 2.9 | 3.6 | 4.6 | 6.0 | 8.1 | 11.6 | 18.6 | 39.5 |
| 25.0 | 0.2 | 0.5 | 1.4 | 2.6 | 4.2 | 6.7 | 10.8 | 18.9 | 43.5 |
| 27.3 | 0.1 | 0.6 | 1.5 | 2.7 | 4.5 | 7.0 | 11.4 | 19.9 | 43.6 |
| 30.0 | – | – | – | 0.1 | 1.5 | 3.8 | 7.8 | 15.7 | 39.4 |
| 40.0 | – | – | – | – | – | 0.1 | 5.0 | 14.8 | 44.4 |
| 26 мас. %-ный водный раствор NaCl | |||||||||
| 10.0 | 13.0 | 13.6 | 14.2 | 15.2 | 16.5 | 18.5 | 21.8 | 28.3 | 50.0 |
| 15.0 | 8.7 | 9.2 | 9.9 | 10.8 | 12.1 | 14.1 | 17.3 | 23.8 | 43.2 |
| 20.0 | 7.3 | 7.9 | 8.6 | 9.6 | 10.9 | 12.9 | 16.3 | 23.0 | 43.1 |
| 25.0 | 5.0 | 5.6 | 6.4 | 7.5 | 9.0 | 11.3 | 15.1 | 22.7 | 45.4 |
| 27.3 | 5.0 | 5.7 | 6.6 | 7.8 | 9.4 | 11.9 | 16.1 | 24.3 | 49.1 |
| 30.0 | 1.6 | 2.3 | 3.2 | 4.4 | 6.1 | 8.6 | 12.9 | 21.4 | 46.8 |
| 40.0 | – | – | – | 0.7 | 2.6 | 5.4 | 10.2 | 19.6 | 48.6 |
С помощью программы “Wolfram Mathematica” построены трехмерные поверхности, описывающие зависимость выхода соли от содержания введенного амина и температуры для указанных растворов. Внешний вид поверхностей для обоих растворов аналогичен, поэтому в качестве примера на рис. 4 она представлена для раствора с 26.0 мас. % соли. Отчетливо заметна складка на построенной поверхности при температурах, близких к 27.3°С (НКТР двойной системы вода–диизопропиламин).
Рис. 4.
Зависимость выхода кристаллов хлорида натрия для ненасыщенного водного раствора с концентрацией 26 мас. % соли от содержания введенного диизопропиламина и температуры.
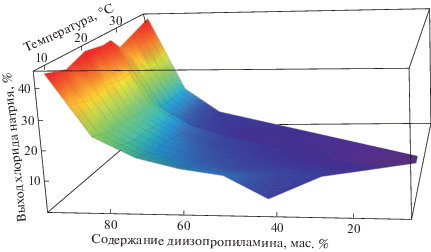
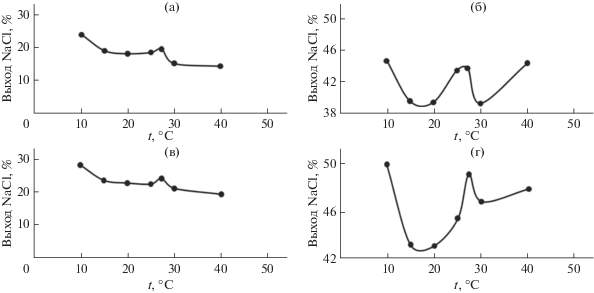
Для детального анализа поверхностей нами были построены зависимости выхода кристаллов соли от температуры при постоянном содержании введенного амина (80 и 90 мас. %, рис. 5). Были выбраны эти концентрации амина, поскольку они отвечали максимальному выходу соли (табл. 3) при любой температуре из указанного интервала. Полученные закономерности указывают на то, что лучший выход соли наблюдается при температурах 10.0 и 27.3°С. Однако температура 10.0°С не является, на наш взгляд, оптимальной для проведения процесса экстрактивной кристаллизации хлорида натрия по двум причинам. Во-первых, требуются энергетические затраты на охлаждение раствора до такой температуры. Во-вторых, коэффициент распределения Kр диизопропиламина при 10.0°С имеет минимальное значение для исследованного температурного интервала (табл. 2), что приводит к некоторому увеличению его потерь в водной фазе. Несмотря на незначительно меньший выход соли при 27.3°С по сравнению с 10.0°С (табл. 3), температура 27.3°С и близкие к ней значения (20–30°С) являются оптимальными для проведения процесса экстрактивной кристаллизации. Кроме того, Kр амина при этих температурах имеет приемлемые значения (табл. 2) для последующей регенерации амина из органической фазы монотектического состояния. Этот вывод согласуется с результатами, полученными ранее [29] для тройной системы с нитратом натрия. Можно предположить, что при температурах, близких к 27.3°С (НКТР двойной системы вода–диизопропиламин), происходит перестройка структуры раствора вследствие расслаивания смесей, что находит отражение в уменьшении растворимости хлорида натрия в водно-органических растворах.
ЗАКЛЮЧЕНИЕ
Сделанные выводы относительно оптимальных условий проведения экстрактивной кристаллизации хлорида натрия получены на основе построения и анализа фазовых диаграмм тройной системы соль–вода–амин при различных температурах без применения аналитических методов, а затем подтверждены экспериментально. Таким образом, из водно-солевого раствора, содержащего 26 мас. % соли, путем введения 90.0 мас. % диизопропиламина при 27.3°С получены кристаллы NaCl с выходом (49%), несколько меньшим, чем в работе [2] при 0.3°С. Однако несомненными преимуществами предлагаемых нами условий получения твердой соли являются отсутствие энергозатратного процесса охлаждения раствора и возможность одновременного или последовательного отделения органической фазы, обогащенной диизопропиламином. Показано, что с повышением температуры от 27.3°С содержание амина в водной и органической фазах изменяется незначительно. Поэтому отделение органической фазы с целью ее повторного использования в следующем цикле кристаллизации целесообразно проводить при температурах, близких к 27.3°С.
Список литературы
Weingaertner D.A., Lynn S., Hanson D.N. // Ind. Eng. Chem. Res. 1991. V. 30. № 3. P. 490. https://doi.org/10.1021/ie00051a009
Zijlema T.G., Geertman R.M., Witkamp G.-J. et al. // Ind. Eng. Chem. Res. 2000. V. 39. № 5. P. 1330. https://doi.org/10.1021/ie990221h
Hanson D.N., Lynn S. Method of Crystallizing Salts from Aqueours Solutions. U.S. Pat. 4.879.042-1989.
Carton A., Bolado S., Marcos M. // J. Chem. Eng. Data. 2000. V. 45. № 2. P. 260. https://doi.org/10.1021/je990235u
Brenner D.K., Anderson E.W., Lynn S. et al. // J. Chem. Eng. Data. 1992. V. 37. № 4. P. 419. https://doi.org/10.1021/je00008a011
Urréjola S., Sánchez A., Hervello M.F. // J. Chem. Eng. Data. 2011. V. 56. № 5. P. 2687. https://doi.org/10.1021/je100979d
Ting A.M., Lynn S., Prausnitz J.M. // J. Chem. Eng. Data. 1992. V. 37. № 2. P. 252. https://doi.org/10.1021/je00006a032
Mydlarz J., Jones A., Millan A. // J. Chem. Eng. Data. 1989. V. 34. P. 124. https://doi.org/10.1021/je00055a033
Hu M., Zhai Q., Jiang Y. et al. // J. Chem. Eng. Data. 2004. V. 49. P. 1070. https://doi.org/10.1021/je049914h
Zafarani-Moattar M.T., Alireza S. // J. Chem. Eng. Data. 1997. V. 42. P. 1241. https://doi.org/10.1021/je970060t
Thompson A.R., Molstad M.C. // Ind. Eng. Chem. 1945. V. 37. № 12. P. 1244. https://doi.org/10.1021/ie50432a031
Hu M., Jin L., Jiang Y. et al. // J. Chem. Eng. Data. 2005. V. 50. P. 1361. https://doi.org/10.1021/je050072b
Zijlema T.G., Witkamp G.J., Rosmalen G.M. // J. Chem. Eng. Data. 1999. V. 44. № 6. P. 1338. https://doi.org/10.1021/je9900880
Zijlema T.G., Oosterhof H., Witkamp G.J. et al. // Separation and Purification by Crystallization. ACS Symposium Series; American Chemical Society: Washington, DC, 1997. Ch. 19. P. 230. https://doi.org/10.1021/bk-1997-0667.ch019
Al-Sahhaf T.A., Kapetanovic E. // J. Chem. Eng. Data. 1997. V. 42. № 1. P. 74. https://doi.org/10.1021/je960234r
Межуева М.А., Данилина В.В., Курский В.Ф. и др. // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2020. Т. 20. Вып. 2. С. 146. https://doi.org/10.18500/1816-9775-2020-20-2-146-156
Позин М.Е. Технология минеральных солей (удобрений, пестицидов, промышленных солей, оксидов и кислот). Л.: Химия, 1974. Ч. 1. 792 с.
Фурман А.А., Бельды М.П., Соколов И.Д. Поваренная соль: Производство и применение в химической промышленности. М.: Химия, 1989. 271 с.
Химическая энциклопедия / Под ред. Кнунянц И.Л. М.: Сов. энциклопедия, 1988–1998. Т. 1–5.
Аносов В.Я., Озерова М.И., Фиалков Ю.Я. Основы физико-химического анализа. М.: Наука, 1976. 504 с.
Il'in K.K., Cherkasov D.G. // Chem. Eng. Commun. 2016. V. 203. № 5. P. 642. https://doi.org/10.1080/00986445.2015.1076802
Трейбал Р. Жидкостная экстракция / Пер. с англ. под ред. Кагана С.З. М.: Химия, 1966. 724 с.
Davison R.R., Smith W.H., Hood D.W. // J. Chem. Eng. Data. 1960. V. 5. № 4. P. 420. https://doi.org/10.1021/je60008a005
Davison R.R. // J. Chem. Eng. Data. 1968. V. 13. № 3. P. 348. https://doi.org/10.1021/je60038a013
Stephenson R.M. // J. Chem. Eng. Data. 1993. V. 38. № 4. P. 625. https://doi.org/10.1021/je00012a039
Мохонова И.Д., Черкасов Д.Г. // Современные проблемы теоретической и экспериментальной химии: межвуз. сб. научн. тр. IX Всерос. конф. молодых ученых с междунар. участием. Саратов: Изд-во “КУБиК”, 2013. С. 10.
Справочник по растворимости: Бинарные системы / Под ред. Кафарова В.В. М.–Л.: АН СССР, 1961, 1962. Т. 1. Кн. 1, 2. 1960 с.
Киргинцев А.Н., Трушникова Л.Н., Лаврентьева В.Г. Растворимость неорганических веществ в воде. Л.: Химия, 1972. 248 с.
Данилина В.В. // Физико-химия и технология неорганических материалов: сб. тр. ХIII Рос. ежегодной конф. молодых научн. сотрудников и аспирантов. М.: ИМЕТ РАН, 2017. С. 284.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии