Журнал неорганической химии, 2021, T. 66, № 6, стр. 836-842
ПОЛУЧЕНИЕ И ФОТОКАТАЛИТИЧЕСКИЕ СВОЙСТВА ГЕТЕРОСТРУКТУР β-Bi2O3/Bi2SiO5
О. Д. Арефьева a, b, *, М. С. Васильева a, b, И. В. Лукиянчук b, Е. С. Сединкина a, Л. А. Земнухова b, А. И. Писарцева a
a Дальневосточный федеральный университет
690090 Владивосток, ул. Суханова, 8, Россия
b Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: arefeva.od@dvfu.ru
Поступила в редакцию 14.12.2020
После доработки 30.12.2020
Принята к публикации 05.01.2021
Аннотация
Механическим перемешиванием смеси безводного нитрата висмута и биогенного кремнезема из рисовой шелухи (BiSi‑X, Х = 1–50% SiO2) с последующим прокаливанием при 600°С получены оксидные гетероструктурные фотокатализаторы Bi2O3/Bi2SiO5. Представлена характеристика материалов методами ИК- и электронной спектроскопии, рентгенофазового и рентгенофлюоресцентного анализов. Определено влияние содержания кремнезема на морфологию образцов. Точка нулевого заряда данных материалов находится в диапазоне от 7.20 (BiSi-1) до 8.64 (BiSi-50). Изучена фотокаталитическая активность образцов в реакции деградации метилового оранжевого в условиях ультрафиолетового и солнечного облучения. Показано, что степень разложения метилового оранжевого при солнечном облучении составляет 27% и не зависит от состава образцов. Установлен диапазон содержания SiO2 (23–39%) в образцах фотокатализаторов, при котором степень разложения метилового оранжевого в условиях УФ-облучения составляет 78–87%.
ВВЕДЕНИЕ
На сегодняшний день гетерогенный фотокатализ привлекает внимание исследователей в связи с возможностью его использования при разложении загрязняющих веществ в воде [1, 2]. В настоящее время активно исследуются различные полупроводниковые фотокатализаторы, в том числе на основе оксидов висмута(III) [1–8]. По фотокаталитической активности модификации Bi2O3 можно расположить в следующий ряд: β-Bi2O3 > α-Bi2O3 > δ-Bi2O3. Наиболее высокая фотокаталитическая активность β-Bi2O3 связана с его меньшей запрещенной зоной, однако β-Bi2O3 является метастабильным и неустойчивым при нормальной температуре [9]. Для улучшения стабильности и активности фотокатализаторов на основе оксида висмута интерес могут представлять смешанные оксиды, например, Bi2SiO5 [10–13] и гетероструктуры Bi2O3/Bi2SiO5 [14]. В настоящее время предложены различные методы получения данных соединений [15]: гидротермальный [12, 13, 16], сольвотермический [17, 18], золь–гель [19], темплатный [10, 11, 20]. Вышеперечисленные методы получения фотокатализаторов на основе оксида висмута(III) осуществляют в водных растворах или органических растворителях. Но более соответствуют принципам зеленой химии методы без использования растворителей, например, механохимический синтез [21] или механическое перемешивание [14].
Для получения фотокатализаторов на основе смешанных оксидов висмута и кремния в качестве источника кремнезема перспективно использовать отходы производства риса – рисовую шелуху и солому. Биогенный аморфный диоксид кремния, получаемый из рисовой шелухи, характеризуется высокой удельной поверхностью [22], химической стойкостью и отсутствием токсичности.
Цель настоящей работы состояла в получении экологически приемлемым методом механического перемешивания смеси безводного нитрата висмута и биогенного кремнезема из рисовой шелухи гетероструктурных фотокатализаторов Bi2O3/Bi2SiO5, исследовании их состава, строения и фотокаталитической активности в реакции деградации метилового оранжевого при возбуждении ультрафиолетовым и солнечным светом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Для приготовления фотокатализаторов на основе смешанных оксидов висмута и кремния использовали Bi(NO3)3 ⋅ 5H2O (ч. д. а.); для исследования фотокаталитической активности – раствор метилового оранжевого, приготовленный из реактива квалификации “ч. д. а.”.
Методика синтеза фотокатализаторов. В настоящей работе из смеси безводного нитрата висмута и биогенного кремнезема из рисовой шелухи было получено девять образцов фотокатализаторов с массовым содержанием SiO2 от 1 до 50% (BiSi-X, Х = 1–50% SiO2) и α-Bi2O3 по методике, предложенной в [14].
Образцы аморфного диоксида кремния получали из шелухи риса сорта “Долинный”, созданного в ФГБНУ “ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки” (Приморский край, п. Тимирязевский), гидролизом сырья 1 М раствором гидроксида натрия с последующим осаждением кремнезема концентрированным раствором соляной кислоты до рН 5–6 [23]. Далее аморфный диоксид кремния подвергали очистке согласно [24].
Реактив Bi(NO3)3 ⋅ 5H2O был высушен при температуре 60°С в течение 2 ч для получения порошка Bi(NO3)3 без кристаллизационной воды.
Очищенный кремнезем и Bi(NO3)3 помещали в агатовую ступку, перемешивали и измельчали в течение 15 мин. Полученную смесь нагревали в муфельной печи (WiseTherm, Южная Корея) до 600°С в течение 2.5 ч и выдерживали при данной температуре 4 ч [14].
Образцы обозначали в зависимости от массовой доли оксида кремния в смеси Bi(NO3)3 и SiO2, т.е. образцы, в которых массовая доля SiO2 составляла 1, 3, 5, 10, 15, 20, 25, 30 и 50%, были обозначены как BiSi-1, BiSi-3, BiSi-5, BiSi-10, BiSi-15, BiSi-20, BiSi-25, BiSi-30, BiSi-50 соответственно. Для сравнения при 600°С из Bi(NO3)3 был получен образец α-Bi2O3.
Методы исследования образцов. Элементный анализ образцов фотокатализаторов был выполнен с помощью метода энергодисперсионного рентгенофлюоресцентного анализа на спектрометре EDX 800 HS (Shimadzu, Япония).
Для определения функциональных групп в исследуемых образцах были записаны ИК-спектры поглощения в области 400–4000 см–1 в бромиде калия на Фурье-спектрометре Vertex 70 (Bruker, Германия).
Рентгенофазовый анализ (РФА) образцов проводили в СuKα-излучении на дифрактометре D8 Advance (Bruker, Германия).
Удельную поверхность образцов определяли по методу Брунауэра–Эммета–Теллера (БЭТ) с помощью анализатора удельной поверхности “Сорбтометр М” (ЗАО “Катакон”, Новосибирск) с использованием азота в качестве адсорбата. Предварительно для удаления адсорбированных молекул воды и кислорода проводили термотренировку образцов в потоке азота при температуре 150°С в течение 60 мин.
Морфологию и элементный состав поверхности катализаторов изучали с помощью сканирующего электронного микроскопа (СЭМ) высокого разрешения S5500 (Hitachi, Япония), оснащенного приставкой для энергодисперсионного рентгеноспектрального анализа (Thermo Scientific, США).
Точку нулевого заряда устанавливали по следующей методике. В потенциометрическую ячейку вносили 25 мл раствора дистиллированной воды и при непрерывном перемешивании магнитной мешалкой через определенные промежутки времени (5–10 мин) последовательно добавляли малыми порциями (по 0.05 г) исследуемый образец фотокатализатора BiSi‑X, где Х = 1–50% SiO2, до достижения неизменяемых значений потенциала стеклянного электрода. Для сравнения были изучены оксид висмута(III) и диоксид кремния.
Методика фотокаталитической деградации метилового оранжевого (МО). Фотокаталитические свойства полученных образцов оценивали на примере реакции деградации метилового оранжевого (рН 6.8) в УФ-области спектра и при облучении солнечным светом. Концентрация МО в обоих случаях составляла 10 мг/л. В качестве фотокатализаторов использовали образцы BiSi‑X, где Х = 1–50% SiO2. Контрольными образцами служили индивидуальные оксиды Bi2O3 и SiO2 (биогенный кремнезем). Загрузку катализатора определяли из расчета 1 г катализатора на 1 л раствора МО.
Фотокаталитическое разложение в УФ-области проводили в кварцевой ячейке объемом 100 мл, в которую помещали 50 мл раствора МО (10 мг/л) и 0.05 г катализатора. Источником облучения служила УФ-лампа 100P/F (максимум излучения при λ = 365 нм). Раствор облучали при постоянном перемешивании на магнитной мешалке (625 об/мин) в течение 3 ч.
При облучении солнечным светом раствор метилового оранжевого (35 мл) и 0.035 г порошкового катализатора помещали в чашку Петри. Процесс проводили при постоянном перемешивании на магнитной мешалке (625 об/мин) в течение 3 ч в одинаковых условиях: в солнечные дни между 9 и 13 ч в октябре–декабре. Температура окружающей среды составляла ~25°С.
В обоих случаях параллельно проводили контрольные эксперименты с раствором МО без катализатора.
Оптическую плотность раствора МО определяли фотоколориметрическим методом на спектрофотометре UNICO-1201 (United Products & Instruments Inc., США) при длине волны 460 нм. Степень разложения МО (χ, %) вычисляли по формуле:
где А0 и А – оптическая плотность раствора MO до и после фоторазложения.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика образцов. В табл. 1 представлены результаты рентгенофлуоресцентного анализа различных образцов, пересчитанные на оксиды висмута и кремния. Из-за разложения Bi(NO3)3 состав образцов после прокаливания отличается от исходного.
Таблица 1.
Химический состав исследуемых фотокатализаторов, мас. %
| Образец | SiO2 | Bi2O3 | Na2O |
|---|---|---|---|
| SiO2 | 98.3 | – | 1.7 |
| Bi2O3 | – | 100.0 | – |
| BiSi-1 | 2.1 | 97.9 | – |
| BiSi-3 | 5.4 | 94.6 | – |
| BiSi-5 | 19.5 | 90.5 | – |
| BiSi-10 | 18.4 | 81.6 | – |
| BiSi-15 | 22.5 | 77.5 | – |
| BiSi-20 | 30.7 | 69.3 | – |
| BiSi-25 | 39.1 | 60.9 | – |
| BiSi-30 | 42.5 | 57.5 | – |
| BiSi-50 | 61.8 | 38.2 | – |
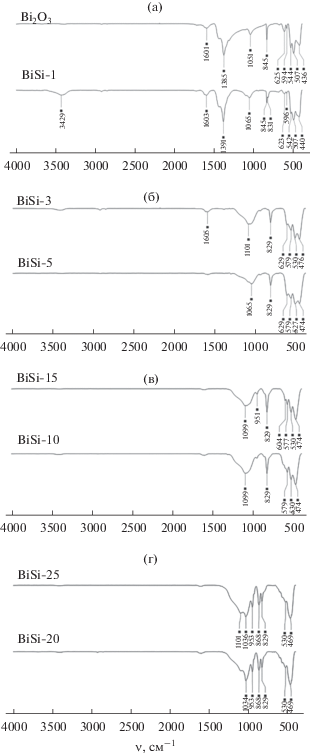
На рис. 1 показаны ИК-спектры Bi2O3 и смешанных оксидных систем Bi2O3–SiO2. ИК-спектры оксида висмута(III) и BiSi-1 практически идентичны между собой (рис. 1а). В ИК-спектрах образцов с более высоким содержанием оксида кремния появляются сначала перегибы и полосы слабой интенсивности (BiSi-3, BiSi-5, BiSi-10, BiSi‑15, рис. 1б, 1в), а затем более отчетливые полосы (BiSi-20, BiSi-25, рис. 1г) при 1036, 951 и 868 см–1, указывающие на наличие силиката висмута. В спектрах данных образцов, в отличие от Bi2O3 и BiSi-1 (рис. 1а), присутствует полоса поглощения при 1036 см–1, характерная для связи Si–O в силикатной структуре, и полоса при 951 см–1, отвечающая валентным колебаниям ${\text{SiO}}_{5}^{{2 - }}$-группы, образующей искаженный тетраэдр. В ИК-спектрах также наблюдается полоса поглощения около 868 см–1, свидетельствующая об образовании связи Bi–O–Si. Этот результат подтверждает образование связей Bi–O–Si и Si–O с увеличением количества SiO2.
Согласно данным РФА (табл. 2), образцы Bi2O3 и BiSi-1 содержат моноклинную модификацию α-Bi2O3, в то время как остальные образцы состоят из тетрагонального β-Bi2O3 и орторомбического Bi2SiO5. Кроме того, в образцах BiSi-1, BiSi-3, BiSi-5, BiSi-10, BiSi-15 дополнительно обнаружен SiO2 в модификации кварц.
Таблица 2.
Данные по фазовому составу гетероструктурных фотокатализаторов Bi2O3/Bi2SiO5, %
| Образец | Данные РФА |
|---|---|
| Bi2O3 | α-Bi2O3 |
| BiSi-1 | α-Bi2O3, SiO2 (кварц) |
| BiSi-3 | β-Bi2O3, Bi2SiO5, SiO2 (кварц) |
| BiSi-5 | β-Bi2O3, Bi2SiO5, SiO2 (кварц) |
| BiSi-10 | β-Bi2O3, Bi2SiO5, SiO2 (кварц) |
| BiSi-15 | β-Bi2O3, Bi2SiO5, SiO2 (кварц) |
| BiSi-20 | β-Bi2O3, Bi2SiO5 |
| BiSi-25 | β-Bi2O3, Bi2SiO5 |
| BiSi-30 | β-Bi2O3, Bi2SiO5 |
| BiSi-50 | β-Bi2O3, Bi2SiO5 |
В работе [25] было показано, что при нагревании аморфный диоксид кремния из рисовой шелухи и соломы переходит в кристаллическое состояние при 820°С. Учитывая, что образцы BiSi-X прокаливали при температуре 600°С, на понижение температуры фазового перехода, очевидно, влияют примеси в виде оксида висмута.
На рис. 2–4 представлены СЭМ-изображения фотокатализаторов. Частицы порошка Bi2O3 размерами 10 ± 20 мкм, образовавшиеся при термическом разложении нитрата висмута, имеют монолитную структуру, состоящую из более мелких оплавленных частиц (рис. 2). При небольшом содержании SiO2 в образцах (BiSi-1) эта структура становится менее оплавленной, а частицы, из которых она собрана, имеют более четкие границы раздела (рис. 3). При более высоком содержании SiO2 (BiSi-15) на снимках высокого разрешения наблюдается образование кристаллов с линейными размерами 200–500 нм (рис. 4). Образование таких кристаллов коррелирует с наличием силиката висмута согласно данным РФА (табл. 2).
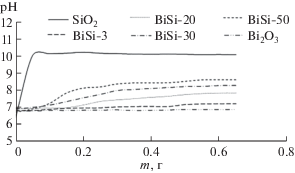
Важной характеристикой фотокатализаторов являются точка нулевого заряда (т.н.з.) и удельная поверхность. Значение т.н.з. для Bi2O3 находится в нейтральной области (рНтнз 6.9). С увеличением содержания SiO2 т. н. з. образцов фотокатализаторов смещается в щелочную сторону – от 7.20 для BiSi-1 до 8.64 для BiSi-50. Такое смещение обусловлено высоким значением рНтнз диоксида кремния, равным 10.09 (рис. 5).
По сравнению с Bi2O3 удельная поверхность образцов фотокатализаторов BiSi-X, установленная многоточечным БЭТ, значительно выше, однако определенной корреляции между удельной поверхностью и содержанием SiO2 не наблюдается (табл. 3). Можно сказать, что значения удельной поверхности для образцов BiSi-5, BiSi-10, BiSi-15 и BiSi-20 находятся в пределах ошибки измерения (~20%). Рост удельной поверхности этих образцов можно связать с морфологией их поверхности, в частности, с образованием мелких кристаллов Bi2SiO5 (рис. 4).
Таблица 3.
Удельная поверхность гетероструктурных фотокатализаторов Bi2O3/Bi2SiO5
| Образец | Bi2O3 | BiSi-5 | BiSi-10 | BiSi-15 | BiSi-20 | BiSi-25 | BiSi-30 | SiO2 |
|---|---|---|---|---|---|---|---|---|
| Sуд, м2/г | 0.2 | 9.1 | 21.9 | 16.9 | 12.2 | 35.5 | 35.5 | 160.6 |
Фотокаталитическая активность образцов. Фотокаталитическую активность образцов оценивали в реакции деградации органического загрязнителя – МО – в условиях облучения солнечным и УФ-светом. Параллельно проводили эксперименты без использования катализаторов, которые показали, что независимо от способа облучения разложения красителя не происходит.
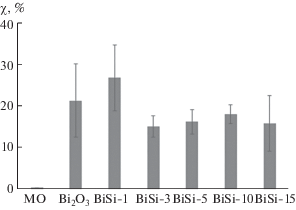
При облучении солнечным светом все исследуемые образцы в условиях эксперимента (масса катализатора, рН, продолжительность облучения) проявляют определенную фотокаталитическую активность в реакции деградации МО (рис. 6). Степень разложения красителя для всех образцов статистически не отличается друг от друга и не превышает 27%. Величины стандартных отклонений имеют высокие значения, что свидетельствует о нестабильности процесса деградации МО при воздействии солнечного света.
Рис. 6.
Степень разложения МО в присутствии гетероструктурных фотокатализаторов Bi2O3/Bi2SiO5 при возбуждении солнечным светом.
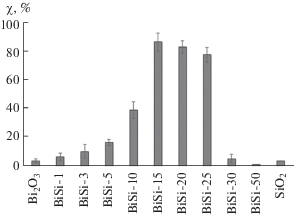
Результаты фотокаталитических испытаний при облучении образцов УФ-светом приведены на рис. 7, из которого видно, что Bi2O3 имеет низкую фотокаталитическую активность. Увеличение содержания кремнезема в образцах до 23% (образец BiSi-15 в табл. 1) приводит к возрастанию степени разложения МО до 87%. Значения χ для образцов BiSi-15, BiSi-20 и BiSi-25 (с содержанием кремнезема 23, 31, 39% соответственно) статистически не отличаются и находятся в пределах от 78 до 87%. Дальнейшее увеличение количества кремнезема до 43% (образец BiSi-30) приводит к снижению фотокаталитической активности образцов.
Рис. 7.
Степень разложения МО в присутствии гетероструктурных фотокатализаторов Bi2O3/Bi2SiO5 при возбуждении УФ-светом.
По-видимому, первоначальное увеличение фотокаталитической активности образцов происходит по ряду причин. Во-первых, поскольку pH раствора МО составляет 6.8, поверхность образца Bi2O3 практически не имеет заряда, в то время как поверхность остальных образцов заряжена положительно. Поэтому анионный краситель практически не реагирует с поверхностью Bi2O3 и взаимодействует с поверхностью остальных BiSi-X фотокатализаторов. Во-вторых, с возрастанием доли SiO2 удельная поверхность увеличивается, что также способствует лучшему контакту между фотокатализатором и красителем. В-третьих, добавление SiO2 приводит к образованию Bi2SiO5 и β-Bi2O3. Bi2SiO5 является типичным полупроводником n-типа, а β-Bi2O3 – полупроводником р-типа, что способствует образованию p–n-гетероперехода и, как следствие, эффективному разделению фотогенерируемых дырок и электронов [14].
Снижение фотокаталитической активности при дальнейшем увеличении доли кремнезема до 43%, возможно, связано с тем, что диоксид кремния как типичный диэлектрик блокирует генерацию электронно-дырочных пар.
ЗАКЛЮЧЕНИЕ
Фотокаталитически активные оксидные гетероструктуры Bi2O3/Bi2SiO5 были получены простым методом механического перемешивания без применения каких-либо растворителей, что соответствует принципам зеленой химии. В качестве источника оксида кремния впервые использовали биогенный кремнезем из рисовой шелухи. Показано влияние содержания оксида кремния в образцах на состав, структуру и их фотокаталитические свойства.
Методом РФА установлено, что образцы, включающие в состав фотоактивные фазы β-Bi2O3 и силикат висмута Bi2SiO5, формируются при содержании SiO2 ≥ 5.4%. Результаты РФА согласуются с данными ИК-спектроскопии, подтверждающими образование связей Bi–O–Si.
Показано, что сформированные гетероструктуры Bi2O3/Bi2SiO5 проявляют фотокаталитическую активность в реакции окисления метилового оранжевого как при облучении солнечным светом, так и при УФ-облучении. Степень деградации метилового оранжевого (рН 6.8) при УФ-облучении в присутствии образцов с содержанием SiO2 от 23 до 39% составляет 78–87%.
Полученные материалы могут быть использованы как недорогие и экологичные фотокатализаторы для очистки сточных вод от стойких органических загрязнителей.
Список литературы
Hoffmann M.R., Martin S.T., Choi W. et al. // Chem. Rev. 1995. V. 95. № 1. P. 69. https://doi.org/10.1021/cr00033a004
Kozlov D.A., Kozlova T.O., Shcherbakov A.B. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1088. [Козлов Д.А., Козлова Т.О., Щербаков А.Б. и др. // Журн. неорган. химии. 2020. Т. 65. № 7. С. 1003. https://doi.org/10.31857/S0044457X20070132]https://doi.org/10.1134/S003602362007013X
Han Q. // Chem. Eng. J. 2020. Art. 127877. https://doi.org/10.1016/j.cej.2020.127877
Chen L., He J., Liu Y. et al. // Chinese J. Catal. 2016. V. 37. № 6. P. 780. https://doi.org/10.1016/S1872-2067(15)61061-0
Dhatshanamurthi P., Subash B., Senthilraja A. et al. // J. Nanosci. Nanotechnol. 2014. V. 14. № 7. P. 4930. https://doi.org/10.1166/jnn.2014.8693
Blake D.M. Bibliography of work on the Heterogeneous Photocatalytic Removal of Hazardous Compounds from Water and Air: Technical Report. Colorado: National Renewable Energy Laboratory, 2001. 167 p.
Buslaeva E.Y., Groshkova Y.A., Gubin S.P. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 1. P. 5. https://doi.org/10.1134/S0036023620010040 [Буслаева Е.Ю., Краевский С.В., Грошкова Ю.А. и др. // Журн. неорган. химии. 2020. Т. 65. № 1. С. 8. https://doi.org/10.31857/S0044457X20010043]
Pronin I.A., Averin I.A., Donkova B.V. et al. // Semiconductors. 2014. V. 48. № 7. P. 842. [Пронин И.А., Донкова Б.В., Дмитров Д.Ц. и др. // Физика и техника полупроводников. 2014. Т. 48. № 7. С. 868.]https://doi.org/10.1134/S1063782614070173
Cheng H., Huang B., Lu J. et al. // Phys. Chem. Chem. Phys. 2010. V. 12. № 47. P. 15468. https://doi.org/10.1039/C0CP01189D
Liu D., Wang J., Zhang M. et al. // Nanoscale. 2014. V. 6. № 24. P. 15222. https://doi.org/10.1039/C4NR05058D
Zhang L., Wang W., Sun S. et al. // Appl. Catal. B. 2010. V. 100. № 1-2. P. 97. https://doi.org/10.1016/j.apcatb.2010.07.018
Chen R., Bi J., Wu L. et al. // Inorg. Chem. 2009. V. 48. № 19. P. 9072. https://doi.org/10.1021/ic901084s
Wei W., Xiea J., Meng S. et al. // J. Mater. Res. 2013. V. 28. № 13. P. 1658. https://doi.org/10.1557/jmr.2013.65
Lu H., Hao Q., Chen T. et al. // Appl. Catal. B. 2018. V. 237. P. 59. https://doi.org/0.1016/j.apcatb.2018.05.069
Reverberi A.P., Varbanov P.S., Vocciante M. et al. // Front. Chem. Sci. Eng. 2018. V. 12. № 4. P. 878. https://doi.org/10.1007/s11705-018-1744-5
Chen C.-C., Yang C.-T., Chung W.-H. et al. // J. Taiwan Inst. Chem. Eng. 2017. V. 78. P. 157. https://doi.org/10.1016/j.jtice.2017.05.021
Dou L., Jin X., Chen J. et al. // Appl. Surf. Sci. 2020. V. 527. Art. 146775. https://doi.org/10.1016/j.apsusc.2020.146775
Dou L., Zhong J., Li J. et al. // Mater. Res. Bull. 2019. V. 116. P. 50. https://doi.org/10.1016/j.materresbull.2019.03.031
Wu Y., Li M., Wang X. et al. // Mater. Manuf. Process. 2017. V. 32. № 5. P. 480. https://doi.org/10.1080/10426914.2016.1221081
Dou L., Xiang Y., Zhong J. et al. // Mater. Lett. 2020. V. 261. Art. 127117. https://doi.org/10.1016/j.matlet.2019.127117
Belik Yu., Kharlamova T., Vodyankin A. et al. // Ceram. Int. 2020. V. 46. P. 10797. https://doi.org/10.1016/j.ceramint.2020.01.090
Zemnukhova L.A., Panasenko A.E., Fedorishcheva G.A. et al. // Inorg. Mater. 2014. V. 50. № 1. P. 75. [Земнухова Л.А., Панасенко А.Е., Цой Е.А. и др. // Неорган. материалы. 2014. Т. 50. № 1. С. 82. https://doi.org/10.7868/S0002337X14010205]https://doi.org/10.1134/S0020168514010208
Zemnukhova L.A., Egorov A.G., Fedorishcheva G.A. et al. // Inorg. Mater. 2006. V. 42. № 1. P. 24. [Земнухова Л.А., Егоров А.Г., Федорищева Г.А. и др. // Неорган. материалы. 2006. Т. 42. № 1. С. 27.]https://doi.org/10.1134/S0020168506010067
Пат. 2394764 Российская Федерация, МПК7 С 01В 33/12. Способ получения диоксида кремния.
Сергиенко В.И., Земнухова Л.А., Егоров А.Г. и др. // Рос. хим. журн. 2004. Т. 48. № 3. С. 116.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии