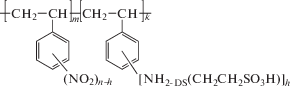Журнал неорганической химии, 2021, T. 66, № 6, стр. 814-821
ОСОБЕННОСТИ СОРБЦИОННОГО КОНЦЕНТРИРОВАНИЯ ИОНОВ БЛАГОРОДНЫХ МЕТАЛЛОВ СУЛЬФОЭТИЛИРОВАННЫМИ АМИНОПОЛИМЕРАМИ
Л. М. к. Алифханова a, *, К. Я. Лопунова a, А. А. Марчук a, Ю. С. Петрова a, А. В. Пестов a, b, Л. К. Неудачина a
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
b Институт органического синтеза им. И.Я. Постовского УрО РАН
620108 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: alifkhanova@rambler.ru
Поступила в редакцию 14.12.2020
После доработки 20.01.2021
Принята к публикации 20.01.2021
Аннотация
Получены зависимости сорбции хлоридных комплексов палладия(II), золота(III) и платины(IV) из индивидуальных и бинарных растворов сорбентами на основе сульфоэтилированного полиаллиламина и полиаминостирола. Установлено, что преобладающим механизмом сорбции золота(III) и палладия(II) является комплексообразование с функциональными группами сорбентов, платины(IV) – ионный обмен. Показано, что возрастание степени сульфоэтилирования аминополимерной матрицы приводит к уменьшению сорбции платины(IV) и, как следствие, к увеличению селективности сорбции палладия(II) относительно данного иона. Наиболее значительным этот эффект является для сорбентов на основе полиаллиламина. Определены условия количественной десорбции исследуемых металлов с поверхности сорбентов. Показано, что сорбция золота(III) сорбентом на основе полиаллиламина осложняется его восстановлением в фазе сорбента.
ВВЕДЕНИЕ
Разработка методик сорбционного разделения и концентрирования благородных металлов в настоящее время имеет важное практическое значение как с точки зрения извлечения ценных компонентов из вторичного сырья и других объектов, так и улучшения метрологических характеристик существующих способов их аналитического определения. Особое значение при этом приобретают селективные свойства используемых сорбентов. Применение сорбционных материалов для селективного разделения и концентрирования близких по свойствам ионов платиновых металлов позволяет использовать для их конечного определения недорогие и доступные методы анализа, например спектрофотометрические, а также избежать возможных наложений спектральных линий при их атомно-спектроскопическом определении [1].
Во многих случаях [2, 3] промышленные растворы благородных металлов являются солянокислыми, в них ионы металлов присутствуют в виде анионных хлоридных комплексов. При этом концентрирование может протекать за счет электростатического взаимодействия с протонированными аминогруппами сорбента и/или за счет комплексообразования с функциональными группами сорбента. Последний механизм является преобладающим при сорбции ионов благородных металлов серо- или серо- и азотсодержащими материалами – полимерами или неорганическими оксидами, модифицированными тиольными [4], тиомочевинными [5, 6], дитиокарбаматными [7], дитиооксамидными [8], дипропилдисульфидными [9] и другими группами. Такие сорбенты в большинстве случаев образуют устойчивые комплексы со многими ионами благородных металлов и позволяют осуществлять их групповое отделение от избыточного количества сопутствующих цветных металлов [9, 10]. В случае азотсодержащих сорбентов могут реализовываться оба механизма [3, 11, 12]. При преобладании электростатического взаимодействия функциональных групп сорбента с хлоридными комплексами ионов благородных металлов процесс сорбции является неселективным и для разделения целевых компонентов необходимо подбирать условия их избирательного элюирования [3].
Наименее распространенным классом сорбционных материалов, применяемых для разделения и концентрирования благородных металлов, являются сорбенты, функциональные группы которых содержат донорный атом кислорода [13]. Тем не менее применение таких сорбентов позволяет в ряде случаев достичь более высокой селективности сорбции [14, 15]. Так, на примере хитозана нами показано [16], что селективность концентрирования отдельных ионов благородных металлов может быть значительно повышена путем введения в состав аминополимера сульфоэтильных групп. Это приводит, во-первых, к уменьшению основности атома азота в составе аминогрупп сорбента (уменьшению степени протонирования аминогрупп, устойчивости образуемых ими комплексов) и, во-вторых, к возникновению электростатического отталкивания между сульфогруппами и отрицательно заряженными хлоридными комплексами ионов благородных металлов. Как следствие, значительно возрастает селективность сорбционного концентрирования палладия(II) в присутствии платины(IV).
Настоящая работа продолжает исследование свойств сульфоэтилированных аминополимеров по отношению к ионам благородных металлов и посвящена исследованию сорбции золота(III), платины(IV) и палладия(II) материалами на основе полиаллиламина и полиаминостирола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
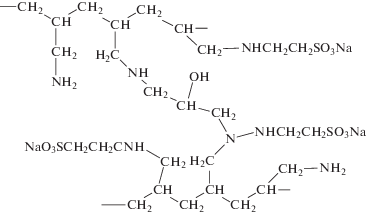
Объекты исследования представляют собой сорбенты на основе сульфоэтилированного полиаминостирола со степенями модифицирования 0.5, 0.7 и 1.0 (СЭПАС 0.5, СЭПАС 0.7 и СЭПАС 1.0 соответственно) и сорбенты на основе сульфоэтилированного полиаллиламина, сшитого эпихлоргидрином, со степенями модифицирования 0.5 и 1.0 (СЭПАА 0.5 и СЭПАА 1.0 соответственно). Синтез и идентификация сорбентов описаны в работах [17, 18]. На рис. 1 и 2 представлены структурные формулы сорбентов.
Значения статической обменной емкости СЭПАС со степенями замещения 0.5, 0.7 и 1.0 составили 2.31, 2.59 и 2.79 ммоль/г [17] соответственно для СЭПАА со степенью замещения 0.5–2.00 ммоль/г [18]. В настоящей работе методом обратного кислотно-основного титрования определена статическая обменная емкость по гидроксид-ионам СЭПАА 1.0, значение которой составило 1.37 ммоль/г.
Сорбцию палладия(II), платины(IV) и золота(III) СЭПАС и СЭПАА исследовали в статических условиях методом ограниченного объема. Изучена сорбция исследуемых ионов металлов из индивидуальных растворов объемом 50.0 мл при их исходной концентрации (0.6–1.5) × 10–4 моль/л в интервале рН 0.5–5.0 и в интервале концентраций раствора HCl 0.5–2 моль/л. Необходимое значение кислотности создавали с помощью растворов HCl и NaOH, значение рН контролировали на иономере И-160МИ, растворы оставляли на 5 сут при периодическом перемешивании. После проведения сорбции проводили разделение фаз фильтрованием и определяли концентрацию ионов металлов в растворах методом атомно-эмиссионной спектроскопии с индуктивно связанной плазмой на спектрометре Thermo Scientific iCAP 6500. Аналогично исследовали сорбцию ионов металлов СЭПАС и СЭПАА из бинарных растворов, содержащих золото(III) и палладий(II), палладий (II) и платину(IV).
Значение сорбции (а, ммоль/г) иона металла рассчитывали в соответствии со следующим выражением:
где С0, С – концентрация исследуемого металла в растворе до и после сорбции, моль/л; V – объем раствора; M – молярная масса металла, г/моль; g – масса навески сорбента.Коэффициенты селективности сорбции палладия по отношению к платине (KPd/Pt) рассчитывали как отношение коэффициентов распределения ионов металлов между раствором и сорбентом [19].
После сорбции ионов металлов проводили их десорбцию с использованием 30.0 мл раствора регенеранта (3.5 моль/л HCl) в течение суток. Концентрацию ионов металлов в растворе после десорбции определяли методом атомно-эмиссионной спектроскопии. По полученным данным рассчитывали степень десорбции как отношение количества десорбированного иона металла к количеству сорбированного иона металла, умноженному на 100%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние степени сульфоэтилирования сорбентов на извлечение ионов благородных металлов из индивидуальных растворов
На рис. 3, 4 и 5 приведены зависимости, характеризующие влияние кислотности раствора и степени сульфоэтилирования сорбентов на основе полиаминостирола и полиаллиламина на сорбцию золота(III), палладия(II) и платины(IV) соответственно. Установлено, что в случае СЭПАС в интервале рН 2–5 степень модифицирования (СМ) полимера и кислотность раствора практически не влияют на сорбцию золота(III). В интервале концентраций соляной кислоты 0.5–2 моль/л наблюдается уменьшение сорбции золота(III) с ростом степени модифицирования сорбента. В случае СЭПАА влияние степени сульфоэтилирования сорбента на сорбцию золота(III) из солянокислых растворов более значительное: при увеличении СМ сорбента от 0.5 до 1.0 степень извлечения рассматриваемых ионов при рН 1 уменьшается от 98 до 7%. Возрастание сорбции золота(III), которое в растворе находится преимущественно в виде анионных хлоридных комплексов, с ростом рН, а значит с уменьшением доли протонированных аминогрупп, указывает на преобладание в механизме сорбции процесса комплексообразования.
Рис. 3.
Влияние кислотности среды на сорбцию хлоридных комплексов золота(III) СЭПАС и СЭПАА с различными степенями модифицирования. Исходная концентрация золота(III) 1 × 10–4 моль/л, g(сорбента) = 0.0200 г. 1 – СЭПАС 0.5, 2 – СЭПАС 0.7, 3 – СЭПАС 1.0 (а); 1 – СЭПАА 0.5, 2 – СЭПАА 1.0 (б).
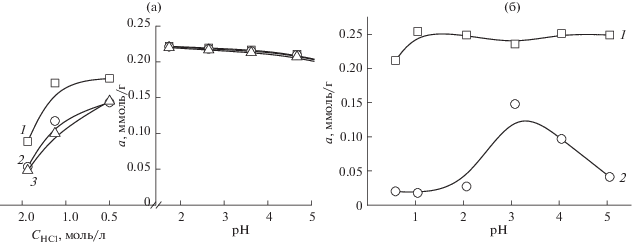
Рис. 4.
Влияние кислотности среды на сорбцию хлоридных комплексов палладия(II) СЭПАС и СЭПАА с различными степенями модифицирования. Исходная концентрация палладия(II) СЭПАС 0.8 × 10–4 моль/л, СЭПАА 1.0 × 10–4 моль/л, g(сорбента) = 0.0200 г. 1 – СЭПАС 0.5, 2 – СЭПАС 0.7, 3 – СЭПАС 1.0 (а); 1 – СЭПАА 0.5, 2 – СЭПАА 1.0 (б).
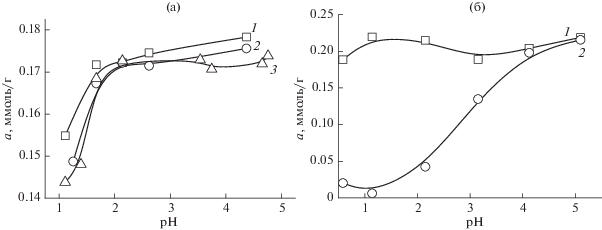
Рис. 5.
Влияние кислотности среды на сорбцию хлоридных комплексов платины(IV) СЭПАС и СЭПАА с различными степенями модифицирования. Исходная концентрация платины(IV) СЭПАС 1 × 10–4 моль/л, СЭПАА 0.6 × 10–4 моль/л, g(сорбента) = 0.0200 г. 1 – СЭПАС 0.5, 2 – СЭПАС 0.7, 3 – СЭПАС 1.0 (а); 1 – СЭПАА 0.5, 2 – СЭПАА 1.0 (б).
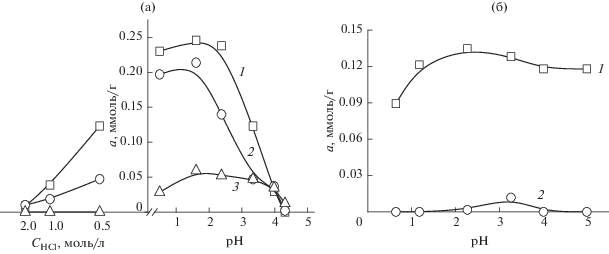
Аналогичными закономерностями характеризуется сорбция хлоридных комплексов палладия(II) исследуемыми сорбентами (рис. 4). Во-первых, в случае СЭПАС влияние степени сульфоэтилирования СЭПАА на сорбцию палладия(II) менее значительное, чем в случае СЭПАА. Во-вторых, извлечение палладия(II) СЭПАА 1.0 значительно возрастает с увеличением рН, достигая максимального значения при рН 4–5.
В наибольшей степени степень сульфоэтилирования полиаминостирола и полиаллиламина влияет на сорбцию хлоридных комплексов платины(IV) (рис. 5): при ее возрастании от 0.5 до 1.0 степень извлечения платины(IV) падает от 100 до 24% (рН 1.6) в случае СЭПАС и от 87 до 7% в случае СЭПАА (рН 1.1). Обращает на себя внимание тот факт, что сорбция платины(IV) СЭПАС является максимальной при рН 1.6. В данных условиях функциональные аминогруппы сорбента в значительной степени протонированы, это позволяет предположить, что преобладающим механизмом сорбции платины(IV) является электростатическое взаимодействие отрицательно заряженных хлоридных комплексов платины(IV) и положительно заряженных аминогрупп сорбента. При рН < 1.6 сорбция платины(IV) уменьшается вследствие значительного увеличения концентрации хлорид-ионов в растворе и, как следствие, конкуренции с их стороны за сорбционные центры. При рН > 1.6 извлечение хлоридных комплексов платины(IV) падает по причине уменьшения степени протонирования аминогрупп СЭПАС.
Для исследуемых сорбентов наблюдается общая закономерность уменьшения степени извлечения исследуемых ионов металлов из солянокислых растворов с ростом степени их сульфоэтилирования. Она объясняется, во-первых, понижением основности атома азота в составе аминогрупп полимера вследствие отрицательного индуктивного эффекта со стороны сульфогруппы и, как следствие, понижением устойчивости комплексов, образующихся в фазе сорбента. Во-вторых, с ростом количества сульфогрупп в составе матрицы возрастает электростатическое отталкивание между ними и отрицательно заряженными хлоридными комплексами ионов благородных металлов. Возрастание степени сульфоэтилирования аминополимера наибольшее влияние оказывает на сорбцию платины(IV): степень ее извлечения СЭПАС и СЭПАА с максимальными степенями сульфоэтилирования не превышает 24 и 7% соответственно. Аналогичными закономерностями характеризуется сорбция палладия(II) и платины(IV) из солянокислых растворов сорбентами на основе сульфоэтилированного хитозана [16].
Влияние степени сульфоэтилирования сорбентов на извлечение ионов благородных металлов из бинарных растворов
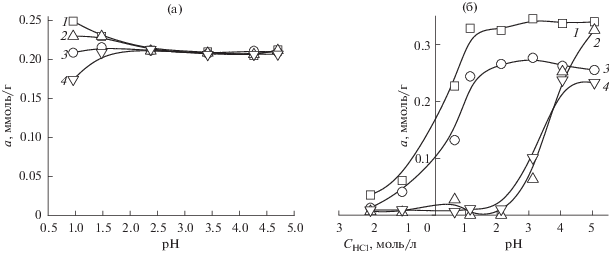
На рис. 6 приведены зависимости сорбции палладия(II) и золота(III) СЭПАС и СЭПАА с различными степенями сульфоэтилирования от кислотности раствора. В случае сорбента на основе полиаминостирола СМ сорбента не влияет на селективность сорбции ионов металлов и степень их извлечения: для всех исследуемых материалов она является количественной. Увеличение степени сульфоэтилирования полиаллиламина приводит в равной степени к уменьшению сорбции как палладия(II), так и золота(III). Зависимости сорбции рассматриваемых ионов СЭПАА от рН имеют схожий вид. Очевидно, что комплексные соединения, образуемые золотом(III) и палладием(II) с функциональными группами СЭПАА и СЭПАС с различными степенями модифицирования, характеризуются близкими значениями констант устойчивости. Это обстоятельство позволяет использовать рассматриваемые материалы для совместного извлечения указанных ионов металлов.
Рис. 6.
Влияние степени модифицирования СЭПАС и СЭПАА на селективность сорбции хлоридных комплексов палладия(II) и золота(III) при их совместном присутствии в растворе. Исходная концентрация ионов палладия(II) и золота(III) СЭПАС 1 × 10–4 моль/л, ионов палладия(II) СЭПАА 1.5 × 10–4 моль/л, ионов золота(III) СЭПАА 1.0 × 10–4 моль/л, g(сорбента) = 0.0200 г. 1 – Au(III) СЭПАС 0.5, 2 – Au(III) СЭПАС 1.0, 3 – Pd(II) СЭПАС 0.5, 4 – Pd(II) СЭПАС 1.0 (а); 1 – Pd(II) СЭПАА 0.5, 2 – Pd(II) СЭПАА 1.0, 3 – Au(III) СЭПАА 0.5, 4 – Au(III) СЭПАА 1.0 (б).
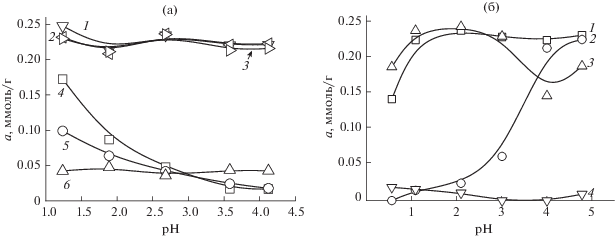
Сорбция палладия(II) и платины(IV) СЭПАА и СЭПАС при их совместном присутствии в растворе характеризуется несколько другими закономерностями влияния кислотности раствора и степени сульфоэтилирования полимера на селективность извлечения. Во-первых, зависимости сорбции палладия(II) и платины(IV) СЭПАС из бинарных растворов отличаются от аналогичных зависимостей, полученных для индивидуальных растворов. Так, в присутствии палладия(II) сорбция платины(IV) СЭПАС с различными СМ в значительной степени подавляется. Это обстоятельство дополнительно подтверждает преобладание в механизме сорбции процесса комплексообразования иона металла с функциональными аминогруппами сорбента. Во-вторых, рост степени модифицирования сорбентов приводит к возрастанию селективности сорбции палладия(II) в присутствии платины(IV).
Значения коэффициентов селективности сорбции палладия(II) по отношению к платине(IV) СЭПАА и СЭПАС в зависимости от степени их модифицирования приведены в табл. 1 и 2 соответственно.
Таблица 1.
Влияние рН раствора на коэффициенты селективности сорбции палладия(II) по отношению к платине(IV) СЭПАА с различными степенями модифицирования
| Степень модифици-рования | KPd(II)/Pt(IV) | |||||
|---|---|---|---|---|---|---|
| pH 0.6 | pH 1.1 | pH 2.1 | pH 3.0 | pH 4.0 | pH 4.8 | |
| 0.5 | 0.73 | 0.84 | 2.20 | 12.6 | 63.6 | 37.2 |
| 1.0 | – | 0.93 | 2.50 | $ \gg $103 | $ \gg $103 | 748 |
Таблица 2.
Влияние рН раствора на коэффициенты селективности сорбции палладия(II) по отношению к платине(IV) СЭПАС с различными степенями модифицирования
| Степень модифици-рования | KPd(II)/Pt(IV) | ||||
|---|---|---|---|---|---|
| pH 1.2 | pH 1.9 | pH 2.7 | pH 3.6 | pH 4.1 | |
| 0.5 | 3.6 | 11 | 26 | 190 | 163 |
| 0.7 | 15 | 19 | 33 | 107 | 83 |
| 1.0 | 27 | 26 | 39 | 38 | 38 |
Из значений коэффициентов селективности видно, что как сорбенты на основе полиаллиламина, так и сорбенты на основе полиаминостирола характеризуются закономерностью возрастания селективности извлечения палладия(II) по сравнению с платиной(IV). В случае СЭПАС данная закономерность соблюдается в интервале рН 1.2–2.7. При сорбции ионов металлов СЭПАА наблюдается наиболее значительное возрастание коэффициентов селективности с ростом СМ сорбента, при этом значения являются максимальными при рН 3.0–5.0.
Подводя итог исследованию влияния природы аминополимерной матрицы на сорбцию ионов благородных металлов, можно заключить, что взаимодействие СЭПАС с ионами металлов сопровождается образованием более устойчивых комплексных соединений по сравнению с СЭПАА. Этот вывод сделан на основании того, что, во-первых, рост степени модифицирования СЭПАА в гораздо большей степени влияет на сорбцию ионов благородных металлов, уменьшая ее; во-вторых, рассматриваемые ионы извлекаются СЭПАА в гораздо более узком интервале кислотности по сравнению с СЭПАС. В-третьих, на основании сравнения зависимостей сорбции платины(IV) и палладия(II) сульфоэтилированными аминополимерами при индивидуальном (рис. 4, 5) и совместном присутствии в растворе (рис. 7) можно заключить, что повышение селективности сорбции палладия(II) с ростом СМ полиаминостирола связано с подавлением сорбции платины(IV) в присутствии палладия(II), в случае же СЭПАА степень извлечения платины(IV) в равной степени падает с ростом СМ полиаллиламина при сорбции как из бинарных, так и из индивидуальных растворов. В целом меньшая устойчивость комплексов, образуемых функциональными группами СЭПАА с ионами металлов, приводит к большей селективности сорбции палладия(II) данным сорбентом по сравнению с СЭПАС, что полностью согласуется с известным принципом достижения высокой селективности [20].
Рис. 7.
Влияние степени модифицирования СЭПАС и СЭПАА на селективность сорбции хлоридных комплексов платины(IV) и палладия(II) при их совместном присутствии в растворе. Исходная концентрация ионов металлов 1 × 10–4 моль/л, g(СЭПАС) = 0.0200 г. 1 – Pd(II) СЭПАС 0.5, 2 – Pd(II) СЭПАС 0.7, 3 – Pd(II) СЭПАС 1.0, 4 – Pt(IV) СЭПАС 0.5, 5 – Pt(IV) СЭПАС 0.7, 6 – Pt(IV) СЭПАС 1.0 (а); 1 – Pd(II) СЭПАА 0.5, 2 – Pd(II) СЭПАА 1.0, 3 – Pt(IV) СЭПАА 0.5, 4 – Pt(III) СЭПАА 1.0 (б).
Несмотря на то, что аминогруппы в составе полиаминостирола связаны непосредственно с бензольным кольцом, согласно литературным данным [21], они характеризуются большей основностью по сравнению с полиаллиламином [22]. Этим обстоятельством объясняется более низкая устойчивость комплексов СЭПАА с ионами благородных металлов по сравнению с СЭПАС. Определенный вклад в высокую устойчивость комплексов СЭПАС с ионами металлов также вносит благоприятное расположение аминогрупп в его составе: они в большей степени удалены друг от друга по сравнению с СЭПАА, что приводит к уменьшению электростатического отталкивания между сорбированными ионами металлов.
Регенерационные свойства сорбентов на основе сульфоэтилированных аминополимеров
Десорбция благородных металлов с поверхности сорбентов во многих случаях осложняется образованием чрезвычайно устойчивых комплексных соединений или протеканием окислительно-восстановительных процессов в фазе сорбента [8, 23]. Регенерационные свойства СЭПАА исследовали при использовании в качестве десорбентов 3.5 моль/л HCl и 1%-ного раствора тиомочевины в 2 моль/л HCl. Показано, что палладий количественно десорбируется с поверхности СЭПАА 30.0 мл 3.5 моль/л соляной кислоты, платина – 30.0 мл 1%-ного раствора тиомочевины в 2 моль/л HCl.
Результаты исследования возможности регенерации поверхности СЭПАА после сорбции золота(III) приведены в табл. 3. Установлено, что десорбция золота с поверхности СЭПАА в обоих случаях не является количественной, что связано с частичным восстановлением золота в фазе сорбента. На это также указывает значительное потемнение сорбента после сорбции золота(III) в интервале рН 3.0–4.5. Показано, что степень десорбции золота с поверхности СЭПАА существенно больше при использовании в качестве регенеранта раствора тиомочевины (табл. 3). При этом после обработки сорбента раствором данного регенеранта он приобретает свой исходный цвет.
Таблица 3.
Степени десорбции золота с поверхности СЭПАА с различными СМ
| рН исходного раствора | 3.5 моль/л HCl | 1%-ный раствор тиомочевины в 2 моль/л HCl |
||
|---|---|---|---|---|
| СЭПАА 0.5 | СЭПАА 1.0 | СЭПАА 0.5 | СЭПАА 1.0 | |
| 0.6 | 3.1 | – | 53.6 | – |
| 1.0 | 2.5 | – | 55.7 | – |
| 2.1 | 2.6 | – | 63.3 | – |
| 3.1 | 2.6 | 5.6 | 64.0 | 47.2 |
| 4.0 | 2.4 | 7.0 | 70.3 | 40.6 |
| 5.0 | 2.7 | 16.7 | 67.9 | 41.7 |
В отличие от сорбентов на основе полиаллиламина, в случае СЭПАС количественная десорбция всех исследуемых металлов (золота, палладия, платины) достигается с применением 30.0 мл 1%-ного раствора тиомочевины в 2 моль/л HCl. Сорбция ионов металлов при этом не сопровождается изменением окраски сорбента, что в совокупности с данными исследования десорбции свидетельствует об отсутствии протекания в фазе СЭПАС окислительно-восстановительных процессов.
ЗАКЛЮЧЕНИЕ
Выявлены закономерности сорбционного концентрирования ионов благородных металлов в виде их хлоридных комплексов сорбентами на основе сульфоэтилированных полиаллиламина и полиаминостирола. Показано, что преобладающим механизмом сорбции золота и палладия является комплексообразование с функциональными группами сорбентов, платины – электростатическое взаимодействие с протонированными аминогруппами исследуемых модифицированных аминополимеров. Установлена перспективность использования СЭПАС для совместного извлечения золота(III) и палладия(II) с последующей десорбцией 1%-ным раствором тиомочевины в 3.5 моль/л HCl из бинарных растворов. Использование СЭПАА для концентрирования золота(III) осложняется восстановлением данного иона в процессе сорбции. Однако сорбент с максимальной степенью модифицирования может быть рекомендован для селективного концентрирования палладия(II) в присутствии платины(IV).
Список литературы
Карпов Ю.А., Барановская В.Б., Житенко Л.П. Аналитический контроль благородных металлов. М.: Техносфера, 2019. 400 с.
Кононова О.Н., Дуба Е.В., Медовиков Д.В. и др. // Журн. физ. химии. 2018. Т. 92. № 10. С. 1641. https://doi.org/10.1134/S0044453718100138
Lee J., Kurniawana, Honga H.J. et al. // Sep. Purif. Technol. 2020. V. 246. Art. 116896. https://doi.org/10.1016/j.seppur.2020.116896
Абовский Н.Д., Блохин А.А., Мурашкин Ю.В. и др. // Сорбц. хромат. процессы. 2007. Т. 7. № 2. С. 264.
Адеева Л.Н., Миронов А.В. // Вестн. Омского ун-та. 2013. № 4. С. 128.
Пестов А.В., Братская С.Ю., Слободюк А.Б. и др. // Изв. АН. Сер. хим. 2010. № 7. С. 1273.
Biswas F.B., Rahman I.M.M., Nakakubo K. et al. // Chem. Eng. J. 2020. V. 407. Art. 127225. https://doi.org/10.1016/j.cej.2020.127225
Неудачина Л.К., Холмогорова А.С., Пузырев И.С. и др. // Журн. физ. химии. 2018. Т. 92. № 11. С. 1779.
Лосев В.Н., Бородина Е.В., Буйко О.В. и др. // Журн. аналит. химии. 2014. Т. 69. № 5. С. 462.
Xie Q., Lin T., Chen F. et al. // Hydromet. 2018. V. 178. P. 188. https://doi.org/10.1016/j.hydromet.2018.04.007
Nikoloski A.N., Ang K.-L., Li D. // Hydromet. 2015. V. 152. P. 20. https://doi.org/10.1016/j.hydromet.2014.12.006
Алифханова Л.М.к., Петрова Ю.С., Босенко С.Н. и др. // Журн. неорган. химии. 2021. Т. 66. № 4. https://doi.org/10.31857/S0044457X21040036
Fujiwara K., Ramesh A., Maki T. et al. // J. Hazard. Mat. 2007. V. 146. P. 39. https://doi.org/10.1016/j.jhazmat.2006.11.049
Liu F., Wang S., Chen S. // Int. J. Biol. Macromol. 2020. V. 152. P. 1242. https://doi.org/10.1016/j.ijbiomac.2019.10.221
Wei W., Reddy D.H.K., Bediako J.K. et al. // Chem. Eng. J. 2016. V. 289. P. 413. https://doi.org/10.1016/j.cej.2015.12.104
Petrova Y.S., Pestov A.V., Usoltseva M.K. et al. // Sep. Sci. Technol. 2019. V. 54. № 1. P. 42. https://doi.org/10.1080/01496395.2018.1505912
Alifkhanova L.M.k., Pestov A.V., Mekhaev A.V. et al. // J. Environ. Chem. Eng. 2019. V. 7. № 1. Art. 102846. https://doi.org/10.1016/j.jece.2018.102846
Alifkhanova L.M.k., Lopunova K.Ya., Pestov A.V. et al. // Sep. Sci. Technol. 2020. In press. https://doi.org/10.1080/01496395.2020.1781175
Мархол М. Ионообменники в аналитической химии. М.: Мир, 1985. 545 с.
Кокотов Ю.А. Равновесие и кинетика ионного обмена. Л.: Химия, 1970. 336 с.
Басаргин Н.Н., Островская Е.Р., Юшковa Е.Ю. и др. // Журн. физ. химии. 2006. Т. 80. № 1. С. 127.
Suh J. // Bioorganic Chemistry. 1994. V. 22. № 3. P. 318. https://doi.org/10.1006/bioo.1994.1025
Bui T.H., Lee W., Jeon S.-B. et al. // Sep. Purif. Technol. 2020. V. 248. https://doi.org/10.1016/j.seppur.2020.116989
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии