Журнал неорганической химии, 2021, T. 66, № 6, стр. 794-797
Фазовая диаграмма системы медь–палладий
П. П. Федоров a, *, Ю. В. Шубин b, Е. В. Чернова a
a Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
b Институт неорганической химии им. А.М. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 20.03.2021
После доработки 28.03.2021
Принята к публикации 29.03.2021
Аннотация
С учетом требований третьего закона термодинамики проведена экстраполяция фазовых равновесий в системе медь–палладий до абсолютного нуля температуры. Кристаллизующийся из расплава непрерывный твердый раствор ГЦК-структуры претерпевает упорядочение с выделением двух интерметаллических фаз (фазы Курнакова), составы которых при понижении температуры стягиваются к стехиометрическим формулам CuPd и Cu3Pd. При повышении температуры палладий частично занимает место меди в кристаллографических позициях интерметаллических фаз. Имеет место также упорядочение по механизму фазового перехода второго рода с выделением фазы идеализированного состава Cu21Pd7. В твердом состоянии в системе реализуются эвтектоид при 390°C и 30 ат. % Pd и два дистектоида с координатами 510°C, 15 ат. % Pd и 600°C, 40 ат. % Pd.
Систему медь–палладий тщательно исследовали на протяжении десятилетий [1–8]. Помимо фундаментального интереса она привлекает внимание благодаря тому, что соответствующие сплавы являются эффективными катализаторами [9–14]. Интерметаллид CuPd является одним из наиболее перспективных материалов для изготовления водородселективных мембран [15, 16].
В системе Cu–Pd при кристаллизации расплава формируется непрерывный твердый раствор между компонентами. И медь, и палладий кристаллизуются в простейшей гранецентрированной кубической (ГЦК) решетке, параметры решетки отличаются незначительно. При понижении температуры сплав претерпевает упорядочение с выделением интерметаллических фаз. Такие фазы, впервые открытые Н.С. Курнаковым с сотрудниками при изучении системы медь–золото [17–19], принято называть фазами Курнакова. Экспериментальные данные, полученные разными исследователями для системы Cu–Pd в интервале 300–600°C, значительно отличаются. Существенной причиной этого является трудность достижения равновесия при таких низких температурах. При понижении температуры время установления равновесия, определяемое диффузией, возрастает экспоненциально [20–23]. Отсюда следует, что для каждой системы существует температура, ниже которой невозможно получить данные о фазовых равновесиях экспериментальным путем.
Соответствующая информация может быть получена термодинамическим моделированием. Простой возможностью является прямое использование третьего закона термодинамики (энтропия системы, находящейся в равновесии, стремится к нулю при стремлении температуры к абсолютному нулю [24]).
В соответствии с третьим законом термодинамики, все фазы переменного состава (твердые растворы, нестехиометрические фазы) должны или распасться (на компоненты или другие фазы постоянного состава), или перейти в строго упорядоченное состояние [23, 25, 26]. Использование этих положений позволяет уверенно проводить экстраполяцию фазовых диаграмм до абсолютного нуля температуры. Надежные результаты можно получить только при использовании достоверных экспериментальных данных, отвечающих равновесному состоянию системы при исследованных температурах. Плодотворность данного подхода продемонстрирована нами на примере системы медь–золото [18].
Цель настоящей работы – применить этот подход к системе медь–палладий.
Предлагаемая нами фазовая диаграмма системы медь–палладий представлена на рис. 1. Кривые ликвидуса и солидуса проведены в соответствии с работой [7]. Фазовые равновесия в области упорядочения твердого раствора при 300–450°C тщательно изучены с помощью комплекса методов в ИНХ СО РАН [8] с контролем за установлением равновесия. Эти данные использованы при построении фазовой диаграммы. Заметим, что данные, полученные в работе [8], естественным образом экстраполируются на нулевую температуру. На рис. 1 сохранены все отрезки кривых, проведенных в [8] непрерывными линиями.
Рис. 1.
Предлагаемая фазовая диаграмма системы медь–палладий: 1 – фаза α (ГЦК-твердый раствор медь–палладий), 2 – фаза β на основе CuPd, 3 – фаза γ на основе Cu3Pd, 4 – фаза δ идеализированного состава Cu21Pd7, 5 – двухфазная область α + β, 6 – двухфазная область δ + β.
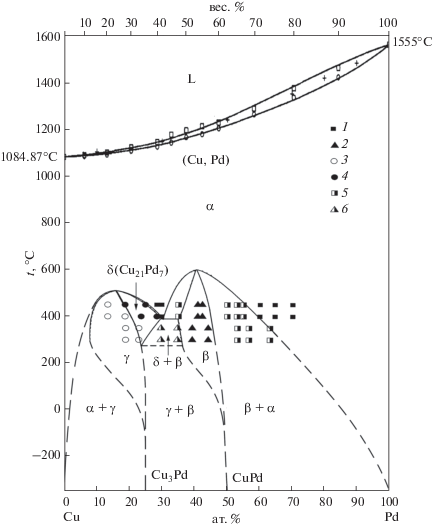
В противоположность этому, использование данных [7] не позволяет проводить экстраполяцию такого типа. Особенно это касается линии предельной концентрации неупорядоченного твердого раствора ниже 400°С. Таким образом, можно сделать косвенный вывод о надежности данных, полученных в работе [8].
В системе Cu–Pd из расплава кристаллизуется непрерывный твердый раствор ГЦК-структуры (пр. гр. Fm$\bar {3}$m). Коэффициент распределения палладия при кристаллизации меди близок к единице, вследствие чего при малом содержании палладия кривые ликвидуса и солидуса практически сливаются и идут почти горизонтально (рис. 1).
Непрерывный твердый раствор претерпевает упорядочение с выделением двух интерметаллических фаз. В соответствии с картинами рентгеновской дифракции, они относятся к структурным типам CsCl и Cu3Au и характеризуются пр. гр. симметрии Pm$\bar {3}$m [3–8]. Идеальные составы, отвечающие полной дифференциации атомов металлов по кристаллографическим позициям, соответствуют формулам CuPd и Cu3Pd. Именно к этим составам стягиваются границы областей гомогенности двух фаз переменного состава при стремлении температуры к абсолютному нулю. Повышение температуры приводит к появлению областей гомогенности этих фаз, причем, судя по их химическому составу (обогащение медью), медь частично занимает место палладия в кристаллографических позициях интерметаллических фаз. Заметим, что в этой системе, в отличие от системы Cu–Au, не образуется третья, обедненная медью, интерметаллическая фаза идеализированного состава CuPd3.
Кроме того, на фазовой диаграмме обозначено также упорядочение по механизму фазового перехода второго рода с выделением фазы идеализированного состава Cu21Pd7 пр. гр. P4mm (тетрагональная решетка, одномерное упорядочение с увеличением параметра с в 7 раз). Еще одна упорядоченная фаза в области около 40 ат. % Pd при 400°C, отмеченная в работе [7], не зафиксирована в [8] и не показана на рис. 1. Это область фазовой диаграммы требует дальнейших исследований.
На построенной фазовой диаграмме привлекает внимание отсутствие интерметаллидов, аналогичных упорядоченным фазам, существующим в системе медь–золото, а именно тетрагональной фазы CuPd и кубической CuPd3. Эти фазы в системе медь–палладий вытесняются фазой CuPd, построенной по другому структурному принципу.
Заметим, что термодинамическая модель фазовой диаграммы системы Cu–Pd, предложенная в работе [1], противоречит третьему началу термодинамики. Причиной этого является включение в расчет недостоверных экспериментальных данных о фазовых равновесиях при низких температурах. Моделирование из первых принципов, предпринятое в работе [2], дает правильное качественное описание термического поведения фазы CuPd, но количественного соответствия с экспериментальными данными не наблюдается.
Таким образом, в твердом состоянии в системе Cu–Pd реализуются эвтектоид при 390°C и 30 ат. % Pd и два дистектоида с координатами 510°C, 15 ат. % Pd и 600°C, 40 ат. % Pd [8].
Список литературы
Li M., Du Z., Guo C., Li C. // Calphad. 2008. V. 32. Art. 439e446. https://doi.org/10.1016/j.calphad.2008.04.004
Geng F., Boes J.R., Kitchin J.R. // Calphad. 2017. V. 56. Art. 224e229. https://doi.org/10.1016/j.calphad.2017.01.009
Bärthlein S., Hart G.L.W., Zunger A. et al. // J. Phys. Condens. Matter. 2007. V. 19. Art. 032201. http://stacks.iop.org/0953-8984/19/ij3/aj032201
Volkov A.Y., Novikova O.S., Antonov B.D. // Inorg. Mater. 2013. V. 49. Art. 43e48. https://doi.org/10.1134/S0020168512110167
Novikova O.S., Volkov A.Y., Matthey J. // Technol. Rev. 2014. V. 58. Art. 195e201. https://doi.org/10.1595/147106714X684579
Huang P., Menon S., de Fontaine D. // J. Phase Equilibria. 1991. V. 12. P. 3. https://doi.org/10.1007/BF02663663
Subramanian P.R., Laughlin D.E. // J. Phase Equilibria. 1991. V. 12. P. 231. https://doi.org/10.1007/BF02645723
Popov A.A., Shubin Yu.V., Plyusnin P.E. et al. // J. Alloys Compd. 2019. V. 777. P. 204. https://doi.org/10.1016/j.jallcom.2018.10.332
Shan S., Petkov V., Prasai B. et al. // Nanoscale. 2015. V. 7. Art. 18936e18948. https://doi.org/10.1039/C5NR04535E
Wu J., Shan S., Luo J. et al. // ACS Appl. Mater. Interfaces. 2015. V. 7. Art. 25906e25913. https://pubs.acs.org/doi/10.1021/acsami.5b08478
Sanchez-Escribano V., Arrighi L., Riani P. et al. // Langmuir. 2006. V. 22. Art. 9214e9219. https://pubs.acs.org/doi/abs/10.1021/la0616101
Goulas K.A., Sreekumar S., Song Y. et al. // J. Am. Chem. Soc. 2016. V. 138. Art. 6805e6812. https://pubs.acs.org/doi/10.1021/jacs.6b02247
Yan B., Wang C., Xu H. et al. // ChemPlusChem. 2017. V. 82. Art.1121e1128. https://onlinelibrary.wiley.com/doi/abs/10.1002/cplu.201700245
Cai F., Yang L., Shan S. et al. // Catalysts. 2016. V. 6. P. 96. http://www.mdpi.com/2073-4344/6/7/96
Krisyuk V.V., Shubin Y.V., Senocq F. et al. // J. Cryst. Growth. 2015. V. 414. Art. 130e134. https://www.sciencedirect.com/science/article/pii/S00220248140065-02?via%3Dihub
Zhao C., Goldbach A., Xu H. // J. Membr. Sci. 2017. V. 542. Art. 60e67. https://www.sciencedirect.com/science/article/pii/S0376738817305021?via%3Dihub
Курнаков Н.С., Жемчужный С.Ф., Заседателев М.М. // Журн. Русского физ.-хим. об-ва. 1915. Т. 47. С. 871. [Kurnakov N.S., Zemczuzny S.F., Zasedatelev M. // J. Inst. Met. London, 1916. V. 15. P. 305.]
Федоров П.П., Волков С.Н. // Журн. неорган. химии. 2016. Т. 61. № 6. С. 809. [Fedorov P.P., Volkov S.N. // Russ. J. Inorg. Chem. 2016. V. 61. № 6. P. 772.] https://doi.org/10.1134/S0036023616060061
Смирнов А.А. Молекулярно-кинетическая теория металлов. М.: Наука, 1966. 488 с.
Федоров П.П. // Журн. неорган. химии. 1992. Т. 37. № 8. С. 1891. [Fedorov P.P. // Russ. J. Inorg. Chem. 1992. V. 37. № 8. P. 973.]
Liu M., Yund R.A. // Am. Mineral. 1992. V. 77. P. 275.
Yashima M., Kakihana M., Yoshimura M. // Solid State Ionics. 1996. V. 86–88. P. 1131.
Федоров П.П. // Журн. неорган. химии. 2010. Т. 55. № 11. С. 1825. [Fedorov P.P. // Russ. J. Inorg. Chem. 2010. V. 55. № 11. P. 1722]. https://doi.org/10.1134/S0036023610110100
Nernst W. The new heat theorem. London: Methuen and Co., 1917.
Abriata J.P., Laughlin D.E. // Prog. Mat. Sci. 2004. V. 49. P. 367.
Laughlin D.E., Soffa W.A. // Acta Mater. 2018. V. 145. P. 49. https://doi.org/10.1016/j.actamat.2017.11.037
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


