Журнал неорганической химии, 2021, T. 66, № 5, стр. 623-630
Формы воды на поверхности и в объеме диоксида кремния
Г. П. Панасюк a, И. В. Козерожец a, *, И. Л. Ворошилов a, Ю. Д. Ивакин b, В. И. Привалов a, М. Н. Данчевская b
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: irina135714@yandex.ru
Поступила в редакцию 09.12.2020
После доработки 03.01.2021
Принята к публикации 11.01.2021
Аннотация
Методами термогравиметрии, масс-спектрометрии, ЯМР 1Н, 29Si, ИК-спектроскопии исследованы термодинамические характеристики и определен механизм испарения воды из структуры кремнезема в интервале температур 100–1000°С. Показано, что на поверхности и в объеме частиц кремнезема присутствует жидкая, поверхностно-связанная и молекулярно-дисперсная вода. Показана роль различных (ОН)n-групп в процессе изменения структуры кремнезема при термической и термопаровой обработке. Предложен способ получения безводного кремнезема, используемого в производстве высококачественного кварцевого стекла.
ВВЕДЕНИЕ
Вода в дисперсных оксидах представляет собой термодинамически сложную систему, зависящую
от свойств исходных оксидов (размера частиц, удельной площади поверхности, морфологии,
состава примесей и др.) [1–5]. В свою очередь, свойства получаемых оксидных материалов при их синтезе в водной
среде, в частности при гидротермальной и термопаровой обработке, зависят от формы
воды, включенной в их структуру. При этом решающую роль в процессе формирования образующегося
материала играет соотношение различных типов водородных связей между молекулами воды
и связи между молекулами воды и элементами металлокислородного скелета оксида [3–7]. Для диоксида кремния это взаимодействие между силанольными 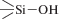 , силандиольными
, силандиольными 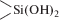 , силантриольными —Si(OH)3 и силоксановыми
, силантриольными —Si(OH)3 и силоксановыми 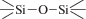 группами и молекулами воды на поверхности и в объеме диоксида кремния [8, 9]. Особенно результативным для управления свойствами получаемых материалов является
взаимодействие между кремнекислородным скелетом оксида и кластерами воды реакционной
среды, что принципиально влияет на такой важнейший термодинамический параметр материала,
как теплота испарения [10]. Это связано с тем, что процесс испарения в общем случае состоит из двух составляющих
его процессов: перехода молекул воды через границу системы вода–пар и образования
молекул воды в жидкой фазе путем разрушения кластерной структуры воды [11–13]. Эти процессы существенно зависят от параметров системы: температуры, давления,
состава примесей, причем именно кластерная структура воды чрезвычайно чувствительна
к составу примесей [14]. Так, авторами [15] при изучении свойств “аномальной” воды выявлена зависимость теплоты испарения воды
от примесей на уровне 10–4 мас. %. Состав примесей во многом определяет “аномальные” свойства воды, в том числе
вязкость и теплопроводность [15], что в настоящее время является предпосылкой для создания нового научно-инженерного
направления, направленного на синтез и изучение свойств нанофлюидов. Нанофлюиды представляют
собой микросуспензии, содержащие примеси в диапазоне от 10–4 до 1 мас. % со средним размером частиц на уровне 40 нм. При этом свойства нанофлюидов
могут составлять до 50% от табличных значений [16–20]. В этом плане наблюдается общность между свойствами воды в дисперсных оксидах и
свойствами воды в нанофлюидах, что обусловливает пристальное внимание к этим объектам
и большое число работ в этой области [1–9, 16–20]. Так, в работе [16] приведена зависимость изменения теплопроводности и вязкости нанофлюидов от концентрации
наночастиц. Установлено, что при увеличении концентрации наночастиц в растворе теплопроводность
и вязкость нанофлюидов увеличиваются.
группами и молекулами воды на поверхности и в объеме диоксида кремния [8, 9]. Особенно результативным для управления свойствами получаемых материалов является
взаимодействие между кремнекислородным скелетом оксида и кластерами воды реакционной
среды, что принципиально влияет на такой важнейший термодинамический параметр материала,
как теплота испарения [10]. Это связано с тем, что процесс испарения в общем случае состоит из двух составляющих
его процессов: перехода молекул воды через границу системы вода–пар и образования
молекул воды в жидкой фазе путем разрушения кластерной структуры воды [11–13]. Эти процессы существенно зависят от параметров системы: температуры, давления,
состава примесей, причем именно кластерная структура воды чрезвычайно чувствительна
к составу примесей [14]. Так, авторами [15] при изучении свойств “аномальной” воды выявлена зависимость теплоты испарения воды
от примесей на уровне 10–4 мас. %. Состав примесей во многом определяет “аномальные” свойства воды, в том числе
вязкость и теплопроводность [15], что в настоящее время является предпосылкой для создания нового научно-инженерного
направления, направленного на синтез и изучение свойств нанофлюидов. Нанофлюиды представляют
собой микросуспензии, содержащие примеси в диапазоне от 10–4 до 1 мас. % со средним размером частиц на уровне 40 нм. При этом свойства нанофлюидов
могут составлять до 50% от табличных значений [16–20]. В этом плане наблюдается общность между свойствами воды в дисперсных оксидах и
свойствами воды в нанофлюидах, что обусловливает пристальное внимание к этим объектам
и большое число работ в этой области [1–9, 16–20]. Так, в работе [16] приведена зависимость изменения теплопроводности и вязкости нанофлюидов от концентрации
наночастиц. Установлено, что при увеличении концентрации наночастиц в растворе теплопроводность
и вязкость нанофлюидов увеличиваются.
В работе [16] исследовано изменение значения энтальпии испарения воды методом ТГА из нанофлюидов с содержанием наночастиц Al2O3 и TiO2 в диапазоне 0.01–1 мас. % с размером частиц 13, 20 и 80 нм. Установлено, что чем выше объемная концентрация нанофлюида и чем больше размер наночастиц Al2O3, тем меньше значение энтальпии испарения воды. Схожая закономерность присутствует и для нанофлюидов, содержащих частицы TiO2.
Также значительно вырос интерес к изучению физико-химических свойств воды в тонких слоях, прилегающих к поверхностям раздела фаз, которая получила название поверхностно-связанной воды. Свойства ее существенно отличаются от свойств обычной жидкой воды. Интерес к этой форме воды определяется ее ролью в физико-химических процессах (адсорбция, катализ, процессы коллоидной химии), но главным образом ее важнейшей ролью в биологических процессах. Теоретически и экспериментально свойства поверхностно-связанной воды исследованы в работах [1–7, 10, 21]. Роль поверхностно-связанной воды в биологических системах рассмотрена в работах [21–23]. Отличие свойств поверхностно-связанной воды от свойств объемной воды определяется главным образом свойствами поверхности, наличием в ней полярных групп, способных образовывать водородные связи; наличием поверхностных ионов; геометрией поверхности и др. Под влиянием поверхностных сил происходит перестройка трехмерной сетки структуры воды. Модификация водного слоя определяется природой и числом поверхностных атомов, способных образовывать водородные связи с молекулами воды.
Свойства поверхностно-связанной воды (теплоемкость, вязкость, плотность, электропроводность, селективная адсорбция) исследовались в работах [3–7, 10]. Наибольший интерес представляет непосредственное экспериментальное определение термических свойств поверхностно-связанной воды, в частности энтальпии и энергии активации испарения; однако ввиду значительных экспериментальных трудностей таких исследований проведено мало. В работе [15] для структурно модифицированной воды, полученной в кварцевых капиллярах, было определено значение давления пара над поверхностью столбика модифицированной воды и зафиксировано существенное уменьшение значения равновесного давления пара. Определенная по температурной зависимости длины столбика жидкости теплота испарения в области 200°С составила в среднем 6 ± 1 ккал/моль. В работах [24–26] на основе анализа экспериментальных данных по физическим свойствам поверхностно-связанной воды предложена модель ее структуры. Модель основывается на бимодальной функции распределения энтальпии для жидкой воды, рассчитанной из экспериментальных данных по теплоемкости. Распределение энтальпии имеет вид бимодальной функции с максимумами ~1 и 3 ккал/моль, что позволило автору постулировать двухструктурную модель жидкой воды и считать, что поверхностно-связанная вода обогащена льдообразной компонентой, для которой доля молекул, связанных четырьмя водородными связями, повышается от 0.1 в объемной воде до 0.4 в связанной [25].
Кремнезем (диоксид кремния SiO2) представляет собой неорганический полимер корпускулярного строения. Для кристаллических модификаций кремнезема валентные углы между атомами кремния и кислорода являются фиксированными и определяют строение и свойства этих модификаций. В то же время для аморфного кремнезема значение валентных углов колеблется в интервале 120°–180°, что в совокупности с наличием локализованных молекул воды приводит к разупорядоченности его структуры. В значительной мере свойства аморфного кремнезема определяются характером надмолекулярных образований – размером флоккул, их симметрией, регулярностью расположения и др. Наличие воды в структуре кремнезема связано как с методом его получения, так и с изменением его структуры при последующей обработке. Взаимодействие воды с гидроксильными группами на поверхности и в объеме кремнезема приводит к ее структурной модификации, т.е. к образованию поверхностно-связанной воды. Таким образом, в аморфном кремнеземе могут присутствовать следующие структурные элементы: кремнекислородный скелет, образованный трехмерными сетками силоксановых связей, гидроксильные группы (ОН)n у атомов кремния и молекулы воды, локализованные на различных участках кремнекислородного скелета.
К настоящему времени нет однозначной картины строения гидратированного кремнезема. Несмотря на большое количество исследований, посвященных этому вопросу [27–31], остаются неясными структура, место и характер локализации воды на поверхности и в объеме кремнезема, относительное количество силанольных, силандиольных, силантриольных и силоксановых групп, координация атомов кремния, содержащих группы (ОН)n, характер взаимного возмущения силанольных групп и их взаимодействие с молекулами или кластерами воды.
Настоящая работа посвящена исследованию форм воды на поверхности и в объеме гидратированного диоксида кремния и выявлению роли различных (ОН)n-групп в процессе изменения структуры кремнезема при термической и термопаровой обработке.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования использовали кремниевую кислоту марки “ч. д. а.”, кремнезем производства Ангарского завода химических реактивов марки “ос. ч. 14-4”, а также образцы кремнезема, синтезированные путем гидролиза реактивов производства ПАО “Химпром” (Новочебоксарск): силиката натрия (Na2SiO3), тетрахлорида кремния (SiCl4), тетраэтоксисилана (C2H5O)4Si. Для нормирования количества гидроксильных групп и воды образцы прогревали на воздухе в интервале 100–1500°С и подвергали гидротермальной и термопаровой обработке в лабораторных автоклавах при 150–350°С.
Термогравиметрическое исследование проводили на дериватографах фирм 1000Д МОМ и Rigaku Corporation со скоростью нагрева 10 град/мин в температурном интервале 20–1000°С. В качестве эталона использовали Al2O3. ИК-спектры снимали на приборах УР-20 и Specord в диапазоне 400–4000 см–1 с использованием таблеток из КВr. Спектры ЯМР 1Н получены на импульсном спектрометре Bruker WP-80 при комнатной температуре (300 K) с рабочей частотой 80 МГц, растворитель и внутренний стандарт – трихлорметан-D; спектры ЯМР 29Si с кросс-поляризацией 29Si–1Н с протонным подавлением во время регистрации сигнала и вращением образца под магическим углом получены на спектрометре Bruker MSL-300 с частотой 15.69 МГц, растворитель и внутренний стандарт – трихлорметан-D. Все химические сдвиги приведены относительно сигнала внешнего эталона тетраметилсилана без учета поправки на объемную магнитную восприимчивость. Методика измерений изложена в работах [10, 32].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При рассмотрении свойств гидратированного кремнезема и идентификации различных форм воды в его структуре одним из основных вопросов является вопрос о координационном числе атома кремния в кремнекислородном скелете. Этот вопрос дискуссионный. По мнению авторов [33, 34], в случае локализации молекул воды около атомов кремния, имеющих не только силоксановые, но и силанольные группы, координационное число кремния должно быть выше по сравнению с апротонными кислородными соединениями кремния. Авторы считают, что в аквагидроксокомплексах кремния можно ожидать КЧ = 5 или 6.
Проведенные нами исследования методом спектроскопии ЯМР 29Si показали, что независимо от способа получения и последующей обработки кремнезема в пределах чувствительности метода не удалось зафиксировать координацию кремния, отличную от четверной. Для образцов водного аморфного кремнезема, полученных гидролизом (SiCl4, Na2SiO3 и (C2H5O)4Si), в спектрах ЯМР 29Si наблюдаются три сигнала с химическими сдвигами при –91, –100 и –109 м.д. (рис. 1, кривая 1), которые относятся к силандиольным, силанольным и силоксановым группам соответственно.
Рис. 1.
Спектры ЯМР 29Si с кросс-поляризацией, протонным подавлением и вращением под магическим углом для кремниевой кислоты: 1 – исходной; 2 – после нагрева в течение 4 ч при 1000°С; 3 – после термопаровой обработки в течение 4 ч при 350°С.
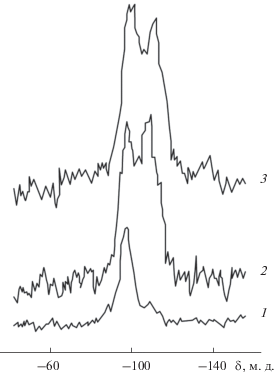
Ни в одном образце не было зафиксировано ни силантриольных групп, ни молекул ортокремниевой кислоты Si(ОН)4. Очевидно, что как на поверхности, так и в объеме кремнезема присутствуют только атомы кремния с КЧ = 4. В спектрах образцов, прогретых на воздухе при 1000°С, имеются лишь два сигнала с химическими сдвигами –100 и –109 м.д. (рис. 1, кривая 2), что указывает на исчезновение силандиольных групп и увеличение относительного количества силоксановых связей. Аналогичное действие оказывает термопаровая обработка (рис. 1, кривая 3). Можно предположить, что исчезновение силандиольных групп, сопровождающееся увеличением количества силоксановых связей, происходит в результате взаимодействия силандиольных групп с соседними силанольными или силандиольными группами (схема 1 ). Затем соседние силандиольные группы рекомбинируют с образованием силоксановых связей.
Схема 1 .
Для проведения термогравиметрических исследований образцы кремнезема были получены гидролизом различных прекурсоров (SiCl4, Na2SiO3 и (C2H5O)4Si). Образцы промывали дистиллированной водой и высушивали на воздухе при 60°С. Во всех случаях на термогравиметрических кривых фиксировали значительный растянутый эндотермический эффект в диапазоне 90–180°С с максимумом при 135–140°С, который сопровождался потерей веса 5–8 мас. % (табл. 1). Значение энтальпии испарения составляло 8.5–9.5 ккал/моль испарившейся воды, что несколько ниже энтальпии испарения жидкой воды (10 ккал/моль). Можно предположить, что в этом диапазоне происходило испарение различных форм воды, что обусловливало более низкое по сравнению с жидкой водой значение энтальпии испарения.
Таблица 1.
Формы воды на поверхности и в объеме диоксида кремния
| Кремнезем, полученный гидролизом | t, °С | tmax, °С | Потеря массы, % | ΔНиспаренияводы, ккал/моль | Форма воды |
|---|---|---|---|---|---|
| Na2SiO3 | 90–180 | 135 | 5–8 | 8.5–9.5 | Испарение различных форм воды |
| Na2SiO3 (послойное испарение) | 90–180 | 135 | 9 | 10 | Жидкая |
| 1 | 5 | Испарение воды, связанной водородными связями с поверхностью SiO2 | |||
| Na2SiO3 и подвергнутый гидротермальной обработке при 180°С в 5 мас. %-ном растворе NH4OH в течение 6 ч (послойное испарение) | 50–260 | 250 | 6 | 10 | Жидкая |
| 260–500 | 350 | 1 | 5 | Кластеры, поверхностно-связанная вода | |
| 500–650 | 550 | 0.1 | 2 | Молекулярно-дисперсная |
Для проверки этого предположения было проведено послойное испарение воды с одновременным определением энтальпии испарения. На рис. 2 представлена термогравиметрическая кривая испарения воды из диоксида кремния, полученного гидролизом силиката натрия, со значением удельной поверхности 180 м2/г.
Рис. 2.
Зависимость энтальпии испарения воды от концентрации воды на открытой поверхности кремнезема.
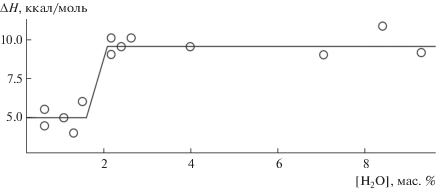
Как видно из рис. 2, для образца диоксида кремния, содержащего 9 мас. % воды, при испарении водного слоя из открытых пор вплоть до 1 мас. % энтальпия испарения составляет 10 ккал/моль, что указывает на испарение жидкой воды. Начиная со слоя 1 мас. % энтальпия испарения составляет 5 ккал/моль, что позволяет сделать вывод о том, что в этом диапазоне происходит испарение воды, связанной водородными связями с силанольными и силандиольными группами поверхности диоксида кремния.
Для исследования состояния воды в объеме диоксида кремния исследуемые образцы были подвергнуты гидротермальной обработке в автоклаве при 180°С в 5 мас. %-ном растворе гидроксида аммония в течение 6 ч. Для этого образца на кривых ДТА фиксировались три эндотермических эффекта с максимумами при 100, 400 и 500°С. Теплота испарения различных форм воды составила 8, 5 и 1 ккал/моль. Очевидно, что дегидратация модифицированных образцов кремнезема происходит в трех температурных интервалах: 50–120, 250–500 и 500–1000°С и сопровождается эндотермическими тепловыми эффектами и заметной потерей массы.
В интервале температур 50–120°С происходит испарение воды из открытых пор силикагеля. Общее количество воды, испаряющейся в этом температурном интервале, составляет ~6 мас. % от массы образца. Интегральная теплота испарения составляет ~10 ккал/моль, а энергия активации испарения, определенная по термогравиметрическим кривым методом неизотермической кинетики, в условиях линейного подъема температуры составляет ~10 ккал/моль. Эти данные указывают на то, что в этом интервале испаряется жидкая вода, которая термодинамически не является однородной. Так, после испарения основного количества воды для оставшегося слоя, составляющего 1% от массы образца, теплота испарения составляет ~6 ккал/моль, тогда как интегральная теплота испарения составляет 10 ккал/моль и соответствует теплоте испарения жидкой воды (рис. 2). Испарение во втором температурном интервале наиболее удобно исследовать на образцах, прошедших гидротермальную или термопаровую обработку. Для таких образцов получены три тепловых эффекта: при температурах 250, 350 и 500°С, величина которых составляет 10, 5 и 1 ккал/моль соответственно. Испарение поверхностной воды заканчивается после прогрева в течение 3 ч при 150°С.
Для исходных образцов, содержащих ~6 мас. % воды, спектр ЯМР 1Н при вращении образца под магическим углом дает только одну линию с химическим сдвигом при 5 м.д., а в ИК-спектре присутствует одна широкая полоса в интервале 3200–3800 см–1. После прогрева в течение 3 ч при 150°С в спектре ЯМР 1Н наблюдается широкая линия с химическим сдвигом 2 м.д.; в ИК-спектре фиксируются три широкие разрешенные полосы с максимумами при 3200, 3450 и 3680 см–1. Спектр ЯМР 29Si идентичен спектру исходного образца. Учитывая, что химический сдвиг жидкой воды на поверхности кремнезема составляет 5 м.д., линия с химическим сдвигом 2 м.д. может быть отнесена к поверхностно-связанной воде в объеме глобул. Можно предположить, что структурная модификация воды в объеме кремнезема определяется силандиольными группами, на присутствие которых указывает линия с химическим сдвигом –90 м.д. в спектре ЯМР 29Si.
Для образцов, подвергнутых гидротермальной обработке, в спектре ЯМР 1Н фиксируются две линии с химическими сдвигами 5 и 3 м.д. Прогрев этих образцов в течение 3 ч при 400°С приводит к исчезновению линии 5 м.д. В спектре остается только одна линия при 3 м.д., которую можно отнести к поверхностно-связанной воде, образующейся за счет модификации жидкой воды совместно с силанольными и силаксановыми группами. Характерно, что для этих образцов (как и в кремнеземе, прогретом при 1000°С) в спектре ЯМР 29Si присутствуют только два сигнала с химическими сдвигами при –100 и –109 м.д. примерно одинаковой интенсивности, обусловленные силанольными и силоксановыми группами.
Для образцов, прогретых при 1300°С, в спектре ЯМР 1Н имеется только одна линия с химическим сдвигом ~1 м.д., при этом в ИК-спектре присутствует одна полоса при 3680 см–1. Поскольку поглощение изолированных гидроксильных групп характеризуется в ИК-спектре полосой при 3750 см–1 [10], можно сделать вывод, что высокотемпературная термическая обработка приводит к образованию не свободных силанольных групп, а силанольных групп, около которых локализованы молекулы воды, связанные двумя водородными связями с протоном силанольной группы и кислородом силоксановой связи.
Проведенные исследования показали, что в аморфном гидратированном кремнеземе как на поверхности, так и в объеме частиц помимо гидроксильных групп и жидкой воды находится вода, структурно модифицированная за счет поверхностных сил. Структурная модификация воды определяется наличием полярных гидроксильных групп как на поверхности частиц кремнезема, так и в их объеме. В зависимости от количества гидроксильных групп у атома кремния (силанольные, силандиольные) характер структурной модификации может существенно изменяться. При взаимодействии молекул воды с гидроксильными группами у атомов кремния происходит образование кластеров поверхностно-связанной воды с несколько более низкой теплой испарения по сравнению с теплотой испарения жидкой воды (~6 ккал/моль). Эта форма воды может находиться как на поверхности частиц кремнезема (при содержании воды не более 1 мас. %), так и в объеме его частиц. По мере частичного дегидроксилирования структуры кремнезема за счет удаления в первую очередь силандиольных групп характер модификации воды изменяется и определяется взаимодействием с гидроксилами силанольных групп. Для этой формы воды теплота испарения значительно ниже и колеблется в интервале 1–3 ккал/моль. Таким образом, для связанной воды в объеме частиц кремнезема характерна высокая энергия активации испарения, указывающая на сравнительную трудность диффузии воды из объема кремнеземных частиц.
В работах [35–39] методом машинного эксперимента показано, что локальная плотность воды в объеме, ограниченном плоскими поверхностями, осциллирует вдоль направления, перпендикулярного к ограничивающей поверхности, затухая на некотором расстоянии от твердой подложки, что может привести к изменению структуры водородных связей и, как следствие, к модификации воды. Континуальное строение воды переходит в дискретное кластерное строение, в котором размеры кластеров определяются областями однородности. Водородные связи молекул воды в одном слое обладают большей энергией, чем в различных слоях.
Результаты исследования термодинамических свойств водных кластеров представлены в работах [35, 36]. Определенная масс-спектрометрическим методом энтальпия образования димера воды составляет 4.2 ккал/моль, а средняя энтальпия, приходящаяся на 1 молекулу воды, равна 2.1 ккал/моль. Энтальпия присоединения молекулы воды к димеру составляет 6.7 ккал/моль, а средняя энтальпия одной молекулы в тримере равна 3.6 ккал/моль, что в 1.7 раза выше, чем для димера. Для тетрамера средняя энтальпия одной молекулы составляет 8.4 ккал/моль, для пентамера – 9.4 ккал/моль, что близко к энтальпии испарения чистой воды.
Сопоставление полученных нами результатов с приведенными литературными данными показывает, что в гидратированном кремнеземе на поверхности (в открытых порах) находится жидкая вода. В процессе прогрева образца по мере удаления воды до содержания ~1 мас. % начинает существенно проявляться ее модификация за счет поверхностных гидроксильных групп. Полученное нами значение теплоты испарения ~6 ккал/моль позволяет на основе данных работ [35–37] сделать вывод, что на поверхности кремнезема при содержании меньше 1 мас. % вода присутствует в виде димеров. В объеме частиц кремнезема, по-видимому, существуют кластеры с различным количеством молекул воды, на что указывает наличие в ИК-спектре трех разрешенных полос (3200, 3450, 3680 см–1) в области валентных колебаний гидроксильных групп и интенсивной полосы при 1640 см–1 деформационных колебаний молекул воды. Протонный обмен между молекулами воды и гидроксильными группами определяет усредненный химический сдвиг в спектре ЯМР 1Н со значением 2 м.д. Удаление из объема частиц единичных молекул воды, связанных с силанольными и силоксановыми группами, кинетически чрезвычайно затруднено, на что указывает высокое значение энергии активации испарения. По этой причине данная форма воды присутствует в кремнеземе вплоть до его плавления и даже в кварцевом стекле (полоса при 3680 см–1). В то же время низкое значение энтальпии испарения (~1 ккал/моль при 500°С) указывает на сравнительно слабую связь этих молекул в объеме частиц кремнезема. Таким образом, в объеме частиц кремнезема могут присутствовать жидкая вода, поверхностно-связанная вода в виде кластеров и вода в молекулярно-дисперсном состоянии, т.е. связанная водородными связями с протонами силанольных групп и кислородом силоксановых связей.
Если строение поверхностного гидратного покрова кремнезема имеет большое значение для таких процессов, как катализ и адсорбция, то энергетическое состояние воды в объеме частиц имеет решающее значение для процессов модификации структуры кремнезема при термической и термопаровой обработке. Полученные результаты важны для получения на основе кремнезема новых материалов с заданными свойствами.
ЗАКЛЮЧЕНИЕ
Исследована энтальпия и механизм испарения воды из структуры кремнезема в интервале температур 100–1300°С. Показано, что на поверхности и в объеме частиц кремнезема присутствует жидкая, поверхностно-связанная и молекулярно-дисперсная вода. Показана роль различных (ОН)n-групп в процессе изменения структуры кремнезема при термической и термопаровой обработке.
Список литературы
Panasyuk G.P., Kozerozhets I.V., Semenov E.A. et al. // Inorg. Mater. 2019. V. 55. № 9. P. 929. https://doi.org/10.1134/S0020168519090139
Panasyuk G.P., Kozerozhets I.V., Semenov E.A. et al. // Inorg. Mater. 2019. V. 55. № 9. P. 920. https://doi.org/10.1134/S0020168519090127
Kozerozhets I.V., Panasyuk G.P., Semenov E.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1529. https://doi.org/10.1134/S0036023620100149
Kozerozhets I.V., Panasyuk G.P., Semenov E.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1384. https://doi.org/10.1134/S0036023620090090
Kozerozhets I.V., Panasyuk G.P., Semenov E.A. et al. // Inorg. Mater. 2020. V. 56. № 7. P. 716. https://doi.org/10.1134/S0020168520070092
Kozerozhets I.V., Panasyuk G.P., Semenov E.A. et al. // Theor. Found. Chem. Eng. 2013. V. 54. № 3. P. 465. https://doi.org/10.1134/S0040579520030082
Panasyuk G.P., Belan V.N., Voroshilov I.L. et al. // Theor. Found. Chem. Eng. 2013. V. 47. № 4. P. 415. https://doi.org/10.1134/S0040579513040143
Mutahi M.W., Nittoli T., Guo L.X. et al. // J. Am. Chem. Soc. 2002. V. 124. № 25. P. 7363. https://doi.org/10.1021/ja026158w
Libanov V.V., Kapustina A.A., Shapkin N.P. et al. // Silicon. 2019. V. 11. № 3. P. 1489. https://doi.org/10.1007/s12633-018-9969-y
Danchevskaya M.N., Kreisberg V.A., Rakcheev V.R. et al. // Inorg. Mater. 1999. V. 35. № 10. P. 1060.
Okada S., Ohsaki S., Nakamura H. et al. // Chem. Eng. Sci. 2020. V. 227. № 115938. https://doi.org/10.1016/j.ces.2020.115938
Berthias F., Feketeova L., Abdoul-Carime H. et al. // Phys. Chem. Chem. Phys. 2018. V. 20. № 26. P. 18066. https://doi.org/10.1039/c8cp02657b
Calvo F., Berthias F., Feketeova L. et al. // Eur. Phys. J. D. 2017. V. 71. № 5. https://doi.org/10.1140/epjd/e2017-80062-5
Chatterjee K., Dopfer O. // Phys. Chem. Chem. Phys. 2018. V. 21. № 45. P. 25 226. https://doi.org/10.1039/c9cp05042f
Derjaguin B., Churaev N. // Nature. 1973. V. 244. P. 430. https://doi.org/10.1038/244430a0
Tso C.Y., Chao Christopher Y.H. // Int. J. Heat Mass Transfer. 2015. V. 84. P. 931. https://doi.org/10.1016/j.ijheatmasstransfer.2015.01.090
Tso C.Y., Fu S.C., Chao Christopher Y.H. // Int. J. Heat Mass Transfer. 2014. V. 70. P. 202. https://doi.org/10.1016/j.ijheatmasstransfer.2013.10.077
Tso C.Y., Chan K.C., Chao Christopher Y.H. et al. // Int. J. Heat Mass Transfer. 2015. V. 85. P. 343. https://doi.org/10.1016/10.1016/j.ijheatmasstransfer.2015.02.005
Lee H.H., Fu S.C., Tso C.Y. et al. // Int. J. Heat Mass Transfer. 2017. V. 105. P. 230. https://doi.org/10.1016/j.ijheatmasstransfer.2016.09.093
Siddiqui F.R., Tso C.Y., Fu S.C. et al. // Int. J. Heat Mass Transfer. 2020. V. 153. № 119618. https://doi.org/10.1016/j.ijheatmasstransfer.2020.119618
Ye Q.L., Eves R., Campbell R.L. et al. // Biochem. J. 2020. V. 477. № 17. P. 3271. https://doi.org/10.1042/BCJ20200539
Igarashi T., Hoshi M., Nakamura K. et al. // J. Phys. Chem. C. 2020. V. 124. № 7. P. 4196. https://doi.org/10.1021/acs.jpcc.0c00423
Symington A.R., Molinari M., Moxon S. et al. // J. Phys. Chem. C. 2020. V. 124. № 6. P. 3577. https://doi.org/10.1021/acs.jpcc.9b09046
Bakker H.J., Skinner J.L. // Chem. Rev. 2010. V. 110. № 3. P. 1498. https://doi.org/10.1021/cr9001879
Мантрова Г.М. // Биомед. Радиоэлектроника. 1999. № 7. С. 58.
Napari I., Laaksonen A. // J. Chem. Phys. 1999. V. 111. № 12. P. 5485. https://doi.org/10.1063/1.479809
Zhou Y., Zheng H.J., Qiu Y.W. et al. // Front. Mater. 2020. V. 7. № 127. https://doi.org/10.3389/fmats.2020.00127
Cretu A., Mattea C., Stapf S. et al. // Mol. Phys. 2019. V. 117. № 7–8. P. 1006. https://doi.org/10.1080/00268976.2018.1513581
Wu Y.P., Wang T. // J. Colloid Interface Sci. 2015. V. 448. P. 100. https://doi.org/10.1016/j.jcis.2015.02.020
Rager B., Krysztafkiewicz A. // Colloids Surf., A: Physicochem. Eng. Asp. 1997. V. 125. № 2–3. P. 121. https://doi.org/10.1016/S0927-7757(97)00063-0
Turov V.V., Leboda R., Bogillo V.I. // Langmuir. 1997. V. 13. № 5. P. 1237. https://doi.org/10.1021/la951565p
Lazarev V.B., Panasyuk G.P., Voroshilov I.L. et al. // Ind. Eng. Chem. Res. 1996. V. 35. № 10. P. 3721. https://doi.org/10.1021/ie950404d
He N., Xie H.B., Ding Y.H. // J. Comput. Chem. 2008. V. 29. № 11. P. 1850. https://doi.org/10.1002/jcc.20959
Chen Y.Z., Feng X.L., Chen J. et al. // Phys. Rev. B. 2019. V. 99. № 18. At. 184106. https://doi.org/10.1103/PhysRevB.99.184106
Reddy S.K., Straight S.C., Bajaj P. et al. // J. Chem. Phys. 2016. V. 145. № 19. At. 194504. https://doi.org/10.1063/1.4967719
Shevkunov S.V. // Colloid J. 2016. V. 78. № 2. P. 257. https://doi.org/10.1134/S1061933X16020137
Karthikeyan S., Kim K.S. // Mol. Phys. 2009. V. 107. № 8–12. P. 1169. https://doi.org/10.1080/00268970902784900
Ju X.H., Xiao J.J., Xiao H.M. // J. Mol. Struct.: Theochem. 2003. V. 626. P. 231. https://doi.org/10.1016/S0166-1280(03)00124-6
Kreisberg V.A., Ivakin Y.D., Danchevskaya M.N. // J. Eur. Ceram. Soc. 2019. V. 39. № 2–3. P. 508. https://doi.org/10.1016/j.jeurceramsoc.2018.09.031
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



