Журнал неорганической химии, 2021, T. 66, № 4, стр. 440-449
Люминесцентные свойства боратов лантана LaBO3 : Eu и La(BO2)3 : Eu, полученных экстракционно-пиролитическим методом
Н. И. Стеблевская a, *, М. В. Белобелецкая a, М. А. Медков a
a Институт химии Дальневосточного отделения РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: steblevskaya@ich.dvo.ru
Поступила в редакцию 03.09.2020
После доработки 29.10.2020
Принята к публикации 06.11.2020
Аннотация
Бораты лантана LaBO3 и α-La(BO2)3, а также La1 –хEuхBO3 и La1 –хEuх(BO2)3 (х = 0.025, 0.05, 0.075, 0.10) синтезированы экстракционно-пиролитическим методом, основным преимуществом которого по сравнению с известными методами синтеза боратов является снижение температуры и времени процесса. Соединения охарактеризованы методами рентгенофазового анализа, ИК- и люминесцентной спектроскопии. Ортобораты La1 –хEuхBO3 и метабораты La1 –хEuх(BO2)3 показывают интенсивную люминесценцию красного цвета в области 550–700 нм. Характер спектров люминесценции в рядах ортоборатов La1 –хEuхBO3 или метаборатов La1 –хEuх(BO2)3 не меняется, что свидетельствует об идентичности ближайшего окружения иона Eu3+. Максимальная интенсивность свечения наблюдается в образцах La0.95Eu0.05BO3 и La0.95Eu0.05(BO2)3, полученных за 2 ч отжига при температуре пиролиза 750 и 800°С соответственно.
ВВЕДЕНИЕ
Светоизлучающие материалы, особенно неорганические люминофоры, такие как фосфаты, вольфраматы, халькогениды, молибдаты, галогениды, бораты, силикаты, легированные трехвалентными ионами редкоземельных элементов (РЗЭ) Ln3+, привлекают большое внимание благодаря их использованию в качестве светодиодов белого света в осветительных системах нового поколения с низким энергопотреблением, в плоских дисплеях, солнечных элементах, медицине, оптоволокне, термолюминесцентных дозиметрах и флуоресцентных лампах [1–15]. Среди этих соединений легированные бораты разного состава – La3BO6, La(BO2)3 и LaBO3 – обладают высокой термической стабильностью и прозрачностью в ультрафиолетовом диапазоне и являются одними из высокоэффективных люминофоров, интерес к которым не ослабевает до настоящего времени [1, 3, 7–9, 11, 12, 15, 16]. Для создания многоцветных люминесцентных материалов в качестве активаторов используют ионы Eu3+, Tb3+, Sm3+, Dy3+ и Ce3+, имеющие высокую эффективность люминесценции, большой стоксов сдвиг и узкополосное излучение в видимой и ближней инфракрасной областях при возбуждении ультрафиолетовым светом [1, 7, 8, 11, 12, 15]. Интенсивность люминесценции можно повысить с помощью правильно выбранного иона-сенсибилизатора, который передает часть поглощенной энергии при возбуждении УФ-светом ионам-активаторам для дальнейшего свечения. При этом может наблюдаться люминесценция не только иона-активатора, но и иона-сенсибилизатора, что позволяет получить при одной длине волны возбуждающего света материал, излучающий белый свет [1, 3, 15]. В частности, в качестве люминофора для получения белого света используют иттрий-алюминиевый гранат, легированный церием YAG : Ce [16].
В последние годы продолжается динамичное развитие методов получения эффективных люминофоров, имеющих в качестве матрицы орто- или метабораты лантана [7, 9–12, 17]. Одним из первых и широко используемых в технологии получения боратов лантана, в том числе легированных другими РЗЭ, является метод твердофазного синтеза [1, 7, 11, 17]. Этот метод сводится по существу к одной схеме, которая заключается в тщательном предварительном измельчении и смешивании в стехиометрическом соотношении исходных оксида бора B2O3 или борной кислоты H3BO3 и оксида лантана La2O3 (при получении легированных боратов добавляют в необходимом количестве оксид другого металла), прокаливании при температуре 700–1100°С в течение 7–12 ч. Для получения материалов, удовлетворяющих предъявляемым к ним требованиям, например фазовой однородности, метод твердофазного синтеза модифицируют. При этом используют различные приемы: промежуточную гомогенизацию шихты, горячее прессование прекурсоров [10], предварительное нагревание подготовленной смеси при температуре ~500°С в течение 2–3 ч [7], механохимическую активацию смеси исходных оксидов и др. [11]. Недостатками твердофазного синтеза являются многостадийность, высокие температуры и длительное время прокаливания прекурсоров.
Использование альтернативных методов синтеза, таких как гидротермальный и золь-гель, дает возможность получать материалы высокой чистоты, а также в некоторых случаях осуществлять контроль морфологии и микроструктуры [6, 12, 15, 18]. Например, в гидротермальном методе [6] использовали водные растворы нитратов Eu(III), Tb(III) и оксида бора B2O3. После полного гомогенного перемешивания добавляли раствор аммиака до получения осадка и выдерживали в автоклаве из нержавеющей стали с тефлоновым покрытием при температуре 210°С в течение 12 ч. Конечный порошковый продукт промывали, сушили в печи при 80°С и прокаливали в муфельной печи 4 ч при 900°С. Золь-гель метод обеспечивает получение однородных люминофоров на основе боратов РЗЭ, в том числе легированных, обладающих высокой кристалличностью и малыми размерами частиц [12, 15, 18]. При реализации золь-гель метода используют процесс полимеризации гидроксикарбоновых кислот (лимонной или винной) с полигидроксильными спиртами (этиленгликолем). Процесс проводят в растворе, содержащем соли РЗЭ, которые включаются в структуру геля (смолы) при комплексообразовании с лимонной или винной кислотой. Полученный прекурсор подвергают нагреванию в течение 24 ч при температуре 80°С и последующему термическому разложению в интервале температур 800–1000°С на воздухе в течение 3–4 ч для получения наноразмерных порошков [18]. В некоторых случаях [15] процесс проводят только в присутствии комплексообразователя, например винной кислоты.
Для синтеза боратов РЗЭ используется также метод осаждения ацетоном из растворов хлоридов РЗЭ [19] или гидроксидом аммония из растворов нитратов [20] в присутствии NaBO2 и при нагревании при 650–900°С. Образующиеся неоднородные продукты многократно промывают деионизированной горячей водой для удаления исходных реагентов. Предложен метод сжигания [9], позволяющий получить высокочистый мелкодисперсный порошок бората лантана LaB3O6, использованный в дальнейшем для введения добавок Eu3+. Исходными компонентами служили нитрат лантана La(NO3)3 ∙ 6H2O, борная кислота H3BO3, нитрат аммония NH4NO3, окислителем – мочевина CO(NH2); их измельчали, смешивали в течение 1 ч на магнитной мешалке и помещали на 10 мин в муфельную печь для сжигания при 450°С и последующего отжига в течение 4 ч при 600–1000°С.
Каждый из перечисленных методов синтеза боратов РЗЭ имеет свои преимущества и недостатки. Метод твердофазного синтеза многоступенчатый, поэтому отличается большой длительностью, проводится при высоких температурах и требует размола конечных продуктов. Кроме того, часто не удается получить однофазные материалы, а это отрицательно сказывается на люминесцентных характеристиках боратов РЗЭ. Гидротермальный и золь-гель методы позволяют получать материалы при более низких температурах и с высокой фазовой однородностью. Однако и они не всегда позволяют синтезировать люминофоры с необходимыми люминесцентными свойствами. Именно используемый способ получения материала в значительной степени влияет на состав, структуру, размеры частиц и, как следствие, функциональные свойства, а также определяет технологичность процесса его получения. Поэтому разработка и модификация методов синтеза люминофоров на основе боратов РЗЭ остается востребованной.
В настоящей работе представлены результаты изучения возможности синтеза боратов лантана, в том числе легированных другими металлами, не используемым для этого ранее экстракционно-пиролитическим методом и исследования состава и люминесцентных свойств полученных люминофоров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза боратов лантана LaBO3 : Eu и La(BO2)3 : Eu применяли органические прекурсоры – насыщенные экстракты лантана и европия. Для получения насыщенных экстрактов в качестве водной фазы использовали нитратные растворы, содержащие 0.012 моль/л лантана и 6.6 × × 10–3 моль/л европия. Экстракцию РЗЭ проводили смешанными растворами 1.95 моль/л ацетилацетона и 0.0167 моль/л 1,10-фенантролина в бензоле. Необходимое для получения насыщенных органических фаз значение рН водной фазы, равное 7.0–7.5, создавали добавлением водного раствора аммиака. Значение рН водной фазы контролировали при помощи рН-метра Radelkis OP-211/1. Для получения насыщенного по бору экстракта использовали 0.45 М раствор триоктиламина в бензоле. Экстракцию проводили из водной фазы, содержащей 0.5 моль/л борной и 0.7 моль/л винной кислот. Органическую и водную фазы в соотношении 1 : 1 интенсивно перемешивали при комнатной температуре в течение 30 мин на механическом встряхивателе SK-30 (Корея). Состав водной и органической фаз контролировали атомно-абсорбционным и рентгенофлюоресцентным методами анализа. При синтезе соединений LaBO3 и La(BO2)3 мольное соотношение Lа : B в смешиваемых экстрактах составляло 1 : 1.2 и 1 : 4 соответственно. Для получения допированных боратов лантана в такой экстракт вводили добавки европия, тербия и висмута в различных соотношениях. Гомогенные насыщенные экстракты упаривали при 60–80°C до образования паст и подвергали пиролизу при различных температурах в муфельной печи в течение 2 ч.
Рентгенографический анализ образцов осуществляли на дифрактометре D8 Advance BrukerAXS (Германия) в СuKα-излучении с использованием программы поиска EVA с банком порошковых данных PDF-2. Спектры возбуждения люминесценции и люминесценции люминофоров регистрировали при 300 K на спектрофлуориметре Shimadzu RF-5301 PC. ИК-спектры образцов записывали при комнатной температуре на приборе Vertex 70 в области 4000–400 см–1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее нами показана перспективность использования экстракционно-пиролитического метода синтеза для функциональных материалов с модифицированными свойствами мультиферроиков на основе оксидов железа и европия, тербия и марганца; люминофоров на основе оксисульфидов, полифосфатов, полиниобатов и политанталатов РЗЭ [21–23]. При этом готовые продукты низкотемпературного пиролиза органических прекурсоров отличаются большей степенью однородности, и их получение становится менее энергозатратным за счет снижения длительности и температуры процесса по сравнению с известными методами, например твердофазного синтеза. Экстракционно-пиролитический метод позволяет с большой точностью вводить легирующие добавки в широком диапазоне соотношений элементов и, меняя температуру и время процесса пиролиза, влиять на состав, размеры частиц, структуру и свойства функционального материала [21–23]. Определенная комбинация редкоземельных ионов в составе люминофора может привести к модификации его люминесцентных характеристик [5].
Ортобораты редкоземельных элементов кристаллизуются в формах арагонита, ватерита и кальцита. Обнаружено, что тип кристаллической решетки зависит от отношения радиусов Ln3+ и О2– [19]. Ортобораты лантанидов с отношением радиусов Ln3+/О2– = 0.71 и выше кристаллизуются в структуре арагонита. К таким ортоборатам относится LaBO3. Кроме низкотемпературной ромбической фазы (фазы арагонита) для LaBO3 характерна высокотемпературная моноклинная фаза. Оказалось, что температурные фазовые последовательности при твердофазном синтезе из аморфных и микрокристаллических прекурсоров различны [24].
Экстракционно-пиролитическим методом получена ромбическая фаза LaBO3, кристаллические параметры которой полностью совпадают с параметрами ромбической кристаллической решетки ортобората LaBO3, синтезированного золь-гель методом, но при более высокой температуре 900оС [12]. По данным рентгенофазового анализа (РФА), первые признаки высокотемпературной моноклинной фазы фиксируются в образце в виде узких отражений после отжига при 450°С (рис. 1, кривая 1). При температуре отжига 550°С на дифрактограмме образца (рис. 1, кривая 2) появляются отражения высокотемпературной моноклинной (пр. гр. Рnam (62), а = 6.348, b = = 5.084, с = 4.186 Å, α = 90°, β = 107.89°, γ = 908°, Z = 2, Vэ.я. = 128.564 Å) и ромбической (пр. гр. Р21/m (11), а = 5.872, b = 8.257, с = 5.107 Å, α = 90°, β = = 908°, γ = 90°, Z = 4, Vэ.я. = 247.613 Å) модификаций. Полный переход в ромбическую фазу арагонита заканчивается при температуре 650°С (рис. 1, кривая 3). Кристаллическая структура LaBO3 [7, 11, 12] содержит многогранники LaO9 со средним расстоянием La–O, равным 2.593 Å, и тригональные [BO3]3–-группы со средним расстоянием B–O, равным 1.373 Å. Атомы лантана, координированные девятью атомами кислорода, расположены между тригональными [BO3]3–-группами. При этом все остальные атомы (один атом La, один атом B и второй атом O), за исключением одного атома кислорода, лежат в зеркальных плоскостях. Фаза арагонита сохраняется до максимально достижимой в эксперименте температуры отжига, равной 1100°С. При дальнейшем нагревании, согласно литературным данным, до температуры 1480°С должен произойти переход арагонита в моноклинную высокотемпературную фазу [25].
Рис. 1.
Дифрактограммы соединений, полученных при разных температурах отжига прекурсоров: 1 – прекурсор, 450°С; 2 – ромбическая и моноклинная (*) фазы LaBO3, 550°С; 3 – ромбическая фаза LaBO3, 650°С; 4 – ромбическая фаза La0.95Eu0.05BO3, 7508С; 5 – моноклинная фаза α-La(BO2)3, 800°С; 6 – моноклинная фаза α-La0.95Eu0.05(BO2)3, 800°С.
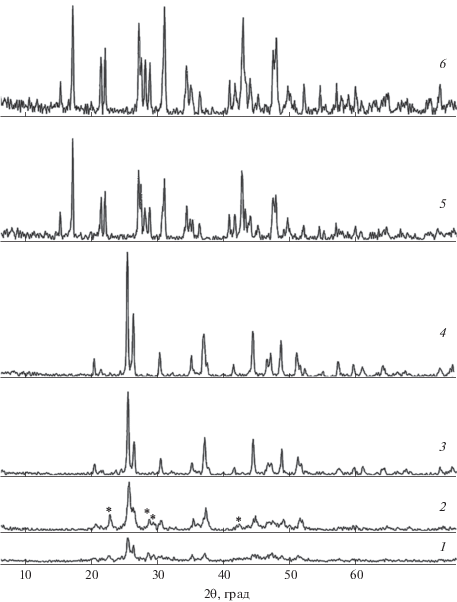
Для ортобората лантана, синтезированного предлагаемым экстракционно-пиролитическим методом, наблюдается такая же последовательность перехода структурных фаз, как в методе твердофазного синтеза из микрокристаллического порошка [25]: “ромбическая фаза арагонита + + высокотемпературная моноклинная фаза → → ромбическая фаза арагонита”. При этом температура перехода в фазу арагонита снижается по сравнению с твердофазным синтезом с 800–1000 до 650–750°С [7, 11, 17, 18]. Такое понижение температуры синтеза объясняется, по-видимому, тем, что в экстракционно-пиролитическом методе прекурсор содержит органические компоненты, оставшиеся после упаривания органической фазы при температуре 50–60°С. Подобный эффект понижения температуры отжига при получении ортоборатов РЗЭ методом твердофазного синтеза описан в работах [14, 18, 24], где в прекурсоры вводили диметилформамид [14], этиленгликоль и лимонную кислоту [19], глицин, мочевину и лимонную кислоту [24], которые выполняли роль топлива, ускоряющего реакцию.
При синтезе метабората La(BO2)3 экстракционно-пиролитическим методом мольное соотношение Lа : B в смешиваемых экстрактах составляло 1 : 4. Для метаборатов редкоземельных металлов(III) в зависимости от размера катионов Ln3+ и условий синтеза могут быть выделены три модификации: α-, β- и γ-Ln(BO2)3 [26]. Отжиг прекурсора в течение 2 ч при температуре 700°С приводит к появлению на дифрактограмме на фоне широких рефлексов отражений моноклинной фазы La(BO2)3. Полный переход в кристаллическую моноклинную модификацию α-La(BO2)3 [10] (пр. гр. C2/c (15), а = 7.956, b = 8.161, с = 6.499 Å, α = = 90°, β = 93.63°, γ = 908°, Z = 4) заканчивается при температуре 800°С (рис. 1, кривая 5). Кристаллическая структура α-La(BO2)3 [10] построена из чередующейся последовательности тетраэдрических групп [BO4]5–, имеющих четыре общих угла с монодентатными тригональными группами [BO3]3–. Данные последовательности можно рассматривать как цепочки анионов [B3O6]3−, выстроенные вдоль оси c. Между цепями в окружении десяти атомов кислорода расположены катионы Lа3+, образуя искаженные четырехугольные антипризмы.
Дифрактограммы ортоборатов La1 –хEuхBO3 (х = 0.025, 0.05, 0.075, 0.10) идентичны дифрактограмме ромбической модификации LaBO3. При этом сохраняется и характерная для ортобората LaBO3 температурная последовательность смены фаз: при 550°С образуются ромбическая фаза арагонита и высокотемпературная моноклинная фаза, а при 750°С наблюдается полный переход в фазу арагонита (рис. 1, кривая 4). Несмотря на то, что ион La3+ в структуре арагонита LaBO3 координирован девятью ионами кислорода [7, 11, 12], а EuBO3 кристаллизуется в структуре ватерита и ион Eu3+ координирован восемью ионами кислорода [3, 6, 9, 18], структура арагонита при введении указанного иона остается неизменной. Никаких примесных пиков на дифрактограммах не наблюдается, это свидетельствует о том, что ион-активатор, имея близкий ионный радиус, не влияет на кристаллическую структуру образца и замещает ион La3+ в решетке LaBO3. Однако при увеличении в образцах содержания иона-активатора (10 мол. % и более) на дифрактограммах появляются дополнительные линии примесной фазы, которая может быть характерной для EuBO3 фазой ватерита [6, 9, 18].
При введении в метаборат La(BO2)3 добавок Eu3+ моноклинная модификация α-La(BO2)3 сохраняется. Образование моноклинной кристаллической фазы α-типа в соединениях La(BO2)3 с ионом-активатором Eu3+ начинается при температуре 700°С, а заканчивается при 800°С, как и для метабората α-La(BO2)3 (рис. 1, кривая 6).
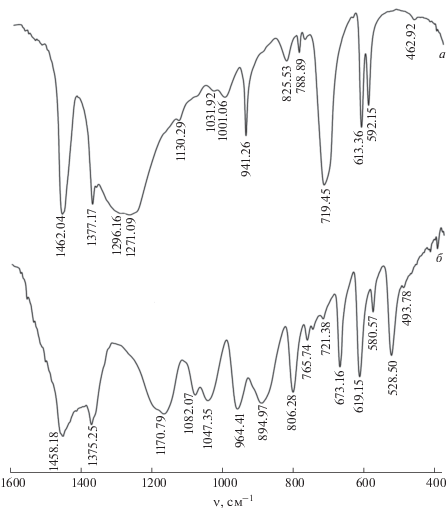
Результаты изучения ИК-спектров (табл. 1) ортоборатов и метаборатов редкоземельных элементов, полученных экстракционно-пиролитическим методом, согласуются с соответствующими данными рентгенофазового анализа. На рис. 2 для примера приведены ИК-спектры соединений La0.95Eu0.05BO3 и α-La0.95Eu0.05(BO2)3. В ИК-спектрах ромбической фазы арагонита LaBO3 и LaBO3 с ионом-активатором Eu3+ проявляются интенсивные полосы поглощения, характерные для колебаний планарных тригональных [BO3]3–-групп при 1400–550 см−1 [18, 23, 24, 26]. В области 1250–1400 см−1 проявляются интенсивные широкие полосы асимметричных (ν3) и деформационных (δ) колебаний связей B–O в [BO3]3–-группах. Две слабые полосы поглощения при ~592 и ~613 см−1 обусловлены внутриплоскостными (ν4), а интенсивная полоса при ~719 см−1 – внеплоскостными (ν2) деформационными колебаниями связей В–О. Полоса при ~941 см−1 (ν1) относится к симметричным колебаниям связей В–О в [BO3]3–-группах. При концентрации иона-активатора Eu3+ ≥ ≥ 10 мол. % в ИК-спектре допированного ромбического LaBO3 появляются слабые полосы в области 1130–950 и 850–770 см–1. Появление в ИК-спектрах ромбического LaBO3 новых полос свидетельствует о перестройке кристаллической структуры образца. Вероятно, при больших концентрациях иона Eu3+ помимо заместительного происходит интерстициальное легирование арагонита LaBO3 с появлением характерной для EuBO3 и TbBO3 фазы ватерита [3, 6, 19, 27], что подтверждается и данными РФА образцов.
Таблица 1.
Важнейшие колебательные частоты в ИК-спектрах ортоборатов и метаборатов лантана, см–1
| LaBO3 La1 – хEuхBO3 |
La(BO2)3 La1 – хEuх(BO2)3 |
Отнесение |
|---|---|---|
| 1462 | 1458 | |
| 1377 | 1375 | ν3 as(В–O) + δ(B–O) B${\text{O}}_{3}^{ - }$ |
| 1296 | 1209 | |
| 1271 | 1171 | |
| 1082 | ν1 s(В–О) B${\text{O}}_{4}^{ - }$ | |
| 1047 | ||
| 941 | 964 | ν1 s(B–O) B${\text{O}}_{3}^{ - }$ |
| 894 | + ν2(В–О) B${\text{O}}_{4}^{ - }$ | |
| 719 | 806 | ν2(В–O) B${\text{O}}_{3}^{ - }$ |
| 673 | ν3 as(В–О) B${\text{O}}_{4}^{ - }$ | |
| 613 | 619 | + ν4(B–O) B${\text{O}}_{3}^{ - }$ |
| 592 | ||
| 581 | + ν1 s(B–O) B${\text{O}}_{3}^{ - }$ | |
| 528 | ||
| 494 | + ν4(В–О) B${\text{O}}_{4}^{ - }$ | |
| 462 |
В ИК-спектре α-La(BO2)3, в том числе с добавками иона-активатора Eu3+, появляются полосы поглощения колебаний тетраэдрических [BO4]5–- и тригональных [BO3]3–-групп (табл. 1, рис. 2), из которых построена кристаллическая структура моноклинной фазы метабората. Полосы поглощения при 1400–1150 (ν3), ~806 (ν2) и ~580 см−1 (ν1) характерны для колебаний связей В–О тригональных [BO3]3–-групп. Две широкие интенсивные полосы поглощения при ~964 и ~895 см−1 обусловлены как симметричными колебаниями В–О (ν1) тригональных [BO3]3-групп, так и деформационными колебаниями В–О (ν2) тетраэдрических [BO4]5–-групп [10, 19, 26, 28]. В области 1085–1045 см−1 присутствуют полосы поглощения симметричных колебаний В–О (ν1) тетраэдрических [BO4]5–-групп. К колебаниям, характерным для тетраэдрических [BO4]5–-групп, относятся асимметричные колебания (ν3) в области 675–610 см−1 и деформационные колебания (ν4) в области 580–500 см−1 [10, 19].
Люминесцентные характеристики полученных образцов ортоборатов La1 – х EuхBO3 и метаборатов La1 –хEuх(BO2)3 оценивали по спектрам возбуждения люминесценции и люминесценции при 300 K, которые регистрировали в идентичных условиях.
Спектры возбуждения люминесценции (λem = = 615 нм) полученных ортоборатов La1 –хEuхBO3 и метаборатов La1 –хEuх(BO2)3 схожи между собой. На рис. 3 для примера приведены спектры возбуждения люминесценции ортобората La1 –хEuхBO3 при различном содержании Eu3+ (рис. 3а) и метабората La0.95Eu0.05(BO2)3 и разной температуре отжига прекурсоров (рис. 3б). В коротковолновой области спектра возбуждения люминесценции соединений наблюдается широкая интенсивная полоса переноса заряда при λmax ≈ 270 нм в спектре как ортоборатов La1 –хEuхBO3, так и метаборатов La1 –хEuх(BO2)3, указывающая на наличие канала передачи энергии возбуждения на ион европия О2– → Eu3+ [18, 27, 29]. В длинноволновой области спектра в интервале длин волн 310–420 нм присутствуют узкие полосы, относящиеся к f−f-переходам электронов иона Eu3+ с основного состояния 7F0 на возбужденные уровни 5D4, 5L6, 5G4,5 [29]. При изменении концентрации иона Eu3+ в соединениях La1 –хEuхBO3 и La1 – хEuх(BO2)3 и температуры отжига прекурсора значительно изменяется интенсивность полосы переноса заряда в спектрах (рис. 3). В спектре возбуждения люминесценции образцов состава La0.95Eu0.05BO3 и La0.95Eu0.05(BO2)3 полоса переноса заряда имеет значительно большую интенсивность, чем в спектрах соединений с другим содержанием допирующего иона Eu3+. Интенсивность полосы переноса заряда в спектрах ортоборатов разного состава La1 –хEuхBO3 достигает максимума при температуре отжига прекурсоров 750°С. При этом соотношение интенсивностей полосы при ~270 нм в коротковолновой части спектра к полосе при λ ~ 385 нм в длинноволновой части спектра возбуждения люминесценции La1 –хEuхBO3 с одинаковой концентрацией иона Eu3+ при температуре отжига 850°С составляет 1 : 3, при 650°С – 1 : 5, при 750°С – 1 : 7. В спектрах возбуждения люминесценции метаборатов разного состава Laх ‒ 1Euх(BO2)3 интенсивности полос переноса заряда при температуре отжига 800 и 900°С примерно одинаковы, но при этом значительно больше интенсивности этой полосы в спектре соединения, полученного при 550°С.
Рис. 3.
Спектры возбуждения люминесценции: а – образцов La1 –хEuхBO3, х: 1 – 0.025, 2 – 0.05, 3 – 0.075, полученных при 750°С; б – образцов La0.95Eu0.05(BO2)3, полученных при различных температурах: 1 – 700; 2 – 800; 3 – 900°С; λem = = 615 нм, 300 K.
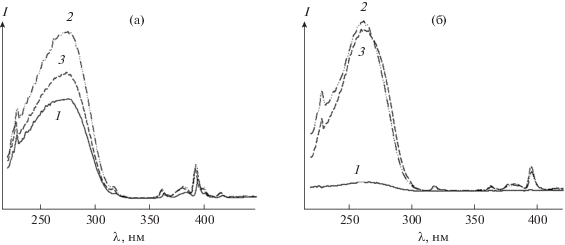
Сопоставление спектров возбуждения люминесценции (λem = 615 нм) образцов La1 –хEuхBO3 и La1 –хEuх(BO2)3, содержащих одинаковое количество иона-активатора, показывает, что положение полос резонансных линий в спектрах этих соединений совпадает (рис. 3). В то же время в спектрах соединений при изменении концентрации иона Eu3+ наблюдается небольшое смещение полосы переноса заряда λmax ~ 270 нм в сторону больших длин волн (рис. 3а). Широкая интенсивная полоса переноса заряда λmax ~ 270 нм появляется в спектре в результате электронного перехода между 2p-орбиталью O2– и 4f-орбиталью Eu3+, энергия которого зависит от устойчивости полей окружающих ионов O2− [18, 29]. Наблюдаемое наибольшее смещение полосы переноса заряда в спектре образцов состава La0.95Eu0.05BO3 и La0.95Eu0.05(BO2)3 свидетельствует о том, что ионы O2– становятся менее стабильными, и для отрыва электронов требуется меньшая энергия. Такое, по-видимому, возможно, если при замещении La3+ на Eu3+ в соединениях LaBO3 или La(BO2)3 происходит некоторое искажение их структуры [3, 18]. К смещению полосы переноса заряда в сторону бóльших длин волн может приводить также уменьшение расстояния между ионами Eu3+–O2– и, как следствие, уменьшение разницы между электроотрицательностью данных ионов [3, 18, 29, 30].
Выбор длины волны возбуждения люминесценции λеx = 270 нм осуществляли по наиболее интенсивной линии после регистрации спектров возбуждения люминесценции соединений. Спектры люминесценции образцов ортоборатов La1 –хEuхBO3 и метаборатов La1 –хEuх(BO2)3 регистрируются в области 550–750 нм и состоят из серии полос, соответствующих переходам между мультиплетами 5D0–7Fj (j = 0, 1, 2, 3, 4) и характерных для иона Eu3+ [18, 29, 30] (рис. 4).
Рис. 4.
Спектры люминесценции: а – La1 –хEuхBO3 и б – La1 –хEuх(BO2)3, полученных при температурах 750 (а) и 800°С (б), х: 1 – 0.025, 2 – 0.05, 3 – 0.075; λex = 270 нм; 300 K.
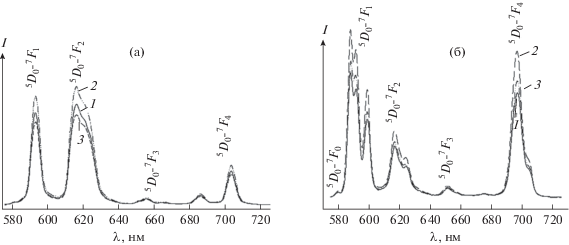
В спектре иона Eu3+ в соединениях с неорганическими и органическими лигандами в результате снятия (2J + 1)-кратного вырождения проявляется определенное число полос переходов, зависящее от параметров кристаллического поля [29]. Единичная линия 5D0 –7F0 перехода в спектрах La1 – хEuх(BO2)3, а также наличие не более трех компонент 5D0–7F1 перехода в спектрах люминесценции каждого из образцов соединений ряда La1 –хEuхBO3 (одна полоса при 593 нм, рис. 4а) или ряда La1 –хEuх(BO2)3 (три полосы при 588, 592 и 599 нм, рис. 4б) указывают на однородность центра люминесценции в каждом из этих рядов соединений. Это свидетельствует об идентичности ближайшего окружения иона Eu3+ в ортоборатах La1 –хEuхBO3, а также в ряду метаборатов La1 –хEuх(BO2)3 при увеличении концентрации иона-активатора Eu3+, т.е. об индивидуальности полученных соединений, и соответствует данным РФА. Наибольшую интенсивность люминесценции, определенную путем интегрирования площади под полосами переходов 5D0–7Fj (j = 0, 1, 2, 3, 4) в спектрах образцов, показывают бораты лантана, содержащие 5 мол. % Eu3+ (рис. 5а). Дальнейшее увеличение концентрации Eu3+ приводит к снижению интенсивности люминесценции, что можно объяснить безызлучательным переносом энергии между ионами Eu3+ – концентрационным тушением [9, 18, 29].
Рис. 5.
Зависимость интенсивности люминесценции соединений: а – от концентрации иона Eu3+: 1 – La1 –хEuхBO3, 2 – La1 –хEuх(BO2)3; б – от температуры отжига прекурсоров: 1 – La0.95Eu0.05BO3, 2 – La0.95Eu0.05(BO2)3; λex = 270 нм; 300 K.
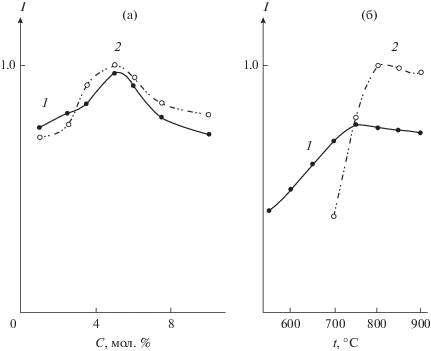
Спектры люминесценции La1 –хEuхBO3 (рис. 4а) значительно отличаются от спектров La1 –хEuх(BO2)3 (рис. 4б), что и должно наблюдаться при изменении кристаллической структуры [3, 29]. В спектрах наблюдаются изменения в перераспределении интенсивности по характерным для иона Eu3+5D0–7Fj переходам, некоторое смещение положения полос этих переходов, а также различия в тонкой структуре расщепления полос 5D0–7F1 и 5D0–7F2 переходов. В отличие от La1 –хEuхBO3, в спектрах образцов La1 –хEuх(BO2)3 имеется слабая полоса 5D0–7F0 перехода (λ = 579 нм). Основная доля энергии излучения иона Eu3+ в спектрах люминесценции ортоборатов La1 – хEuхBO3 приходится на 5D0–7F1 и 5D0–7F2 переходы. При этом доминирующими являются полосы, соответствующие электродипольному 5D0–7F2 переходу (λ = 618 нм) (рис. 4а), а полоса магнитно-дипольного 5D0–7F1 перехода (λ = 593 нм) в спектре имеет чуть меньшую интенсивность, в то время как в спектрах люминесценции La1 ‒ хEuх(BO2)3 (рис. 4б) основная доля энергии излучения иона Eu3+ приходится на 5D0–7F1 и 5D0–7F4 переходы. При этом наибольшую интенсивность имеет полоса, соответствующая магнитно-дипольному 5D0 – 7F1 переходу (λ ~ 588 нм), интенсивность полосы 5D0–7F4 перехода немного меньше. Отношение интенсивностей полос 5D0–7F1 и 5D0–7F2 переходов позволяет оценить степень искажения локального окружения ионов Eu3+. В случае высокой центросимметричности окружения иона Eu3+ полоса магнитно-дипольного 5D0–7F1 перехода в спектре люминесценции является более интенсивной, а при низкой симметрии наибольшая интенсивность приходится на полосу электродипольного 5D0–7F2 перехода [9, 29].
Следует отметить, что для каждого из образцов ряда арагонита La1 –хEuхBO3 или ряда моноклинной модификации α-La1 –хEuх(BO2)3 в интервале температур пиролиза от 650 до 900°С фазовый состав, по данным порошковой рентгенографии, остается неизменным. Постепенное повышение температуры пиролиза приводит к постепенному росту интенсивности люминесценции боратов (рис. 5б) как в ряду La1 –хEuхBO3, так и в ряду La1 – хEuх(BO2)3, что связано, согласно данным [18, 31], с увеличением кристалличности образцов. Для синтеза люминофоров ортоборатов La1 – хEuхBO3 и метаборатов La1 –хEuх(BO2)3 экстракционно-пиролитическим методом оптимальными температурами можно считать 750 и 800°С соответственно.
ЗАКЛЮЧЕНИЕ
Показана возможность получения экстракционно-пиролитическим методом при низкотемпературном пиролизе прекурсоров ромбической модификации арагонита LaBO3 и моноклинной модификации метабората α-La(BO2)3. Синтезированы La1 –хEuхBO3 и La1 –хEuх(BO2)3 разного состава (х = 0.025, 0.05, 0.075, 0.10).
Для LaBO3 наблюдается последовательность перехода структурных фаз ромбическая фаза арагонита + высокотемпературная моноклинная фаза → ромбическая фаза арагонита. При этом температура перехода в фазу арагонита снижается по сравнению с твердофазным синтезом с 800–1000 до 650–750°С. Для α-La(BO2)3 полный переход в кристаллическую моноклинную фазу в экстракционно-пиролитическом методе также заканчивается при более низкой температуре (800°С) по сравнению с твердофазным синтезом. В ИК-спектрах ромбической фазы арагонита проявляются полосы поглощения колебаний тригональных групп [BO3]3–, а в ИК-спектрах моноклинной фазы метабората присутствуют дополнительные полосы поглощения колебаний тетраэдрических групп [BO4]5–.
Ортобораты La1 –хEuхBO3 и метабораты La1 – хEuх(BO2)3 обладают люминесценцией красного цвета в области 550–700 нм с λmax ~618 и ~593 нм соответственно. Характер спектров люминесценции в рядах ортоборатов La1 –хEuхBO3 или метаборатов La1 – хEuх(BO2)3 при увеличении концентрации иона Eu3+ не меняется. В спектрах люминесценции La1 –хEuхBO3 наибольшая доля энергии излучения приходится на электродипольный 5Dо–7F2 переход, а в спектрах La1 –хEuх(BO2)3 – на магнитно-дипольный 5Dо–7F1 переход. Максимальная интенсивность свечения наблюдается в образцах La1 –хEuхBO3 и La1 –хEuх(BO2)3 (при концентрации иона Eu3+ 5 мол. %), полученных за 2 ч отжига при температуре пиролиза 750 и 800°С соответственно. Экстракционно-пиролитический метод с учетом параметров синтеза и допирования является эффективным для получения как ортоборатов, так и метаборатов лантана, активированных другими металлами.
Список литературы
Beihoucif R., Velazquez M., Platevin O. et al. // Opt. Mater. 2017. V. 73. P. 658. https://doi.org/10.1016/j.optmat.2017.09.026
O'Connell K., Hanson M., O’Shea H. et al. // J. Non-Cryst. Solids. 2015. № 430. P. 1.
Шмурак С.З., Кедров В.В., Киселев А.П. и др. // Физика твердого тела. 2015. Т. 57. № 8. С. 1558. [Shmurak S.Z., Kedrov V.V., Kiselev A.P. et al. // Phys. Solid State. 2015. V. 57. № 8. P. 1588. https://doi.org/10.1134/S1063783415080326]
Jia Z., Xia Y., Shao X. et al. // Ind. Lubr. Tribol. 2014. V. 66. P. 1.
Фёдоров П.П. // Журн. структур. химии. 2019. Т. 60. № 5. С. 713. [Fedorov P.P. // J. Struct. Chem. 2019. V. 60. № 5. Р. 679. https://doi.org/10.1134/S0022476619050019]https://doi.org/10.26902/JSC_id40256
Sohn Y. // Ceram. Int. 2014. V. 40. P. 2467.
Wei H.W., Shao L.M., Jiao H. et al. // Opt. Mater. 2018. V. 75. P. 442. https://doi.org/10.1016/j.optmat.2017.10.011
Pytalev D.S., Cauran D., Majérus O. et al. // J. Alloys Compd. 2015. V. 641. P. 43. https://doi.org/10.1016/j.jallcom.2015.03.244
Halefoglu Y.Z. // Appl. Radiat. Isot. 2019. V. 148. № 1. P. 40. https://doi.org/10.1016/j.apradiso.2019.03.011
Sari S., Senberber F.T., Yildirim M. et al. // Mater. Chem. Phys. 2017. V. 200. P. 196. https://doi.org/10.1016/j.matchemphys.2017.07.056
Nayar R.,Tamboli S., Sahu A.K. et al. // J. Fluoresc. 2017. V. 27. P. 251. https://doi.org/10.1007/s10895-016-1952-7
Omanwar S.K., Sawala. N.S. // Appl. Phys. A. 2017. P. 123. https://doi.org/10.1007/s00339-017-1268-8
Chen X., Wang F., Zhang W. // J. Mater. Sci. Mater. Electron. 2019. V. 30. P. 3098. https://doi.org/10.1007/s10854-018-00589-y
Liu R., Xu H., Chen X. et al. // Opt. Mater. 2018. V. 86. P. 360.
Kruopyte A., Kruopyte A., Giraitis R. et al. // J. Lumin. 2017. V. 192. P. 520.
Xu Y.W., Chen J., Zhang H. et al. // J. Mater. Chem. 2020. V. 8. № 1. P. 247. https://doi.org/10.1039/c9tc05311e
Fuchs B., Huppertz H. // Z. Naturforsch. B: Chem. Sci. 2019. V. 74. № 9. P. 685.
Szczeszak A., Kubasiewicz K., Lis S. // Opt. Mater. 2013. V. 35. № 6. P. 1297. https://doi.org/10.1016/j.optmat.2013.02.001
Velchuri R., Kumar B.V., Devi V.R. et al. // Mater. Res. Bull. 2011. V. 46. P. 1219. https://doi.org/10.1016/j.materresbull.2011.04.006
Ткаченко Е.А., Федоров П.П., Кузнецов С.В. и др. // Журн. неорган. химии. 2005. Т. 50. № 5. С. 754.
Стеблевская Н.И., Белобелецкая М.В., Устинов А.Ю. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 146. [Steblevskaya N.I., Belobeletskaya M.V., Ustinov A.Yu. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 179. https://doi.org/10.1134/S0036023619020219]https://doi.org/10.1134/S0044457X19020211
Холькин А.И., Патрушева Т.Н. // Химическая технология. 2015. Т. 16. № 10. С. 576. [Khol’kin A.I., Patrusheva T.N. // Theor. Found. Chem. Eng. 2016. V. 50. № 5. P. 785.]
Стеблевская Н.И., Медков М.А., Белобелецкая М.В. Пат. RU № 2651028. Опубл. 18.04.2018 // Бюл. изобр. 2017. № 11.
Badan C., Esenturk O., Yilmaz A. // Solid State Sci. 2012. V. 14. № 11–12. P. 1710. https://doi.org/10.1016/j.solidstatesciences.2012.07.026
Шмытько И.М., Кирякин И.Н., Струкова Г.К. // Физика твердого тела. 2013. Т. 55. № 7. С. 1369. [Shmyt’ko I.M., Kiryakin I.N., Strukova G.K. // Physics of the Solid State. 2013. V. 55. № 7. P. 1468. https://doi.org/10.1134/S1063783413070305]
Heymann G., Soltner T., Huppertz H. // Solid State Sci. 2006. V. 8. № 7. P. 827. https://doi.org/10.1016/j.solidstatesciences.2006.03.002
Abaci O.G.H., Metc E., Esenturk O. et al. // Opt. Mater. 2019. V. 98. P. 1. https://doi.org/10.1016/j.optmat.2019.109487
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds: Part A – Theory and Applications in Inorganic Chemistry. N.Y.: John Wiley and Sons, 2009.
Blasse G., Grabmaier B.C. Luminescent materials. Berlin-Heidelberg: Springer-Verlag., 1994. 233 p.
Zhang J., Yang M., Jin H. et al. // Mater. Res. Bull. 2012. V. 47. № 2. P. 247.
Стеблевская Н.И., Медков М.А., Белобелецкая М.В. // Журн. неорган. химии. 2015. Т. 60. № 2. С. 214. [Steblevskaya N.I., Medkov M.A., Belobeletskaya M.V. // Russ. J. Inorg. Chem. 2015. V. 60. P. 214.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии