Журнал неорганической химии, 2021, T. 66, № 4, стр. 450-455
Получение нанопорошка La0.6Sr0.4Co0.2Fe0.8O3–δ с помощью гликоль-цитратного метода
Т. Л. Симоненко a, *, Н. П. Симоненко a, Е. П. Симоненко a, В. Г. Севастьянов a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: egorova.offver@gmail.com
Поступила в редакцию 20.11.2020
После доработки 27.11.2020
Принята к публикации 30.11.2020
Аннотация
В ходе исследования изучен процесс синтеза нанодисперсного оксида состава La0.6Sr0.4Co0.2Fe0.8O3 – δ с использованием гликоль-цитратного метода. Полученный нанопорошок изучен с помощью комплекса современных физико-химических методов анализа. С использованием синхронного ТГА/ДСК анализа исследовано термическое поведение полученного порошка в токе воздуха в интервале температур 20–1000°С и определены оптимальные условия его термической обработки, приводящей к образованию однофазного нанокристаллического оксида. С помощью рентгенофазового и рентгеноспектрального элементного анализов, а также ИК-спектроскопии показано, что предложенный метод синтеза является удобным и эффективным для получения высокодисперсного порошка указанного состава с целевой кристаллической структурой. С помощью растровой электронной микроскопии изучена морфология оксидного нанопорошка и определен средний размер частиц и пор.
ВВЕДЕНИЕ
По оценкам различных международных информационных агентств, уже к 2048 г. уровень общемирового энергопотребления возрастет на 50% по сравнению с уровнем 2012 г., что при инерционном развитии энергетического сектора и использовании традиционных источников энергии в качестве основных может повлечь за собой негативные экологические последствия в связи с растущими объемами выбросов, загрязняющих атмосферу и окружающую среду в целом [1, 2]. В связи с этим многие развитые страны ведут активную политику по поиску и интеграции экологически чистых возобновляемых источников энергии в существующую систему энергоснабжения [3, 4]. На сегодняшний день значительное внимание привлекают технологии электрохимической энергетики, в частности, электрохимические генераторы электроэнергии – твердооксидные топливные элементы (ТОТЭ) [5, 6]. Этот тип устройств позволяет напрямую преобразовывать химическую энергию окислительно-восстановительной реакции (между топливом и окислителем, как правило, воздухом) в электрическую с высоким КПД (до 80% с использованием технологии когенерации), использовать в качестве топлива не только водород, но и различные углеводороды (в частности, метан, пропан, природный газ) и биотопливо, а также существенно минимизировать выбросы углекислого газа в атмосферу [7]. Одной из ключевых задач при разработке современных энергоэффективных ТОТЭ является снижение их рабочих температур при создании среднетемпературных топливных ячеек, что позволит, в свою очередь, существенно расширить круг применяемых конструкционных материалов, снизить стоимость, а также повысить надежность и срок службы устройства в целом [8–10]. Решение поставленной задачи требует поиска и разработки новых электролитных и электродных материалов, не уступающих по своим рабочим характеристикам традиционно используемым компонентам, при формировании высокотемпературных ТОТЭ [11–15]. Так, перспективными кандидатами на роль катода среднетемпературных твердооксидных топливных элементов являются оксиды со структурой перовскита на основе кобальтита лантана, допированные стронцием и железом (La1 – xSrxCoyFe1 –yO3 – δ, LSCF) [16–21]. Данные материалы характеризуются высокими значениями электропроводности (350–400 См/см для состава La0.6Sr0.4Co0.2Fe0.8O3 – δ) и смешанной электронно-ионной проводимостью (1 × 10–2 и 102 См/см при 800°С соответственно) наряду с высокой каталитической активностью в реакциях восстановления кислорода. Кроме того, такие твердые растворы по своим химическим и механическим характеристикам хорошо сочетаются со среднетемпературными электролитами на основе диоксида церия, допированного редкоземельными элементами. Так, ЛКТР для электролитов в системе CeO2–Gd2O3 составляет (11.5–11.9) × 10–6 K–1, для катодов на основе LSCF – (14–15.29) × 10–6 K–1 [22–27]. Как известно, итоговые функциональные характеристики материалов определяются как их дисперсностью, так и микроструктурой. При этом удобными и масштабируемыми методами синтеза, позволяющими получать однофазные нанокристаллические материалы на основе La1 – xSrxCoyFe1 – yO3 – δ, являются методы сжигания: цитрат-нитратный [28–30], глицин-нитратный [31–33], а также гликоль-цитратный методы [34–37]. Однако получение подобных твердых растворов этими методами требует высокотемпературной обработки (как правило, выше 700°С) в связи с необходимостью разложения органических компонентов в реакционной системе и удаления остаточного углерода. В свою очередь, это приводит к значительному снижению дисперсности и пористости, которые являются важными параметрами для катодных материалов. Тем не менее, варьируя соотношения между исходными реагентами (неорганическими солями) и органическими компонентами (лимонной кислотой, этиленгликолем), а также нитратом аммония, можно влиять на полноту протекания окислительно-восстановительной реакции формирования целевого продукта, снижая температуру последующей термообработки, что позволяет сохранить высокую дисперсность получаемых материалов [38].
Таким образом, целью данной работы являлось изучение процесса гликоль-цитратного синтеза нанопорошка состава La0.6Sr0.4Co0.2Fe0.8O3 – δ, а также исследование его термического поведения и микроструктурных особенностей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Нанопорошок состава La0.6Sr0.4Со0.2Fe0.8O3 был получен гликоль-цитратным методом. В качестве исходных реагентов использовали нитраты бария, кобальта, стронция и хлорид железа, навески которых растворяли в минимальном количестве дистиллированной воды. С целью предотвращения загрязнения целевого оксида ионами хлора непосредственно перед началом синтеза проводили кипячение растворов солей в присутствии азотной кислоты с целью замещения ионов хлора на нитрат-ионы. Далее к полученной реакционной смеси добавляли моногидрат лимонной кислоты, нитрат аммония и этиленгликоль в мольном соотношении к целевому продукту 3 : 1, 6 : 1 и 2 : 1 соответственно. Полученную смесь упаривали при 250°С до образования вязкой системы, которая при дальнейшем нагревании самовоспламенялась с образованием целевого вспененного оксидного нанопорошка (рис. 1).
Термическое поведение полученного нанопорошка было изучено с помощью синхронного (ТГА/ДСК) термического анализа, проведенного с использованием термоанализатора SDT Q-600. Контролируемый нагрев производили в Al2O3-микротиглях в интервале температур 20–1000°С со скоростью 10 град/мин в токе воздуха 250 мл/мин.
ИК-спектры пропускания исследуемого образца записывали с помощью ИК-Фурье-спектрометра ИнфраЛЮМ ФТ-08. Готовили суспензию порошка в вазелиновом масле и помещали в виде пленки между стеклами KBr. Спектральный анализ проводили в диапазоне волновых чисел 350–4000 см–1 (время накопления сигнала составляло 15 с, разрешение – 1 см–1).
Рентгенофазовый анализ (РФА) порошка выполняли на дифрактометре Bruker D8 Advance (излучение CuKα, диапазон углов 2θ 20°–80°, разрешение 0.02°, время накопления сигнала в точке 0.3 с).
Микроструктуру и элементный состав полученного порошка изучали с помощью растровой электронной микроскопии (РЭМ) на трехлучевой рабочей станции NVision 40 (Carl Zeiss), оснащенной энергодисперсионным микрозондовым анализатором Oxford Instruments X-MAX 80.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
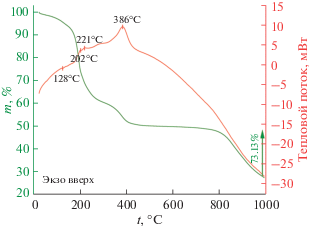
Термическое поведение порошка, полученного в результате гликоль-цитратного синтеза, было исследовано с помощью синхронного термического анализа в потоке воздуха. При нагревании порошка до 1000°С на термограмме (рис. 2) наблюдается шесть ступеней потери массы (Δm = = 73.11%), первые две из которых (2.32 и 5.20%) находятся в интервале температур 20–175°С и сопровождаются малоинтенсивным эндотермическим эффектом с минимумом при 128°С, что связано с удалением сорбированных атмосферных газов и воды. На следующем этапе (175–300°С) имеет место наибольшая ступень потери массы (32.13%), которой соответствуют два экзоэффекта с максимумами при 202 и 221°С, связанные с окислением органических компонентов, входящих в состав реакционной системы. Далее в диапазоне температур 300–500°С наблюдается интенсивный экзоэффект (Δm = 10.55%), обусловленный окислением остаточного углерода, образовавшегося ходе реакции окисления на предыдущем этапе. В ходе дальнейшего нагрева в интервалах температур 500–765 и 765–1000°С наблюдаются две ступени потери массы (1.73 и 21.20% соответственно). С целью окисления остаточных органических компонентов реакционной системы и формирования оксидного нанопорошка заданного состава были выбраны условия дальнейшей термообработки: нагрев до 500°С с изотермической выдержкой в течение 1 ч.
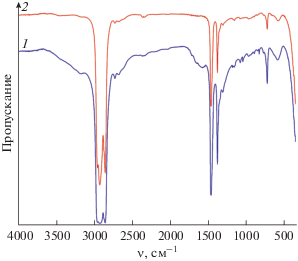
Порошки, полученные после синтеза, а также после дополнительной термической обработки (500°С, 1 ч), были исследованы с помощью ИК-Фурье-спектроскопии (рис. 3). Видно, что в спектре полученного после синтеза порошка присутствуют полосы поглощения в интервале 3100–3700 см–1, соответствующие валентным колебаниям ОН-групп. В интервале 1750–1530 см–1 также наблюдаются полосы поглощения, характерные для валентных колебаний С–О-, С=О- и ОН-групп [39]. Кроме того, в интервале 1180–800 см–1 имеют место характеристические полосы валентных колебаний C–O и C–O–C групп [40]. После прокаливания порошка интенсивность полос поглощения, соответствующих колебаниям ОН-связей, значительно уменьшается, исчезают полосы поглощения, соответствующие колебаниям карбонатных и карбонильных групп. При этом в спектрах до и после термообработки присутствуют полосы с максимумами при 660 и 575 см–1, соответствующие колебаниям связей La–O и Fe–O [41, 42], что указывает на формирование соединения целевого состава.
Рис. 3.
ИК-спектры пропускания порошка, полученного в результате гликоль-цитратного синтеза (1) и последующей термообработки при 500°С в течение 1 ч (2).
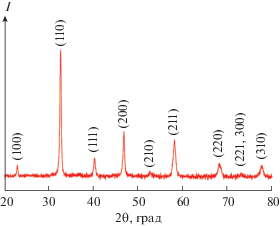
Кристаллическая структура порошка, полученного после термической обработки при 500°С, была исследована методом РФА (рис. 4). Как видно из рентгенограммы, рефлексы с максимумами при 23°, 32°, 41°, 47°, 53°, 58°, 68°, 73° и 78° соответствуют кристаллографическим плоскостям (100), (110), (111), (200), (210), (211), (220), (221, 300) и (310) кубической кристаллической решетки типа перовскита (Pm$\bar {3}$m) [43]. Таким образом, результаты РФА находятся в хорошем согласии с результатами ИК-спектроскопии и свидетельствуют о формировании однофазного целевого оксида, не содержащего примесных кристаллических включений. Средний размер ОКР для данного нанопорошка был рассчитан по формуле Шерера: $d = {{K{\lambda }} \mathord{\left/ {\vphantom {{K{\lambda }} {{\beta cos\theta }}}} \right. \kern-0em} {{\beta cos\theta }}}$, где d – средний размер ОКР, K = 0.9 в приближении, что частицы порошка имеют сферическую форму [43], λ – длина волны рентгеновского излучения, β – ширина рефлекса на полувысоте, θ – угол дифракции. Так, средний размер ОКР составил 26 ± 3 нм.
Рис. 4.
Рентгенограмма нанопорошка состава La0.6Sr0.4Со0.2Fe0.8O3 – δ, полученного после термообработки при 500°С.
Морфология порошка состава La0.6Sr0.4Со0.2Fe0.8O3 – δ после термообработки была изучена с помощью растровой электронной микроскопии. По данным РЭМ (рис. 5а, 5б), он характеризуется наличием пористых агломератов (средний размер пор составляет ~38 нм), состоящих из частиц со средним размером ~83 нм. Таким образом, учитывая результаты РФА, можно предположить, что одна частица состоит в среднем из 3–4 кристаллитов. Элементный состав исследуемого нанопорошка контролировали с помощью рентгеноспектрального элементного анализа, проведенного в рамках растровой электронной микроскопии. Анализ полученного спектра (рис. 5в) подтвердил целевое соотношение металлов в оксидном нанопорошке, а также отсутствие примесных включений.
ЗАКЛЮЧЕНИЕ
Изучен процесс гликоль-цитратного синтеза оксида состава La0.6Sr0.4Со0.2Fe0.8O3 – δ. По результатам рентгенофазового анализа, ИК-спектроскопии, а также рентгеноспектрального элементного анализа в рамках растровой электронной микроскопии установлено, что данный метод, условия синтеза и последующая термическая обработка позволяют при достаточно низкой температуре (500°С) получать однофазный нанокристаллический порошок (средний размер ОКР 26 ± 3 нм) целевого состава, характеризующийся кубической кристаллической структурой типа перовскита (Pm$\bar {3}$m) и не содержащий кристаллических примесей.
Таким образом, исходя из экспериментальных данных, полученных с использованием комплексного анализа: РФА, РЭМ, ИК-спектроскопии, синхронного термического анализа, синтезированный оксид по своим физико-химическим характеристикам и микроструктурным особенностям представляет практический интерес; на его основе в дальнейшем планируется получение стабильных дисперсных систем, подходящих по своим реологическим характеристикам для применения в качестве функциональных чернил при формировании катодных покрытий для среднетемпературных твердооксидных топливных элементов с помощью печатных технологий.
Список литературы
IEA (2019), World Energy Outlook 2019, IEA, Paris https://www.iea.org/reports/world-energy-outlook-2019
U.S. Energy Information Administration // International Energy Outlook 2019 with projections to 2050, 2019. https://www.eia.gov/outlooks/ieo/
Fuel Cell and Hydrogen Technology: Europe’s Journey to a Greener World, Fuel Cells and Hydrogen Joint Undertaking, 2017. https://doi.org/10.2843/875050
State of the States: Fuel Cells in America, U. S. Department of Energy, Office of Energy Efficiency& Renewable Energy. 2018. https://www.energy.gov/sites/prod/files/2018/06/f52/fcto_state_of_states_2017_0.pdf
Simonenko T.L., Simonenko N.P., Mokrushin A.S. et al. // Ceram. Int. 2020. V. 46. № 1. P. 121. https://doi.org/10.1016/j.ceramint.2019.08.241
Sreedhar I., Agarwal B., Goyal P. et al. // J. Electroanal. Chem. 2019. V. 848. P. 113 315. https://doi.org/10.1016/j.jelechem.2019.113315
Thiruselvi D., Kumar P.S., Kumar M.A. et al. // Int. J. Hydrogen Energy. 2020. https://doi.org/10.1016/j.ijhydene.2020.10.023
Pachauri R.K., Chauhan Y.K. // Renew. Sustain. Energy Rev. 2015. V. 43. P. 1301. https://doi.org/10.1016/j.rser.2014.11.098
Simonenko T.L., Kalinina M.V., Simonenko N.P. et al. // Int. J. Hydrogen Energy. 2019. V. 44. № 36. P. 203 45. https://doi.org/10.1016/j.ijhydene.2019.05.231
Jacobson A.J. // Chem. Mater. 2010. V. 22. № 3. P. 660. https://doi.org/10.1021/cm902640j
Simonenko T.L., Simonenko N.P., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 12. P. 1475. https://doi.org/10.1134/S0036023619120167
Kalinina M.V., Morozova L.V., Khlamov I.I. et al. // Glas. Phys. Chem. 2014. V. 40. № 5. https://doi.org/10.1134/S108765961405006X
Simonenko T.L., Ivanova V.M., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1753. https://doi.org/10.1134/S0036023619140080
Carneiro J., Nikolla E. // Nano Res. 2019. V. 12. № 9. P. 2081. https://doi.org/10.1007/s12274-019-2375-y
Sun Y., He S., Saunders M. et al. // Int. J. Hydrogen Energy. 2020. https://doi.org/10.1016/j.ijhydene.2020.10.113
Lou X., Wang S., Liu Z. et al. // Solid State Ionics. 2009. V. 180. № 23–25. P. 1285. https://doi.org/10.1016/j.ssi.2009.06.014
Liu M., Liu M., Ding D. et al. // Int. J. Hydrogen Energy. 2012. V. 37. № 10. P. 8613. https://doi.org/10.1016/j.ijhydene.2012.02.139
Jiang S.P., Zhang S., Zhen Y.D. // J. Electrochem. Soc. 2006. V. 153. № 1. P. A127. https://doi.org/10.1149/1.2136077
Gostovic D., Smith J.R., Kundinger D.P. et al. // Electrochem. Solid-State Lett. 2007. V. 10. № 12. P. 214. https://doi.org/10.1149/1.2794672
Shen F., Lu K. // Fuel Cells 2018. V. 18. № 4. P. 457. https://doi.org/10.1002/fuce.201800044
Jiang S.P. // Int. J. Hydrogen Energy. 2019. V. 44. № 14. P. 7448. https://doi.org/10.1016/j.ijhydene.2019.01.212
Qiu P., Yang X., Zou L. et al. // ACS Appl. Mater. Interfaces 2020. V. 12. № 26. P. 29133. https://doi.org/10.1021/acsami.0c01962
Muhammed Ali S.A., Raharjo J., Anwar M. et al. // Appl. Sci. 2020. V. 10. № 11. https://doi.org/10.3390/app10113761
Ismail I., Osman N., Jani A.M.M. // J. Sol-Gel Sci. Technol. 2020. V. 94. № 2. P. 435. https://doi.org/10.1007/s10971-020-05231-0
Esquirol A., Brandon N.P., Kilner J.A. et al. // J. Electrochem. Soc. 2004. V. 151. № 11. P. A1847. https://doi.org/10.1149/1.1799391
Mostafavi E., Babaei A., Ataie A. // Iran. J. Hydrog. Fuel Cell. 2014. V. 2. № 2014. P. 239.
Wang W.G., Mogensen M. // Solid State Ionics 2005. V. 176. № 5–6. P. 457. https://doi.org/10.1016/j.ssi.2004.09.007
Zhou G.H., Fu X.Z., Luo J.L. et al. // Mater. Technol. 2013. V. 28. № 1–2. P. 3. https://doi.org/10.1179/1753555712Y.0000000035
Nie L., Liu Z., Liu M. et al. // J. Electrochem. Sci. Technol. 2010. V. 1. № 1. P. 50. https://doi.org/10.5229/jecst.2010.1.1.050
Liu Y., Hashimoto S., Nishino H. et al. // J. Power Sources. 2007. V. 164. № 1. P. 56. https://doi.org/10.1016/j.jpowsour.2006.10.093
Muhammed Ali S.A., Anwar M., Somalu M.R. et al. // Ceram. Int. 2017. V. 43. № 5. P. 4647. https://doi.org/10.1016/j.ceramint.2016.12.136
Zhou W., Shao Z., Ran R. et al. // J. Am. Ceram. Soc. 2008. V. 91. № 4. P. 1155. https://doi.org/10.1111/j.1551-2916.2007.02242.x
Lei Z., Zhu Q., Zhao L. // J. Power Sources. 2006. V. 161. № 2. P. 1169. https://doi.org/10.1016/j.jpowsour.2006.06.016
Chrzan A., Karczewski J., Gazda M. et al. // J. Solid State Electrochem. 2015. V. 19. № 6. P. 1807. https://doi.org/10.1007/s10008-015-2815-x
Ghouse M., Al-Yousef Y., Al-Musa A. et al. // Int. J. Hydrogen Energy. 2010. V. 35. № 17. P. 9411. https://doi.org/10.1016/j.ijhydene.2010.04.144
Guo S., Wu H., Puleo F. et al. // Catalysts. 2015. V. 5. № 1. P. 366. https://doi.org/10.3390/catal5010366
Ismail I., Jani A.M.M., Osman N. // AIP Conf. Proc. 2017. V. 1877. https://doi.org/10.1063/1.4999860
Simonenko N.P., Sakharov K.A., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 12. P. 1452. https://doi.org/10.1134/S0036023615120232
Bohlender C., Kahnes M., Müller R. et al. // J. Mater. Sci. 2019. V. 54. № 2. P. 1136. https://doi.org/10.1007/s10853-018-2916-x
Chin S.F., Romainor A.N.B., Pang S.C. et al. // J. Drug Deliv. Sci. Technol. 2019. V. 54. № August. P. 101 239. https://doi.org/10.1016/j.jddst.2019.101239
Thuy N.T., Minh D. Le // Adv. Mater. Sci. Eng. 2012. V. 2012. № 3. https://doi.org/10.1155/2012/380306
Hussain M., Muneer M., Abbas G. et al. // Ceram. Int. 2020. V. 46. № 11. P. 18208. https://doi.org/10.1016/j.ceramint.2020.04.143
Muhammed Ali S.A., Anwar M., Baharuddin N.A. et al. // J. Solid State Electrochem. 2018. V. 22. № 1. P. 263. https://doi.org/10.1007/s10008-017-3754-5
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии