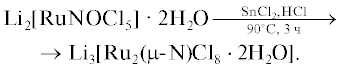Журнал неорганической химии, 2021, T. 66, № 3, стр. 350-357
Синтез и кристаллическая структура биядерного нитридного комплекса рутения с литиевыми противокатионами – предкатализатора реакции окисления воды в искусственном фотосинтезе
В. Ю. Ткаченко a, b, З. М. Джабиева b, *, Г. В. Шилов b, Л. В. Авдеева b, В. В. Добрыгин a, Т. С. Джабиев b
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт проблем химической физики РАН
142432 Московская обл, Черноголовка, пр-т Академика Семенова, 1, Россия
* E-mail: dzhabiev@icp.ac.ru
Поступила в редакцию 21.07.2020
После доработки 12.09.2020
Принята к публикации 14.09.2020
Аннотация
Синтезирована литиевая соль биядерного нитридного комплекса рутения Li3[Ru2NCl8 · 2H2O]. Строение комплекса изучено методом РСА. Кристаллы триклинные, пр. гр. P$\bar {1},$ a = 7.4044, b = = 8.1818, c = 8.7123 Å, α = 117.970°, β = 115.139°, γ = 90.014°, V = 408.65 Å3, Z = 1, ρвыч = 2.654 г/см3. Комплекс термостабильный, в кислой среде он димеризуется с образованием тетраядерного кластера ${\text{R}}{{{\text{u}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}_{{\text{5}}}^{ + }$ – активного катализатора четырехэлектронного окисления воды с выделением О2. Эффективность катализатора в реакции окисления воды (TON) достигает 356 за 1 ч.
ВВЕДЕНИЕ
В настоящее время достаточно остро стоит проблема загрязнения окружающей среды отходами производства. Это связано с накоплением углекислого газа в атмосфере, что приводит к парниковому эффекту и в итоге может привести к глобальному потеплению всей Земли. Поэтому поиск альтернативных источников энергии является актуальной задачей. Таким источником является солнечная энергия.
Наиболее актуальной задачей XXI в. является поиск путей утилизации солнечной энергии (СЭ). Бóльшая часть современных источников энергии в мире образовалась из солнечного света, преобразованного фотосинтезирующими организмами в химическую энергию. Поэтому многие современные исследования сосредоточены на так называемом искусственном фотосинтезе – фотоиндуцированном разложении воды на кислород и водород, который является наиболее перспективным энергоносителем в будущем [1–4]. Для создания эффективных фотокаталитических преобразователей СЭ в химическую энергию необходимо иметь стабильные высокоэффективные катализаторы.
В преобразователях СЭ одной из ключевых стадий является формирование продуктов многоэлектронного окисления воды в координационной сфере кластерного катализатора под действием одноэлектронных окислителей. В оксигенном фотосинтезе (ОФС) такого рода одноэлектронными окислителями (“дырками”) являются катион-радикалы Р680+·, а катализатором окисления воды – фермент вода : пластохинон – оксидоредуктаза с марганцевым кофактором Mn4CaO5 [5]. В фотокаталитических преобразователях солнечной энергии вместо ионов марганца в катализаторе могут быть использованы ионы других переходных металлов, например рутения.
Хорошо изученные ранее рутениевые катализаторы окисления воды, одним из представителей которых является cis,cis-[(bpy)2Ru(OH2)]2O4+ (“голубой димер” и его многочисленные аналоги), проявляют невысокую активность (TON = = 30–40 оборотов) из-за наличия органических лигандов, которые окисляются быстрее, чем вода, и содержат лабильные связи Ru–O–Ru, приводящие к разрушению катализатора [6–10]. Помимо лигандов существенную роль в активности и стабильности катализатора играют и противокатионы (K+, Rb+, Cs+, Li+ и др.), окружающие полианионное ядро [11–18].
Для создания активного и стабильного рутениевого катализатора в данной работе исследованы следующие подходы:
1) замена органических лигандов в комплексах на неорганические лиганды;
2) замена кислородного мостика между ядрами рутения на азотный;
3) использование в синтезе противокатионов Li+.
Ранее была получена калиевая соль биядерного комплекса рутения, изучено ее строение и некоторые физические свойства [19–21]. Сведения о синтезе литиевой соли нитридоцентрированного комплекса и его участии в катализе реакции окисления воды в искусственном фотосинтезе (ИФС) найти не удалось.
В настоящей работе представлены результаты синтеза комплекса Li3[Ru2(μ-N)Cl8 · 2H2O], изучения его строения методом РСА и каталитических свойств в реакции окисления воды в ИФС.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции по синтезу и выделению комплекса проводили на воздухе с использованием коммерческих реагентов (Fluka). Синтез осуществляли по методике [22] в две стадии.
1. Получение нитрозильного комплекса рутения Li2[RuNOCl5] · 2H2O:
В колбу с магнитной мешалкой заливали теплый раствор RuCl3 (2.4 г, 0.0157 моль) в 10 мл Н2О. К нему добавляли избыток LiNO2 (3 г, 0.0344 моль) в 5 мл воды. Реакцию вели в 6.5 М растворе HCl. После завершения реакции и выделения NO и NO2 добавляли еще избыток LiNO2 (2.5 г, 0.0289 моль) в 3 мл воды. Реакционную смесь перемешивали в течение 3 ч при 50°С до окрашивания раствора в малиновый цвет. Затем раствор оставляли испаряться при комнатной температуре до малого объема. Кристаллы отфильтровывали и перекристаллизовывали из воды. Выход 70%.
| Cl | N | Ru | O | |
| Найдено, %: | 49.50; | 3.91; | 28.31; | 13.36. |
| Для Li3RuNO3Cl5H4 | ||||
| вычислено, %: | 49.48; | 3.92; | 28.21; | 13.39. |
ИК-спектр (KBr, ν, см–1): Ru–Cl 189, 285, 328; Ru–N–O 340; Ru–N 583; N–O 900.
2. Получение биядерного нитридного комплекса рутения Li3[Ru2(μ-N)Cl8 · 2H2O]:
К свежеприготовленному раствору Li2[RuNOCl5] · 2H2O (3.64 г, 0.00826 моль) в 20 мл Н2О добавляли раствор SnCl2 (5 г, 0.0219 моль) в 40 мл 20%-ной HCl. Смесь нагревали при перемешивании в течение 3 ч при 90°С. Раствор из малинового становился красно-коричневым, при охлаждении его на бане (спирт + жидкий азот) выпадали кристаллы, которые отделяли от маточного раствора, промывали минимальным количеством холодной воды, затем 35%-ным раствором ацетона и высушивали. Перекристаллизовывали из 20%-ного раствора HCl. Выход 50%.
| Cl | N | Ru | O | Н | |
| Найдено, %: | 50.91; | 2.53; | 36.28; | 5.72; | 0.75. |
| Для Li3Ru2NO2Cl8H4 | |||||
| вычислено, %: | 50.95; | 2.52; | 36.32; | 5.75; | 0.72. |
ИК-спектр (KBr, ν, см–1): Cl–Ru–Cl 220, Ru–Cl 301, Ru–N–Ru 330, Ru–N 1075.
Отнесение полос выполнено на основании данных [23].
Элементный анализ соединений выполнен в Аналитическом центре Института проблем химической физики РАН на CHNOS-анализаторе Vario EI (Германия), содержание хлора определяли меркурометрически [24], рутений – на атомно-абсорбционном спектрометре MGA-915 (Россия). ИК-спектры снимали на ИК-фурье-спектрометре Bruker INVENIO R в диапазоне 6000–80 см–1, образец для анализа готовили в виде таблетки с KBr.
Рентгенодифракционный эксперимент проводили на CCD-дифрактометре Agilent XCalibur c детектором EOS (Agilent Technologies UK Ltd, Англия). Сбор, обработка данных, определение и уточнение параметров элементарной ячейки выполнены в программе CrysAlis PRO (AgilentTechnologies UK Ltd, Англия) [25]. Структурные исследования в полном объеме проводили при температуре 100 K. Кристаллическая структура была расшифрована прямым методом с последующей серией синтезов Фурье. Позиции и температурные параметры неводородных атомов уточнены в изотропном, а затем в анизотропном приближении полноматричным методом наименьших квадратов (МНК). Позиции атомов водорода молекулы воды выявлены из разностных синтезов и уточнены с наложением ограничений на длины связей и тепловые параметры. Все расчеты выполнены с использованием комплекса программ SHELXTL 6.14 [26]. Параметры элементарной ячейки кристаллов и основные кристаллографические данные представлены в табл. 1, координаты атомов независимой части структуры – в табл. 2, основные длины связей и валентные углы – в табл. 3.
Таблица 1.
Параметры элементарной ячейки кристалла и основные кристаллографические данные
| Параметр | Значение |
|---|---|
| Брутто-формула | H4Cl8Li3NO2Ru2 |
| М | 556.68 |
| Т, K | 100 |
| Длина волны | 0.71073 Å |
| Сингония, пр. гр. | Триклинная, P$\bar {1}$ |
| a, Å | 7.4044(3) |
| b, Å | 8.1818(3) |
| c, Å | 8.7123(4) |
| α, град | 117.970(4) |
| β, град | 115.139(4) |
| γ, град | 90.014(3) |
| V, Å3 | 408.65(3) |
| Z | 1 |
| ρвыч, г/см3 | 2.654 |
| μ, мм–1 | 3.901 |
| F(000) | 308 |
| Размер кристалла, мм | 0.2 × 0.15 × 0.05 |
| Область сбора данных по θ, град | 2.91–34.06 |
| Общее число отражений | 5841 |
| Число независимых отражений | 3359 [R(int) = 0.0236] |
| Число уточняемых параметров | 82 |
| GOOF по F2 | 1.030 |
| R-факторы по [I > 2σ(I)] | R1 = 0.0281, wR2 = 0.0570 |
| R-факторы по всем отражениям | R1 = 0.0343, wR2 = 0.0601 |
| Остаточная электронная плотность (min/max), eÅ3 | –1.142 /1.528 |
Таблица 2.
Координаты атомов (×104) и эквивалентные изотропные смещения (Å2 × 103)
| Атом | x | y | z | Uэкв |
|---|---|---|---|---|
| N(1) | 0 | 0 | 0 | 7(1) |
| Ru(1) | 1117(1) | 2138(1) | 2235(1) | 6(1) |
| Li(1) | 1410(1) | –2531(1) | 2821(1) | 15(1) |
| Li(2) | 5000 | 0 | 0 | 16(1) |
| Cl(1) | –470(1) | 1117(1) | 3600(1) | 11(1) |
| Cl(2) | 4069(1) | 1118(1) | 3599(1) | 11(1) |
| Cl(3) | 2911(1) | 3597(1) | 1295(1) | 10(1) |
| Cl(4) | –1616(1) | 3596(1) | 1296(1) | 10(1) |
| O(1) | 2530(3) | 4821(2) | 5053(3) | 12(1) |
| H(1A) | 3870(30) | 5000(40) | 5910(40) | 14 |
| H(1B) | 1960(40) | 5030(40) | 5820(40) | 14 |
Таблица 3.
Основные длины связей (d) и валентные углы (ω) в комплексе
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| N(1)–Ru(1)#1 | 1.7236(2) | Ru(1)–Cl(1) | 2.3692(6) |
| N(1)–Ru(1) | 1.7236(2) | Ru(1)–Cl(4) | 2.3871(6) |
| Ru(1)–O(1) | 2.1685(17) | Ru(1)–Cl(3) | 2.3872(6) |
| Ru(1)–Cl(2) | 2.3686(6) | ||
| Угол | ω, град | Угол | ω, град |
| Ru(1)#1N(1)Ru(1) | 180.0 | O(1)Ru(1)Cl(4) | 85.17(5) |
| N(1)Ru(1)O(1) | 179.72(6) | Cl(2)Ru(1)Cl(4) | 171.78(2) |
| N(1)Ru(1)Cl(2) | 93.136(17) | Cl(1)Ru(1)Cl(4) | 89.62(2) |
| O(1)Ru(1)Cl(2) | 86.62(5) | N(1)Ru(1)Cl(3) | 95.058(17) |
| N(1)Ru(1)Cl(1) | 93.138(17) | O(1)Ru(1)Cl(3) | 85.08(5) |
| O(1)Ru(1)Cl(1) | 86.73(5) | Cl(2)Ru(1)Cl(3) | 89.61(2) |
| Cl(2)Ru(1)Cl(1) | 90.38(2) | Cl(1)Ru(1)Cl(3) | 171.79(2) |
| N(1)Ru(1)Cl(4) | 95.073(17) | Cl(4)Ru(1)Cl(3) | 89.21(2) |
Кинетику восстановления комплекса Li3[Ru2(μ-N)Cl8 · 2H2O] (RuIV–N–RuIV) изучали на спектрофотометре Specord M-40 на длине волны λ = 283 нм в термостатируемой кварцевой кювете с l = 1 см. Текущую концентрацию комплекса определяли по закону Бугера–Ламберта–Бэра: А = ε [cat] l (ε = 13000 M–1 cм–1). Количество выделившегося кислорода рассчитывали по формуле для идеального газа μ = pV/RT (моль). Для установления состава и строения образованного in situ тетраядерного катализатора окисления воды использовали метод ESI-масс-спектрометрии. Масс-спектр получен на жидкостном хромато-масс-спектрометре LCM-2020 (Shimadzu Corporation, Япония), оснащенном автодозатором SIL-20 AC. Водные растворы вводили в электроспрей-источник ионизации с помощью автодозатора со скоростью потока 20 мкл/мин. Объем вводимой пробы варьировали от 0.1 до 3 мкл. При приложении к капилляру напряжения (от 0.5 до 4.5 кВ) происходит тонкодисперсное распыление анализируемого раствора, конечной стадией которого является полевое испарение ионов, содержащихся в пробе. Часть этих ионов через вакуумный интерфейс поступает в масс-анализатор.
Кинетику образования кислорода в ходе реакции изучали на вакуумной стеклянной установке. В термостатируемый реактор заливали раствор катализатора в 3М HCl, а в боковое устройство – раствор окислителя (NH4)2Ce(NO3)6. После предварительной дегазации с замораживанием и размораживанием (3 раза) растворы доводили до нужной температуры, смешивали и наблюдали реакцию. С помощью калиброванного вакуумного манометра следили за кинетикой выделения кислорода. После окончания реакции газообразные продукты собирали в масс-спектрометрическую ампулу, соединенную с реактором.
Масс-спектрометрический анализ газообразных продуктов реакции проводили на масс-спектрометре МИ-1201 (ООО “Селми”, Россия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
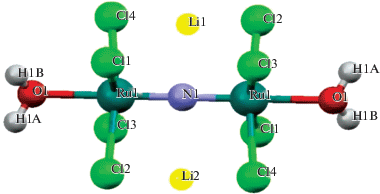
Для многосубстратных концертных процессов, которым является ОФС, очень важно минимальное расстояние между ионами переходного металла в каталитическом центре. Для этой цели был синтезирован биядерный комплекс Li3[Ru2(μ-N)Cl8 · 2H2O] (RuIV–N–RuIV), молекулярная структура которого представлена на рис. 1. Он представляет собой кристаллы красного цвета, хорошо растворимые в воде. Согласно данным РСА, это биядерный центросимметричный комплекс с линейным скелетом. В кристаллической структуре комплекса два атома рутения связаны азотным мостиком. Расстояние Ru–N в этом комплексе более короткое (1.72 Å), чем расстояние Ru–O (1.86 Å) в его кислородном аналоге Li4[Ru2(μ-O)Cl10] [17], что свидетельствует о наличии двойной связи между атомами Ru и N. Кристаллы триклинные, пр. гр. P$\bar {1},$ параметры ячейки: a = 7.4044, b = 8.1818, c = 8.7123 Å; α = 117.970°, β = 115.139°, γ = 90.014°, V = 408.65 Å3, Z = 1, ρвыч = = 2.654 г/см3. В структуре, изображенной на рис. 1, два атома рутения, лежащие в зеркальной плоскости, имеют искаженную октаэдрическую координацию с молекулами воды, которые находятся в транс-положении к азоту. Атомы хлора затеняют друг друга вследствие жестокой мультиплетной связи Ru–N–Ru. В табл. 3 приведены длины связей и валентные углы в структуре. Атомы хлора отклоняются от атома азота на ~95°. Внутримолекулярное расстояние N…Cl в этом соединении равно 3.06 Å. Если бы угол NRuCl был равен 90°, а не 95°, то расстояние N…Cl составило бы 2.9 Å, т.е. было бы слишком коротким и атомы N…Cl сильнее отталкивались бы друг от друга. Расстояние между затененными атомами Cl >3.6 Å. В структуре имеются также два независимых иона лития. Оба иона Li+ координированы к 8 атомам хлора в пустотах искаженного куба с расстояниями Li–Cl 3.15–3.34 Å. На рис. 2 представлена упаковка димеров в кристалле в виде искаженного куба, в углах которого расположены атомы азота.
Возможность распада комплекса в кислом растворе маловероятна. Для подтверждения этого предположения ранее мы сравнили ИК-спектры исходного твердого комплекса и вещества, полученного выпариванием при комнатной температуре на роторном испарителе его раствора, выдержанного в течение 2 сут [23]. Сравнение показало, что полоса при νac = 1075 см–1, характерная для валентных колебаний связи Ru–N–Ru, присутствует в ИК-спектрах обоих веществ, но в спектре вещества, полученного после выпаривания раствора, появляется вторая полоса при νac = 1049 см–1, что может быть вызвано замещением атомов хлора на молекулы воды.
Восстановление комплекса координированными молекулами воды
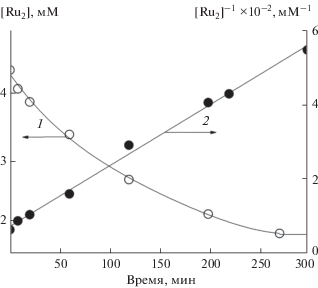
Перед исследованием механизма каталитического окисления воды соединениями (NH4)2Ce(NO3)6 (Ce(IV)) предварительно была изучена реакция восстановления комплекса координированными молекулами воды в отсутствие экзогенного окислителя. На рис. 3 показан электронный спектр поглощения кислого раствора комплекса (кривая 1) и его изменение во времени.
Рис. 3.
Электронный спектр поглощения раствора комплекса в 3М HCl при 65°С и его изменение во времени [RuIV–N–RuIV] = 1.0 × 10–3 М, время, мин: 1 – 0, 2 – 10, 3 – 30, 4 – 60, 5 – 120, 6 – 200, 7 – 270.
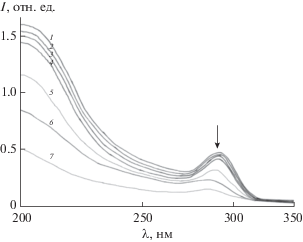
Видно, что в ходе восстановления комплекса RuIV–N–RuIV происходит убыль его концентрации. Кривая 1 на рис. 4 хорошо спрямляется в координатах {[Ru2]–1, τ}, что свидетельствует о бимолекулярном механизме реакции восстановления. Из линейной анаморфозы 2 кинетической кривой 1 в соответствующих координатах определена константа скорости реакции k2 = 0.22 М–1 мин–1. Подставив это значение в дифференциальное уравнение второго порядка –d[Ru2]/dτ = k2 [Ru2]2, получим расчетное кинетическое уравнение реакции (сплошная кривая 1 на рис. 4), которое хорошо согласуется с экспериментальной кривой 1 (кружочки). Из рис. 4 видно, что бимолекулярная реакция идет до 85%-ного превращения.
Исходный комплекс RuIV–N–RuIV является двухэлектронным окислителем, следовательно, для четырехэлектронного окисления двух молекул воды до O2 ему необходимо димеризоваться в тетраядерный кластер по реакции (1):
(1)
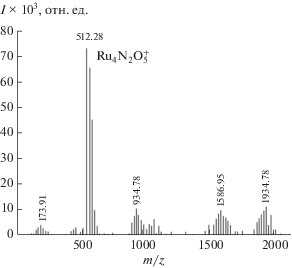
$\begin{gathered} 2\left[ {{\text{R}}{{{\text{u}}}^{{{\text{IV}}}}} - {\text{N}} - {\text{R}}{{{\text{u}}}^{{{\text{IV}}}}}} \right] + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = 2\left[ {{\text{R}}{{{\text{u}}}^{{{\text{III}}}}} - {\text{N}} - {\text{R}}{{{\text{u}}}^{{{\text{III}}}}}} \right] + {{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }}. \\ \end{gathered} $Методом ESI-масс-спектрометрии было установлено образование тетрарутениевого динитридного комплекса ${\text{R}}{{{\text{u}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}_{{\text{5}}}^{ + }.$ В масс-спектре, изображенном на рис. 5, присутствует максимальный пик молекулярной массы m/z = 512.28, который соответствует тетрарутениевому динитридному катиону ${\text{R}}{{{\text{u}}}_{{\text{4}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}_{{\text{5}}}^{ + }.$
Рис. 5.
ESI-масс-спектр продуктов восстановления комплекса Li3[Ru2(μ-N)Cl8 · 2H2O] (1.0 × 10–3 M) в смеси CH3CN : H2O : HCOOH = 29 : 70 : 1.
Таким образом, тетраядерные комплексы образуются в результате самоорганизации двух исходных биядерных комплексов RuIV–N–RuIV. Они осуществляют четырехэлектронное окисление воды до O2 в координационной сфере тетраядерного кластера.
Изучение реакции окисления воды соединениями (NH4)2Ce(NO3)6, катализированной кластерами рутения $R{{u}_{4}}{{N}_{2}}O_{5}^{ + }$
Каталитическое окисление воды до О2 соединениями церия в координационной сфере тетрарутениевого кластера осуществляется также по четырехэлектронному механизму по реакции (2):
(2)
${\text{4Ce}}\left( {{\text{IV}}} \right) + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 4{\text{Ce}}\left( {{\text{III}}} \right) + {{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }}.$В каталитическом процессе для регенерации восстановленного тетрамера [RuIII–N–RuIII]2 в активное состояние [RuIV–N–RuIV]2 необходимо израсходовать четыре одноэлектронных окислителя Ce(IV). Но это не означает, что происходит одновременное столкновение четырех молекул Ce(IV), идут последовательные бимолекулярные реакции ступенчатого окисления восстановленного комплекса [RuIII–N–RuIII]2 до [RuIV–N–RuIV]2 с его последующим распадом на [RuIII–N–RuIII]2, О2 и 4 Н+ по реакции (1).
Для оценки эффективности катализатора (числа оборотов катализатора – TON) были проведены кинетические исследования реакции образования кислорода при избытке (NH4)2Ce(NO3)6 в 3 М HCl при 65°С. На рис. 6 представлены кинетические кривые выделения кислорода при разных концентрациях окислителя. Концентрацию Ce(IV) варьировали от 4 × 10–3 до 4 × 10–2 М. Из рис. 6 видно (кривая 5), что скорость образования О2 высокая (TOF = 0.38 с–1, число оборотов катализатора TON = 356).
Рис. 6.
Кинетика образования О2 при разных концентрациях Се(IV). Li3[Ru2(μ-N)Cl8 ⋅ 2H2O] – 1 × 106 моль, (NH4)2Ce(NO3)6: 1 – 4 × 10–5, 2 – 6 × 10–5, 3 – 1 × 10–4, 4 – 2 × 10–4, 5 – 4 × 10–4 моль при 65°С в 3 М HCl.
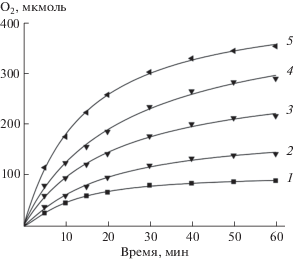
В табл. 4 приведены активности катализатора при разных концентрациях окислителя.
Таблица 4.
Влияние концентрации окислителя на активность катализатора
| [(NH4)2Ce(NO3)6] × 103, M | TOF | TON |
|---|---|---|
| 4 | 0.092 | 90 |
| 6 | 0.123 | 123 |
| 10 | 0.205 | 218 |
| 20 | 0.26 | 292 |
| 40 | 0.383 | 356 |
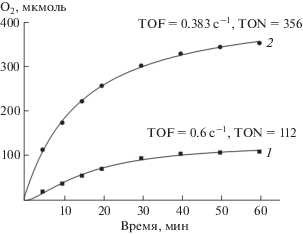
В ходе исследований обнаружено, что противокатион оказывает существенное влияние на стабильность и эффективность катализатора. На рис. 7 представлены кинетические кривые образования О2 в присутствии нитридных комплексов с противокатионами K+ и Li+. Сравнивая кинетические кривые, видно, что кривая с K+ достаточно быстро запределивается, т.е. катализатор разрушается, идет образование оксосоединений рутения в более высокой степени окисления, в отличие от кривой с противокатионом Li+. Сравнение активностей двух аналогичных комплексов с разными противокатионами показало, что число оборотов комплекса с катионом Li+ (TON = 356) в 3 раза выше, чем с катионом K+ (TON = 112), и на порядок выше, чем у ранее описанных биядерных рутениевых комплексов с органическими лигандами.
Рис. 7.
Кинетика образования О2 в присутствии комплексов с разными противокатионами: 1 – K3[Ru2(μ-N)Cl8 · · 2H2O], 2 – Li3[Ru2(μ-N)Cl8 · 2H2O]. TOF – частота оборотов, т.е. максимальное количество образующегося О2 на одном активном центре в единицу времени (1 с); TON – число оборотов, т.е. количество молей О2, образовавшееся на одном моле катализатора за время реакции.
ЗАКЛЮЧЕНИЕ
Исследование полученной литиевой соли биядерного нитридного комплекса рутения позволило нам установить механизм реакции окисления воды и показать существенные различия его каталитической активности и стабильности по сравнению с комплексом cis,cis-[(bpy)2Ru(OH2)]2O4+ и его многочисленными аналогами, содержащими органические лиганды и лабильные связи Ru–O–Ru. Обнаружен эффект противокатиона Li+, хотя механизм его действия пока не ясен и является предметом дальнейших исследований.
Список литературы
Джабиев Т.С., Шилов А.Е. // Успехи химии. 2012. Т. 81. № 12. С. 1146. [Dzhabiev T.S., Shilov A.E. // Russ. Chem. Rev. 2012. V. 81. № 12. P. 1146.] https://doi.org/10.1070/RC2012v081n
Kärkäs M.D., Verho O., Johnston E.V., Âkermark B. // Chem. Rev. 2014. V. 114. P. 11863. https://doi.org/10.1021/cr400572
Дьячков Е.П., Дьячков П.Н. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 971. [D’yachkov E.P., D’yachkov P.N. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1152. https://doi.org/10.1134/S0036023619090080]
Козлов Д.А., Козлова Т.О., Щербаков А.Б. и др. // Журн. неорган. химии. 2020. Т. 65. № 7. С. 1003. [Kozlov D.A., Kozlova T.O., Shcherbakov A.B. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 7. P. 1088. https://doi.org/10.1134/S003602362007013X]
Umena Y., Kawakami K., Shen Y.R., Kamiya M. // Nature. 2011. V. 473. P. 55. https://doi.org/10.1038/nature09913
Hurst J.K. // Science. 2010. V. 328. P. 315. https://doi.org/10.1126/science.1187721
Gersten S.W., Samuels G.J., Meyer T.J. // J. Am. Chem. Soc. 1982. V. 104. P. 4029. https://doi.org/10.1021/ja00378a053
Yagi M., Kaneko M. // Chem. Rev. 2001. V. 101. P. 21. https://doi.org/10.1021/cr9801081
Sens C., Romero I., Rodriguez M. et al. // J. Am. Chem. Soc. 2004. V. 126. P. 7798. https://doi.org/10.1021/ja0486824
Suess-Fink G. // Angew. Chem. Int. Ed. 2008. V. 47. P. 5888. https://doi.org/10.1002/anie.200801121
Джабиев Т.С., Денисов Н.Н., Моисеев Д.Н., Шилов А.Е. // Докл. АН. 2004. Т. 396. № 2. С. 263. [Dzhabiev T.S., Denisov N.N., Moiseev D.N., Shilov A.E. // Dokl. Biochem. Biophys. 2004. V. 396. № 1–6. P. 151. https://doi.org/10.1023/B:DOBI.0000033515.31091.f4]
Sartorel A., Carraro M., Scorrano G. et al. // J. Am. Chem. Soc. 2008. V. 130. P. 5006. https://doi.org/10.1021/ja0778371
Geletii Y.V., Botar B., Koegerler P. et al. // Angew. Chem. Int. Ed. 2008. V. 47. P. 3896. https://doi.org/10.1002/anie.200705652
Geletii Y.V., Huang Zh., Hou Yu. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 7522. https://doi.org/10.1021/ja901373m
Sala X., Romero I., Rodriguez M. et al. // Angew. Chem. Int. Ed. 2009. V. 48. P. 2842. https://doi.org/10.1002/anie.200802659
Besson C., Huang Zh., Geletii Y.V. et al. // Chem. Commun. 2010. V. 46. P. 2784. https://doi.org/10.1039/B926064A
Джабиева З.М., Шилов Г.В., Ткаченко В.Ю. и др. // Журн. неорган. химии. 2016. Т. 61. № 6. С. 724. [Dzhabieva Z.M., Shilov G.V., Tkachenko V.Yu. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 6. P. 688. https://doi.org/10.1134/S003602361606005X]
Джабиева З.М., Ткаченко В.Ю., Джабиев Т.С. // Химия высоких энергий. 2017. Т. 51. № 3. С. 230. [Dzhabieva Z.M., Tkachenko V.Yu., Dzhabiev T.S. // Russ. High Energy Chem. 2017. V. 51. № 3. P. 215. https://doi.org/10.1134/S0018143917030043]
Ciehanovich M., Skapski A.C. // J. Chem. Soc. A. 1971. P. 1792. https://doi.org/10.1039/J19710001792
Cleare By M., Griffith W.P. // Chem. Commun. 1968. P. 1302. https://doi.org/10.1039/C19680001302
Mukaida M. // Bull. Chem. Soc. Jpn. 1970. V. 43. P. 3805. https://doi.org/10.1246/bcsj.43.3805
Seddon E., Sedeon K. The Chemistry of Ruthenium. The Netherlands: Elsevier, Amsterdam, 1984. 1373 p.
Dzhabieva Z.M., Shilov G.V., Avdeeva L.V. et al. // Biomimetics. 2020. V. 5. № 1. P. 3. https://doi.org/10.3390/biomimetics5010003
Cheng W.J. // Microchem. J. 1959. V. 24. № 6. P. 989.
Agilent. Crys Alis PRO. Agilent Technologies UK Ltd. Yarnton, Oxfordshire, England, 2011.
Sheldrick G.M. (8/06/2000) SHELXTL: Structure Determination Software Suite; v.6.14; Brucker AXS, Madison, Wisconsin, USA, 2000.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии