Журнал неорганической химии, 2021, T. 66, № 3, стр. 344-349
Образование и деструкция карбонила платины [Pt(CO)2]n
И. В. Федосеев a, *, А. В. Шевельков b, К. Б. Поярков c, В. В. Васекин a, Н. В. Ровинская a
a Акционерное общество “Научно-производственный комплекс “Суперметалл” им. Е.И. Рытвина”
115184 Москва, Озерковская наб., 22/24, корп. 2, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, 1, Россия
c Московский институт электронной техники, Зеленоград
124498 Москва, пл. Шокина, 1, Россия
* E-mail: prof.igor.fedoseev@gmail.com
Поступила в редакцию 28.05.2020
После доработки 16.09.2020
Принята к публикации 18.09.2020
Аннотация
Светлой памяти академика Виктора Ивановича Спицына посвящается
Методами рентгенофазового анализа, ИК-спектроскопии и термографии, а также путем анализа состава продуктов деструкции карбонила платины установлено, что олигомерный карбонил платины [Pt(CO)2]n неустойчив на воздухе при комнатной температуре и быстро разлагается с потерей СО-лигандов за счет их удаления из комплекса в результате диссоциации СО, а также за счет окисления СО-лигандов кислородом воздуха. Описаны процессы деструкции карбонила платины [Pt(CO)2]n и состав продуктов деструкции.
ВВЕДЕНИЕ
Первым из карбонилов платиновых металлов в 1910 г. был синтезирован Ru(CO)5, затем в 1940 г. были получены Rh2(CO)8 и Ir2(CO)8, а в 1943 г. – Os(CO)5. Общим способом синтеза этих карбонилов была обработка порошка соответствующего металла монооксидом углерода при повышенных давлении и температуре [1]. Нестабильные карбонилы палладия Pd(CO)n, где n = 1, 2, 3, 4, были получены только в 1972–1973 гг. путем совместной конденсации атомов Pd и смеси CO + Ar в криогенных условиях [1].
Первое сообщение о получении карбонила платины появилось в 1965 г. [2]. Оказалось, что при обработке растворов H2PtCl6 или H2PtCl4 монооксидом углерода при атмосферном давлении происходит восстановление Pt(IV) и Pt(II) до Pt(0) с образованием олигомерного карбонила платины [Pt(CO)2]n, где n кратно 3.
Образование карбонила платины (КП) описывается следующими реакциями:
(1)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{PtC}}{{{\text{l}}}_{{\text{6}}}} + 4{\text{CO}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{Pt}}{{\left( {{\text{CO}}} \right)}_{{\text{2}}}} + 2{\text{C}}{{{\text{O}}}_{2}} + 6{\text{HCl}}, \\ \end{gathered} $(2)
${{{\text{H}}}_{{\text{2}}}}{\text{PtC}}{{{\text{l}}}_{{\text{4}}}} + 3{\text{CO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Pt}}{{\left( {{\text{CO}}} \right)}_{{\text{2}}}} + {\text{C}}{{{\text{O}}}_{2}} + 4{\text{HCl}}.$Визуально протекание реакций (1) и (2) сопровождается образованием на поверхности растворов пленки темно-вишневого цвета и осаждением порошка такого же цвета.
Следует отметить, что независимо от авторов работы [2] это соединение было синтезировано и описано также в работе [3]. Еще раньше образование темно-вишневых пленок при проведении реакций (1) и (2) наблюдали японские и российские исследователи [4, 5], но состав этого продукта не был определен.
Кинетика и механизм реакций (1) и (2) были подробно описаны в работах [6–8]. Оказалось, что скорость протекания реакции (1) значительно меньше, чем реакции (2). Реакция (1) протекает через промежуточную стадию восстановления платины Pt(IV) до Pt(II), это вызывает резкое увеличение скорости образования КП, так как процесс восстановления платины является автокаталитическим [6]. Такое же влияние на скорость реакции (1) вызывает присутствие в растворе хлорокомплекса Pt(IV) комплекса Pt(II) [7].
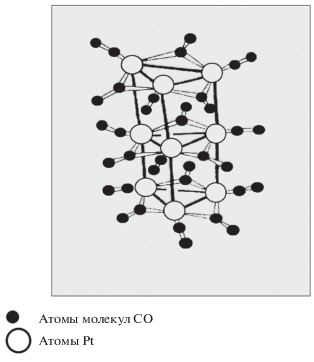
Исследование состава вещества темно-вишневого цвета показало, что это КП – олигомер с общей формулой [Pt(CO)2]n, где n кратно 3. Его структура (рис. 1) образована трехчленными циклами из атомов Pt, соединенными связями Pt–Pt. Лиганды СО представлены η1- и η2-конфигурационными сайтами с νCO = 2050 и 1865 см–1 [3].
Рис. 1.
Олигомерная структура карбонильного комплекса [Pt(CO)2]n, где n кратно 3, по данным работы [3].
Цель настоящей работы заключалась в синтезе олигомерного карбонила платины и исследовании его свойств, в первую очередь стабильности и продуктов деструкции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза КП первоначально использовали реактивный раствор H2PtCl6, полученный растворением гексагидрата платинохлористоводородной кислоты (H2PtCl6 · 6H2O, ОАО “Аурат”, х. ч.) в дистиллированной воде, и раствор H2PtCl6, полученный при регенерации Pt-губок, полученных при исследовании образцов [Pt(CO)2]n.
Монооксид углерода синтезировали действием концентрированной муравьиной кислоты на горячую концентрированную серную кислоту и собирали в газометре.
Образцы КП получали пропусканием СО через растворы H2PtCl6 при атмосферном давлении, интенсивном механическом перемешивании и t = = 60°C. Полученные осадки КП отделяли фильтрацией через стеклянный фильтр и промывали 1 М раствором HCl. Фильтрацию, промывку и хранение осадков КП осуществляли в атмосфере СО.
ИК-спектр записывали в режиме нарушенного полного внутреннего отражения на ИК-спектрометре Perkin–Elmer Spectrum One в диапазоне 4000–400 см–1.
Рентгенофазовый анализ проводили с использованием камеры Гинье высокого разрешения (Image Plate Huber G 670 CuKα1, длина волны излучения λ = 1.54051 Å), съемку осуществляли при комнатной температуре в диапазоне углов 2θ от 5° до 100°. Для обработки полученных данных использовали стандартный пакет программ WinXPow и базу данных PDF-2.
Термогравиметрический анализ выполняли на синхронном термическом анализаторе NETZSCH 449 Jupiter. Измерения проводили на воздухе и в токе осушенного азота и аргона в интервале температур 25–650°С со скоростью нагрева 5 град/мин в платиновых тиглях. Для калибровки весов использовали стандартный образец CaC2O4 · H2O, точность изменения массы составляла не менее 0.05%. Температуру измеряли с точностью ±0.1°С. Программный пакет Proteus использовали для обработки результатов.
Исследования морфологии и состава образцов проводили на растровом электронном микроскопе JSM-6010 Plus/La(JEOL) с энергодисперсионным детектором для проведения элементного EDX-анализа при ускоряющем напряжении 20 кВ в вакууме ≤1 × 10–4 Па.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для оценки стабильности КП на воздухе были сняты ИК-спектры свежеприготовленного образца КП и этого же образца после его выдерживания на воздухе. Полученные результаты приведены в табл. 1.
Таблица 1.
Стабильность карбонила платины на воздухе (ИК-спектры)
| № образца | Продукт | νCO, см–1 |
|---|---|---|
| 1 | [Pt(CO)2]n по данным [3] | 2050, 1865, 445–450 |
| 2 | [Pt(CO)2]n синтезированный, хранение в атмосфере СО | 2060, 1865, 470 |
| [Pt(CO)2]n синтезированный после контакта с воздухом, мин | ||
| 3 | 10 | 2060, 1885, 1815, 470 |
| 4 | 35 | 2060, 1885, 1815, 1635, 470 |
| 5 | 55 | 2060, 1885, 1815, 470 |
| 6 | 75 | 2060, 1885 о.сл, 1815, 470 |
| 7 | 100 | 2060 сл |
| 8 | 145 | 2060 о.сл |
По данным [9], значения νCO для различных конфигурационных сайтов адсорбции СО на плотноупакованной поверхности Pt составляют, см–1: η1 – 2153, η2 – 1961, η3 – 1853.
Данные, приведенные в табл. 1, свидетельствуют о том, что в молекуле [Pt(CO)2]n присутствуют СО-лиганды (η1 и η2), что подтверждается частотами колебаний при 2060 и 1885 см–1, характерными соответственно для концевых и мостиковых лигандов CO [3, 10]. Однако на воздухе при комнатной температуре соединение неустойчиво и быстро претерпевает изменения в лигандном составе. Это может быть следствием высокой лабильности СО-лигандов, что характерно для карбонильных комплексов платиновых металлов в низших степенях окисления и проявляется в появлении новой частоты колебаний связи C=O (1815 см–1) и исчезновении полосы поглощения при 470 см–1 [10, 11]. Кроме того, высокая активность СО-лигандов может приводить к их окислению до СО2.
При протекании реакций (1) и (2) наблюдается быстрое уменьшение окислительно-восстановительного потенциала (ОВП) системы. Так, в одном из экспериментов было определено изменение ОВП от времени гидрокарбонилирования. В трехгорлую колбу с платиновым электродом ЭПЛ-02 и хлорсеребряным электродом ЭВЛ-1М3.1, подсоединенными к милливольтметру ЛПМ-60М с погрешностью измерения ±1%, помещали 150 мл раствора H2PtCl6 (платина 18 г/л) в 2М HCl. Через этот раствор пропускали монооксид углерода при атмосферном давлении, интенсивном перемешивании (800 об/мин) и t = 60°C, при этом наблюдали изменение величины ОВП (табл. 2).
Появление осадка [Pt(CO)2]n происходило при φ = 340–330 мВ. При выдержке на воздухе после обработки СО величина ОВП быстро возрастала. При интенсивном перемешивании раствора с осадком КП на воздухе в течение 10 мин ОВП возрастала от 265 до 480 мВ, при этом раствор приобретал светло-желтую окраску, характерную для аниона ${\text{Pt}}\left( {{\text{СО}}} \right){\text{Cl}}_{{\text{3}}}^{--}.$ Обработка этого раствора СО вызывала быстрое осаждение [Pt(CO)2]n.
Окисление Pt(0) в [Pt(CO)2]n до Pt(II) описывается уравнением:
(3)
$\begin{gathered} {\text{Pt}}{{\left( {{\text{CO}}} \right)}_{{\text{2}}}} + {\text{3HCl}} + {{{\text{O}}}_{{\text{2}}}} = {\text{Pt}}\left( {{\text{CO}}} \right){\text{Cl}}_{{\text{3}}}^{--} + \\ + \,\,{\text{C}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}^{ + }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $В то же время Pt(0) в металлическом виде не окисляется кислородом воздуха в обычных условиях.
Квантово-механические исследования, выполненные на основе метода обобщенного градиентного приближения, показали наличие корреляционной связи между энергией адсорбции и энергией выхода электрона с поверхности металла [12, 13]. Наибольшим абсолютным значениям энергии адсорбции соответствуют плотноупакованные поверхности (111) для ГЦК и (001) для ГПУ-структур. По мере роста конфигурационного индекса ηСО наблюдается увеличение абсолютного значения энергии адсорбции СО [14–16], что снижает работу выхода электрона атома Pt и делает возможным протекание реакции (3).
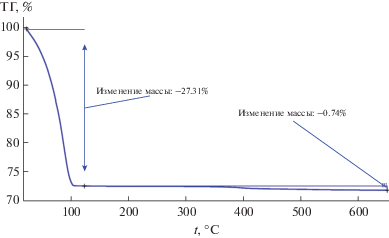
Для определения термической устойчивости КП исследовали образец [Pt(CO)2]n, находившийся на подложке в атмосфере СО. При вскрытии образца на воздухе и переносе его в рабочий тигель начиналось его разложение, которое сопровождалось неконтролируемым изменением массы. Записать кривую изменения массы образца оказалось возможным в атмосфере осушенного азота или аргона, причем результаты, полученные в атмосфере двух разных газов, не отличались с точностью до погрешности, вызванной частичным разложением образца в процессе его приготовления. Полученные результаты представлены на рис. 2.
Наблюдаются две стадии разложения исходного КП. Первая стадия заканчивается при 100°С и сопровождается потерей 27.31% массы образца. Превышение потери массы по сравнению с рассчитанной для полного удаления СО (22.3%), вероятно, связано с тем, что при подготовке образца к исследованию происходит краткий контакт с атмосферой, приводящий к воздействию кислорода воздуха и паров воды на КП, что типично для большинства карбонильных производных платины [17, 18]. Вторая стадия начинается при 365–370°С, определяется, по-видимому, удалением тонкодисперсного углерода за счет его окисления и заканчивается около 470°С. При этом потеря массы образца составляет 0.74%.
Аналогичный образец [Pt(CO)2]n был высушен на воздухе при 100°С в течение 10 ч, затем был проведен рентгенофазовый анализ полученного соединения (рис. 3а). Результаты РФА свидетельствуют об отсутствии в этом образце, за исключением металлической платины, других кристаллических продуктов. При этом интенсивность фона увеличилась в направлении малых величин 2θ, что может свидетельствовать о присутствии в образце аморфного алмазоподобного углерода, описанного в работе [19] как тетрагональный углерод ta-C, или недавно предсказанного пентаалмаза – новой формы углерода высокой прочности, сочетающей sp2- и sp3-гибридные атомы углерода [20].
Рис. 3.
Дифрактограммы образцов платиновой губки, полученных в результате деструкции [Pt(CO)2]n и сушки при 100°С в течение 10 ч (а) и при 500°С в течение 10 ч (б). Вертикальными штрихами показана теоретическая рентгенограмма платины.
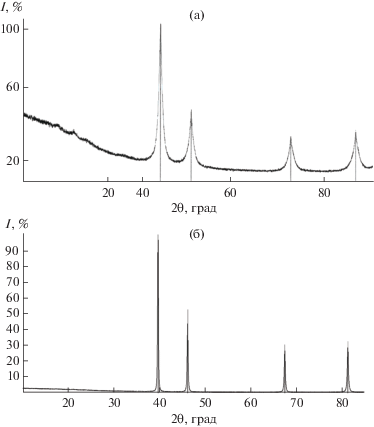
Для уменьшения содержания аморфных примесей и укрупнения размера частиц образец КП отжигали в печи при температуре 500°С в течение 10 ч. Результаты рентгеновской дифракции полученного после отжига образца представлены на рис. 3б. Низкий фон и отсутствие пиков, не относящихся к фазе платины, свидетельствуют об отсутствии аморфных и кристаллических примесей в образце соответственно. Узкие пики высокой интенсивности указывают на высокую степень кристалличности образца, кроме того, примесные фазы в детектируемом количестве отсутствуют.
В табл. 3 приведены физико-химические параметры ta-C в сравнении с алмазом.
Таблица 3.
Физико-химические параметры алмаза и аморфного тетрагонального углерода ta-C [19]
| Форма углерода | Доля sp3-атомов, % | Плотность, г/см3 | Ширина запрещенной зоны, эВ | Твердость, ГПа |
|---|---|---|---|---|
| Алмаз | 100 | 3.5 | 5.5 | 100 |
| ta-C | 80–88 | 3.1 | 2.5 | 80 |
Это объясняет, почему при наличии высокой абразивности Pt-губок, полученных деструкцией [Pt(CO)2]n, их рентгенофазовый анализ не показал присутствия кристаллических структур, включая алмазоподобную, кроме структуры платины.
Подобную форму углерода мы находили и при исследовании продуктов разложения карбонильных комплексов палладия. РФА палладиевых черней, образующихся при деструкции комплекса, показал наличие высокого фона в области малых величин 2θ, при этом палладиевые губки обладали высокой абразивностью [21].
Несколько образцов КП были исследованы методом растровой электронной микроскопии (РЭМ). В табл. 4 приведены составы поверхности образцов, выдержанных на воздухе при разных температурах. Отмечается, что с повышением температуры выдержки образцов происходит уменьшение доли углерода в платиновой губке.
Таблица 4.
Содержание платины и углерода в продуктах деструкции [Pt(CO)2]n по данным РЭМ
| № образца |
Точка анализа |
Содержание, ат. % | Pt : C, ат. % | Условия подготовки образца | ||||
|---|---|---|---|---|---|---|---|---|
| Pt | C | |||||||
| 1 | 1 | 64.64 | 35.36 | 1.83 : 1 | Сушка на воздухе при 200°С в течение 2 ч | |||
| 2 | 62.82 | 28.65 | 2.19 : 1 | |||||
| 3 | 64.31 | 35.09 | 1.83 : 1 | |||||
| 4 | 64.54 | 30.85 | 2.09 : 1 | |||||
| 5 | 64.29 | 30.85 | 2.09 : 1 | |||||
| 6 | 59.29 | 33.43 | 1.77 : 1 | |||||
| 7 | 59.07 | 34.47 | 1.71 : 1 | |||||
| 8 | 60.61 | 31.90 | 1.90 : 1 | |||||
| 9 | 45.52 | 39.18 | 1.16 : 1 | |||||
| 10 | 59.39 | 36.33 | 1.64 : 1 | |||||
| 11 | 57.73 | 35.30 | 1.63 : 1 | |||||
| Среднее | 61.11 | 33.75 | 1.81 : 1 | |||||
| 2 | 1 | 70.13 | 29.89 | 2.35 : 1 | Сушка на воздухе при 500°С в течение 2 ч | |||
| 2 | 78.88 | 21.12 | 3.74 : 1 | |||||
| 3 | 79.37 | 20.63 | 3.85 : 1 | |||||
| Среднее | 76.12 | 23.88 | 3.18 : 1 | |||||
| 3 | 1 | 83.16 | 16.84 | 4.94 : 1 | Сушка на воздухе при 700°С в течение 1 ч | |||
| 2 | 76.10 | 13.83 | 5.50 : 1 | |||||
| 3 | 81.11 | 16.90 | 4.80 : 1 | |||||
| 4 | 70.75 | 12.75 | 5.53 : 1 | |||||
| Среднее | 77.53 | 15.08 | 5.19 : 1 | |||||
| Температура выдержки, °С | Комнатная | 200 | 500 | 700 | ||||
| Pt : C, ат. | 1 : 1 | 9 : 5 | 16 : 5 | 26 : 5 | ||||
| Система Pt–C | PtC | Pt9C5 | Pt16C5 | Pt26C5 | ||||
Во всех исследованных образцах продуктов деструкции КП не обнаружен кислород. Таким образом, продукты деструкции не содержат СО при большом содержании углерода. Это подтверждают и результаты ИК-спектроскопии, показавшие быстрое удаление СО-лигандов из КП. И это не может быть результатом только их высокой лабильности, но, скорее всего, сопровождается деструкцией молекул СО по реакции, обратной реакции Белла–Будуара:
которую могут катализировать наночастицы платины на своих дефектах [14]. Возможна также диссоциация адсорбированных молекул СО с последующей диффузией атомов углерода внутрь кристаллической решетки платины [22].Результаты исследований методом РЭМ показывают, что с увеличением температуры выдержки [Pt(CO)2]n в полученных продуктах уменьшается содержание углерода по сравнению с платиной. Но дальнейшая длительная выдержка КП при 1000°С не приводит к полному удалению углерода. После растворения выдержанных при 1000°С платиновых губок в царской водке остается ~0.1% углеродных субстанций в виде нитей, зерен, имеющих высокую абразивность. Такое количество согласуется с данными РФА отожженного образца, где малое содержание углеродных субстанций не детектируется.
ЗАКЛЮЧЕНИЕ
Совокупность результатов рентгенофазового анализа, ИК-спектроскопии, термографии и анализа состава продуктов деструкции [Pt(CO)2]n позволяет сделать следующие выводы.
1. Олигомерный карбонил платины [Pt(CO)2]n неустойчив на воздухе при комнатной температуре и быстро разлагается с потерей СО-лигандов.
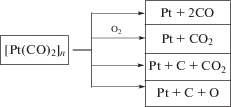
2. Потеря СО-лигандов происходит как за счет их удаления из комплекса из-за их высокой лабильности, так и в результате диссоциации СО за счет катализа наночастицами платины по реакции (4). Кроме того, активные СО-лиганды могут окисляться кислородом воздуха. Процесс деструкции карбонила платины [Pt(CO)2]n можно представить следующей схемой:
3. В образцах системы Pt–С углерод находится в аморфной форме, и атомы углерода частично находятся в состоянии sp3-гибридизации.
4. При нагревании на воздухе содержание углерода в системе Pt–С уменьшается с ростом температуры, но и при длительном прокаливании при температуре 1000°С углерод полностью не удаляется из системы и остается в количестве ~0.1% от массы платины в форме зерен и нитей, обладающих высокой абразивностью.
Список литературы
Спицын В.И., Федосеев И.В. Карбонильные комплексы платиновых металлов. М.: Наука, 1980. 200 с.
Booth G., Chatt J., Chini P. // Chem. Commun. 1965. V. 24. P. 639. https://doi.org/10.1039/C19650000639
Матвеев К.И., Рачковская Л.Н., Еременко Н.К. // Изв. СО АН СССР. 1968. Вып. 2. № 4. С. 81.
Sano I. // Bull. Chem. Soc. Jpn. 1934. V. 9. P. 320.
Гельман (Никитина) А. Комплексные соединения платины с ненасыщенными молекулами. М.–Л.: Изв. АН СССР, 1945. 96 с.
Спицын В.И., Федосеев И.В. // Докл. АН СССР. 1977. Т. 236. № 6. С. 1415.
Спицын В.И., Федосеев И.В. // Докл. АН СССР. 1977. Т. 237. № 2. С. 398.
Спицын В.И., Федосеев И.В. // Журн. неорган. химии. 1986. Т. 31. № 7. С. 1800.
Abild-Pedersen F., Anderson M.P. // Surf. Sci. 2007. V. 601. № 7. P. 1747. https://doi.org/10.1016/j.susc.2007.01.052
Kratzl K., Kratky T., Günther S. et al. // J. Am. Chem. Soc. 2019. V. 141. P. 13962. https://doi.org/10.1021/jacs.9b07083
Nováková J. // Phys. Chem. Chem. Phys. 2001. V. 3. P. 2704. https://doi.org/10.1039/B101307F
Stoppa A., Termentzidis K., Paier G. et al. // Phys. Rev. B. 2007. V. 76. P. 195440. https://doi.org/10.1103/PhysRevB.76.195440
Steckel J., Eichler A., Hafner J. // Phys. Rev. B. 2003. V. 68. № 8. P. 085416. https://doi.org/10.1103/PhysRevB.68.085416
Gil A., Clotet A., Ricart J.M. et al. // Surf. Sci. 2003. V. 530. P. 71. https://doi.org/10.1016/S0039-6028(03)00307-8
Lin W., Zhu Y.F., Lian J.S., Jiang Q. // J. Phys. Chem., C. 2007. V. 111. P. 1005. https://doi.org/10.1021/jp0661488
Sorbelli D., Belpassi L., Tarantelli F., Belanzoni P. // Inorg. Chem. 2018. V. 57. P. 6161. https://doi.org/10.1021/acs.inorgchem.8b00765
Berti B., Cesari C., Conte F. et al. // Inorg. Chem. 2018. V. 57. P. 7578. https://doi.org/10.1021/acs.inorgchem.8b00447
Cesari C., Ciabatti I., Femoni C. et al. // Inorg. Chem. 2017. V. 56. P. 1655. https://doi.org/10.1021/acs.inorgchem.6b02750
Robertson J. // Mater. Sci. Eng. R. 2002. V. 37. P. 129. https://doi.org/10.1016/S0927-796X(02)00005-0
Fujii Y., Maruyama M., Cuong N.T., Okada S. // Phys. Rev. Lett. 2020. V. 125. P. 016001. https://doi.org/10.1103/PhysRevLett.125.016001
Федосеев И.В., Шевельков А.В., Васекин В.В. и др. // Журн. неорган. химии. 2020. Т. 65. № 2. С. 162. https://doi.org/10.31857/S0044457X20020038
Balmes A., Resta A., Wermeiller D. et al. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 4796. https://doi.org/10.1039/C2CP22873D
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии