Журнал неорганической химии, 2021, T. 66, № 3, стр. 382-388
Исследование системы KLa(SO4)2 · H2O–SrSO4 · 0.5H2O
Н. Н. Бушуев a, *, Г. С. Тюльбенджян a, Ю. А. Великодный b, А. Н. Егорова a, Т. Б. Шаталова b
a Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская площадь, 9, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: nbushuev@muctr.ru
Поступила в редакцию 23.06.2020
После доработки 14.09.2020
Принята к публикации 20.09.2020
Аннотация
Методами рентгенофазового, дифференциального термогравиметрического анализа и электронной микроскопии исследована система КLa(SO4)2 · H2O–SrSO4 · 0.5H2O. Определены пределы существования двух типов твердых растворов: на основе структуры гексагональной модификации α-SrSO4 · 0.5H2O в концентрационном интервале 10–70 мол. % SrSO4 · 0.5H2O и на основе структуры ромбической модификации β-SrSO4 · 0.5H2O в концентрационном интервале 85–100 мол. % SrSO4 · 0.5H2O.
ВВЕДЕНИЕ
Ромбическая модификация безводного СаSO4 является хорошим абсорбентом лантаноидов в виде NaLn(SO4)2, где Ln = La, Ce, Nd, в результате гетеровалентного замещения двух ионов Ca2+ на ионы Na+ и Ln3+, имеющие близкие ионные радиусы. В работах [1–4] методом твердофазных реакций исследованы бинарные системы СаSO4–NaLn(SO4)2 и определены области указанного выше изоморфного замещения. В работах [5, 6] установлены пределы аналогичного изоморфного замещения в структуре гексагональной модификации CaSO4 · 0.5H2O. При изоморфном замещении в системе CaSO4 · · 0.5H2O–CePO4 · 0.5H2O происходит одновременная компенсация зарядов в катионной (3Сa2+ = 2Ce3+) и анионной (3[SO4]2– = 2[PO4]3–) подрешетках структуры. Этот процесс требует больше времени для достижения равновесия по сравнению с системой CaSO4 · 0.5H2O–NaCe(SO4)2 · H2O. Структура LnPO4 · 0.5H2O наиболее устойчива для лантаноидов цериевой группы (La–Sm) [7]. В фосфорной кислоте (38 мас. % P2O5) реализуется структурная форма CePO4 · 0.5H2O, изоморфная CaSO4 · 0.5H2O [8, 9]. Эти соединения образуют широкую область твердых растворов на основе структуры CaSO4 · 0.5H2O. Структурное родство CaSO4 · 0.5H2O и указанных соединений РЗЭ позволяет использовать полугидрат сульфата кальция в качестве затравочного материала для сорбционного извлечения лантаноидов из растворов экстракционной фосфорной кислоты (ЭФК) с образованием твердых растворов на основе структуры CaSO4 · 0.5H2O. Поиск дешевых адсорбентов РЗЭ из ЭФК без использования дорогостоящих ионообменных смол [10] или органических экстрагентов [11], в том числе на основе широко известного CaSO4 · 0.5H2O, имеет важное научное и практическое значение. Как показано в работе [12], присутствие солей натрия в растворах ЭФК приводит к уменьшению концентрации лантаноидов в жидкой фазе и образованию осадков NaLn(SO4)2 · H2O, где Ln = La–Sm. Однако использование абсорбционной способности ионов лантаноидов кристаллической матрицей СаSO4 или CaSO4 · 0.5H2O приводит к ряду существенных затруднений в процессе отделения соединений кальция от соединений лантаноидов [13–15].
Методами твердофазного синтеза при температуре выше 550°С была исследована безводная система СаSO4–KLa(SO4)2, в которой не установлено образование промежуточных соединений или областей твердых растворов, что исключает возможность изоморфного включения лантаноидов в структуру безводной модификации CaSO4 с участием ионов калия по схеме гетеровалентного замещения K+ + La3+ = 2Ca2+ вследствие большого различия их ионных радиусов [16].
Целью настоящей работы является изучение возможности гетеровалентного замещения достаточно близких по размеру ионов K+ + La3+ = 2Sr2+, что может предполагать использование SrSO4 в качестве матрицы для извлечения РЗЭ из различных сульфатных систем калия и лантаноидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Первый этап работы заключался в исследовании безводной системы KLa(SO4)2–SrSO4 и изучении возможности образования кристаллогидратных форм в системе КLa(SO4)2 · H2O–SrSO4 · 0.5H2O. Твердофазное взаимодействие исходных компонентов осуществлялось в широком концентрационном и температурном интервале с целью выяснения возможности образования индивидуальных соединений или твердых растворов в результате возможного гетеровалентного замещения K+ + La3+ = 2Sr2+ в катионной подрешетке структуры сульфатов.
Образцы для исследования безводной системы КLa(SO4)2–SrSO4 готовили смешиванием стехиометрических количеств КLa(SO4)2, предварительно синтезированного методом твердофазных реакций при температуре 500°С исходя из K2SO4 (ч. д. а.) и La2(SO4)3 (ч. д. а.), и образцов SrSO4 (ч. д. а.) с шагом 10 мол. %. Образцы в количестве 1–2 г тщательно смешивали, перетирали в агатовой ступке и подвергали отжигу при 550°С в течение 30 ч с промежуточным перетиранием через каждые 5 ч отжига с целью увеличения скорости твердофазных реакций и достижения состояния равновесия.
В результате выполненных исследований, включающих рентгенографический анализ, в системе KLa(SO4)2–SrSO4 не установлено какое-либо взаимодействие. Все образцы с различными стехиометрическими составами, отожженные ниже температуры разложения KLa(SO4)2 (905°С), содержали фазы исходных KLa(SO4)2 и SrSO4 без видимого смещения дифракционных линий на соответствующих рентгенограммах, что исключает существование областей твердых растворов в указанной безводной системе.
С целью исследования возможности образования кристаллогидратных соединений в системе KLa(SO4)2 · H2O – SrSO4 · 0.5H2O образцы с шагом 5–10 мол. % (при необходимости 2–3 мол. %) готовили из растворов с концентрацией нитрата калия и нитрата лантана 1 моль/л, с одной стороны, и раствора с концентрацией 1 моль/л нитрата стронция – с другой. Осаждение сульфатных осадков осуществляли внесением эквивалентного количества серной кислоты с концентрацией 1 моль/л в подготовленные смеси растворов нитратов. Полученные осадки тщательно отфильтровывали на мелкопористом стеклянном нутч-фильтре № 4 и промывали небольшим количеством этилового спирта для удаления остаточной адсорбированной влаги.
Рентгенографический анализ выполняли с помощью фокусирующей камеры-монохроматора G-670 фирмы HUBER (CuKα1-излучение, шаг измерения 2θ 0.005°) и программного комплекса WinXPOW (version 2.20 2006 г.) фирмы STOE. Термогравиметрический анализ (ТГА) и дифференциальную сканирующую калориметрию (ДСК) образцов проводили на синхронном термоанализаторе Netzsch STA 409 PC в режиме ТГ–ДСК в динамическом потоке воздуха (30 мл/мин) при нагреве до 1000 или 1400°С со скоростью 1 град/мин. Образцы сульфатов массой 10 мг помещали в корундовый тигель и нагревали. Микроскопическое исследование концентратов РЗЭ выполнено в аналитическом центре ЦКП РХТУ им. Д.И. Менделеева с использованием растрового электронного микроскопа JEOL JSM-6510LV, оснащенного камерой X-max 20 мм.
Методом рентгенофазового анализа установлена кристаллизация чистого однофазного моногидрата состава KLa(SO4)2 · H2O с параметрами тригональной ячейки a = 7.172(2), с = 13.286(2) Å (пр. гр. P3221), очень близкими к параметрам этого соединения (a = 7.149, c = 13.244 Å), полученного в работе [17]. Аналогичным образом – смешиванием растворов нитрата стронция и серной кислоты с концентрацией 1 моль/л – нами получен осадок чистого безводного сульфата стронция SrSO4, кристаллизующегося в ромбической сингонии с параметрами а = 8.369(2), b = 5.355(2), c = 6.875(2) Å, V = 307.0(3) Å3, которые очень близки к параметрам SrSO4, определенным в работах [18, 19].
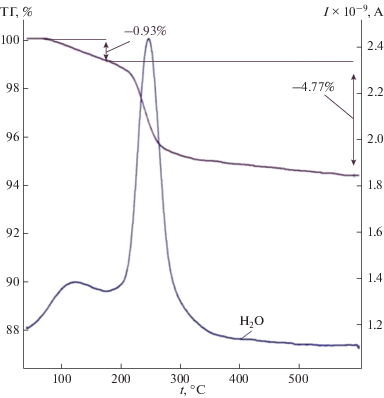
На рис. 1 приведена кривая потери массы (ТГ) образца исходного КLa(SO4)2 · H2O, из которой видно, что при температуре 250–260°С происходит удаление всей кристаллогидратной воды. В результате термогравиметрических исследований системы KLa(SO4)2 · H2O–SrSO4 · 0.5H2O установлено, что кристаллогидратная вода в синтезированных образцах существует во всем концентрационном интервале, а ее количественное содержание позволяет рассматривать систему KLa(SO4)2 · H2O–SrSO4 · 0.5H2O как квазибинарную.
Гетеровалентное замещение двух ионов стронция на ионы калия и лантана стабилизирует существование метастабильной модификации полугидратной формы SrSO4 · 0.5H2O. В концентрационном интервале от 100 до 85 мол. % SrSO4 · 0.5H2O установлено существование области гомогенности, представляющей собой твердый раствор на основе структуры ромбической модификации β-SrSO4 · 0.5H2O. В интервале концентраций 70–10 мол. % SrSO4 · 0.5H2O образуется твердый раствор на основе гексагональной структуры α-SrSO4 · 0.5H2O, достаточно близкой к гексагональной модификации KLa(SO4)2 · H2O. В концентрационном интервале 10–0 мол. % SrSO4 · 0.5H2O существует двухфазная область, включающая исходный KLa(SO4)2 · H2O и образовавшийся твердый раствор на основе структуры α-SrSO4 · 0.5H2O. Изоморфное гетеровалентное замещение двух атомов стронция на атомы калия и лантана в гексагональной структуре твердого раствора α-SrSO4 · 0.5H2O протекает без строгого чередования атомов K, La, Sr. Такое статистическое распределение этих атомов сопровождается исчезновением некоторых дифракционных линий на соответствующих рентгенограммах. Статистическое расположение атомов в катионной подрешетке твердого раствора на основе α-SrSO4 · 0.5H2O приводит к уменьшению параметра с в 2 раза по сравнению с параметром с достаточно близкой гексагональной структуры исходного образца KLa(SO4)2 · H2O. В табл. 1 представлены результаты индицирования линий рентгенограммы образца твердого раствора состава 33.3 мол. % KLa(SO4)2 · H2O + 66.7 мол. % SrSO4 · · 0.5H2O, свидетельствующие о его однофазности. Параметры его гексагональной элементарной ячейки равны: а = 7.208(2), c = 6.642(2) Å, V = = 298.9(2) Å3 (гексагональный тип структуры α-SrSO4 · 0.5H2O). Существование подобной гексагональной модификации с близкими параметрами отмечалось нами в работах [18, 19], а также в работах других исследователей [20, 21].
Таблица 1.
Результаты индицирования линий рентгенограммы образца состава 33.3 мол. % KLa(SO4)2 · H2O + + 66.7 мол. % SrSO4 · 0.5H2O
| d, Å | I, % | hkl | 2θэксп, град | 2θрасч, град | 2θэксп – 2θрасч, град |
|---|---|---|---|---|---|
| 6.241 | 51.2 | 100 | 14.179 | 14.176 | 0.0036 |
| 4.547 | 16.1 | 101 | 19.506 | 19.499 | 0.0065 |
| 3.605 | 62.0 | 110 | 24.678 | 24.681 | –0.0025 |
| 3.162 | 2.7 | 111 | 28.203 | 28.147 | 0.0562 |
| 3.122 | 98.1 | 200 | 28.569 | 28.574 | –0.0056 |
| 2.932 | 100.0 | 102 | 30.467 | 30.466 | 0.0017 |
| 2.825 | 0.9 | 201 | 31.643 | 31.648 | –0.0048 |
| 2.442 | 15.0 | 112 | 36.769 | 36.771 | –0.0025 |
| 2.360 | 10.4 | 210 | 38.109 | 38.109 | 0.0007 |
| 2.274 | 6.1 | 202 | 39.601 | 39.594 | 0.0066 |
| 2.224 | 32.4 | 211 | 40.539 | 40.541 | –0.0020 |
| 2.217 | 14.9 | 003 | 40.661 | 40.724 | –0.0622 |
| 2.086 | 2.2 | 103 | 43.335 | 43.330 | 0.0055 |
| 1.9859 | 12.9 | 301 | 45.646 | 45.650 | –0.0045 |
| 1.9236 | 55.0 | 212 | 47.211 | 47.217 | –0.0057 |
| 1.8863 | 3.3 | 113 | 48.203 | 48.202 | 0.0015 |
| 1.8042 | 11.6 | 203 | 50.549 | 50.501 | 0.0476 |
| 1.7636 | 20.1 | 302 | 51.796 | 51.806 | –0.0102 |
| 1.7398 | 1.5 | 221 | 52.559 | 52.578 | –0.0192 |
| 1.7318 | 18.4 | 310 | 52.822 | 52.833 | –0.0117 |
| 1.6754 | 2.8 | 311 | 54.745 | 54.744 | 0.0016 |
| 1.6158 | 1.0 | 213 | 56.942 | 56.995 | –0.0529 |
| 1.6049 | 4.9 | 104 | 57.366 | 57.378 | –0.0125 |
| 1.5842 | 4.3 | 222 | 58.188 | 58.199 | –0.0106 |
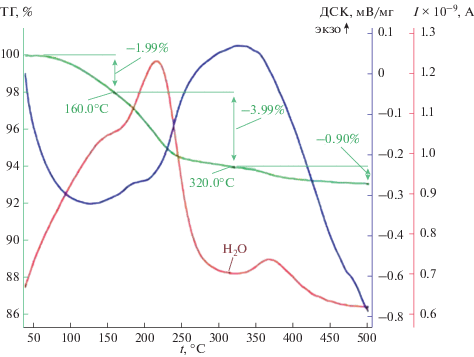
На рис. 2 представлена термограмма образца 33.3 мол. % KLa(SO4)2 · H2O + 66.7 мол. % SrSO4 · · 0.5H2O, из которой видно, что основная потеря кристаллогидратной воды происходит в интервале температур 230–250°С, что близко к температуре дегидратации исходного чистого образца KLa(SO4)2 · H2O. Остаточное количество воды удаляется при 350°С.
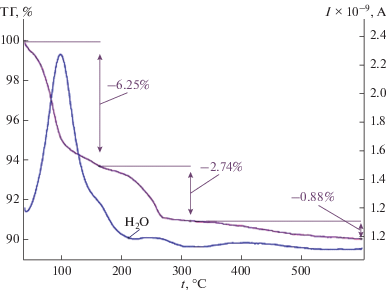
При температуре 250–260°С кристаллогидратная вода удаляется из образцов всех составов в системе KLa(SO4)2 · H2O–SrSO4 · 0.5H2O (рис. 3).
На рис. 4a и 4б приведены соответственно электронные фотографии кристаллов исходного соединения KLa(SO4)2 · H2O и гексагональных кристаллов твердого раствора состава 33.3 мол. % KLa(SO4)2 · H2O + 66.7 мол. % SrSO4 · 0.5H2O.
Рис. 4.
Макроснимки образцов: а – KLa(SO4)2 · H2O (×1000), б и в – 33.3 мол. % KLa(SO4)2 · H2O + + 66.7 мол. % SrSO4 · 0.5H2O (×1000 и ×5000 соответственно).

Как видно из фотографий, образование твердого раствора сопровождается уменьшением размеров кристаллов по сравнению с размером кристаллов KLa(SO4)2 · H2O. На рис. 4в приведена электронная фотография кристаллов твердого раствора (увеличение ×5000), на которой отчетливо видна игольчатая форма, характерная для гексагональных кристаллитов.
На рис. 5а и 5б приведены соответственно электронные фотографии кристаллов исходного соединения SrSO4 и кристаллов впервые обнаруженного нами твердого раствора на основе ромбической модификации β-SrSO4 · 0.5H2O.
Рис. 5.
Макроснимки образцов: а – SrSO4 (×1000), б и в – 11 мол. % KLa(SO4)2 · H2O + 89 мол. % SrSO4· · 0.5H2O (×1000 и ×5000 соответственно).

Образование твердого раствора также сопровождается уменьшением размеров кристаллов по сравнению с образцом безводного ромбического SrSO4. При увеличении в 5000 раз отчетливо видна характерная ромбическая огранка (рис. 5в). Параметры элементарной ромбической ячейки твердого раствора 11 мол. % KLa(SO4)2 · H2O + + 89 мол. % SrSO4 · 0.5H2O на основе ромбической модификации β-SrSO4 · 0.5H2O составляют: a = 8.389(2), b = 5.364(2), c = 6.879(2) Å, V = 310(3) Å3.
Следует отметить, что образцы в интервале концентраций 85–70 мол. % SrSO4 · 0.5H2O содержат как β-SrSO4 · 0.5H2O, так и α-SrSO4 · 0.5H2O. Такое неустойчивое состояние сопровождается образованием рентгеноаморфной фазы, состав которой ориентировочно отвечает SrSO4 · 2H2O. На рис. 3 приведена кривая потери массы (TГ) при нагревании образца, содержащего 80 мол. % SrSO4 · 0.5H2O. Видно, что исходный образец содержит избыточное количество адсорбированной влаги по сравнению со стехиометрическим содержанием влаги в системе КLa(SO4)2 · H2O–SrSO4 · 0.5H2O. При нагревании этого образца при 120°С происходит интенсивная потеря воды в результате разложения предполагаемой фазы SrSO4 · 2H2O. Как видно из термограмм, приведенных на рис. 2 и 3, окончательная потеря кристаллогидратной воды завершается при температуре 230–250°С, что характерно для всех образцов системы КLa(SO4)2 · · H2O–SrSO4 · 0.5H2O. Определить точный состав и структуру рентгеноаморфной фазы, существующей в области концентраций 85–70 мол. % SrSO4 · 0.5H2O, нам не удалось. Однако на рентгенограмме образца 80 мол. % SrSO4 · 0.5H2O нами обнаружены следы метастабильной моноклинной модификации сульфата стронция с неуказанным количеством кристаллогидратной воды, упомянутой в работе Takahashi S. [22].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Авторами [20] установлено образование гексагональной кристаллогидратной формы SrSO4 · 0.5H2O с параметрами ячейки а = 7.178, b = c = 6.589 Å, которая существует при нормальной влажности, давлении и комнатной температуре только в течение 120 мин. В отличие от работы [20], образцы полученного нами твердого раствора на основе SrSO4 · 0.5H2O, имеющие аналогичную гексагональную структуру, достаточно устойчивы и стабилизированы за счет гетеровалентного замещения 2Sr2+ = K+ + La3+. Например, твердый раствор состава 33.3 мол. % KLa(SO4)2 · H2O + + 66.7 мол. % SrSO4 · 0.5H2O может существовать в течение нескольких месяцев при обычных условиях. При нагревании гексагональный полугидрат сульфата стронция SrSO4 · 0.5H2O полностью обезвоживается с переходом в ромбическую структуру SrSO4. Изоморфное замещение двух ионов Sr2+ на ионы K+ и La3+ в областях существования твердых растворов с ростом содержания KLa(SO4)2 · H2O сопровождается незначительным увеличением объема элементарной ячейки вследствие большего размера иона K+ (1.38 Å) по сравнению с ионом Sr2+ (1.16 Å) [23].
В результате проведенного исследования установлено, что в концентрационной области 100–90 мол. % SrSO4 ∙ 0.5H2O существует твердый раствор на основе ромбической структуры β-SrSO4 ∙ ∙ 0.5H2O, содержащий кристаллогидратную воду. Увеличение объема элементарной ячейки от 307.7 Å3 (100 мол. % SrSO4 ∙ 0.5H2O) до 310.0 Å3 (90 мол. % SrSO4 ∙ 0.5H2O) объясняется замещением ионов стронция на более крупные ионы калия. В концентрационной области 90–70 мол. % SrSO4 ∙ 0.5H2O существует два вида твердых растворов: на основе ромбической модификации β-SrSO4 ∙ 0.5H2O и на основе гексагональной модификации α-SrSO4 · 0.5H2O. В концентрационной области 70–10 мол. % α-SrSO4 · 0.5H2O сохраняется область твердого раствора на основе гексагональной структуры α-SrSO4 · 0.5H2O с увеличением объема элементарной ячейки от 297.6 до 300.7 Å3. В области концентраций 10–0 мол. % SrSO4 · 0.5H2O присутствуют две фазы: исходный КLa(SO4)2 · H2O и твердый раствор на основе α-SrSO4 · 0.5H2O.
Установленное нами существование различных неустойчивых кристаллогидратных форм сульфата стронция позволяет предположить следующую схему превращений при нагревании с последовательным повышением симметрии кристаллизующихся фаз: SrSO4 · 2H2O (возможно, моноклинная) → SrSO4 · 0.5H2O (ромбическая) → → SrSO4 · 0.5H2O (гексагональная) → SrSO4 (ромбическая) → SrSO4 (кубическая выше 1280°С). Эта схема аналогична предложенной нами [24] для фазовых превращений сульфата кальция в процессе нагревания: СаSO4 · 2H2O (моноклинная) → → СаSO4 · 0.5H2O (моноклинная–псевдогексагональная) → СаSO4 · 0.5H2O (гексагональная) → → СаSO4 (ромбическая) → СаSO4 (кубическая выше 1200°С).
Установленная нами возможность гетеровалентного замещения ионов по схеме 2Sr2+ = K+ + La3+ с образованием твердых растворов на основе SrSO4 предполагает его использование в качестве абсорбента для извлечения РЗЭ из различных водосодержащих сульфатных систем калия и лантана. Отжиг полученных кристаллогидратных форм твердых растворов на основе ромбической или гексагональной модификации SrSO4 · 0.5H2O при температурах выше 250–260°С предполагает разложение твердого раствора c образованием практически нерастворимой безводной ромбической модификации SrSO4 и достаточно растворимой фазы KLa(SO4)2, растворимость которой в 20–50 раз выше по сравнению с SrSO4 [12]. В результате водной обработки или при выщелачивании отожженных образцов возможно полное отделение лантаноидов от стронция.
ЗАКЛЮЧЕНИЕ
Впервые изучены фазовые равновесия в системах KLa(SO4)2–SrSO4 и KLa(SO4)2 · H2O–SrSO4 · 0.5H2O. Взаимное растворение компонентов в безводной системе не обнаружено. В системе, образованной кристаллогидратами, установлено существование твердых растворов на основе структур ромбической и гексагональной модификации SrSO4 · 0.5H2O. Возможность протекания гетеровалентного замещения 2Sr2+ = K+ + La3+ в этой системе, приводящего к образованию твердых растворов, позволяет предполагать перспективность использования SrSO4 в качестве матрицы для извлечения РЗЭ из различных сульфатных систем калия и лантаноидов, что предполагает практическую значимость предпринятого авторами исследования.
Список литературы
Бушуев Н.Н. Физико-химическое исследование структурных особенностей сульфата кальция / Сер. Минеральные удобрения и серная кислота. М.: НИИТЭХИМ, 1990. 31 с.
Bushuev N.N., Tavrovskaya A.Ya., Babaev S.N., Egorova A.N. // Russ. J. Inorg. Chem. 1989. V. 34. № 1. P. 100. [Бушуев Н.Н., Тавровская А.Я., Бабаев С.И., Егорова А.Н. // Журн. неорган. химии. 1989. Т. 34. № 3. С. 179.]
Bushuev N.N., Efremov O.I., Tavrovskaya A.Ya. // Russ. J. Inorg. Chem. 1988. V. 33. № 3. P. 418. [Бушуев Н.Н., Ефремов О.Н., Тавровская А.Я. // Журн. неорган. химии. 1988. Т. 33. № 3. С. 743.]
Bushuev N.N., Tavrovskaya A.Ya., Zaitsev P.M. // Russ. J. Inorg. Chem. 1988. V. 33. № 9. P. 1384. [Бушуев Н.Н., Тавровская А.Я., Зайцев П.М. // Журн. неорган. химии. 1988. Т. 33. № 9. С. 2420.]
Бушуев Н.Н., Набиев А.Г., Классен П.В. Влияние примесей на кристаллизацию сульфата кальция в производстве экстракционной фосфорной кислоты. Сер. Минеральные удобрения и серная кислота. М.: НИИТЭХИМ, 1990. 36 с.
Bushuev N.N., Nabiev A.G., Petropavlovskiy I.A., Smirnova I.S. // Russ. J. Appl. Chem. 1988. V. 61. № 10. P. 1973. [Бушуев Н.Н., Набиев А.Г., Петропавловский И.А., Смирнова И.С.// Журн. прикл. химии. 1988. Т. 61. № 10. С. 2153.]
Rafiuddin M.R., Grosvenor A.P. // Inorg. Chem. 2016. V. 55. № 19. P. 9685.
Skogareva L.S., Shekunova T.O., Baranchikov A.E. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 10. P. 1219. [Скогарева Л.С., Шекунова Т.О., Баранчиков А.Е. и др. // Журн. неорган. химии. 2016. Т. 61. № 10. С. 1276.]
Mesbah A., Clavier N., Elkaim E. // Cryst. Growth Des. 2014. V. 14. № 10. P. 5090.
Kumar B.N., Radhika S., Reddy B.R. // Chem. Eng. J. 2010. V. 160. № 1. P. 138.
Radhika S., Kumar B.N., Kantam M.L., Reddy B.R. // Separation Purification Technol. 2010. V. 75. № 3. P. 295.
Lokshin E.P., Tareeva O.A., Kashulina T.G. // Russ. J. Appl. Chem. 2008. V. 81. № 1. P. 1. [Локшин Е.П., Тареева О.А., Кашулина Т.Г. // Журн. прикл. химии. 2008. Т. 81. № 1. С. 3.]
Bushuev N.N., Zinin D.S. // Russ. J. Inorg. Chem. 2016. V. 61. № 2. Р. 161. [Бушуев Н.Н., Зинин Д.С. // Журн. неорган. химии. 2016. Т. 61. № 2. С. 173.]
Zinin D.S., Bushuev N.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. Р. 251. [Зинин Д.С., Бушуев Н.Н. // Журн. неорган. химии. 2018. Т. 63. № 2. С. 239.]
Zinin D.S., Bushuev N.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 9. Р. 1211. [Зинин Д.С., Бушуев Н.Н. // Журн. неорган. химии. 2018. Т. 63. № 9. С. 1189.]
Тюльбенджян Г.С., Бушуев Н.Н. // Успехи в химии и хим. технологии. 2017. Т. 31. № 4. С. 61.
Kazmierczak K., Henning A. Höppe // J. Solid State Chem. 2010. V. 183. № 9. P. 2087.
Bushuev N.N., Nabiev A.G. // Russ. J. Inorg. Chem. 1988. V. 33. № 11. Р. 1708. [Бушуев Н.Н., Набиев А.Г. // Журн. неорган. химии. 1988. Т. 33. № 11. С. 2962.]
Bushuev N.N., Nikonova N.S., Mishenina N.V. // Russ. J. Inorg. Chem. 1988. V. 33. № 2. Р. 2991. [Бушуев Н.Н., Никонова Н.С., Мишенина Н.В. // Журн. неорган. химии. 1988. Т. 33. № 2. С. 531.]
Satoshi Takahashi, Masanobu Seki, Katsumi Setoyama // Bull. Chem. Soc. Jpn. 1993. V. 66. P. 2219.
Carlos M. Pina, Alvaro Tamayo // Geochim. Cosmochim. Acta. 2012. V. 92. P. 220.
ICDD. card № 44-0375 // Takahashi S. // Kougakuin University. Japan. Private Communication. 1993.
Shannon R.D., Prewitt C.T. // Acta Crystallogr. 1969. V. 25. P. 925.
Bushuev N.N., Maslennikov B.M., Borisov V.M. // Russ. J. Inorg. Chem. 1983. V. 28. № 10. Р. 1404. [Бушуев Н.Н., Масленников Б.М., Борисов В.М. // Журн. неорган. химии. 1983. Т. 28. № 10. С. 2469.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии