Журнал неорганической химии, 2021, T. 66, № 11, стр. 1632-1644
Наночастицы пероксида цинка: мицеллярный синтез, получение пленок
В. В. Татарчук a, *, С. А. Громилов a, Е. А. Максимовский a, П. Е. Плюснин a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: tat@niic.nsc.ru
Поступила в редакцию 06.03.2021
После доработки 23.05.2021
Принята к публикации 27.05.2021
Аннотация
Исследованы наночастицы (НЧ) ZnO2, которые благодаря полупроводниковым и окислительным свойствам представляются перспективными при разработке новых материалов в области оптоэлектроники, фотокатализа, сенсорики, биомедицины и тераностики. Опробован синтез НЧ ZnO2 в дисперсных системах на основе липофильных поверхностно-активных веществ (ПАВ). Показана возможность простого синтеза НЧ ZnO2 размером ~5 нм по реакции Zn(CH3COO)2 и H2O2 в обратных мицеллах и эмульсиях ПАВ Brij 30, Span 80 и AOT. Установлено, что тип дисперсной системы и природа ПАВ изученного ряда не оказывают сильного влияния на размер НЧ. Порошок НЧ ZnO2 проявляет фотолюминесценцию с максимумом эмиссии при 520 нм, при нагревании разлагается до ZnO с выделением кислорода и экзотермическим эффектом с максимумом при 213°C. С использованием органозолей НЧ ZnO2 и их смеси с НЧ Au получены пленки на подложках из стекла и полиэтилентерефталата, а также пленки ZnO за счет прогревания пленок ZnO2. Пленки ZnO2 и ZnO имеют зернистую морфологию, композитные пленки ZnO2 и Au – островковую на основе сфероидальных агломератов НЧ Au с вкраплениями нанокристаллов ZnO2.
ВВЕДЕНИЕ
Пероксид цинка хорошо известен и находит широкое применение. В литературе имеются указания на использование ZnO2 в производстве резины и переработке пластиковых отходов, во взрывчатых и пиротехнических смесях, в косметике и фармакологии, в фотокатализе [1, 2]. Для новых функциональных наноматериалов пероксид цинка интересен в первую очередь двумя свойствами: полупроводниковыми и окислительными.
Пероксид цинка ZnO2 является непрямозонным полупроводником с шириной запрещенной зоны Eg ~ 4.5 эВ [3, 4], что открывает перспективы применения его НЧ в оптоэлектронных и фотокаталитических устройствах, в частности, в энергонезависимых ячейках компьютерной памяти [5, 6] и фотоэлементах [4], при изготовлении фотодиодов [7], а также для фотокаталитического восстановления CO2 [8] и разложения нитробензола [3].
Окислительные свойства НЧ ZnO2 и способность выделять активные формы кислорода (АФК) при нагревании свыше 190–200°C в твердой фазе или при показателе кислотности среды pH < 6–7.5 в водном растворе [9–11] представляют интерес для химического синтеза, экологии и биомедицины. Предложено использовать НЧ ZnO2 для окисления ароматических спиртов в карбонильные соединения [12], детоксикации боевых отравляющих веществ, в частности иприта [13], и отбеливания реакционной массы при переработке вторичного сырья полиэтилентерефталата (ПЭТ) [11]. Первое медицинское применение ZnO2 в качестве эффективного антисептика было реализовано еще в 1903 г., но широкую известность препарат получил после 1935 г. [14]. В наше время показана биосовместимость и безопасность НЧ ZnO2 на клеточном уровне [15]. Наибольший интерес вызывает применение НЧ ZnO2 в качестве pH-тригерного генератора АФК в клетках. Функционализированные или включенные в микрогели НЧ ZnO2 в зависимости от своего размера и состава, а также pH среды способны постепенно выделять кислород, обеспечивая пролонгированное бактерицидное действие [11, 16]. На примере синегнойной палочки показано, что НЧ ZnO2 оказывают антибактериальное действие на биопленки с множественной лекарственной устойчивостью [17] (отметим, что борьба с такими бактериальными пленками особенно актуальна для изолированных замкнутых пространств типа космических станций, подводных лодок и т.п.). На другом примере продемонстрировано, что НЧ ZnO2 после внедрения в опухолевые клетки мышей высвобождали экзогенные H2O2 и Zn2+, которые стимулировали выработку эндогенных АФК в митохондриях; такое кооперативное действие увеличивало уничтожение раковых клеток в результате суммарного окислительного стресса [18]. Хорошие перспективы для тераностики показали НЧ ZnO2, легированные парамагнитными ионами Mn2+, так как они позволяют проводить не только терапию больных клеток, но и МРТ-мониторинг процесса [18]. Кроме бактерицидных свойств НЧ ZnO2 показывают ранозаживляющее действие за счет усиления ангиогенеза – образования новых кровеносных сосудов, для которого, как известно, важную роль также играют АФК [19]. Существенно, что ZnO2 в НЧ и покрытиях после потери кислорода можно легко регенерировать для многократного использования в качестве антисептика, антибиообрастательного или противогрибкового агента [20].
Еще одно применение НЧ ZnO2 – в качестве прекурсоров НЧ ZnO и их пленок [7, 21–24]. Оксид цинка, в свою очередь, масштабно используется в производстве резины, красок и в пищевой индустрии [25, 26], а НЧ ZnO представляются перспективными для оптоэлектроники, тераностики, биомедицинской и химической сенсорики [27–32]. Применительно к получению “материалов с фазовым переходом” (Phase Change Materials, PCM), которые позволяют накапливать/отдавать тепло при фазовом переходе, НЧ ZnO2 также показали себя эффективными прекурсорами для создания внешних теплозащитных оболочек из НЧ ZnO поверх сферических микронных полимерных капсул, заполненных парафином [33].
Помимо всего прочего, НЧ ZnO2 оказались хорошими сорбентами при очистке сточных вод от красителей типа Конго красного [34].
Синтез НЧ ZnO2 в большинстве случаев проводят по реакции пероксида водорода с ацетатом цинка в растворах [4, 10–12, 15–19, 22–24, 34–36], применение в качестве прекурсоров НЧ ZnO [1] в последнее время не актуально. Относительно устойчивые НЧ ZnO2 при необходимости можно дополнительно стабилизировать введением в их состав оксидов марганца [37].
Для получения пленочно-слоевых структур и агломератов из НЧ ZnO2 на различных поверхностях предложены методы последовательной адсорбции и реакции ионного слоя – SILAR [7, 21, 38], окисления ZnO в процессе химического осаждения в ванне (CBD) [4], обработки пероксидом водорода готовых пленок ZnO [5, 6, 8], осаждения НЧ из золя ZnO2 [23].
В настоящей работе мы опробовали синтез НЧ ZnO2 в обратных мицеллах и эмульсиях ряда поверхностно-активных веществ (ПАВ) и получение пленок с использованием органозолей НЧ ZnO2 и их смеси с НЧ Au.
Кроме того, была сделана попытка мицеллярного синтеза НЧ ZnO2 с использованием вместо пероксида водорода его клатрата с карбамидом – гидроперита (NH2)2CO ⋅ H2O2. Выделенный при этом продукт, как оказалось, содержал лишь небольшое количество НЧ ZnO2, а основное вещество представляло собой игольчатые микрокристаллы лактата цинка [Zn(lact)2(H2O)2]. Эти данные изложены в отдельной публикации [39].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали следующие реактивы: ацетат цинка дигидрат “х. ч.”, (3-аминопропил)триэтоксисилан (≥98%, Sigma-Aldrich), 1,2-этандитиол (>90%, Technical grade, Aldrich), золото (+99.95%, проволока); маслорастворимые ПАВ: Brij 30 (Sigma-Aldrich), Tergitol NP-4 (99%, Dow Chemical Company), Span 80 (Sigma-Aldrich), AOT (97%, Sigma-Aldrich); растворители: н-декан “х. ч.”, ацетон “ос. ч.”, н-гептан “эталонный”, толуол “ос. ч.”, хлороформ “х. ч.”, этанол (ректификат); концентрированные водные растворы кислот HCl, HNO3 “х. ч.”, пероксида водорода “ч. д. а.” (~30%) и гидразина “х. ч.” (~20 М).
Водные растворы Zn(CH3COO)2 · 2H2O (1 М) и HAuCl4 (0.2 М) из металлического золота, а также растворы ПАВ (0.25 М) в декане, (3-аминопропил)триэтоксисилана (АПС, 0.02 М) в толуоле и этандитиола (ЭДТ, 0.01 М) в этаноле готовили по навескам реактивов согласно [40]. Обратномицеллярные растворы Zn(CH3COO)2, HAuCl4, H2O2 и N2H4 получали путем инъекционной солюбилизации порций их водных растворов объемом Vs в порции органического раствора 0.25 М Brij 30 объемом Vo. Солюбилизация сопровождалась обработкой растворов в ультразвуковой ванне “Сапфир” в течение 30 мин.
Для синтеза НЧ ZnO2 в обратных мицеллах ПАВ Brij 30 смешивали мицеллярные растворы соли цинка и пероксида водорода в объемном соотношении 1 : 1 и нагревали смесь при 60°C в течение 3 ч при перемешивании на магнитной мешалке. Полученный прозрачный бесцветный органозоль НЧ ZnO2 (cZn = 9 мМ, Vs/Vо = 0.02) охлаждали до комнатной температуры и использовали для получения пленок из НЧ ZnO2 и из смеси НЧ ZnO2 и Au. Для исследований в твердой фазе НЧ ZnO2 осаждали добавлением к части органозоля избытка хлороформа для разрушения мицелл; полученный белый осадок центрифугировали при 4000 об/мин, промывали деканом и 4 раза гептаном методом декантации, высушивали при 100°С и хранили в эксикаторе над Р2О5.
Органозоль НЧ Au (cAu = 5 мМ, Vs/Vо = 0.01) получали смешиванием обратномицеллярных растворов HAuCl4 и N2H4 [40], золь смеси НЧ (cZn = 4.3 мМ, cAu = 2.3 мМ, Vs/Vо = 0.015) – смешиванием равных объемов органозолей НЧ ZnO2 и Au.
Синтез НЧ ZnO2 в эмульсиях ПАВ проводили в стаканчиках при интенсивном магнитном перемешивании. К 10 мл раствора 0.25 М ПАВ в декане постепенно (в течение 3–4 мин) добавляли 2 мл водного раствора 1 М Zn(CH3COO)2, а затем по каплям 2 мл концентрированного водного раствора Н2О2 и продолжали перемешивание при комнатной температуре в течение 1 ч. Образовавшуюся белую эмульсию переливали в закрытую пробирку и оставляли расслаиваться. Отстаивание в течение 4 ч приводило к образованию мутных органической и водной фаз и белого осадка на дне. Осадок отделяли центрифугированием при 4000 об/мин (при этом фазы осветлялись), дважды промывали деканом и один раз гептаном методом декантации, хранили в гептане.
Подложками для пленок НЧ служили прямоугольные пластинки 12 × 5 × 1 мм, вырезанные из предметных стекол Levenhuk для микроскопов, и 40 × 8 × 0.1 мм, вырезанные из ПЭТ-пленок BASF для цветной струйной печати. Цикл нанесения НЧ на подготовленную подложку включал следующие последовательные операции с ней: контактирование с капиллярным слоем органозоля НЧ ZnO2 (или смеси НЧ ZnO2 и Au), промывку деканом, промывку этанолом, высушивание, контактирование с капиллярным слоем этанольного раствора ЭДТ как межслоевого линкера, промывку этанолом и высушивание. Процесс формирования пленки заключался в повторении этого цикла необходимое число раз (n). Методики подготовки подложек, включая очистку и модификацию их поверхности аминогруппами при помощи АПС, а также нанесения пленок путем хемосорбции НЧ из капиллярного слоя их коллоидной дисперсии изложены ранее [40–42]. Оборудование и условия исследования растворов, частиц и пленок методами УФ-видимой, ИК- и КР-спектроскопии, рентгенографии, фотолюминесценции (ФЛ), сканирующей электронной микроскопии (СЭМ), рентгеновской энергодисперсионной спектроскопии (ЭДС), четырехконтактного измерения поверхностного сопротивления уже были представлены в работах [41, 43].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
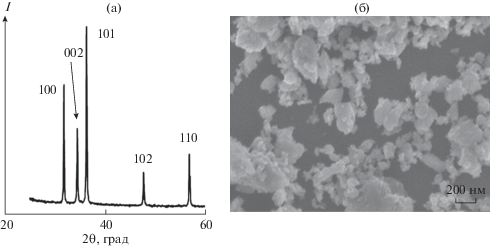
Синтез НЧ ZnO2. Рентгенофазовый анализ (РФА) продукта, синтезированного в обратных мицеллах Brij 30, показал наличие одной кристаллической фазы с рефлексами, типичными для кубической кристаллической структуры ZnO2 (рис. 1а): 2θ = 31.0° (индекс 111), 36.5° (200) и 53.0° (220), которые совпали с известными данными [10, 11]. Оценка размера области когерентного рассеяния (ОКР) по формуле Селякова–Шеррера составила 4–5 нм. Таким образом, относительно простой синтез НЧ в обратных мицеллах Brij 30 позволил получить НЧ ZnO2 небольшого размера, ненамного превышающие 2.4–3.6 нм, для которых используется более сложный синтез в специальном реакторе высокого давления [10, 11]. Недостатком мицеллярного синтеза является то, что он не позволяет получать органозоли с высокой концентрацией НЧ [44]. Это обусловлено уровнем величины объемного отношения Vs/Vо ~ ~ 10–2, необходимым для существования термодинамически стабильных и оптически прозрачных обратномицеллярных систем ПАВ. Учитывая связь концентраций, например общих молярных концентраций металла в конечном органозоле в форме НЧ (cо) и в исходной диспергируемой водной фазе в виде ионов (cдф) согласно уравнению cо = cдфVs/Vо, а также возможные значения Vs/Vо ~ 10–2 и cдф < ~1 М, верхний уровень оценки концентрации cо составил ~10–2 М.
Рис. 1.
Дифрактограммы (CuKα-излучение) продуктов синтеза в обратных мицеллах Brij 30 (а) и в эмульсиях ПАВ Brij 30 (1), Span 80 (2) и АОТ (3). Показаны индексы отражений ZnO2 (a = 4.871 Å, пр. гр. $Pa\bar {3},$ № PDF 01-077-2414).
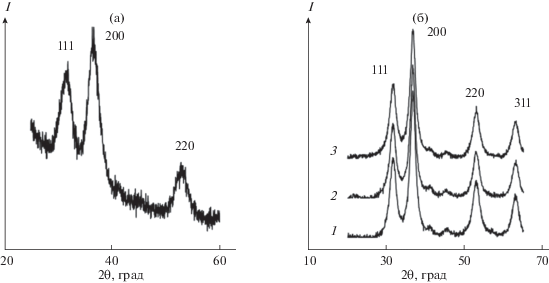
Концентрационные ограничения можно преодолеть при синтезе НЧ в эмульсиях, где может быть достигнуто отношение Vs/Vо ~ 9 [44, 45]. Мы протестировали синтез НЧ ZnO2 в эмульсиях с использованием четырех разных ПАВ: Brij 30, Tergitol NP-4, Span 80 и AOT. Эмульсия на основе Tergitol NP-4 оказалась очень устойчивой, и из нее не удалось выделить существенного количества твердой фазы после нескольких суток отстаивания. В остальных системах после расслаивания эмульсии в течение нескольких часов и центрифугирования были отделены белые осадки, которые, по данным РФА, отвечали фазе ZnO2 (рис. 1б) и имели размеры ОКР, равные 5.9 (в случае Brij 30), 5.6 (Span 80) и 5.5 нм (АОТ). Близость этих параметров между собой и к ОКР при синтезе в мицеллах показывает небольшое влияние на размер НЧ природы применявшихся ПАВ и способа синтеза (мицеллярного или эмульсионного).
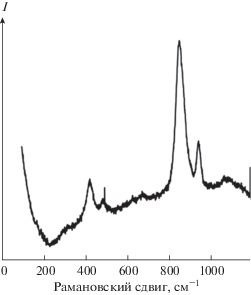
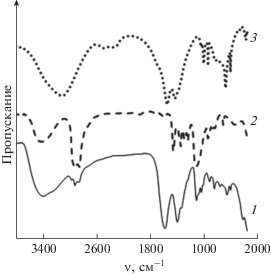
Характеристика НЧ ZnO2. Ниже приведены некоторые характеристики НЧ ZnO2 на примере продукта, полученного в обратных мицеллах Brij 30. В сухом виде продукт представляет собой порошок субмикронных слоистых агломератов НЧ (рис. 2). В энергодисперсионном спектре порошка присутствуют полосы цинка и кислорода. Спектр КР содержит пики при 415, 486, 842 и 934 см–1 (рис. 3), характерные для ZnO2 [1, 36]. Химический микроанализ показал присутствие в порошке НЧ углерода (9.7%) и водорода (1.4%), что свидетельствует о наличии примесей органической природы. Судя по ИК-спектру (рис. 4), источником C и H могли быть Brij 30 (C20H42O5) и Zn(CH3COO)2, например, в составе поверхностного слоя НЧ ZnO2 подобно тому, как это наблюдали ранее для НЧ ZnO [43].
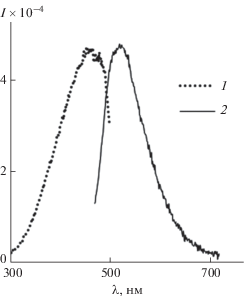
На рис. 5 представлены спектры возбуждения люминесценции и фотолюминесценции (ФЛ) порошка НЧ ZnO2. Спектр ФЛ представляет собой одиночную широкую полосу c максимумом эмиссии при длине волны 520 нм, квантовый выход составляет 4.45%.
Синхронный термический анализ (СТА) при нагревании порошка НЧ ZnO2 в атмосфере гелия показал, что полное разложение образца происходит за три ступени: 80–220, 220–500 и 500–900°C (рис. 6). Согласно данным СТА, трансформация ZnO2 в ZnO происходит на первой ступени, температура максимального развития процесса составляет 213°C. При этом в газовой фазе масс-спектрометрически фиксируются молекулярный кислород и кислородсодержащие фрагменты (OH, H2O, CO, CO2, CH2CHO + H), а также ряд углеводородных фрагментов. На второй и третьей ступенях происходит разложение органических примесей, по-видимому, как имевшихся исходно, так и образовавшихся на первой ступени термолиза НЧ. РФА подтвердил, что конечным продуктом термолиза является фаза ZnO, крупинки которой на СЭМ-изображении выглядят слоистыми и имеют субмикронный размер подобно порошку ZnO2 (рис. 7).
Рис. 6.
Синхронный термический анализ порошка НЧ ZnO2. Условия: масса образца 3.7 мг, корундовый тигель, атмосфера гелия, скорость нагревания 10 град/мин.
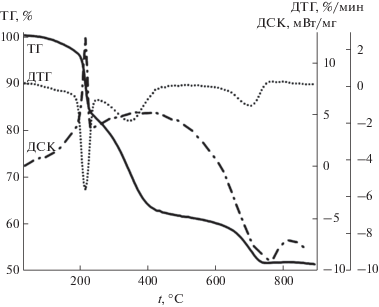
Рис. 7.
Дифрактограмма (CuKα-излучение) (а) и СЭМ продукта мицеллярого синтеза, прогретого при 380°С (б). На дифрактограмме показаны индексы отражений ZnO (a = 3.253, с = 5.213 Å, пр. гр. P63mc, № PDF 01-076-0704).
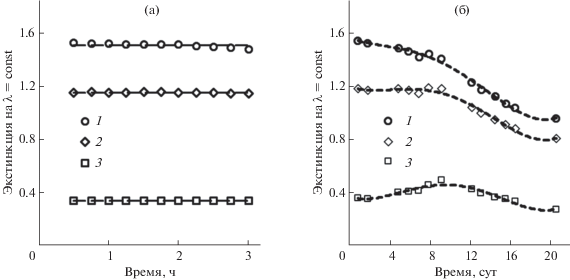
Устойчивость НЧ ZnO2 в обратномицеллярном растворе, в котором они были синтезированы, исследована спектрофотометрическим методом при сканировании спектра этого органозоля в течение 20 сут с момента его приготовления (рис. 8). Первые 3 ч органозоль оставался стабильным – его спектр практически не изменялся, значения экстинкции (поглощение + рассеяние) при фиксированных длинах волн были постоянными (рис. 9а). В период от 1 до 9 сут происходит трансформация спектра при наличии изобестической точки, при длине волны которой (λ = = 232 нм) экстинкция остается неизменной при том, что слева от этой точки она уменьшается, а справа увеличивается (рис. 9б). За время от 12 до 20 сут экстинкция при всех длинах волн монотонно снижается. В ходе изменения в спектре сформировались два плеча при 223 и ~270 нм. Диапазон длин волн от 265 до 370 нм представляет особый интерес, так как именно в нем следует ожидать появления полосы экситонного поглощения ZnO. Значение 370 нм характерно для максимума полосы в УФ-видимом спектре компактного макроскопического образца ZnO, а 265 нм относится к зародышам НЧ ZnO минимального размера ~1 нм, ниже которого существуют кластеры, не имеющие свойств квантовых точек [46]. Согласно литературным сведениям, по мере роста зародышей полоса смещается в длинноволновую область, а интенсивность спектра сначала возрастает, а потом снижается. Аналогичное изменение экстинкции на примере λ = 265 нм, представленное кривой 3 на рис. 9б, позволяет предположить, что в нашем случае в период времени от 1 до 20 сут также происходит постепенный рост зародышей ZnO, образовавшихся из НЧ ZnO2.
Рис. 8.
Изменение спектра мицеллярного раствора НЧ ZnO2 в течение от 0.5 до 220 ч (сплошные линии) и от 12 до 20 сут (пунктирные линии) после его приготовления. cZn = 8.9 мМ, длина кюветы l = 0.1 см.
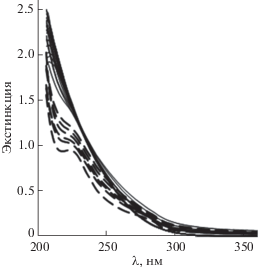
Рис. 9.
Временные зависимости экстинкции на фиксированных длинах волн за первые 3 ч после приготовления мицеллярного раствора НЧ ZnO2 (а) и в течение 20 сут (б). λ = 223 (1), 232 (2) и 265 нм (3), cZn = 8.9 мМ, длина кюветы l = 0.1 см.
Пленки НЧ ZnO2. Выше в качестве недостатка обратномицеллярного синтеза отмечалось, что он позволяет получать органозоли лишь с низким содержанием НЧ, которые неэффективны для последующего концентрирования и выделения продуктов синтеза. Тем не менее такие органозоли можно использовать напрямую для нанесения пленок НЧ, что было показано ранее на примере НЧ Au [40, 41]. В настоящей работе такая возможность проверена для получения пленок с использованием синтезированных органозолей НЧ ZnO2, а также смеси НЧ ZnO2 и Au. Для этого спектрофотометрическим методом изучены процессы формирования пленок на прозрачных подложках из стекла и ПЭТ.
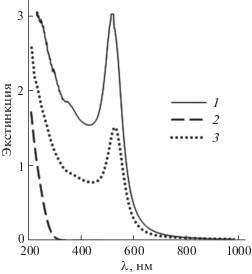
Спектры применявшихся органозолей НЧ ZnO2, Au и их смеси приведены на рис. 10. У золя НЧ ZnO2 край поглощения находится в районе 300 нм, при λ > 300 нм экстинкция в кювете длиной l = 0.1 см не превышает величины A = 0.05. Спектр органозоля НЧ Au имеет узкую симметричную полосу локализованного поверхностного плазмонного резонанса с максимумом при λ = = 530 нм, характерную для частиц при синтезе в мицеллах Brij 30 [40]. НЧ Au дают основной вклад в спектр смеси НЧ ZnO2 и Au.
Рис. 10.
Спектры мицеллярных растворов НЧ Au (1, cAu = 4.6 мМ), ZnO2 (2, cZn = 8.6 мМ) и их смеси (3, cAu = 2.3 мМ, cZn = 4.3 мМ), l = 0.1 см.
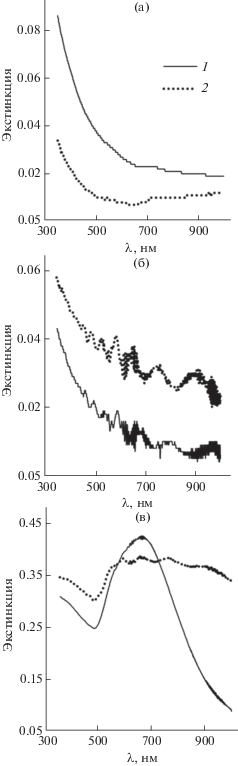
В процессе формирования пленок интенсивность их спектров монотонно возрастает с каждым циклом нанесения НЧ (рис. 11). Особенностью спектров пленок на ПЭТ является волнистость и тонкая структура, обусловленные подложкой из ПЭТ, что наблюдали и ранее [42]. Специфический вклад подложки был более заметен для спектров пленок ZnO2, которые сами имели небольшую экстинкцию (рис. 11б). Ростовые зависимости экстинкции пленок (поглощение + рассеяние + отражение) на фиксированных длинах волн от числа циклов имеют одинаковый вид (рис. 12) и неплохо воспроизводятся в параллельных опытах (рис. 12г). На рис. 13 приведены конечные спектры пленок, приготовленных из НЧ ZnO2 и смеси НЧ ZnO2 с НЧ Au, а также таких же пленок, в течение 1 ч прогретых при температуре 380 или 235°С в случае образцов на стекле и ПЭТ соответственно для превращения ZnO2 в ZnO. Экстинкция пленок, полученных в результате термолиза, у образцов на стекле ниже, а у образцов на ПЭТ выше, чем у исходных пленок. Вероятно, такие спектральные явления в поведении пленок ZnO, полученных при 380 и 235°С, связаны с влиянием температуры на структуру пленок, а также на их химический состав с учетом того, что продукты термолиза органических примесей – поверхностного модификатора (C9H20NSi≡), линкера (C2H4S2=), ПАВ (C20H42O5) в защитных оболочках НЧ – при разных температурах будут разные. Метод энергодисперсионной спектроскопии (ЭДС) показал, что пленка из НЧ ZnO2 на стекле содержит 5.3 мас. % углерода и 0.7 мас. % серы; после прогревания содержание серы снизилось в 5 раз, углерод не зафиксирован. Визуально пленки ZnO2 и ZnO бесцветные и прозрачные, пленки ZnO2 + Au – серовато-голубые на просвет и зеркально-золотистые в отраженном свете, пленки ZnO + Au – фиолетовые на просвет и красновато-золотистые с зеркальным блеском на темном фоне.
Рис. 11.
Развитие спектров пленок в процессе формирования из НЧ ZnO2 на стекле (а) и ПЭТ (б) при n = 24 и из смеси НЧ ZnO2 с НЧ Au на стекле (в) и ПЭТ (г) при n = 20.
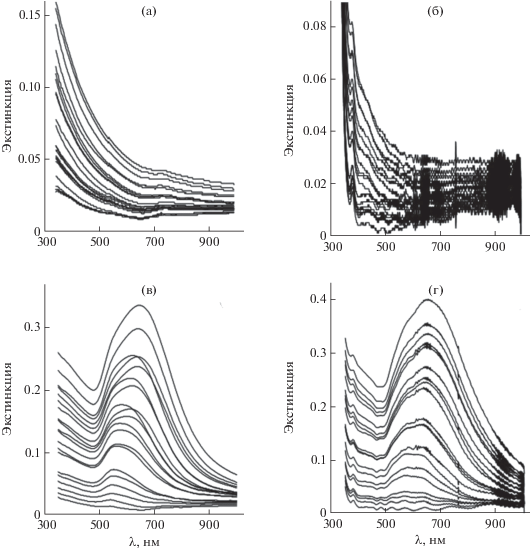
Рис. 12.
Ростовые зависимости для пленок на фиксированных длинах волн: а – НЧ ZnO2 на стекле, λ = 350 (1) и 730 нм (2); б – НЧ ZnO2 на ПЭТ, λ = 380 (1) и 800 нм (2); в – смесь НЧ ZnO2 и Au на стекле, λ = 650 (1) и 1000 нм (2); г – смесь НЧ ZnO2 и Au на ПЭТ, λ = 650, два параллельных опыта (1) и (2).
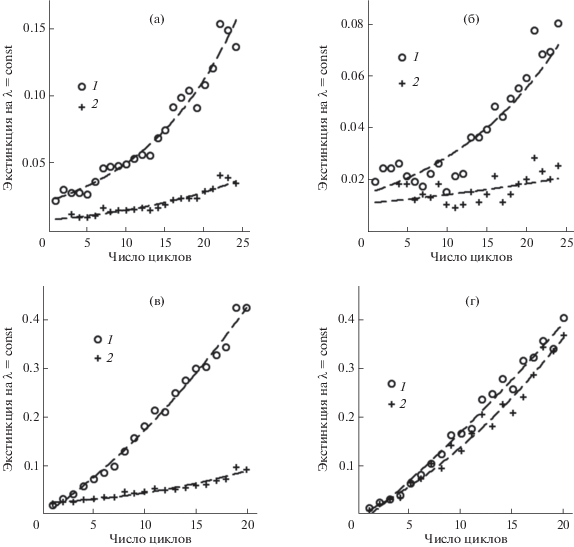
Рис. 13.
Спектры пленок, полученных из НЧ ZnO2 на стекле (а) и ПЭТ (б), а также из смеси НЧ ZnO2 и Au на ПЭТ (в), до (1) и после прогревания (2).
СЭМ-изображения пленок на стекле до и после прогревания представлены на рис. 14. Пленка из НЧ ZnO2 имеет зернистую морфологию, линейный размер поперечного сечения зерен составляет ~102 нм. После трансформации в пленку ZnO за счет прогревания размер уменьшается в ~1.5–2 раза, а границы между зернами расширяются (рис. 14а, 14б). Это согласуется с тем, что плотность ZnO примерно в 3.6 раза больше плотности ZnO2.
Рис. 14.
СЭМ пленок на стекле, полученных с использованием мицеллярных растворов НЧ ZnO2 (а, б) и смеси НЧ ZnO2 и Au (в–е). Изображения (б, д, е) относятся к пленкам, прогретым при 380°C. Изображения (а, б, в, д) зарегистрированы в режиме вторичных электронов, (г, е) – обратнорассеянных электронов.

Пленка, полученная с использованием смеси органозолей НЧ ZnO2 и Au, не сплошная, она состоит из нанокристаллов кубической фазы ZnO2 и островковых 3D-структур из НЧ Au (рис. 14в). Нанокристаллы ZnO2 имеют вид прямоугольных параллелепипедов длиной L от ~90 до 220 нм и шириной W от ~70 до 100 нм, отношение L/W в кристаллах варьируется от ~1 до 2.5. 3D-структуры золота представляют собой грозди (кластеры) сферических агломератов с диаметром от ~20 до 40 нм, построенных, в свою очередь, из сферических частиц диаметром <10 нм. Большая гроздь из НЧ Au размером ~400–500 нм хорошо видна в центре рис. 14 в. Золотую природу этой грозди и других более мелких кластеров агломератов подтверждает СЭМ-изображение того же участка пленки, снятое в режиме регистрации обратно-рассеянных электронов, на котором хорошо видны ярко-белые металлические частицы и практически не видны оксидные нанокристаллы (рис. 1г). Прогревание при 380°C приводит к спеканию агломератов НЧ Au в сфероидальные гранулы диаметром от ~20 до 150 нм с расстояниями между ними ~102 нм (рис. 14д, 14е). При этом в процессе трансформации в ZnO нанокристаллы ZnO2 разрушаются и, вероятно, осыпаются с подложки, так как зерна оксида цинка не видны на рис. 14д, а данные ЭДС показали, что содержание Zn в образце при прогревании уменьшилось от 0.1 мас. % до ~0.
В силу полупроводниковых свойств ZnO2 и ZnO, а также островковой природы объемных структур из НЧ Au все полученные пленки не обладают электропроводностью при обычных условиях, их поверхностное сопротивление до и после прогревания Rsq > 108 Ом/◻.
ЗАКЛЮЧЕНИЕ
Экспериментально показана возможность простого синтеза НЧ ZnO2 размером ~5 нм по реакции ацетата цинка с пероксидом водорода в дисперсных системах типа обратных мицелл и эмульсий на основе липофильных ПАВ Brij 30, Span 80 или АОТ. Судя по близости ОКР, разные способы синтеза как в мицеллах, так и в эмульсиях, а также природа ПАВ изученного ряда не оказывают большого влияния на размер НЧ. Порошок НЧ ZnO2 проявляет фотолюминесценцию с максимумом эмиссии при λmax = 520 нм. При нагревании порошка НЧ ZnO2 трансформируются в НЧ ZnO с выделением кислорода и экзотермическим эффектом с максимумом при 213°C. В органозоле постепенное восстановление ZnO2 за счет органических веществ становится заметным спектрофотометрически через >3 ч от завершения синтеза НЧ. С использованием синтезированного органозоля НЧ ZnO2 и метода послойного осаждения частиц из капиллярного слоя дисперсии получены пленки на прозрачных подложках из стекла и ПЭТ. Пленки из НЧ ZnO2 имеют зернистую морфологию с размером зерен ~102 нм. При соответствующей термообработке они трансформируются в пленки ZnO с немного меньшим размером зерен. Применение смеси органозолей НЧ ZnO2 и Au приводит к получению пленок с островковой структурой на основе сфероидальных агломератов НЧ Au с вкраплениями нанокристаллов кубической фазы ZnO2 в виде прямоугольных параллелепипедов с линейными размерами ~70–200 нм и отношением длины к ширине ~1–2.5. При нагревании в ходе превращения ZnO2 в ZnO кристаллы разрушаются и осыпаются с подложки, а кластеры агломератов НЧ Au спекаются в сфероидальные гранулы диаметром ~20–150 нм, распределенные по поверхности подложки на расстояниях друг от друга ~102 нм. Полученные НЧ ZnO2 и их пленки как сами по себе, так и в качестве прекурсоров материалов ZnO с учетом оптических, полупроводниковых и окислительных свойств ZnO2 и ZnO могут представлять интерес для оптоэлектроники, фотокатализа, химической и биомедицинской сенсорики, экологии, медицины и тераностики.
Список литературы
Bai H., Liu X. // Mater. Lett. 2010. V. 64. P. 341. https://doi.org/10.1016/j.matlet.2009.11.008
Chen W., Lu Y.H., Wang M. et al. // J. Phys. Chem. C. 2009. V. 113. P. 1320. https://doi.org/10.1021/jp808714v
Ramirez J.I.D.L., Villegas V.A.R., Sicairos S.P. et al. // Catalysts. 2020. V. 10. P. 1041. https://doi.org/10.3390/catal10091041
Deb S., Kalita P.K., Datta P. // Materials Today: Proceedings. 2017. V. 4. P. 3994. www.materialstoday.com/proceedings (5th International Conference of Materials Processing and Characterization (ICMPC 2016))
Simanjuntak F.M., Chandrasekaran S., Lin C.-C., Tseng T.-Y. // APL Mater. 2019. V. 7. 051108. https://doi.org/10.1063/1.5092991
Simanjuntak F.M., Chandrasekaran S., Lin C.-C., Tseng T.-Y. // Nanoscale Res. Lett. 2018. V. 13. Art. 327. https://doi.org/10.1186/s11671-018-2743-7
Aquí-Romero F., Willars-Rodríguez F.J., Chávez-Urbiola I.R., Ramírez-Bon R. // Semiconductor Sci. Technol. 2020. V. 35. № 2. P. 025012. https://doi.org/10.1088/1361-6641/ab5f2a
Guoa Q., Zhanga Q., Wangb H., Zhao Z. // Cat. Commun. 2018. V. 103. P. 24. https://doi.org/10.1016/j.catcom.2017.09.010
Wolanov Y., Prikhodchenko P.V., Medvedev A.G. et al. // Environ. Sci. Technol. 2013. V. 47. P. 8769. https://doi.org/10.1021/es4020629
Bergs C., Simon P., Prots Y., Pich A. // RSC Adv. 2016. V. 6. P. 84777. https://doi.org/10.1039/c6ra16009c
Bergs C.T. Syntheses, Characterizations and Applications of Zinc Peroxide Nanoparticles. Dissertation, Aachen University, Deutschland, 2017. 146 p. http://publications.rwth-aachen.de/record/696219/fi-les/696219.pdf
Verma S., Jain S.L. // Inorg. Chem. Front. 2014. V. 1. P. 534. https://doi.org/10.1039/c3qi00092c
Giannakoudakisa D.A., Florenta M., Wallacea R. et al. // App. Cat. B: Environ. 2018. V. 226. P. 429. https://doi.org/10.1016/j.apcatb.2017.12.068
Sunderland D.A., Binkley J.S. // Radiology. 1940. V. 35. № 5. P. 606. https://doi.org/10.1148/35.5.606
Sharma B., Singh N., Tandon R.P., Mahapatro A.K. // Adv. Materials Proceedings. 2017. V. 2. № 7. P. 440. https://doi.org/10.5185/amp.2017/708
Bergs C., Brück L., Rosencrantz R.R. et al. // RSC Adv. 2017. V. 7. P. 38998. https://doi.org/10.1039/c7ra063321
El-Shouny W.A., Moawad M.S., Haider A.S. et al. // Egypt. J. Bot. 2019. V. 59. № 3. P. 657. https://doi.org/10.21608/ejbo.2019.7062.1277
Lin L.-S., Wang J.-F., Song J. et al. // Theranostics. 2019. V. 9. № 24. P. 7200. https://doi.org/10.7150/thno.39831
Ahtzaz S., Nasir M., Shahzadi L. et al. // Materials Design. 2017. V. 132. P. 409. https://doi.org/10.1016/j.matdes.2017.07.023
Prikhodchenko P.V., Medvedev A.G., Mikhaylov A.A. et al. // Mater. Lett. 2014. V. 116. P. 282. https://doi.org/10.1016/j.matlet.2013.11.042
Aquí-Romero F., Willars-Rodríguez F.J., Chávez-Urbiola I.R., Ramírez-Bon R. // Semicond. Sci. Technol. 2020. V. 35. № 2. P. 025012. https://doi.org/10.1088/1361-6641/ab5f2a
Morales-Mendoza J.E., Paraguay-Delgado F., Duarte Moller J.A. et al. // J. Nano Res. 2019. V. 56. P. 49. https://doi.org/10.4028/www.scientific.net/JNanoR.56
Sebök D., Szabó T., Dékány I. // Appl. Surf. Sci. 2009. V. 255. P. 6953. https://doi.org/10.1016/j.apsusc.2009.03.020
Pawar R.A., Shinde D.R., Tambade P.S. // Desalination and Water Treatment. 2016. V. 57. № 35. P. 16514. https://doi.org/10.1080/1944.3994.2015.1079248
Moezzi A., McDonagh A.M., Cortie M.B. // Chem. Eng. J. 2012. V. 185–186. P. 1. https://doi.org/10.1016/j.cej.2012.01.076
Li X., Zhu G., Dou J. et al. // Ionics. 2019. V. 25. P. 5527. https://doi.org/10.1007/s11581-019-03118-x
George J.M., Antony A., Mathew B. // Microchim. Acta. 2018. V. 185. Art. 358. https://doi.org/10.1007/s00604-018-2894-3
Huang F., Zhu S., Wang F. et al. // Matter. 2020. V. 2. P. 1091. https://doi.org/10.1016/j.matt.2020.03.002
Rahman F. // Opt. Eng. 2019. V. 58. № 1. P. 010901. https://doi.org/10.1117/1.OE.58.1.010901
Paul S.K., Dutta H., Sarkar S. et al. // Food Rev. Int. 2019. V. 35. № 6. P. 505. https://doi.org/10.1080/87559129.2019.1573828
Yu X., Marks T.J., Facchetti A. // Nature Mater. 2016. V. 15. P. 383. https://doi.org/10.1038/NMAT4599
Воробьева О.А., Павинская А.А., Кочубейник А.В. и др. // Биорадикалы и антиоксиданты. 2019. Т. 6. № 2.
Mikhaylov A.A., Medvedev A.G., Grishanov D.A. et al. // Adv. Mater. Interfaces. 2019. V. 6. P. 1900368. https://doi.org/10.1002/admi.201900368
Chawla S., Uppal H., Yadav M. et al. // Ecotoxicology Environmental Safety. 2017. V. 135. P. 68. https://doi.org/10.1016/j.ecoenv.2016.09.017
Rosenthal-Toib L., Zohar K., Alagem M., Tsur Y. // Chem. Eng. J. 2008. V. 136. P. 425. https://doi.org/10.1016/j.cej.2007.07.071
Sun M., Hao W., Wang C., Wang T. // Chem. Phys. Lett. 2007. V. 443. P. 342. https://doi.org/10.1016/j.cplett.2007.06.098
Shames A.I., Lev O., Mikhaylov A.A. et al. // J. Phys. Chem. C. 2019. V. 123. P. 20884. https://doi.org/10.1021/acs.jpcc.9b04523
Lindroos S., Leskelä M. // Int. J. Inorg. Mater. 2000. V. 2. P. 197.
Громилов С.А., Пирязев Д.А., Татарчук В.В. // Журн. структур. химии. 2021. Т. 62. № 4. С. 611. https://doi.org/10.26902/JSC_id71139
Tatarchuk V., Druzhinina I., Zaikovskii V. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 3. P. 372. [Татарчук В.В., Дружинина И.А., Зайковский В.И. и др. // Журн. неорган. xимии. 2017. Т. 62. № 3. С. 359.]https://doi.org/10.1134/S00360236170030184
Tatarchuk V.V., Druzhinina I.A., Maksimovskii E.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 8. P. 1264. [Татарчук В.В., Дружинина И.А., Максимовский Е.А. и др. // Журн. неорган. xимии. 2020. Т. 65. № 8. С. 1140.]https://doi.org/10.1134/S0036023620070219
Tatarchuk V., Druzhinina I., Maksimovskii E., Gromilov S. // J. Coat. Technol. Res. 2021. V. 18. № 1. P. 205. https://doi.org/10.1007/s11998-020-00397-2
Tatarchuk V., Druzhinina I., Zaikovskii V. et al. // J. Sol-Gel Sci. Technol. 2018. V. 85. P. 66. https://doi.org/10.1007/s10971-017-4512-y
Bulavchenko A.I., Arymbaeva A.T., Demidova M.G. et al. // Langmuir. 2018. V. 34. P. 2815. https://doi.org/10.1021/acs.langmuir.7b04071
Shaparenko N.O., Arymbaeva A.T., Demidova M.G. et al. // Colloid J. 2019. V. 81. № 4. P. 478. [Шапаренко Н.О., АрымбаеваА.Т., Демидова М.Г. и др. // Коллоидный журн. 2019. Т. 81. № 4. С. 532. https://doi.org/10.1134/S0023291219040153]https://doi.org/10.1134/S1061933X1904015X
Wood A., Giersig M., Hilgendorff M. et al. // Aust. J. Chem. 2003. V. 56. № 10. P. 1051. https://doi.org/10.1071/CH03120
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии