Журнал неорганической химии, 2021, T. 66, № 11, стр. 1620-1626
Фазовые равновесия в системе KNO3–Ca(NO3)2–H2O при 25°C
Н. С. Кистанова a, *, А. Р. Мукминова a, И. Н. Конева a, О. С. Кудряшова b, c
a Пермский государственный национальный исследовательский университет
614990 Пермь, ул. Букирева, 15, Россия
b Естественнонаучный институт Пермского государственного национального исследовательского университета
614990 Пермь, ул. Генкеля, 4, Россия
c Пермский государственный аграрно-технологический университет им. акад. Д.Н. Прянишникова
614990 Пермь, ул. Петропавловская, 23, Россия
* E-mail: natalya.kistanova@gmail.com
Поступила в редакцию 06.04.2021
После доработки 11.05.2021
Принята к публикации 24.05.2021
Аннотация
Фазовые равновесия в системе KNO3–Ca(NO3)2–H2O изучены изотермическим методом сечений при 25°C. На диаграмме состояния системы обнаружены шесть фазовых областей, три линии моновариантного равновесия, две нонвариантные точки, отвечающие эвтоническому раствору, насыщенному KNO3 и KNO3 ⋅ Ca(NO3)2 ⋅ 3H2O, и перитоническому раствору, находящемуся в равновесии с Ca(NO3)2 ⋅ 4H2O и KNO3 ⋅ Ca(NO3)2 ⋅ 3H2O. Структура двойной соли установлена методом рентгеноструктурного анализа, с помощью дифференциальной сканирующей калориметрии определены температура и теплота плавления: ∆Нпл = 132.2 кДж/кг и tпл = 52.1°С. Измерена плотность расплава соли при 60, 80 и 85°C. Теплофизические характеристики соединения позволяют рассматривать его в качестве перспективного теплоаккумулирующего материала.
ВВЕДЕНИЕ
Конверсионный способ получения нитрата калия из нитрата кальция и хлорида калия защищен рядом патентов, но в промышленном масштабе до сих пор не реализован. Основная причина – переработка маточного раствора, содержащего хлориды и нитраты кальция и калия. В большинстве патентов отсутствуют сведения о получении хлорида кальция из маточного раствора, что свидетельствует о трудностях, связанных с кристаллизацией этой соли [1–6].
Маточный раствор производства нитрата калия может быть использован в качестве противогололедного реагента, хладагента, теплоносителя в энергетических системах, минерального удобрения и тяжелых жидкостей в нефтяной промышленности. Однако в каждом конкретном случае требуется доработка его состава с целью достижения необходимых физико-химических и функциональных свойств.
Известно, что кристаллогидраты, эвтонические и эвтектические смеси неорганических соединений чрезвычайно перспективны в качестве теплоаккумулирующих материалов с фазовым переходом. В работах [7–10] описаны некоторые теплофизические свойства таких теплоаккумулирующих материалов (температура и теплота плавления, теплопроводность и плотность). На рынке представлены теплоаккумулирующие материалы на основе кристаллогидратов неорганических солей с температурой плавления от 7 до 117°С [7]. Недостатки соединений, связанные с образованием пересыщенных растворов, инконгруэнтным плавлением и коррозионной активностью, устраняются их капсулированием [11–13]. Области применения теплоаккумулирующих материалов различны – от систем хранения и транспортировки материалов [8, 14], отопления и охлаждения зданий [15–18] до автомобилестроения [19, 20], текстильной промышленности и медицины [7]. В последние годы разрабатываются высокотемпературные многокомпонентные нитратные смеси для хранения солнечной энергии на коммерческих электростанциях, обладающие хорошими теплофизическими свойствами, более низкими температурами кристаллизации, низкой токсичностью и низкой стоимостью по сравнению с аналогичными материалами [21–23].
Интерес представляет переработка маточных растворов производства нитрата калия из нитрата кальция с целью получения функциональных материалов.
В системе, образованной хлоридами и нитратами калия и кальция, в интервале температур от –20 до 50°С установлено образование кристаллогидратов хлорида и нитрата кальция [24–27] и двойных солей [5, 6, 26–28]. В работе [26] при 45°С обнаружена область кристаллизации новой твердой фазы, отвечающей составу двойной соли Ca(NO3)2 ⋅ 4KNO3. В [27] установлено образование кристаллогидратов двойных солей состава KNO3 · Ca(NO3)2 · 3H2O и 5Ca(NO3)2 ⋅ KNO3 ⋅ 10H2O в интервале температур 0−50°C. Существование в системе безводной двойной соли Ca(NO3)2 ⋅ ⋅ 4KNO3 не подтверждено. Тригидрат нитратов калия и кальция получен из раствора, содержащего эквивалентное количество солей. При медленном охлаждении раствора кристаллизуется нитрат калия, который отфильтровывают, а в маточном растворе при испарении воды образуются кристаллы Ca(NO3)2 ⋅ KNO3 ⋅ 3H2O в форме крупных моноклинных призм. Из пересыщенного тетрагидратом нитрата кальция раствора при медленном испарении кристаллизуется 5Ca(NO3)2 ⋅ KNO3 ⋅ ⋅ 10H2O в форме гексагональных бипирамид. Установлено, что декагидрат нитратов калия и кальция устойчив при температурах выше +33°C. Авторы [24] не определили границы фазовых областей, отвечающих двойным солям и их кристаллогидратам, при 0, 25 и 30°C. При 0 и 25°C эвтонический раствор насыщен нитратом калия и тетрагидратом нитрата кальция. При 30°С в системе происходит обезвоживание тетрагидрата нитрата кальция до дигидрата. Изотерма растворимости системы KNO3–Ca(NO3)2–H2O при 25°C исследована изопиестическим методом [29] и рассчитана c применением уравнений Питцера [29, 30]. Результат термодинамического расчета хорошо согласуется с данными [27].
В статье представлены результаты экспериментального исследования фазовых равновесий в системе KNO3–Ca(NO3)2–H2O при 25°C и теплофизических характеристик двойной соли KNO3 · · Ca(NO3)2 · 3H2O.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали нитрат калия и тетрагидрат нитрата кальция марки “х. ч.”, безводный нитрат кальция марки “ч.”, дистиллированную воду ($n_{{\text{D}}}^{{{\text{25}}}}$ = 1.3325).
Фазовые равновесия в системе Ca(NO3)2−KNO3−H2O при 25°C исследовали изотермическим методом сечений [31, 32]. Исходные смеси компонентов заданного состава готовили взвешиванием на аналитических электронных весах AND GR-200 с точностью ±0.0001 г. Термостатирование осуществляли при помощи циркуляционного термостата LOIP LT-316a c погрешностью ±0.2°С и шейкера DAIHAN WiseShake SHO-2D. Показатель преломления жидкой фазы измеряли на рефрактометре ИРФ-454 Б2М с погрешностью ±1 × 10–4.
Исходные смеси компонентов термостатировали в течение 12–16 ч до установления состояния равновесия и измеряли показатель преломления жидкой фазы. О достижении равновесия судили по постоянной во времени величине показателя преломления жидкой фазы гетерогенных смесей. На функциональной зависимости показателя преломления жидкой фазы от состава исходных смесей компонентов каждому виду фазового равновесия соответствует определенная линия, а точка пересечения линий указывает на состав, лежащий на границе фазовых областей. Состав образующейся двойной соли определен методом сечений и подтвержден физико-химическими методами анализа.
Температура и теплота плавления двойной соли определены методом дифференциальной сканирующей калориметрии (Netzsch DSC 214 Polyma DSC 21400 A-0115-L). Образец помещали в алюминиевый тигель и нагревали со скоростью 5.0 град/мин от 28 до 210°C.
Параметры кристаллической решетки KNO3 · · Ca(NO3)2 · 3H2O установлены рентгеноструктурным анализом на дифрактометре Xcalibur Ruby.
Плотность расплавов двойной соли при 60, 80 и 85°C измеряли плотномером Mettler Tolledo DM40.
Тригидрат нитрата кальция синтезировали из безводного нитрата кальция на основании политермической диаграммы двухкомпонентной системы Ca(NO3)2–H2O [33]. Смесь, содержащую 73 мас. % нитрата кальция, нагревали до гомогенного состояния. При охлаждении раствора до 47°С кристаллизовался тригидрат нитрата кальция Ca(NO3)2 ⋅ 3H2O, который отфильтровывали на воронке Шотта и хранили в бюксе при комнатной температуре. Комплексонометрическим титрованием установлено соотношение нитрата кальция и воды, равное 1 : 3.
Для синтеза тригидрата нитратов калия и кальция состав реакционной смеси выбирали в поле кристаллизации двойной соли. Раствор, содержащий рассчитанное количество тетрагидрата нитрата кальция и нитрата калия, нагревали до гомогенного состояния. При охлаждении раствора до 25°С происходила кристаллизация двойной соли, которую отфильтровывали на воронке Шотта и хранили в бюксе при комнатной температуре. Тригидрат нитратов калия и кальция склонен к образованию пересыщенных растворов. Пересыщение снимали добавлением нескольких кристаллов этой соли к раствору. Кристаллы KNO3 · · Ca(NO3)2 · 3H2O для рентгенофазового анализа выращивали из маточного раствора в течение 2–3 сут.
Содержание ионов кальция в соединениях Ca(NO3)2 ⋅ 3H2O и KNO3 · Ca(NO3)2 · 3H2O определяли титриметрическим методом с эриохромом черным Т [34].
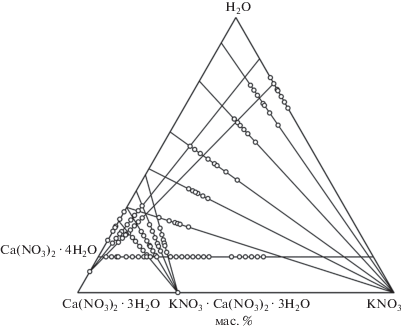
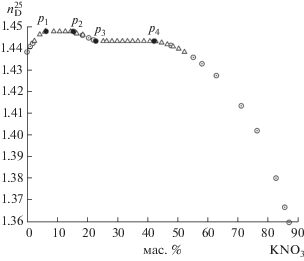
Для определения составов насыщенных растворов и равновесных им твердых фаз в трехкомпонентной системе изучено 16 разрезов (рис. 1). В изогидрическом разрезе (13.0 мас. % H2O) исходные смеси компонентов готовили смешиванием нитрата калия, воды и тригидрата нитрата кальция в определенном соотношении. Состав тригидрата нитрата кальция подтверждали комплексонометрическим титрованием перед каждым взвешиванием. На функциональной зависимости показателя преломления жидкой фазы от состава исходных смесей компонентов присутствуют два линейных участка, соответствующих нонвариантным фазовым областям (рис. 2). Это свидетельствует об образовании в системе новой твердой фазы KNO3 · Ca(NO3)2 · 3H2O, состав и структура которой установлены методом ренгеноструктурного анализа. В кристаллографической базе данных это соединение не обнаружено.
Рис. 2.
Функциональная зависимость показателя преломления жидкой фазы от состава смесей компонентов в сечениях в пересчете на изогидрический разрез (13.0 мас. % воды). △ – составы изогидрического разреза, ⚪ – составы с линий моновариантного равновесия, ⚫ – вычисленные составы на границах нонвариантных областей (pi).
Линия моновариантного равновесия относительно тетрагидрата нитрата кальция изучена с помощью двух сечений Ca(NO3)2 · 4H2O (кристаллы) – раствор KNO3 с содержанием нитрата калия 15.0 и 24.0 мас. %. Смеси исходных компонентов готовили, добавляя тетрагидрат нитрата кальция в раствор нитрата калия. Равенство показателя преломления жидкой фазы гетерогенных смесей сечения показывает, что раствор насыщен Ca(NO3)2 · 4H2O. Линия моновариантного равновесия относительно нитрата калия определена с помощью пяти сечений KNO3 (кристаллы) – раствор Ca(NO3)2 с содержанием нитрата кальция 7.0, 17.4, 31.3, 41.4 и 51.9 мас. %.
Составы на ветви кристаллизации тригидрата двойной соли установлены с помощью четырех сечений KNO3 · Ca(NO3)2 · 3H2O (кристаллы) – раствор Ca(NO3)2 с содержанием нитрата кальция 43.0, 47.4, 51.9, 55.7 мас. %. Исходные смеси компонентов готовили, добавляя тригидрат двойной соли к раствору нитрата кальция.
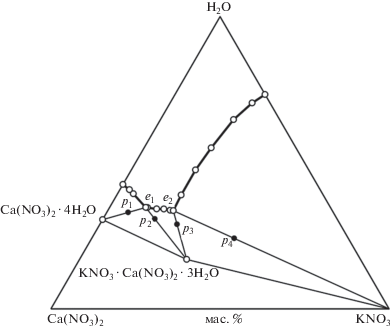
Состав эвтонического раствора e1 соответствует точке пересечения ветви кристаллизации соединения KNO3 · Ca(NO3)2 · 3H2O с предельной нодой Ca(NO3)2 · 4H2O – е1 (рис. 3). Состав эвтонического раствора e2 соответствует точке пересечения ветви кристаллизации нитрата калия с предельной нодой KNO3 – е2. Точка состава новой твердой фазы KNO3 · Ca(NO3)2 · 3H2O установлена пересечением двух предельных нод: e1 – KNO3 · Ca(NO3)2 · 3H2O и e2 – KNO3 · Ca(NO3)2 · 3H2O. Результаты исследований представлены в табл. 1.
Таблица 1.
Состав насыщенных растворов в системе Ca(NO3)2–KNO3–H2O при 25°C
| Состав насыщенного раствора, мас. % | Состав равновесной твердой фазы | ||
|---|---|---|---|
| Ca(NO3)2 | KNO3 | H2O | |
| 57.5 | – | 42.5 | Ca(NO3)2 ⋅ 4H2O |
| 56.0 | 4.7 | 39.3 | Ca(NO3)2 ⋅ 4H2O |
| 56.4 | 2.8 | 40.8 | Ca(NO3)2 ⋅ 4H2O |
| 54.6 | 10.7 | 34.7 | Ca(NO3)2 ⋅ 4H2O + KNO3 · Ca(NO3)2 · 3H2O (e1) |
| 54.2 | 11.2 | 34.6 | KNO3 ⋅ Ca(NO3)2 ⋅ 3H2O |
| 51.7 | 14.2 | 34.1 | KNO3 ⋅ Ca(NO3)2 ⋅ 3H2O |
| 49.6 | 16.3 | 34.1 | KNO3 ⋅ Ca(NO3)2 ⋅ 3H2O |
| 47.9 | 18.4 | 33.7 | KNO3 ⋅ Ca(NO3)2 ⋅ 3H2O |
| 47.0 | 19.4 | 33.6 | KNO3 · Ca(NO3)2 · 3H2O + KNO3 (e2) |
| 42.0 | 19.1 | 38.9 | KNO3 |
| 33.5 | 19.0 | 47.5 | KNO3 |
| 25.1 | 19.8 | 55.1 | KNO3 |
| 13.6 | 21.6 | 64.8 | KNO3 |
| 5.3 | 24.3 | 70.4 | KNO3 |
| – | 26.6 | 73.4 | KNO3 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно литературным данным, в системе, образованной нитратами калия и кальция, возможно образование новой твердой фазы. В одних работах определены поля кристаллизации только KNO3 и Ca(NO3)2 ⋅ H2O, в других – соединений Ca(NO3)2 ⋅ 4KNO3, KNO3 · Ca(NO3)2 · 3H2O, а с увеличением температуры и KNO3 ⋅ 5Ca(NO3)2 ⋅ 10H2O.
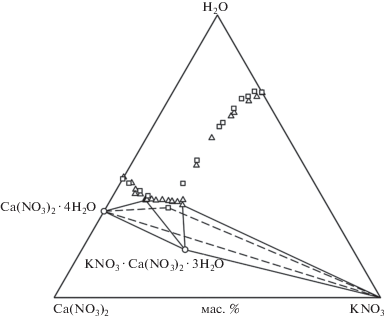
На рис. 3, 4 изображена изотерма растворимости трехкомпонентной системы Ca(NO3)2–KNO3–H2O при 25°C, построенная по нашим (○) и литературным (△ [27], ◻ [24]) данным. Видно, что в работе [24] не установлено образование двойной соли. Сравнивая результаты трех исследований, можно заметить хорошую сходимость состава насыщенных растворов на ветвях кристаллизации нитрата калия и нитрата кальция. Поле кристаллизации KNO3 · Ca(NO3)2 · 3H2O установлено в работе [27] и в ходе наших исследований. Эвтоническая точка, состав которой определен в работе [24], попадает в поле кристаллизации двойной соли.
Исследование системы осложнено тем, что в ней происходит образование гидратированной двойной соли KNO3 · Ca(NO3)2 · 3H2O, склонной к образованию устойчивых пересыщенных растворов. Кроме того, нагревание и охлаждение смесей компонентов также приводят к образованию устойчивых пересыщений. Возможно, поэтому авторам [24] не удалось обнаружить поле кристаллизации двойной соли при 0, 25 и 30°C. Исключить влияние процессов перекристаллизации твердых фаз можно, если готовить исходные смеси с той твердой фазой, которая находится в равновесии с насыщенным раствором. Именно поэтому мы уделили большое внимание синтезу кристаллогидратов солей.
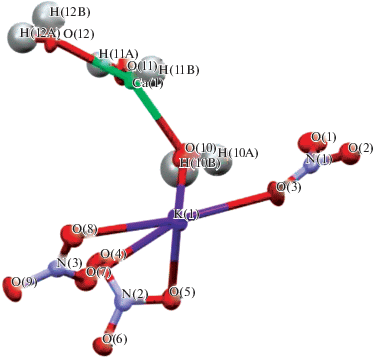
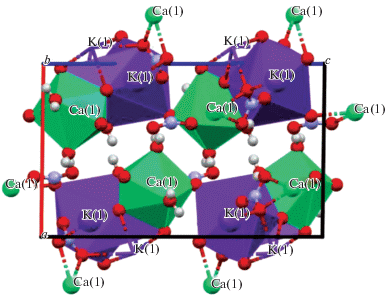
Для двойной соли KNO3 · Ca(NO3)2 · 3H2O впервые получены параметры элементарной ячейки. Методом рентгеноструктурного анализа установлено, что кристаллическая система соединения обладает моноклинной низшей сингонией (а ≠ b ≠ c, α = γ = 90°C, β ≠ 90°C), пр. гр. P21/с, параметры решетки: а = 9.87370, b = = 6.57870, c = 16.01200 Å; α = 90.0000°, β = = 90.7600°, γ = 90.0000°. Объем ячейки составляет 1039.985707 Å3. Симметрически независимая часть элементарной ячейки кристалла соединения и кристаллическая упаковка показаны на рис. 5 и 6.
Методом дифференциальной сканирующей калориметрии определена теплота плавления ∆Нпл = 132.2 кДж/кг двойной соли KNO3 · ⋅ Ca(NO3)2 · 3H2O, достаточно высокая для гидратов солей [7], ее температура плавления tпл = = 52.1°С. Важной характеристикой теплоаккумулирующих материалов является высокая плотность раствора или расплава. Плотность расплава KNO3 · Ca(NO3)2 · 3H2O при 60, 80 и 85°С приведена в табл. 2. Для сравнения там же приведена плотность расплава тетрагидрата нитрата кальция.
Таблица 2.
Теплоаккумулирующие материалы на основе кристаллогидратов
| Соединение | t, °С | ρ, г |
|---|---|---|
| KNO3 · Ca(NO3)2 · 3H2O | 60 | 1.849 |
| 80 | 1.830 | |
| 85 | 1.827 | |
| Ca(NO3)2 ⋅ 4H2O | 52 | 1.733 |
| 77 | 1.711 |
Теплофизические свойства (температура плавления, теплота плавления, плотность) позволяют рассматривать KNO3 · Ca(NO3)2 · 3H2O в качестве перспективного теплоаккумулирующего материала.
ЗАКЛЮЧЕНИЕ
Фазовые равновесия в системе Ca(NO3)2–KNO3–H2O изучены изотермическим методом сечений при 25°C. Определен состав двух нонвариантных точек, изучены три линии моновариантного равновесия, установлены поля кристаллизации не только индивидуальных солей KNO3 и Ca(NO3)2 ⋅ 4H2O, но и двойной соли KNO3 ⋅ ⋅ Ca(NO3)2 · 3H2O. Впервые получены кристаллографические характеристики двойной соли. Измеренные теплофизические свойства соединения позволяют рассматривать его в качестве перспективного теплоаккумулирующего материала.
Последующее изучение фазовых равновесий в четырехкомпонентной взаимной системе K+, Ca2+ // ${\text{NO}}_{3}^{ - },$ Cl–H2O позволит установить возможность получения теплоаккумулирующего вещества из маточных растворов производства нитрата калия из нитрата кальция.
Список литературы
Абрамов О.Б., Афанасенко Е.В., Дедов А.С. и др. Способ получения нитрата калия. Пат. 2261227 РФ. 2004. Б.И. № 27.
Pipko G. A process for the production of potassium nitrate. Pat. 2001077019 WO. 2000.
Tang Sh. High-purity potassium nitrate manufacture by low-temperature crystallization from concentrated calcium nitrate solution. Pat. 1706748 People Rep. China. 2004. № CN200410049426.
Кудрявцев П.Г., Кудряшова О.С., Елохов А.М. // Альтернативная энергетика и экология (ISJAEE). 2017. № 25–27. С. 60. https://doi.org/10.15518/isjaee.2017.25-27.060-070
Flatt R., Flatt A., Flatt J.-P. Process for the preparation of potassium nitrate. Pat. 3361522A US. 1963. № 3942.
Рустамбеков М.К., Таран А.Л., Данилов В.П. и др. Способ получения хлорида кальция и нитрата калия из хлорида калия и нитрата кальция. Пат. РФ № 2206506. Б.И. 2002. № 2002112843/12.
Zalba B., Marin J.M., Cabeza L.F. et al. // Appl. Thermal Eng. 2003. V. 23. P. 251. https://doi.org/10.1016/S1359-4311(02)00192-8
Farid M.M., Khudhair A.M., Razack S.A K. et al. // Energy Convers. Manage. 2004. V. 45. P. 1597. https://doi.org/10.1016/j.enconman.2003.09.015
Lane G.A. Solar heat storage: latent heat materials. V. II. USA: CRC Press Inc., 1986. 243 p.
Bukhalkin D.D., Semenov A.P., Novikov A.A. et al. // Chem. Technol. Fuels Oils. 2020. V. 55. № 6. P. 733. https://doi.org/10.1016/j.enconman.2003.09.015
Shchukina E.M., Graham M., Zheng Z. et al. // Chem. Soc. Rev. 2018. V. 47. № 11. P. 4156. https://doi.org/10.1039/C8CS00099A
Milian Y.E., Gutierrez A., Grageda M. et al. // Renewable and Sustainable Energy Rev. 2017. V. 73. P. 983. https://doi.org/10.1016/j.rser.2017.01.159
Zhu X., Shchukin D. // Adv. Eng. Mater. 2018. V. 20. № 11. Art. 1800618https://doi.org/10.1002/adem.201800618
Anisur M.R., Mahfuz M.H., Kibria M.A. et al. // Renewable and Sustainable Energy Rev. 2013. V. 18. P. 23. https://doi.org/10.1016/j.rser.2012.10.014
Gil A., Medrano M., Martorel I. et al. // Renewable and Sustainable Energy Rev. 2010. V. 14. № 1. P. 31. https://doi.org/10.1016/j.rser.2009.07.035
Persson J., Westermark M. // Energy and Buildings. 2012. V. 54. P. 490. https://doi.org/10.1016/j.enbuild.2012.05.012
Al-Abidi A.A., Mat S.B., Sopian K. et al. // Renewable and Sustainable Energy Rev. 2012. V. 16. P. 5802. https://doi.org/10.1016/j.rser.2012.05.030
Tyagi V.V., Buddhi D., Kothari R. et al. // Energy and Buildings. 2011. V. 51. P. 248. https://doi.org/10.1016/j.enbuild.2012.05.023
Gumus M., Ugurlu A. // Appl. Energy. 2011. V. 88. № 12. P. 4803. https://doi.org/10.1016/j.apenergy.2011.06.053
Vasiliev L.L., Burak V.S., Kulakov A.G. et al. // Appl. Thermal Eng. 2000. V. 20. P. 913. https://doi.org/10.1016/S1359-4311(99)00061-7
Gomez J.C., Calvet N., Starace A.K. et al. // J. Solar Energy Eng. 2013. V. 135. № 2. P. 021016-1. https://doi.org/10.1115/1.4023182
Bonk A., Sau S., Uranga N. et al. // Progress in Energy and Combustion Sci. 2018. V. 67. P. 69. https://doi.org/10.1016/j.pecs.2018.02.002
Delise T., Tizzoni A.C., Ferrara M. et al. // ACS Sustainable Chem. Eng. 2008. V. 8. № 1. P. 111. https://doi.org/10.1021/acssuschemeng.9b04472
Коган В.Б., Огородников С.К., Кафаров В.В. Справочник по растворимости Т. 3. Кн. 3. Л.: Наука, 1969.
Ehret W.F. // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3126. https://doi.org/10.1021/ja01347a014
Деркачева В.Н., Верещагина В.И. // Журн. прикл. химии. 1970. № 5. С. 1019.
Flatt R., Bocherens P. // Helv. Chim. Acta. 1962. V. 45. № 23. P. 187.
Воскобойников Н.Б., Скиба Г.С., Захаров В.И. // Журн. неорган. химии. 1991. Т. 36. № 8. С. 2118.
Чарыков Н.А., Пучков Л.В., Рамайа Гонзалез Н.В. // Журн. неорган. химии. 1992. Т. 37. № 3. С. 691.
Lach A., Andre L., Guignot S. et al. // J. Chem. Eng. Data. 2018. V. 63. № 3. P. 787. https://doi.org/10.1021/acs.jced.7b00953
Журавлев Е.Ф., Шевелева А.Д. // Журн. неорган. химии. 1960. Т. 5. № 11. С. 2630.
Mazunin S.A., Noskov M.N., Elsukov A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 539. [Мазунин С.А., Носков М.Н., Елсуков А.В. // Журн. неорган. химии. 2017. Т. 62. № 5. С. 539.]https://doi.org/10.1134/S0036023617050163
Киргинцев А.Н., Трушникова Л.Н., Лаврентьева В.Г. Растворимость неорганических веществ в воде. Справочник. Л.: Химия, 1972.
Шварценбах Г., Флашка Г. Комплексонометрическое титрование / Пер. с нем. Вайнштейн Ю.И. М.: Химия, 1970.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии