Журнал неорганической химии, 2021, T. 66, № 11, стр. 1577-1584
Квантово-химические расчеты структуры и анализ устойчивости комплексов меди(II) с криптандом[2.2.2]
В. А. Исаева a, *, Г. А. Гамов a, В. А. Шарнин a
a Ивановский государственный химико-технологический университет
153000 Иваново, Шереметевский пр-т, 7, Россия
* E-mail: kvol1969@gmail.com
Поступила в редакцию 01.04.2021
После доработки 25.05.2021
Принята к публикации 27.05.2021
Аннотация
Проведен анализ констант устойчивости моноядерного, протонированного и биядерного комплексов меди(II) с криптандом[2.2.2] и квантово-химические расчеты структуры криптанда[2.2.2], его протонированных форм и комплексов с ионом меди(II). Выявлено, что образование моноядерного криптата меди(II) связано со значительным сжатием макроцикла в направлении оси азот–азот, а биядерного – напротив, с растяжением полости. С привлечением литературных данных об устойчивости комплексов двухвалентных d-металлов с N-донорными лигандами рассмотрено соотношение криптатного и хелатного эффектов при образовании координационных соединений с макроциклическими лигандами и лигандами с открытой цепью. Показано, что при образовании комплексов криптанда[2.2.2] c ионами Zn2+, Co2+, Ni2+, Cu2+ хелатный эффект значительно превышает криптатный. Наличие криптатного эффекта сопоставлено с геометрическими размерами катиона и макроцикла.
ВВЕДЕНИЕ
Основным свойством макроциклических соединений (краун-эфиров, криптандов, подантов) является их способность селективно образовывать комплексы с ионами металлов и нейтральными молекулами, что определяет их практическое применение [1–3]. Высокая селективность взаимодействия криптанда с металлом позволяет использовать криптаты для выделения неустойчивых химических соединений, для избирательных каталитических и различных межфазных процессов, а также как экстрагенты для металлов, высокоселективные сорбенты, ионофоры [4, 5].
Наиболее изученными являются комплексы криптандов с ионами щелочных и щелочноземельных металлов, что отражено в обзорной работе [6]. Имеется большое число работ, в которых исследована устойчивость криптатных комплексов серебра(I) в водных и водно-органических растворах [6]. Процессы комплексообразования криптандов с двухвалентными d-металлами исследованы в меньшей степени и в основном представлены работами по установлению констант устойчивости комплексов состава 1 : 1 [6].
Для моноядерного комплекса меди(II) с криптандом[2.2.2] в работах [7, 8] определена его константа устойчивости в водном растворе, авторами [9–12] изучена устойчивость этого комплекса в некоторых индивидуальных органических растворителях. Возможность образования в растворе протонированного и биядерного комплексов меди(II) с криптандом[2.2.2] в литературе не рассмотрена, за исключением работы [11], в которой приведено значение константы устойчивости биядерного криптата меди(II) в безводном метанольном растворе.
Целью настоящей работы является анализ координационных равновесий в водных растворах меди(II) с криптандом[2.2.2] в условиях образования моноядерного, протонированного и биядерного криптатных комплексов. Для этого необходимо определить структурные характеристики образующихся комплексов, что позволит обсудить их стабильность с учетом соответствия ионного радиуса меди(II) и размера макроциклической полости.
РАСЧЕТНАЯ ЧАСТЬ
Геометрические параметры свободного криптанда[2.2.2], моно- и бипротонированного лигандов, моноядерного, протонированного и биядерного комплексов меди(II) с криптандом[2.2.2] оптимизированы при помощи программного обеспечения Firefly QC (версия 8.2.0) [13], частично основанного на коде GAMESS (US) [14] в рамках теории функционала плотности. Использован трехпараметрический функционал Беке–Ли–Янга–Парра B3LYP [15] и базисный набор 6-31G* [16]. С целью проверки достижения минимума потенциальной энергии проводили вычисление матриц вторых производных. Во всех случаях отмечалось отсутствие мнимых частот в расчетном колебательном спектре. Визуализацию молекулярных моделей осуществляли при помощи программного обеспечения ChemCraft [17]. В качестве исходной структуры криптанда[2.2.2] для последующей оптимизации использовали результаты расчетов Д. Шарапы [18]. Все расчеты проводили in vacuo.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Криптанд[2.2.2] представляет собой трехмерный обьемный аминоэфир, узловые атомы азота которого соединены тремя оксиэтиленовыми цепочками, каждая из которых содержит два эфирных атома кислорода:
Размер внутримолекулярной полости криптанда[2.2.2] подходит для размещения небольшого катиона меди(II) (r = 0.73 Å [19]) с образованием в растворе комплекса мольного состава 1 : 1. В литературе константа устойчивости моноядерного комплекса меди(II) с криптандом[2.2.2] определена при хорошей сходимости результатов в работах [8] (lgK1 = 7.1, µ = 0.05(Et4NClO4)) и [7] (lgK1 = 6.81, µ = 0.1(Et4NClO4)). Образование биядерного комплекса меди(II) с криптандом[2.2.2] с константой устойчивости lgK3 = 4.56 (µ = = 0.05(Et4NClO4) установлено в метанольной среде [11]. Несмотря на отсутствие в литературе сведений о протонированном комплексе катиона меди(II) с криптандом[2.2.2], вероятность его формирования в растворе при постановке потенциометрического эксперимента нами не исключалась [20], поскольку известно, что с ионами d-металлов криптанды могут образовывать протонированные координационные соединения [7, 21]. Возможность образования билигандного комплекса меди(II) с криптандом[2.2.2] не рассматривалась в виду очевидных стерических препятствий. Комплексообразование сопровождается реакциями протонирования лиганда, соответственно, общую схему равновесных процессов в растворе с участием катиона меди(II) и криптанда[2.2.2] можно представить в виде:
Kонстанты протонирования криптанда[2.2.2] в водном растворе (${\text{lg}}K_{4}^{^\circ }$ = 9.87, ${\text{lg}}K_{5}^{^\circ }$ = 7.23) получены в работе [22]. Kонстанты равновесия реакций образования моноядерного, протонированного и биядерного комплексов меди(II) с криптандом[2.2.2] в водном растворе (${\text{lg}}K_{1}^{^\circ }$ = 6.68, ${\text{lg}}\beta _{2}^{^\circ }$ = = 14.65, ${\text{lg}}K_{3}^{^\circ }$ = 3.42) определены нами в работе [20].
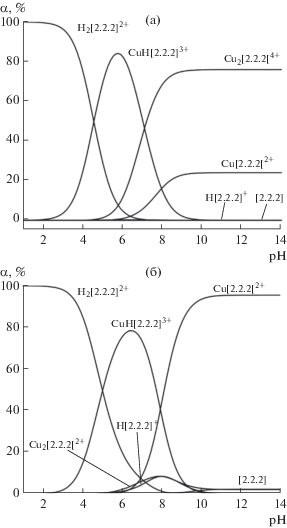
С использованием значений констант равновесия реакций образования криптатов меди(II) и протонирования криптанда[2.2.2] построены диаграммы долевого распределения частиц в зависимости от рН раствора при различном соотношении Cu2+ : [2.2.2]. Как показывает рис. 1, в диапазоне значений рН ~ 6–7 в растворе преобладает протонированный криптат меди(II) вне зависимости от соотношения металл : лиганд. При сдвиге в щелочную область начинается накопление в растворе непротонированных форм криптатов меди(II). Количественное соотношение моноядерного и биядерного криптатов меди(II) в растворе определяется исходным мольным соотношением перхлората меди(II) и криптанда[2.2.2].
Рис. 1.
Диаграмма долевого распределения частиц в зависимости от рН при мольном соотношении Cu2+ : : криптанд[2.2.2] = 2 : 1 (а), 1 : 1 (б).
Представляет интерес проиллюстрировать соображения о возможности образования комплексов различного состава, приведенные выше, данными квантово-химических расчетов. Как следует из оптимизированной структуры свободного лиганда (рис. 2а), в полости молекулы могут разместиться два протона или два иона меди(II), несмотря на существенную разницу ионных радиусов (рис. 2, табл. 1). Протонирование лиганда (рис. 2б) вызывает сжатие молекулы криптанда[2.2.2] в направлении оси N16–N24, а также приводит к небольшому уменьшению расстояния между атомами кислорода O4, 35, 38 и O9, 49, 52. Однако при добавлении второго иона водорода (рис. 2в) необходимость размещения в полости криптанда[2.2.2] еще одной положительно заряженной частицы приводит к растягиванию молекулы вдоль оси N16–N24 за счет относительно сильного сжатия в поперечном сечении (укорачиваются расстояния O4, 35, 38 и O9, 49, 52). Аналогичной закономерности подчиняются изменения геометрии лиганда при введении в полость ионов меди(II) (рис. 2г, 2д, 2ж): для [Cu[2.2.2]]2+ характерно сильное сжатие вдоль оси N16–N24 при некотором растяжении в поперечных плоскостях, для [CuH[2.2.2]]3+ – растяжение вдоль оси N16–N24, а для [Cu2[2.2.2]]4+ – еще более сильное растяжение в продольной плоскости и сжатие в поперечной. В последнем случае ионы меди сближаются друг с другом на расстояние до 2.70 Å.
Рис. 2.
Оптимизированные геометрические модели свободного криптанда[2.2.2] (а), H[2.2.2]+ (б), H2[2.2.2]2+ (в), [Cu[2.2.2]]2+ (г), [CuH[2.2.2]]3+ (д), [Cu[2.2.2]]2+ (альтернативная модель) (е), [Cu2[2.2.2]]4+ (ж), [Cu2[2.2.2]]4+ (альтернативная модель) (з).

Таблица 1.
Основные расстояния (d, Å) для свободного криптанда[2.2.2], протонированного и его комплексов с ионом Cu(II)
| d, Å | N16–N24 | O4–O35, O35–O38, O38–O4 | O9–O49, O49–O52, O52–O9 | N16–H, N24–H | N16–Cu, N24–Cu | O4–Cu, O35–Cu, O38–Cu | O9–Cu, O49–Cu, O52–Cu |
|---|---|---|---|---|---|---|---|
| [2.2.2] | 5.17 | 4.75 | 5.23 | – | – | – | – |
| H[2.2.2]+ | 4.75 | 4.70 | 5.20 | 1.03 | – | – | – |
| H2[2.2.2]2+ | 5.98 | 4.07 | 4.14 | 1.03 | – | – | – |
| [Cu[2.2.2]]2+ | 4.11 | 4.83 | 5.37 | – | 2.07, 2.05 | 2.87 | 3.75 |
| [Cu[2.2.2]]2+ (альтернативная) | 6.46 | 3.41, 3.42, 3.88 | 3.49, 3.28, 4.11 | – | 2.12, 4.39 | 2.10, 2.20, 2.02 | 3.46, 2.03, 3.81 |
| [CuH[2.2.2]]3+ | 6.38 | 3.37, 3.45, 3.83 | 3.49, 3.28, 4.11 | 1.04 | 2.12 | 2.05, 2.27, 1.98 | 3.51, 2.15, 3.88 |
| [Cu2[2.2.2]]4+ | 6.84 | 3.42, 3.64, 3.46 | 3.25, 3.72, 3.45 | – | 2.07, 2.08 | 2.10, 2.00, 2.00 | 2.15, 1.99, 1.97 |
| [Cu2[2.2.2]]4+ (альтернативная) | 7.27 | 3.64 | 3.98, 2.84, 3.34 | – | 2.04, 2.06 | 2.21, 2.17, 1.98 | – |
Учитывая, что в координации меди(II) могут принимать участие не только атомы азота, но и атомы кислорода лиганда, мы также оптимизировали альтернативную модель для комплекса состава [Cu[2.2.2]]2+, в котором с катионом взаимодействуют атомы O4, 35, 38. Однако полная энергия такого альтернативного комплекса (рис. 2е) выше, чем комплекса, в котором координация осуществляется через два атома азота (рис. 2г), причем различие составляет 0.337 атомных единиц энергии (–2908.212 по сравнению с –2907.875 а. е. э.). Таким образом, можно заключить, что выигрыш в энергии за счет образования большего количества координационных связей не компенсирует затраты на серьезное искажение структуры лиганда.
С другой стороны, выбирая между моделями моноядерного криптата меди(II) (рис. 2г и 2е), следует учитывать также особенности геометрии координационной сферы иона Cu2+. Основное электронное состояние октаэдрического комплекса меди(II) дважды вырождено (2Eg,терм) [23], и координационный октаэдр может как удлиняться, так и сжиматься [23]. При этом, например, для кристаллического соединения гексаамминмеди(II) в кристалле характерно удлинение [24], а для гексааквакомплекса – как удлинение, так и сжатие в зависимости от того, на которой из двух разрыхляющих орбиталей (dx2 – y2 или dz2) будет локализована электронная дырка [25]. Это, в свою очередь, определяется особенностями внутреннего электрического поля, порождаемого окружением комплексного иона [25]. Согласно модели (рис. 2г), ион меди(II) находится практически точно в центре равностороннего треугольника, образованного атомами О4, 35, 38, несколько выходя из его плоскости, а атомы азота N16, 24 образуют с катионом металла почти прямую линию (телесный угол 179.9°). Можно предположить, что для криптата меди(II) реализуется как раз сжатие координационного октаэдра, причем с учетом расстояний Cu–O, равных 2.87 Å, имеет место не координация атомами кислорода в экваториальной плоскости, а электростатическое притяжение между частично отрицательно заряженными атомами О4, 35, 38 и катионом. В альтернативной модели (рис. 2е) атом меди расположен внутри равнобедренного треугольника О35–О4–О38, причем расстояния Cu–O (2.02–2.20 Å) существенно меньше, чем в модели (рис. 2г). В качестве второго аксиального лиганда вместо N24 выступает атом кислорода О49, однако угол N16CuO49 составляет уже 158°. Таким образом, координационный полиэдр иона меди(II) в альтернативной структуре значительно отличается от октаэдра, вытянутого/сплющенного из-за эффекта Яна–Теллера, характерного для комплексов меди с малыми молекулами [24, 25].
Следует отметить также, что дополнительную координацию иона меди(II) внутри криптанда молекулами растворителя мы считаем маловероятной, несмотря на то, что присоединение одной молекулы растворителя (тетрагидрофурана) было отмечено, например, для криптатов[2.2.2] лантанидов(II) [26]. Для ионов f-металлов характерно большее координационное число (9), у них больше ионный радиус (например, 1.31 Å у Eu2+ [27]), что допускает больше свободы в размещении лиганда, в том числе за пределами полости макроцикла.
Участие атомов кислорода криптанда[2.2.2] в координации иона Cu2+, исходя из квантово-химических расчетов, отмечено при образовании комплексных частиц с двумя катионами внутри полости, т.е. протонированного и биядерного криптатов меди(II) (рис. 2д, 2ж).
Для комплекса состава [Cu2[2.2.2]]4+ была также рассмотрена альтернативная модель. Согласно этой модели, один катион размещается внутри полости криптанда[2.2.2], а второй располагается снаружи (рис. 2з). В этом случае альтернативная модель энергетически на 0.077 а. е. э. менее выгодна (–4547.187 по сравнению с –4547.264 а. е. э.). Однако малое расстояние (2.70 Å) между положительными двухзарядными ионами требует для их расположения в полости лиганда крайне эффективной делокализации избыточного заряда, что, по-видимому, труднодостижимо для комплекса [Cu2[2.2.2]]4+. Таким образом, альтернативная модель, в которой один катион экранирован от другого, все же может быть более предпочтительной. В любом случае следует ожидать существенно более низкого значения константы присоединения второго иона металла по сравнению с ${\text{lg}}K_{1}^{^\circ }$ либо из-за сильного электростатического отталкивания катионов внутри полости, либо из-за наружной координации, в которой криптатный эффект будет отсутствовать. Экспериментально определенные значения ${\text{lg}}K_{1}^{^\circ }$ и ${\text{lg}}K_{3}^{^\circ }$ [20] показывают, что образование биядерного криптата меди(II) характеризуется ступенчатой константой устойчивости, в два раза меньшей, чем константа устойчивости моноядерного комплекса.
При включении в полость криптанда[2.2.2] протонов не наблюдается столь сильного отличия в ступенчатых константах протонирования по первой и второй ступеням. Кроме того, протонирование криптанда[2.2.2] характеризуется константами, идентичными константам протонирования этилендиамина (lgK°(НEn+) = 9.91, lgK°(Н2En2+) = 7.05 [28]). Это может свидетельствовать об отсутствии взаимного влияния двух протонов, находящихся внутри полости макроцикла на расстоянии 3.92 Å друг от друга.
С учетом структурных характеристик криптатов меди(II) можно сравнить константы устойчивости комплексов Cu2+ c криптандом[2.2.2] и другими N-донорными лигандами с целью рассмотрения влияния различных факторов на устойчивость комплексов, а также оценить криптатный эффект либо отсутствие такового при координации иона металла макроциклом.
При образовании биядерного и протонированного криптата меди(II) координация катиона металла осуществляется посредством одного атома азота, поэтому значения ступенчатых констант образования [Cu2[2.2.2]]4+ (${\text{lg}}K_{3}^{^\circ }$ = 3.42) и [CuH[2.2.2]]3+ ((${\text{lg}}K_{2}^{^\circ }$ = ${\text{lg}}\beta _{2}^{^\circ }$ – ${\text{lg}}K_{4}^{^\circ }$ = 14.65 – 9.87 = = 4.78) соизмеримы с константой устойчивости моноаммиаката меди(II) (lgK° = 4.03 [29]). Kоординация меди(II) макроциклом через атом азота в обоих комплексах дополняется донорно-акцепторными связями с атомами кислорода, что способствует стабилизации комплексов. Однако наличие второго катиона в полости макроцикла при ступенчатом образовании [Cu2[2.2.2]]4+ и [CuH[2.2.2]]3+ оказывает обратный эффект. Вероятно, меньшее отрицательное влияние на устойчивость комплекса наличия протона, чем двухзарядного катиона Cu2+, определяет большее значение константы устойчивости протонированного криптата меди(II) по сравнению с биядерным комплексом.
Образование моноядерного криптатного комплекса связано с участием двух атомов азота лиганда и вхождением иона металла внутрь макроцикла (рис. 2г), что предполагает дополнительную стабилизацию комплексной частицы за счет пространственного удерживания иона металла стенками трехмерной полости. Действительно, константа устойчивости моноядерного комплекса меди(II) с криптандом[2.2.2] выше, чем с его моноциклическим аналогом диаза-краун-эфиром[2.2] [30]. Для прочих двухвалентных d-металлов в большинстве случаев их комплексы с диаза-краун-эфиром[2.2] также менее стабильны по сравнению с комплексами с криптандом[2.2.2] (табл. 2). Однако выигрыш в устойчивости комплекса от пространственного удерживания катиона во внутримолекулярной полости криптанда[2.2.2] для многих металлов незначителен. Известно, что криптатный эффект будет проявляться при топологическом соответствии размера катиона величине полости криптанда. Структура криптанда[2.2.2] не позволяет макроциклу оптимально подстроиться под размер катиона при координации иона металла с малым радиусом. При вхождении таких катионов внутрь полости она сжимается вдоль оси азот–азот и растягивается в поперечных плоскостях (рис. 2г), что требует дополнительных затрат энергии на организацию структуры, а это сказывается на устойчивости комплекса. Катионы меди(II), никеля(II), кобальта(II), цинка(II) вследствие своего малого размера образуют с криптандом[2.2.2] комплексы, которые характеризуются меньшими константами устойчивости, чем у соответствующих биаммиачных комплексов (табл. 2), что демонстрирует не только отсутствие выигрыша в стабилизации указанных криптатных комплексов за счет удерживания стенками полости, но и отсутствие хелатного эффекта. Для криптатных комплексов меди(II), так же как и для комплексов кобальта(II), цинка(II), никеля(II) с криптандом[2.2.2], наблюдается более низкая устойчивость (на 3 и более лог. ед. (табл. 2)) по сравнению с комплексами этих металлов с этилендиамином (En), подвижная структура которого легко образует хелатный цикл.
Таблица 2.
Константы устойчивости комплексов d-металлов с N-донорными лигандами, Т = 298 K
| M2+ | r, Å [19] | lgK (µ) | ||||
|---|---|---|---|---|---|---|
| [MeNH3]2+ | [Me(NH3)2]2+ | [MeEn]2+ | [Me[2.2]]2+ | [Me[2.2.2]]2+ | ||
| Co2+ | 0.65 | 1.99(0.0) [31] | 3.50 (0.0) [31] | 5.89 (0.1) [36] | 3.25 (0.1) [42] | 2.8 (0.05) [8] |
| Ni2+ | 0.69 | 2.70 (0.0) [32] | 4.82 (0.0) [32] | 7.36 (0.0) [37] | 3.43 (0.1) [42] | 4.4 (0.05) [8] |
| Cu2+ | 0.73 | 4.03 (0.0) [29] | 7.42 (0.0) [29] | 10.42 (0.0) [38] | 6.18 (0.1) [30] | 6.68 (0.0) |
| Zn2+ | 0.74 | 2.35 (0.1) [33] | 4.80 (0.1) [33] | 5.84 (0.3) [39] | 3.0 (0.05) [8] | 2.8 (0.05) [8] |
| Cd2+ | 0.95 | 2.66 (0.1) [33] | 4.75 (0.1) [33] | 5.45 (0.2) [40] | 5.31 (0.1) [30] | 7.10 (0.1) [7] |
| Hg2+ | 1.02 | 8.8 (2.0) [34] | 17.5 (2.0) [34] | 14.3 (0.1) [41] | – | 18.2 (0.1) [30] |
| Pb2+ | 1.19 | 1.55 (5.0) [35] | – | 5.05 (0.1) [35] | 6.90 (0.1) [30] | 12.72 (0.1) [7] |
Если рассмотреть устойчивость комплексов с ионами двухвалентных кадмия и свинца, то они, имея наименьшую стабильность комплексов с нециклическими аминами (lgK: [PbEn]2+ < [CdEn]2+ < < [ZnEn]2+ ≤ [CoEn]2+ < [NiEn]2+ < [CuEn]2+ < < [HgEn]2+), демонстрируют высокую устойчивость криптатных комплексов (lgK: [Zn[2.2.2]]2+ = = [Co[2.2.2]]2+ < [Ni[2.2.2]]2+ < [Cu[2.2.2]]2+ < < [Cd[2.2.2]2+ < [Pb[2.2.2]]2+ < [Hg[2.2.2]]2+) (табл. 2). Радиусы ионов Cd2+, Hg2+, Pb2+ больше соответствуют размеру полости криптанда[2.2.2]. Следовательно, эти ионы получают значительный выигрыш в устойчивости при координировании макроциклом за счет криптатного эффекта по сравнению с ионами с малым радиусом. Криптатный эффект максимально проявляется при включении в полость криптанда[2.2.2] иона Pb2+, для которого наблюдается наилучшее в рассматриваемом ряду металлов соответствие геометрических размеров катиона и макроцикла, о чем свидетельствует разница 7.6 лог. ед. в константах устойчивости криптатного и этилендиаминового комплексов свинца(II).
ЗАКЛЮЧЕНИЕ
При сопоставлении констант устойчивости комплексов d-металлов с различными N-донорными лигандами выявлено, что затраты энергии на искажение полости макроцикла с двумя донорными атомами азота при координировании ионов малого радиуса не позволяют проявиться хелатному эффекту и нивелируют криптатный эффект. При помощи квантово-химических расчетов продемонстрирована возможность вхождения в координационную полость макроцикла одновременно двух протонов или двух катионов меди(II). Установлено, что в зависимости от количества катионов, образующих комплекс, криптанд[2.2.2] может как сжиматься (один ион Cu2+), так и растягиваться (два иона Cu2+) в направлении оси азот–азот.
Список литературы
Хираока М. Краун-соединения. М.: Мир, 1986. 363 с.
Сафиулина А.М., Иванец Д.В., Кудрявцев Е.М. и др. // Журн. неорган. химии. 2019. Т. 64. № 4. С. 430. [Safiulina A.M., Ivanets D.V., Kudryavtsev E.M. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 536. https://doi.org/10.1134/S0036023619040181]https://doi.org/10.1134/S0044457X19040184
Цивадзе А.Ю., Чернядьев А.Ю. // Журн. неорган. химии. 2020. Т. 65. № 11. С. 1469. [Tsivadze A.Y., Chernyad’ev A.Y. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1662. https://doi.org/10.1134/S0036023620110194]https://doi.org/10.31857/S0044457X20110197
Lehn J.M. // Struct. Bond. 1973. V. 16. P. 1. https://doi.org/10.1007/BFb0004364
Lehn J. M. // Pure Appl. Chem. 1980. V. 52. № 10. P. 2303. https://doi.org/10.1351/pac198052102303
Izatt R.M., Bradshaw J.S., Nielsen S.A. et al. // Chem. Rev. 1985. V. 85. № 4. P. 271. https://doi.org/10.1021/cr00068a003
Amaud-Neu F., Spiess B., Schwing-Weill M.J. // Helv. Chim. Acta. 1977. V. 60. № 8. P. 2633. https://doi.org/10.1002/hlca.19770600815
Buschman H.J., Cleve E., Schollmever E. // J. Coord. Chem. 1997. V. 42. P. 127. https://doi.org/10.1080/00958979708045285
Lewandowski A., Malinska J. // New J. Chem. 1996. V. 20. № 6. P. 653.
Arnaud-Neu F., Spiess B., Schwing-Weill M.J. // J. Am. Chem. Soc. 1982. V. 104. № 21. P. 5641. https://doi.org/10.1021/ja00385a014
Spiess B., Arnaud-Neu F., Schwing-Weill M.J. // Helv. Chim. Acta. 1979. V. 62. № 5. P. 1531. https://doi.org/10.1002/hlca.19790620518
Bessiere J., Lejaille M. // Anal. Lett. 1979. V. 12. № 7. P. 753. https://doi.org/10.1080/00032717908059756
Granovsky A.A. Firefly version 8, www http://classic.chem.msu.su/gran/firefly/index.html
Schmidt M.W., Baldridge K.K., Boatz J.A. et al. // J. Comput. Chem. 1993. V. 14. № 11. P. 1347. https://doi.org/10.1002/jcc.540141112
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 5648. https://doi.org/10.1063/1.464913
Rassolov V.A., Ratner M.A., Pople J.A. et al. // J. Comp. Chem. 2001. V. 22. P. 976. https://doi.org/10.1002/jcc.1058
Zhurko G.A., Zhurko D.A. http://www.chemcraftprog.com/index.html
https://figshare.com/articles/dataset/Cryptand-222/6790061
Волков А.И., Жарский И.М. Большой химический справочник. Мн.: Современная школа, 2005. 608 с.
Исаева В.А., Кипятков К.А., Гамов Г.А., Шарнин В.А. // Журн. физ. химии. 2021. Т. 95. № 5. С. 758. https://doi.org/10.31857/S0044453721050162 [Isaeva V.A., Kipyatkov K.A., Gamov G.A., Sharnin V.A. // Russ. J. Phys. Chem. A. 2021. V. 95. № 5. P. 968. https://elib.belstu.by/handle/123456789/2997810.31857/S0044453721050162
Anderegg G. // Helv. Chim. Acta. 1981. V. 64. № 6. P. 1790. https://doi.org/10.1002/hlca.19810640608
Исаева В.А., Шарнин В.А. // Журн. физ. химии. 2018. Т. 92. № 4. С. 600. [Isaeva V.A., Sharnin V.A. // Russ. J. Phys. Chem. A. 2018. V. 92. № 4. P. 710. https://doi.org/10.1134/S0036024418040088]https://doi.org/10.7868/S0044453718040131
Минкин В.И., Симкин Б.Я., Миняев Р.М. Теория строения молекул. Ростов-на-Дону: Феникс, 1997. С. 453.
Woidy P., Meng W., Kraus F. // Z. Naturforsch. 2014. V. 69b. P. 1. https://doi.org/10.5560/ZNB.2014-3291
Aramburu J.A., Bhowmik A., Garcia-Lastra J.M. et al. // J. Phys. Chem. C. 2019. V. 123. P. 3088. https://doi.org/10.1021/acs.jpcc.8b10441
Huh D.N., Kotyk C.M., Gembicky M. et al. // Chem. Commun. 2017. V. 53. P. 8664. https://doi.org/10.1039/c7cc04396a
Lin C., Yang S., Lin J., Yang C. // Appl. Sci. 2017. V. 7. P. 30. https://doi.org/10.3390/app7010030
Пятачков А.А., Шорманов В.А., Крестов Г.А. // Изв. вузов. Химия и хим. технология. 1983. Т. 26. № 11. С. 1329.
Михеев С.В., Шарнин В.А., Шорманов В.А. // Журн. неорган. химии. 1999. Т. 44. № 8. С. 1330.
Anderegg G. // Helv. Chim. Acta. 1975. V. 58. № 4. P. 1218. https://doi.org/10.1002/hlca.19750580427
Schwarzenbach G. // Helv. Chim. Acta. 1952. V. 35. № 7. P. 2344. https://doi.org/10.1002/hlca.19520350721
Невский А.В., Шорманов В.А., Крестов Г.А. // Коорд. химия. 1985. Т. 11. № 5. С. 666.
Doi K., Tanaka M. // Anal. Chim. Acta. 1974. V. 71. № 2. P. 464. https://doi.org/10.1016/S0003-2670(01)85454-4
Bjerrum J. // Coord. Chem. Rev. 1989. V. 94. P. 1. https://doi.org/10.1016/0010-8545(89)80042-6
Mulla F., Marsicano F., Nakani B., Hancock R.D. // Inorg. Chem. 1985. V. 24. P. 3076. https://doi.org/10.1021/ic00213a042
Nakon R., Martell A. // J. Inorg. Nucl. Chem. 1972. V. 34. № 4. P. 1365. https://doi.org/10.1016/0022-1902(72)80338-5
Невский А.В., Шорманов В.А., Крестов Г.А. // Коорд. химия. 1989. Т. 15. № 11. С. 1576.
Михеев С.В., Фадеев Ю.Ю., Шарнин В.А., Шорманов В.А. // Журн. неорган. химии. 1994. Т. 39. № 9. С. 1502.
Леденков С.Ф., Шарнин В.А., Исаева В.А., Шорманов В.А. // Коорд. химия. 1993. Т. 19. № 9. С. 691.
Vaidyan A.V., Bhattacharya P.K. // Indian J. Chem. 1996. V. 35A. № 10. P. 839. http://nopr.niscair.res.in/handle/123456789/41475
Paoletti P. // Pure Appl. Chem. 1984. V. 56. № 4. P. 491. https://doi.org/10.1351/pac198456040491
Luboch E., Cygan A., Biernat J.F. // Inorg. Chim. Acta. 1983. V. 68. P. 201. https://doi.org/10.1016/S0020-1693(00)88961-6
Дополнительные материалы
- скачать ESM.docx
- Fig. 2a. - Fig. 2h.
Инструменты
Журнал неорганической химии