Журнал неорганической химии, 2021, T. 66, № 10, стр. 1412-1420
Синтез и характеристика координационных соединений карбоксилатов никеля(II) с салицилгидразидом. Кристаллическая структура [NiL3]Pht (L – салицилгидразид, Pht2– – анион фталевой кислоты)
В. С. Сергиенко a, b, *, Т. В. Кокшарова c, А. В. Чураков a, Т. В. Мандзий c, М. Д. Суражская a, О. А. Егорова d
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Всероссийский институт научной и технической информации РАН
125190 Москва, ул. Усиевича, 20, Россия
c Одесский национальный университет им. И.И. Мечникова
65082 Одесса, ул. Дворянская, 2, Украина
d Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 22.12.2020
После доработки 09.03.2021
Принята к публикации 27.03.2021
Аннотация
Синтезированы координационные соединения различных карбоксилатов (валерат, бензоат, фталат, малеат, фумарат) никеля(II) с салицилгидразидом и исследованы методом ИК-спектроскопии. Кристаллическая структура комплекса фталата никеля(II) с салицилгидразидом [NiL3]Pht (I) (L – салицилгидразид, Pht2– – дианион фталевой кислоты) определена методом рентгеноструктурного анализа. Структурные единицы кристалла I – комплексные катионы [NiL3]2+ и анионы фталевой кислоты Pht2–, объединенные межионными водородными связями N–H…O, O–H…O. Атом никеля имеет искаженную цис-октаэдрическую координацию с тремя атомами кислорода и тремя атомами азота трех бидентатно-хелатных лигандов L (Ni–O 2.027–2.059 Å, Ni–N 2.067–2.097 Å).
ВВЕДЕНИЕ
Комплексы металлов с гидразидами и их производными привлекают внимание исследователей благодаря биологическому значению этих соединений [1]. Особый интерес с этой точки зрения представляют координационные соединения с салицилгидразидом, поскольку сама салициловая кислота и многие ее производные являются традиционными лекарственными веществами, а антимикробная активность обнаружена и у недавно синтезированных комплексов [2]. Наиболее перспективными биоактивными соединениями являются координационные соединения на основе карбоксилатов. Однако из карбоксилатных комплексов салицилгидразида описаны лишь ацетатные [1], а структурные данные для подобных соединений нами не обнаружены.
В качестве комплексообразователя в координационных соединениях с лигандами, содержащими гидразидный фрагмент, большой интерес может представлять никель(II). Для него в зависимости от соотношения реагентов возможно изменение дентатности лиганда [3], образование изомеров [4] или сольватов различного состава [5, 6]. В результате проведенных нами ранее исследований, в том числе и методом рентгеноструктурного анализа (РСА), показано, что в координационных соединениях никеля(II) с одним и тем же гидразидным либо тиогидразидным лигандом фактором, определяющим стехиометрию комплекса, является анион взятой для синтеза соли. Гидразиды и тиогидразиды всегда координированы к металлу бидентатно через кислород или серу и гидразиновый атом азота с образованием пятичленных хелатных колец, а соотношение металл : лиганд варьируется в зависимости от аниона. От природы аниона существенно зависит и количество входящей в состав гидразидного комплекса воды. Так, методом РСА нами было показано, что комплексы никеля(II) с тиосемикарбазидом (Tsc) имеют соотношение Ni : Tsc = 1 : 2 для сульфата, салицилата [7] и 1,5-нафталиндисульфоната [8] и 1 : 3 для хлорида [7]. В случае комплекса с малонатом $\left( {{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}} \right)$ формальный состав соответствует соотношению Ni : Tsc : малонат = 1 : 1 : 1, а по данным РСА, это соединение состоит из катионов [Ni(Tsc)2]2+, анионов [Ni(C3H2O4)2(H2O)2]2– и кристаллизационной воды [9]. Зависимость стехиометрии образующихся комплексов никеля(II) определяется не только и не столько основностью соответствующих кислот, сколько пространственными факторами и способностью анионов к образованию разнообразных водородных связей с участием гидразида, аниона и молекул растворителя. В частности, образование указанного координационного соединения с участием никеля(II) и в катионе, и в анионе обусловлено способностью малонат-аниона образовывать устойчивые шестичленные хелатные циклы.
Представляет интерес синтез и исследование комплексов карбоксилатов никеля(II) с различными анионами и с салицилгидразидом.
В настоящей работе описан синтез и ИК-спектры комплексов различных карбоксилатов: валерата (Val), бензоата (Benz), малеата (Mal), фумарата (Fum), фталата (Pht) никеля(II) с салицилгидразидом. Для комплекса [NiL3]Pht (I) определена кристаллическая и молекулярная структура.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали салицилгидразид марки “х. ч.”. Исходные карбоксилаты никеля(II) получали обменными реакциями хлорида никеля(II) с натриевыми солями соответствующих карбоновых кислот в водном растворе.
Синтез [NiL2]Val2 (II), [NiL3]Benz2 (III), [NiL3]Pht · H2O (IV). Навеску 0.76 г салицилгидразида (0.005 моль) растворяли при нагревании до 60оС в 150 мл этанола и небольшими порциями при постоянном перемешивании в течение 30 мин добавляли 0.0025 моль мелкоизмельченного карбоксилата никеля(II). Выпавший осадок отделяли на фильтре Шотта, промывали этанолом и сушили при 60°С до постоянной массы.
Синтез [NiL3]Mal (V) и [NiL3]Fum (VI). Навеску 3.04 г салицилгидразида (0.02 моль) растворяли при комнатной температуре в 40 мл ДМФА, затем небольшими порциями при перемешивании добавляли 0.01 моль мелкоизмельченного малеата или фумарата никеля(II) и перемешивали на магнитной мешалке в течение 1 ч. Выпавший осадок отделяли с помощью фильтра Шотта, промывали этанолом и сушили до постоянной массы.
Для получения кристаллов более высокого качества соединения II–VI перекристаллизовывали из смеси этанола и воды (1 : 1). Для этого 0.5 г комплекса при нагревании и постоянном перемешивании растворяли в 25 мл указанной смеси растворителей, после получения однородного раствора его оставляли для самопроизвольного удаления растворителя. Пригодные для РСА кристаллы образовывались из соединения IV, но при этом был получен безводный комплекс I, что, очевидно, связано с действием этанола.
Элементный анализ на никель проводили методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой на приборе Perkin–Elmer Optima 8000, на углерод, водород и азот – с помощью анализатора LECO Tru Spec СНN.
ИК-спектры регистрировали на приборе Perkin–Elmer Spectrum BX II FT-IR SYSTEM (Perkin–Elmer), образцы готовили в виде таблеток с KBr.
РСА. Кристаллографические и экспериментальные данные для комплекса I приведены в табл. 1. Структура определена прямым методом и уточнена полноматричным анизотропным МНК по F2 для всех неводородных атомов (SHELXL-97 [10]). Все атомы водорода помещены в рассчитанные позиции с фиксированными расстояниями О—Н 0.82 Å, N—H(NH) 0.86 Å, N—H(NH2) 0.90 Å. Гидроксоатом О(5) неупорядочен в двух равновероятных позициях: О(5А) и О(5В).
Таблица 1.
Кристаллографические и экспериментальные данные для I
| Параметр | Значение |
|---|---|
| Эмпирическая формула | C29H28N6NiO10 |
| М | 679.28 |
| Цвет, габитус | Синий, блок |
| Размер кристалла, мм | 0.200 × 0.100 × 0.050 |
| Сингония | Моноклинная |
| Пр. гр. | С2/с |
| Параметры ячейки | |
| a, Å | 20.114(3) |
| b, Å | 16.606(2) |
| c, Å | 20.335(2) |
| β, град | 92.060(10) |
| V, Å3 | 6787.5(15) |
| Z | 8 |
| ρвыч, г/см3 | 1.329 |
| µMo, мм–1 | 1.356 |
| F(000) | 2816 |
| Дифрактометр | Enraf-Nonius CAD-4 |
| Т, K | 293 |
| Излучение, Å | Графитовый монохроматор, CuKα, 1.54183 |
| Метод сканирования | ω |
| Пределы сканирования по θ, град | 4.04–69.94 |
| Интервалы индексов | –24 ≤ h ≤ 24, –20 ≤ k ≤ 20, –24 ≤ l ≤ 24 |
| Общее число рефлексов | 24473 |
| Число независимых рефлексов | 6421 [R(int) = 0.0310] |
| Число уточняемых параметров | 420 |
| Метод уточнения | Полноматричный МНК по F2 (SHELXL-93) |
| GOOF по F2 | 1.061 |
| Rhkl [I > 2σ(I)] | R1 = 0.0444, wR2 = 0.1240 |
| Rhkl(по всем данным) | R1 = 0.0636, wR2 = 0.1358 |
| Коэффициент экстинкции | 0.00016(3) |
| Δρmax/Δρmin, eÅ–3 | 0.453/–0.597 |
Основные межатомные расстояния и валентные углы в структуре I приведены в табл. 2, геометрические параметры межионных водородных связей (ВС) – в табл. 3. Структурные характеристики I депонированы в Кембриджском банке структурных данных (CCDC № 2051088).
Таблица 2.
Основные межатомные расстояния (d, Å) и валентные углы (ω, град) в структуре I
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| Ni(1)–O(1) | 2.027(2) | O(1)Ni(1)O(3) | 91.49(7) |
| Ni(1)–O(2) | 2.056(2) | O(1)Ni(1)O(2) | 91.53(7) |
| Ni(1)–O(3) | 2.059(2) | O(3)Ni(1)O(2) | 94.82(8) |
| Ni(1)–N(1) | 2.067(2) | O(1)Ni(1)N(1) | 93.17(8) |
| Ni(1)–N(5) | 2.078(2) | O(3)Ni(1)N(1) | 172.90(8) |
| Ni(1)–N(3) | 2.097(2) | O(2)Ni(1)N(1) | 79.70(8) |
| O(1)–C(1) | 1.253(3) | O(1)Ni(1)N(5) | 170.75(8) |
| C(8)–O(2) | 1.255(3) | O(3)Ni(1)N(5) | 79.27(8) |
| O(3)–C(15) | 1.245(3) | O(2)Ni(1)N(5) | 88.98(9) |
| O(4)–C(7) | 1.351(3) | N(1)Ni(1)N(5) | 96.01(9) |
| O(5A)–C(14) | 1.421(6) | O(1)Ni(1)N(3) | 79.27(7) |
| O(5B)–C(10) | 1.481(8) | O(3)Ni(1)N(3) | 91.63(8) |
| O(6)–C(17) | 1.350(4) | O(2)Ni(1)N(3) | 168.90(8) |
| N(1)–N(2) | 1.416(3) | N(1)Ni(1)N(3) | 94.51(9) |
| N(2)–C(8) | 1.323(3) | N(5)Ni(1)N(3) | 101.11(9) |
| N(3)–N(4) | 1.414(3) | C(1)O(1)Ni(1) | 113.49(15) |
| N(4)–C(1) | 1.333(3) | C(8)O(2)Ni(1) | 112.8(2) |
| N(5)–N(6) | 1.412(3) | C(15)O(3)Ni(1) | 113.4(2) |
| N(6)–C(15) | 1.334(3) | N(2)N(1)Ni(1) | 107.76(15) |
| C(8)N(2)N(1) | 118.1(2) | ||
| N(4)N(3)Ni(1) | 106.44(14) | ||
| C(1)N(4)N(3) | 117.8(2) | ||
| N(6)N(5)Ni(1) | 107.35(15) | ||
| C(15)N(6)N(5) | 118.5(2) | ||
| O(1)C(1)N(4) | 120.4(2) | ||
| O(1)C(1)C(2) | 120.2(2) | ||
| N(4)C(1)C(2) | 119.4(2) | ||
| O(4)C(7)C(6) | 121.8(3) | ||
| O(2)C(8)N(2) | 121.0(2) | ||
| O(2)C(8)C(9) | 120.3(3) | ||
| O(7)–C(22) | 1.241(3) | N(2)C(8)C(9) | 118.7(3) |
| O(8)–C(22) | 1.261(3) | C(9)C(10)O(5B) | 123.0(4) |
| O(9)–C(29) | 1.260(3) | C(11)C(10)O(5B) | 115.9(5) |
| O(10)–C(29) | 1.228(4) | C(13)C(14)O(5A) | 116.7(4) |
| O(3)C(15)N(6) | 120.2(2) | ||
| O(9)–C(29) | 1.260(3) | O(3)C(15)C(16) | 120.9(2) |
| O(10)–C(29) | 1.228(4) | N(6)C(15)C(16) | 118.9(2) |
| O(6)C(17)C(18) | 122.1(3) | ||
| O(6)C(17)C(16) | 118.2(2) | ||
| O(7)C(22)O(8) | 123.8(3) | ||
| O(7)C(22)C(23) | 118.0(2) | ||
| O(8)C(22)C(23) | 118.2(2) |
Таблица 3.
Геометрические параметры межионных водородных связей в соединении I
| D–H…A | D–H, Å | H…A, Å | D…A, Å | <DHA, град |
|---|---|---|---|---|
| O(4)–H(4B)…O(9)#1 | 0.82 | 1.72 | 2.544(3) | 178 |
| O(6)–H(6C)…O(8)#2 | 0.82 | 1.77 | 2.574(3) | 165 |
| N(1)–H(1A)…O(7)#3 | 0.89 | 2.05 | 2.909(3) | 161 |
| N(5)–H(5B)…O(9)#3 | 0.89 | 2.03 | 2.896(3) | 164 |
| N(3)–H(3C)…O(4)#4 | 0.89 | 2.34 | 3.223(3) | 174 |
| O(5A)–H(5A)…O(2) | 0.82 | 1.85 | 2.538(3) | 141 |
| N(1)–H(1B)…O(7) | 0.89 | 2.12 | 2.910(3) | 147 |
| N(2)–H(2A)…O(5A) | 0.86 | 2.02 | 2.676(5) | 133 |
| N(2)–H(2A)…O(10) | 0.86 | 2.18 | 2.820(3) | 131 |
| N(3)–H(3B)…O(7) | 0.89 | 2.55 | 3.240(3) | 135 |
| N(4)–H(4C)…O(4) | 0.86 | 1.98 | 2.624(3) | 131 |
| N(6)–H(6B)…O(6) | 0.86 | 2.01 | 2.638(3) | 128 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из данных химического анализа (табл. 4) видно, что для всех полученных соединений реализуется соотношение никель : салицилгидразид = 1 : 3, за исключением комплекса валерата никеля(II), для которого соотношение составляет 1 : 2. При взаимодействии валерата никеля(II) с бензгидразидом удалось получить только комплексы состава 1 : 2, тогда как для бензоата выделены комплексы 1 : 2 и 1 : 3 [11]. Наиболее вероятной причиной уменьшения числа координированных никелем молекул гидразидов являются, по-видимому, существенные стерические препятствия, обусловленные длинной углеродной цепочкой у валерат-аниона.
Таблица 4.
Данные химического анализа комплексов карбоксилатов никеля(II) с салицилгидразидом
| Соединение | Выход, % | Найдено, % | Брутто-формула | |||
|---|---|---|---|---|---|---|
| Вычислено, % | ||||||
| С | H | N | Ni | |||
| II | 85 | $\frac{{{\text{50}}{\text{.60}}}}{{{\text{50}}{\text{.97}}}}$ | $\frac{{{\text{6}}{\text{.29}}}}{{{\text{6}}{\text{.02}}}}$ | $\frac{{{\text{10}}{\text{.00}}}}{{{\text{9}}{\text{.91}}}}$ | $\frac{{{\text{10}}{\text{.80}}}}{{{\text{10}}{\text{.44}}}}$ | C24H34N4O8Ni |
| III | 83 | $\frac{{{\text{55}}{\text{.60}}}}{{{\text{55}}{\text{.48}}}}$ | $\frac{{{\text{4}}{\text{.44}}}}{{{\text{4}}{\text{.49}}}}$ | $\frac{{{\text{10}}{\text{.80}}}}{{{\text{11}}{\text{.10}}}}$ | $\frac{{{\text{7}}{\text{.50}}}}{{{\text{7}}{\text{.79}}}}$ | C35H34N6O10Ni |
| IV | 81 | $\frac{{49.55}}{{49.93}}$ | $\frac{{4.60}}{{4.30}}$ | $\frac{{12.00}}{{12.05}}$ | $\frac{{8.29}}{{8.46}}$ | C29H30N6O11Ni |
| V | 87 | $\frac{{47.49}}{{47.69}}$ | $\frac{{4.46}}{{4.13}}$ | $\frac{{13.50}}{{13.35}}$ | $\frac{{9.01}}{{9.38}}$ | C25H26N6O10Ni (малеат) |
| VI | 82 | $\frac{{47.47}}{{47.69}}$ | $\frac{{4.49}}{{4.13}}$ | $\frac{{13.00}}{{13.35}}$ | $\frac{{9.44}}{{9.38}}$ | C25H26N6O10Ni (фумарат) |
Присутствие воды именно в комплексе с фталат-анионом, очевидно, связано с большей гидрофильностью фталата, содержащего две гидрофильные карбоксигруппы. Большее число связанных молекул воды для фталатов ранее было подтверждено нами методом РСА на примере никотинамидных комплексов меди и кобальта. Так, для комплексов с соотношением металл : никотинамид = 1 : 2 в медном комплексе с валерат-анионом вода отсутствует [12], а во фталатном комплексе соотношение Cu : вода составляет 1 : 1.5 [13]. В комплексах кобальта с тем же соотношением металл : никотинамид = 1 : 2 для валерат-аниона одна молекула воды приходится на два атома кобальта [14], а для фталата соотношение Со : вода = 1 : 6 [15].
О близости строения гидратированного комплекса IV, полученного из фталата никеля(II), и безводных комплексов свидетельствует большая близость полос поглощения лиганда в ИК-спектрах всех комплексов (табл. 5), причем сдвиги полос салицилгидразида особенно похожи для бензоата и фталата – анионов ароматических кислот.
Таблица 5.
Волновые числа (частоты, см–1) максимумов полос поглощения в ИК-спектрах салицилгидразида и его комплексов с карбоксилатами никеля(II)
| Отнесение | L | [NiL2]Val2 | [NiL3]Benz2 | [NiL3]Pht · H2O | [NiL3]Mal | [NiL3]Fum |
|---|---|---|---|---|---|---|
| ν(NH + OH) | 3321, 3269, 3056 | 3277, 3180, 3068 | 3275 | 3283, 3230, 3130 | 3262, 3211 | 3220, 3075 |
| ν(С—H) аром. кольцо | – | 3064 | 2990 | 2963 | 2963 | |
| ν(C=O) амид I | 1648 | 1642 | 1641 | 1643 | 1633 | 1647 |
| δ(NH2) | – | 1608 | 1607* | 1607 | 1608 | 1608 |
| ν(С—С) аром. кольцо | 1587, 1486 | 1493 | 1455 | 1492, 1455 | 1474* | 1492 |
| δ(NH) + ν(CN) амид II | 1533 | 1561* | 1533 | 1562, 1543 | 1566 | 1567 |
| δ(ОН) | 1366, 1353 | 1363 | 1384 | 1384 | 1389 | 1385 |
| ν(CN) + δ(NH) амид III | 1301 | 1316 | 1316 | 1314 | 1308 | 1313 |
| ν(CN) + ν(N—N) + + τ(NH2) + δ(CСН) | 1178, 1153, 1135 | 1201, 1159, 1133 | 1207, 1134 | 1159, 1146, 1133 | 1152, 1129 | 1157, 1134 |
| ν пульс. кольцо + + ρ(NH2) + τ(NH2) | 1086, 1035, 964, 947, 882, 850, 823 | 1098, 1049, 1022, 902, 825 | 1099, 1070, 1049, 1025, 902, 860, 825 | 1099, 1083, 1051, 1030, 986, 903 | 1101, 1031, 901, 865, 834 | 1098, 1049, 1029, 901, 869, 826 |
| δ(СNН) + δ(CСС) | 665 | 662 | 663 | 663 | 662 | 663 |
| δ(СCN) + δ(NСО) | 531 | 529 | 528 | 530 | 535 | 531 |
| νas(COO–) | 1561* | 1607* | 1607 | 1566 | 1567 | |
| νs(COO–) | 1414 | 1491 | 1492 | 1474* | 1385 | |
| Δν(COO–) | 147 | 116 | 115 | 92 | 182 | |
| νas(COO–) исх. соль | 1568 | 1596 | 1560 | 1551 | 1560 | |
| νs(COO–) исх. соль | 1417 | 1498 | 1405 | 1418 | 1393 | |
| Δν(COO–) исх. соль | 151 | 98 | 155 | 133 | 167 | |
| ΔΔν(COO–) | –4 | 18 | –40 | –41 | 15 | |
| рK кислоты | рK = 4.86 | рK = 4.20 | рK2 = 5.41 | рK2 = 6.22 | рK2 = 4.38 |
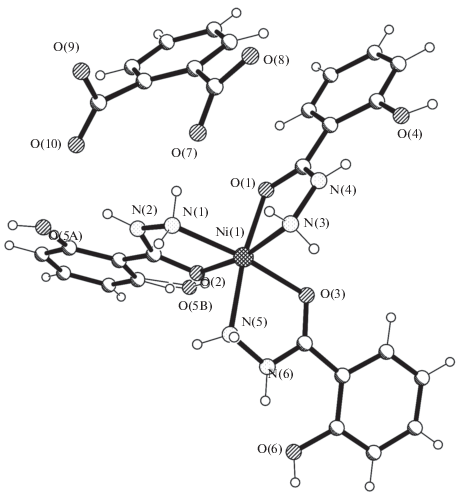
По данным РСА, моногидрат соединения IV [NiL3]Pht · H2O, содержащий комплексный катион [NiL3]2+ и противоион, при перекристаллизации теряет молекулу воды. Структурные единицы кристалла [NiL3]Pht – комплексные катионы [NiL3]2+ и анионы фталевой кислоты Pht2–. Атом никеля цис-октаэдрически координирован тремя атомами кислорода и тремя атомами азота трех бидентатно-хелатных (O, N) лигандов L. Средняя длина связей Ni–O составляет 2.047 ± 0.020 Å, Ni–N – 2.081 ± 0.016 Å. При координации с атомом металла лигандов L замыкаются пятичленные хелатные циклы NiNNCO.
Комплексные катионы и противоионы фталевой кислоты объединены разветвленной системой межионных водородных связей (ВС) N–H…O, O–H…O (табл. 3, рис. 1) двух троек NH2- и NH-групп комплексного катиона, всех трех его гидроксогрупп ОН (включая один из двух неупорядоченных в равновероятных позициях атом кислорода О5А) и всех четырех атомов кислорода аниона фталевой кислоты (N…O 2.624–2.909, 3.223 и 3.240 Å, O…O 2.538–2.574, 2.566 Å, Н…О 1.72–2.18, 2.34 и 2.55 Å, углы NHO 128°–174°, OHO 141°, 165° и 178°).
Известна кристаллическая структура более десяти комплексов никеля(II) с производными основания Шиффа – салицилгидразида [16–22]. В 2019 г. определена кристаллическая структура четырех моноядерных комплексов подобного типа [9]: [NiL1] (VII), [Ni(L1–Py)] (VIII), [Ni(L1–О)Lig)] (Lig = Py (IX) и DMSO (X), L1 – ацетилацетон бис(салицилгидразон)). Лиганды (L1)2–, (L1–Py)2–, (L1–О)2– в структурах VII–X тетрадентатные (2N, 2O) трис-хелатные. При координации с атомами никеля лиганды L, L–Py, L–O замыкают два пятичленных металлоцикла NiN2CO и один шестичленный NiNC3N, сочлененный с двумя пятичленными хелатными кольцами по связям Ni–N. В транс-октаэдрических комплексах IX, X связи Ni–N(L) (2.021 ± 0.007 и 2.007 ± ± 0.005 Å) и Ni–O(L) (2.072 ± 0.014 и 2.036 ±0.012 Å) сопоставимы по длине с аналогичными связями в исследованном цис-октаэдрическом комплексе I (cм. выше), тогда как в двух цис-квадратных комплексах VII, VIII аналогичные связи существенно короче (Ni–N(L) 1.810 ± 0.003 и 1.805 ± 0.002 Å, Ni—O(L) 1.860 ± 0.004 и 1.844 ± 0.003 Å).
Во всех четырех структурах есть прочные внутримолекулярные ВС N–H…O в VII, O–H…N в VII–X между фенольными атомами кислорода и иминными атомами азота (N…O 2.550 ± 0.045, 2.601 ± 0.041, 2.550 ± 0.013 и 2.563 ± 0.009 Å соответственно в VII, VIII, IX и Х).
Отнесение полос поглощения в ИК-спектрах салицилгидразида (L) и полученных комплексов II—VI (табл. 5) выполнено с учетом данных [1, 23—26]. Для салицилгидразида характерны разнообразные внутри- и межмолекулярные ВС. Согласно данным РСА [27], в кристаллической структуре гидразида орто-оксибензойной кислоты группы ОН в орто-положении участвуют во внутримолекулярной ВС с атомом кислорода гидразидной карбоксигруппы, что приводит к образованию шестичленного Н-кольца ОНОС3, смежного с ароматическим циклом через общую связь С–С. Кроме того, молекулы салицилгидразида попарно соединены межмолекулярными ВС N–H…N, в результате образуются центросимметричные димеры с центральным шестичленным Н-циклом N2HN2H, включающим две межмолекулярные ВС. Отметим, что циклическая система с межмолекулярными ВС N–H…N характерна для гидразидкарбоновых кислот и найдена в одном из изомеров 3-метил-4-фураксанкарбогидразида [28] (N…N 2.928 Å, угол NHN 153°) и в гидразиде никотиновой кислоты [29] (N…N 2.967 Å, угол NHN 168°). Н-цикл ОНОС3 с участием орто-гидроксильного атома кислорода, найденного в структуре молекулы L, присутствует и в других производных ароматических кислот, например, в структуре 2,5-диацетилгидрохинона [30] (O…O 2.58 Å, H…O 1.87 Å, угол ОНО 145°). Из-за образования ВC в ИК-спектре кристаллического салицилгидразида частоты ν(N–H) и ν(С=О) смещены в низкочастотную область. Поэтому следует сравнивать частоту ν(C=O) (амид I) в ИК-спектрах синтезированных нами комплексов с частотой ν(C=O) органических соединений в таких условиях, когда вероятность проявления и внутри-, и межмолекулярных ВС минимальна. В наибольшей степени этому соответствует газообразное состояние. По данным [31], в ИК-спектре газообразного салицилгидразида полоса ν(C=O) фиксируется около 1660 см–1. В ИК-спектрах синтезированных нами соединений никеля(II) по сравнению со спектром газообразной органической молекулы частота этой полосы понижается на 13–27 см–1, что указывает на связь салицилгидразида с металлом через атом кислорода. Полосы амид II при 1533 см–1 (в основном δ(NH) + ν(CN)) и амид III (в основном ν(CN) + + δ(NH)) при 1301 см–1 повышают свою частоту, кроме ИК-спектра комплекса с бензоат-анионом III. Триплет ν(NH + OH) в спектрах комплексов с различными анионами ведет себя по-разному. Для бензоата III он превращается в синглет, для малеата V и фумарата VI – в дублет. Для валерата II и фталата IV сохраняется триплет, но при этом частоты полос при 3321 и 3269 см–1 понижаются, а при 3056 см–1 повышается. Описанное поведение полос поглощения в ИК-спектрах синтезированных нами комплексов II–VI соответствует данным РСА о связывании салицилгидразида с участием гидразидной группы через атомы кислорода и азота с образованием пятичленного хелатного цикла.
Несмотря на то, что для изомерных малеат- и фумарат-солей брутто-формулы полученных соединений идентичны, метод ИК-спектроскопии позволяет успешно различать полученные координационные соединения. Согласно [25, 26], для цис- и транс-изомеров, каковыми являются малеиновая и фумаровая кислоты, наблюдаются довольно существенные различия полос поглощения деформационных колебаний связей С–Н. Плоское колебание δ(СН) цис-двойной связи проявляется в области 1415 см–1, для транс-двойной связи такие полосы не наблюдаются. В нашем случае малеатный комплекс отличается от фумаратного присутствием полосы при 1413 см–1, отсутствующей в спектре фумаратного комплекса. Неплоское колебание δ(СН) цис-двойной связи проявляется в области 730–675 см–1, а транс-двойной связи – около 965 см–1. В нашем случае это соответствует наличию полосы при 697 см–1 для малеатного комплекса и при 987 см–1 для фумаратного комплекса. Имеются и существенные отличия в поведении полос поглощения карбоксигрупп малеат- и фумарат-анионов (табл. 5).
Для интерпретации координационного поведения карбоксигрупп в комплексах по данным ИК-спектроскопии наиболее удобной оказывается величина ΔΔν(COO–), представляющая собой разницу Δν(COO–) комплекса и исходного карбоксилата, где параметр Δν(COO–) = = νas(COO–) – νs(COO–). Значительные величины ΔΔν(COO–) характерны для монодентатно координированных карбоксилат-анионов, малые – для бидентатно координированных и внешнесферных. Для всех полученных нами комплексов никеля(II) с салицилгидразидом ΔΔν(COO–) имеет небольшие положительные или даже отрицательные значения, что соответствует внешнесферному характеру анионов, это подтверждают данные РСА для комплекса I ([NiL3]Pht). В табл. 5 приведены значения рК кислот [32] для той формы аниона, в виде которой он входит в состав координационного соединения (рК для одноосновных кислот и рK2 для двухосновных). Следует обратить внимание на тот факт, что величины ΔΔν(COO–) изменяются симбатно с изменением силы кислот, соответствующих изученным анионам. Это можно объяснить следующим образом. Уменьшение рК кислоты соответствует повышению ее способности к диссоциации и уменьшению ее склонности к ассоциации. В нашем случае поведение комплексного катиона подобно поведению протона при диссоциации кислоты. Следовательно, при прочих равных условиях (одинаковые комплексообразователь и лиганд) величину ΔΔν(COO–), очевидно, можно в первом приближении считать мерой силы взаимодействия карбоксилат-аниона с комплексным катионом.
Список литературы
Issa R.M., El-Shazly M.F., Iskander M.F. // Z. Anorg. Allg. Chem. 1967. V. 354. № 1–2. P. 90. https://doi.org/10.1002/zaac.19673540118
Salami H.A., Haruna A.U., Ezeala F.T., Salawu O.W. // Der Pharma Chem. 2015. V. 7. № 4. P. 261. http://derpharmachemica.com/archive.html
Присяжнюк А.И., Кокшарова Т.В. // Укр. хим. журн. 1986. Т. 52. № 1. С. 13.
Кокшарова Т.В., Курандо С.В., Стоянова И.В. // Журн. общей химии. 2013. Т. 83. № 1. С. 60. [Koksharova T.V., Kurando S.V., Stoyanova I.V. // Russ. J. Gen. Chem. 2013. V. 83. № 1. P. 54.] https://doi.org/10.1134/S107036321301009X
Кокшарова Т.В., Гриценко И.С., Стоянова И.В. // Журн. общей химии. 2006. Т. 76. № 6. С. 901. [Koksharova T.V., Gritsenko I.S., Stoyanova I.V. // Russ. J. Gen. Chem. 2006. V. 76. № 6. P. 862.] https://doi.org/10.1134/S1070363206060041
Кокшарова Т.В., Васалатий Т.Н., Полищук В.Е. // Коорд. химия. 2003. Т. 29. № 11. С. 852. [Koksharova T.V., Vasalatii T.N., Polishchuk V.E. // Russ. J. Coord. Chem. 2003. V. 29. № 11. P. 790.] https://doi.org/10.1023/b:ruco.0000003436.77280.ac
Садиков Г.Г., Анцышкина А.С., Кокшарова Т.В. и др. // Кристаллография. 2012. Т. 57. № 4. С. 597. [Sadikov G.G., Antsyshkina A.S., Koksharova T.V. et al. // Crystallography Reports. 2012. V. 57. № 4. P. 528.] https://doi.org/10.1134/S1063774512030170
Сергиенко В.С., Кокшарова Т.В., Суражская М.Д., Скакун Т.С. // Журн. неорган. химии. 2018. Т. 63. № 9. С. 1146. [Sergienko V.S., Koksharova T.V., Surazhskaya M.D., Skakun T.S. // Russ. J. Inorg. Chem. 2018. V. 63. № 9. P. 1171.] https://doi.org/10.1134/S0036023618090176
Анцышкина А.С., Садиков Г.Г., Кокшарова Т.В., Сергиенко В.С. // Журн. неорган. химии. 2014. Т. 59. № 2. С. 176. [Antsyshkina A.S., Sadikov G.G., Koksharova T.V., Sergienko V.S. // Russ. J. Inorg. Chem. 2014. V. 59. № 2. P. 50.] https://doi.org/10.1134/S003602361402003X
Sheldrick G.M. // Acta Crystallogr. 2008. V. 64. № 1. P. 112.
Кокшарова Т.В., Мандзий Т.В., Стоянова И.В., Полищук А.А. // Журн. общей химии. 2016. Т. 86. № 10. С. 1714. [Koksharova T.V., Mandzii T.V., Stoyanova I.V., Polishchuk A.A. // Russ. J. Gen. Chem. 2016. V. 86. № 10. P. 2361.] https://doi.org/10.1134/S1070363216100194
Анцышкина А.С., Садиков Г.Г., Кокшарова Т.В. и др. // Журн. неорган. химии. 2006. Т. 51. № 10. С. 1671. [Antsyshkina A.S., Sadikov G.G., Koksharova T.V. et al. // Russ. J. Inorg. Chem. 2006. V. 51. № 10. P. 1571.] https://doi.org/10.1134/S003602360610010X
Садиков Г.Г., Кокшарова Т.В., Анцышкина А.С. и др. // Кристаллография. 2008. Т. 53. № 4. С. 668. [Sadikov G.G., Koksharova T.V. // Crystallography Reports. 2008. V. 53. № 4. P. 631.] https://doi.org/10.1134/S1063774508040135
Садиков Г.Г., Анцышкина А.С., Кокшарова Т.В. и др. // Кристаллография. 2007. Т. 52. № 5. С. 847. [Sadikov G.G., Antsyshkina A.S., Koksharova T.V. et al. // Crystallography Reports. 2007. V. 52. № 5. P. 819.] https://doi.org/10.1134/S1063774507050112
Анцышкина А.С., Садиков Г.Г., Кокшарова Т.В. и др. // Журн. неорган. химии. 2009. Т. 54. № 8. С. 1379. [Antsyshkina A.S., Sadikov G.G., Koksharova T.V. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 8. P. 1310.] https://doi.org/10.1134/S003602360908021X
Laziz D., Beghidja C., Baali et al. // Inorg. Chim. Acta. 2019. V. 497. P. 119085.
Cariepy K.C., Curtin M.A., Clarce M.G. // J. Am. Chem. Soc. 1989. V. 111. P. 4947.
Choi S., Delaney S., Orbai L. et al. // Inorg. Chem. 2001. V. 40. P. 5481.
Zhxhiong R., Lackner S., Akermann L. // Angew. Chem. Int. Ed. 2016. V. 55. P. 3153.
Xiao-hua Cai, Bing Xie // Rev. Acc. 2015. V. 1. P. 184.
Humair M.O., Liu P. // J. Am. Chem. Soc. 2017. V. 139. P. 9909.
Cho S.H., Kim J.Y., Kwak J., Chang S. // Chem. Soc. Rev. 2011. V. 40. P. 5068.
Iskander M.F., Zayan S.E., Khalifa M.A., El-Sayed L. // J. Inorg. Nucl. Chem. 1974. V. 36. № 3. P. 551. https://doi.org/org/10.1016/0022-1902[74]80112-0
Харитонов Ю.Я., Мачхошвили Р.И., Генералова Н.Б. // Журн. неорган. химии. 1974. Т. 19. № 6. С. 1564.
Наканиси К. Инфракрасные спектры и строение органических соединений. М.: Мир, 1965.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 с.
Кроль И.А., Агре В.М., Пангани В.С. // Журн. структур. химии. 1988. Т. 29. № 2. С. 194. [Krol’ I.A., Agre V.M., Pangani V.S. // J. Struct. Chem. 1988. V. 29. № 2. P. 336.] https://doi.org/org/10.1007/bf00748003
Callert M., Chiari G., Germain G., Viterbo D. // Acta Crystallogr. 1973. V. 29B. P. 1618.
Jensen L.H. // J. Am. Chem. Soc. 1954. V. 76. P. 4663.
Waisman E., Grabowski M.G., Steplen A., Cagler M. // Cryst. Struct. Commun. 1978. V. 7. P. 232.
NIST [National Institute of Standards and Technology] Standard Reference Data Program Collection [C], 2009.
Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. Киев: Наук. думка, 1974.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии