Журнал неорганической химии, 2020, T. 65, № 9, стр. 1222-1228
Термодинамическая оценка процесса химического транспорта VSe2 и ZrSe2 с Сl2 и I2 в качестве транспортных агентов
К. С. Никонов a, *, А. С. Ильясов a, М. Н. Бреховских a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119071 Москва, Ленинский пр-т, 31, Россия
* E-mail: NikonovK.S@yandex.ru
Поступила в редакцию 19.03.2020
После доработки 19.04.2020
Принята к публикации 30.04.2020
Аннотация
С целью изучения процессов химического транспорта и оптимизации методик синтеза монокристаллы диселенидов V и Zr были выращены методом химических транспортных реакций с использованием I2 и Cl2 в качестве транспортных агентов. Проведена оценка термодинамических параметров процесса химического транспорта и установлено направление массопереноса в ростовой ампуле. Фазовый состав полученных образцов изучен методом РФА. Анализ дифрактограмм вещества, извлеченного из низкотемпературных и высокотемпературных зон ростовых ампул, подтвердил предположения, сделанные на основе термодинамических расчетов. Показано, что при транспорте ZrSe2 в обоих случаях наблюдается перенос дихалькогенида из холодной в горячую зону ампулы. При транспорте VSe2 направление переноса зависит от природы транспортного агента. При использовании I2 транспорт протекает из горячей в холодную зону ампулы, а при использовании Cl2 – в обратном направлении. Микрофотографии полученных образцов подтверждают выводы, сделанные на основе термодинамических расчетов и РФА. Полученные результаты могут быть использованы для оптимизации технических процессов получения слоистых дихалькогенидов переходных элементов.
ВВЕДЕНИЕ
Слоистые дихалькогениды переходных элементов (TMDC) представляют собой группу бинарных соединений, обладающих общей характерной структурой и очень широким спектром физико-химических свойств. Слоистые дихалькогениды переходных элементов отличает многообразие наблюдаемых физических эффектов, каталитическая активность и обширные возможности для получения нано- и интеркаляционных материалов на их основе [1–3]. Эти качества позволяют применять TMDC и материалы на их основе в аккумуляторных батареях [4–6], для создания катализаторов [7] и наноразмерных электронных устройств [8].
Структура слоистых дихалькогенидов переходных элементов состоит из повторяющихся слоев, разделенных ван-дер-ваальсовыми промежутками так, что все ковалентные связи в структуре лежат в пределах одного слоя. В свою очередь, слои связаны между собой только слабыми межатомными взаимодействиями. Каждый тройной блок состоит из трех атомных слоев: двух, построенных из атомов халькогена, и расположенного между ними слоя атомов переходного элемента. Кристаллы такого строения относятся к структурному типу CdI2. Слоистой природой кристаллов TMDС обусловлена легкость, с которой они образуют интеркаляционные соединения [9], и предрасположенность к образованию тонких пленок и 2D-материалов [10]. Монокристаллы TMDC могут заменить графен в качестве подложек при создании гетероструктур, описанных в работе [11].
Основным методом получения наноразмерных пленок различных материалов являются различные варианты молекулярно-лучевой эпитаксии [12]. Этот метод позволяет с высокой точностью контролировать толщину и стехиометрию синтезируемого слоя, но непригоден для получения отдельных макроскопических монокристаллов. Главным способом получения крупных монокристаллов VSe2 и ZrSe2 является метод химических транспортных реакций (ХТР) [13, 14]. В основе этого метода лежит обратимая реакция между переносимым веществом (в данном случае VSe2 и ZrSe2) и транспортным агентом, в результате которой образуется газообразная транспортируемая форма (например, VI4), пары которой смещаются вдоль градиента температуры, пока равновесие не сдвинется в обратную сторону, что приводит к образованию кристаллов XSe2 и высвобождению транспортного агента [15].
Стандартным выбором транспортного агента при использовании метода химических транспортных реакций для роста монокристаллов TMDC является кристаллический I2. Применение альтернативных транспортных агентов для получения монокристаллов дихалькогенидов Mo, Ta, V и Zr рассмотрено в работах [16–18].
В отличие от тройных селенидов различных переходных элементов, термодинамические параметры которых подробно рассмотрены в работе [19], экспериментальные данные о термодинамических характеристиках слоистых дихалькогенидов V и Zr практически отсутствуют в литературе.
Цель настоящей работы – исследование процессов химического транспорта в системах MSe2/I2, MSe2/Cl2 (M = V, Zr) для оптимизации методик синтеза и условий роста монокристаллов этих соединений методом ХТР.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Кристаллы VSe2 и ZrSe2 выращены методом химических транспортных реакций с использованием Сl2 и I2 в качестве транспортного агента. Кристаллы VSe2 и ZrSe2 получали из простых веществ путем отжига стехиометрической навески исходных простых веществ в вакуумированной ампуле. Затем полученные кристаллы вместе с источником транспортного агента загружали в кварцевую ампулу, которая была откачана до остаточного давления ~0.03 мБар, и помещали в трубчатую печь с температурным градиентом. Полученные кристаллы исследованы методом РФА при помощи дифрактометра Bruker D8 Advance. Микрофотографии кристаллов получены с использованием микроскопа МИМ-7. Условия роста кристаллов приведены в табл. 1.
Таблица 1.
Параметры роста кристаллов VSe2 и ZrSe2
| Кристаллы | Навеска, г | Транспортный агент, ×10–4 моль | Температура роста, °С | Время, ч | |
|---|---|---|---|---|---|
| tгор | tхол | ||||
| VSe2 | 2.0 | 1.97 I2 | 850 | 800 | 48 |
| VSe2 | 0.4 | 1.32 Cl2 | 850 | 800 | 48 |
| ZrSe2 | 1.0 | 2.75 Cl2 | 915 | 850 | 48 |
| ZrSe2 | 0.4 | 1.77 I2 | 850 | 800 | 48 |
Чтобы избежать потерь вещества при вакуумировании и отпайке ростовой ампулы, кристаллический I2 вносили в тонкостенном капилляре из пирекса, который разрушался при нагревании ампулы до температуры роста, выпуская пары иода в объем ампулы. Галогениды VCl3 и ZrCl4 вносили в ампулу в сухом боксе в атмосфере азота в виде порошков. При нагревании в ростовой ампуле галогениды переходных элементов VCl3 и ZrCl4 разлагались до Сl2 и VCl2 или ZrCl2 соответственно.
Реакции (1)–(4) демонстрируют процесс разложения вещества – источника транспортного агента:
(1)
${\text{2VC}}{{{\text{l}}}_{3}} \to {\text{VC}}{{{\text{l}}}_{4}} + {\text{VC}}{{{\text{l}}}_{2}},$(2)
$2{\text{VC}}{{{\text{l}}}_{4}} \to {\text{2VC}}{{{\text{l}}}_{3}} + {\text{C}}{{{\text{l}}}_{2}},$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основываясь на данных, представленных в работах [13, 15], предполагаем, что в общем случае процесс химического транспорта в данных системах можно описать следующим образом: в высокотемпературной зоне печи дихалькогенид вступает в реакцию с транспортным агентом, т.е. с парами галогена, что приводит к образованию газообразного тетрагалогенида. В низкотемпературной области печи галогенид вступает в обратную реакцию с парами ceлена, в результате которой снова образуется дихалькогенид XSe2 (X = V, Zr) и высвобождается транспортный агент (Сl2 или I2).
Реакции (5)–(8) приближенно описывают ход процесса химического транспорта в системах МSe2/СI2 и МSe2/I2 (М = Zr, V).
(5)
${\text{ZrS}}{{{\text{e}}}_{{2({\text{тв)}}}}} + 2{\text{C}}{{{\text{l}}}_{{{\text{2(г)}}}}} \leftrightarrow {\text{ZrC}}{{{\text{l}}}_{{{\text{4(г)}}}}} + {\text{S}}{{{\text{e}}}_{{{\text{2(г)}}}}},$(6)
${\text{ZrS}}{{{\text{e}}}_{{{\text{2(тв)}}}}} + 2{{{\text{l}}}_{{{\text{2(г)}}}}} \leftrightarrow {\text{Zr}}{{{\text{l}}}_{{{\text{4(г)}}}}} + {\text{S}}{{{\text{e}}}_{{{\text{2(г)}}}}},$(7)
${\text{VS}}{{{\text{e}}}_{{{\text{2(тв)}}}}} + 2{\text{C}}{{{\text{l}}}_{{{\text{2(г)}}}}} \leftrightarrow {\text{VC}}{{{\text{l}}}_{{{\text{4(г)}}}}} + {\text{S}}{{{\text{e}}}_{{{\text{2(г)}}}}},$(8)
${\text{VS}}{{{\text{e}}}_{{{\text{2(тв)}}}}} + 2{{{\text{l}}}_{{{\text{2(г)}}}}} \leftrightarrow {\text{V}}{{{\text{l}}}_{{{\text{4(г)}}}}} + {\text{S}}{{{\text{e}}}_{{{\text{2(г)}}}}}.$Для создания более полного представления о природе процессов, протекающих в ходе синтеза и роста кристаллов ZrSe2 и VSe2 методом ХТР, проведена оценка термодинамических параметров реакций (5)–(8) и значений констант равновесия в интервале температур от 298 до 1400 K.
При расчете ΔrG0 и Kp предполагалось, что ΔfH реакций в интервале 298–1400 K не зависит от температуры. Для VI4 и ZrI4 были использованы приближенные значения энтропии образования $S_{{298}}^{0}$, экстраполированные на основе известных значений для родственных галогенидов. Необходимость ввода этих значений связана с отсутствием надежных экспериментальных данных о термодинамических параметрах этих веществ в литературных источниках [17–24]. Результаты вычислений приведены в табл. 2.
Таблица 2.
Приближенные термодинамические параметры реакций химического транспорта
| Система | Δr$H_{{298}}^{0}$, кДж/моль | Δr$S_{{298}}^{0}$, кДж/(моль K) | Δr$G_{{298}}^{0}$, кДж/моль | $K_{p}^{{\left( {298} \right)}}$ | Δr$G_{{1188}}^{0}$, кДж/моль |
$K_{p}^{{\left( {1188} \right)}}$ | Δr$G_{{1123}}^{0}$, кДж/моль |
$K_{p}^{{\left( {1123} \right)}}$ |
|---|---|---|---|---|---|---|---|---|
| ZrSe2/Cl2 | –414.3 | –0.10 | –382.31 | 1.17 | –287.7 | 1.029 | – | – |
| ZrSe2/I2 | –41.4 | 0.18 | –95.59 | 1.04 | –257.7 | 1.026 | – | – |
| VSe2/Cl2 | –259.9 | 0.28 | –344.20 | 1.15 | – | – | –606.6 | 1.06 |
| VSe2/I2 | 49.5 | 0.14 | 5.09 | 0.10 | – | – | –117.9 | 1.01 |
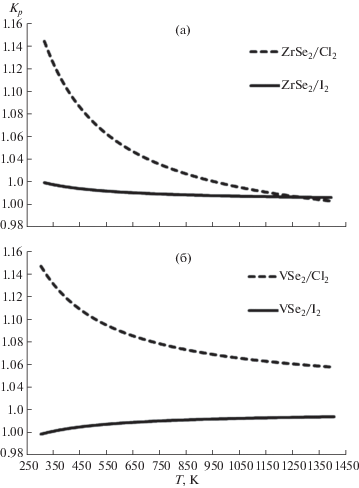
Зависимость Кp от температуры представлена на рис. 1. Согласно нашим оценкам, поведение константы равновесия реакции (8) при изменении температуры отличается от такового для реакций (5)–(7). На отрезке 300–1400 K Кp убывает для реакций (5)–(7) и возрастает для реакции (8). Во всех четырех случаях с повышением температуры скорость изменения Кр уменьшается.
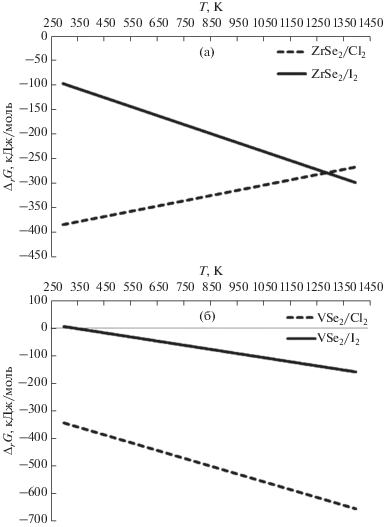
Зависимость свободной энергии Гиббса ΔrG реакции от температуры приведена на рис. 2. Приближенные расчеты показывают, что значение ΔrG уменьшается с ростом температуры для реакций (5), (7) и (8). Для реакции (6) значение ΔrG увеличивается, и при Т = 3889.7 K становится больше нуля. Для реакции (8) ${{\Delta }_{r}}G_{{298}}^{^\circ }$ незначительно >0, но ΔrG уменьшается с ростом температуры.
Взаимные соотношения ΔrG, ΔrH и ΔrS позволяют спрогнозировать поведение транспортной реакции в каждом конкретном случае согласно правилам, приведенным в работе [15]. Эти закономерности представлены в табл. 3.
Таблица 3.
Оценка возможности протекания транспортной реакции и направления переноса
| Система | Δr$S_{{298}}^{0}$ | Δr$H_{{298}}^{0}$ | Δr$G_{{298}}^{0}$ | Возможность протекания | Направление транспорта |
|---|---|---|---|---|---|
| ZrSe2/Cl2 | <0 | <0 | <0 | Ограничена сверху по Т | Тхол → Тгор |
| ZrSe2/I2 | >0 | <0 | <0 | Возможна | Тхол → Тгор |
| VSe2/Cl2 | >0 | <0 | <0 | Возможна | Тхол → Тгор |
| VSe2/I2 | >0 | >0 | >0 | Ограничена снизу по Т | Тгор → Тхол |
Результаты экспериментов совпадают с прогнозируемым ходом транспортного процесса. В случаях ZrSe2/Cl2, ZrSe2/I2 и VSe2/Cl2 наблюдается рост кристаллов в высокотемпературной области ампулы и незначительное образование мелких кристалликов в низкотемпературной зоне, свидетельствующее о сосуществовании нескольких механизмов переноса в ростовой ампуле. В случае ZrSe2 в низкотемпературной зоне ампулы наблюдается накопление примесных фаз различного состава. В случае VSe2/I2 наблюдается образование многочисленных крупных монокристаллов в низкотемпературной зоне.
Дифрактограммы полученных образцов представлены на рис. 3. При рассмотрении диселенида ванадия в обоих случаях наблюдается образование чистого VSe2 в высоко- и низкотемпературных областях, что говорит об эффективной работе механизмов переноса. Различия в интенсивности пиков объясняются размером кристаллов и текстурой полученного материала.
Рис. 3.
Дифрактограммы образцов VSe2 (а), образованных в высокотемпературной области ампулы с Сl2 (1) и I2 (2) и в низкотемпературной области ампулы с Cl2 (3) и I2 (4). а – характеристические пики VSe2 (PDF 01-074-1411). Дифрактограммы образцов ZrSe2 (б), образованных в высокотемпературной области ампулы с Сl2 (1) и I2 (2) и в низкотемпературной области ампулы с I2 (3) и Cl2 (4): а – ZrSe2 (PDF 03-065-3376), б – ZrSe3 (PDF 00-036-1338), в – ZrCl2 (PDF 01-072-1904), г – Zr4Se3 (PDF 00-015-0221), д – Se (PDF 00-027-0603).
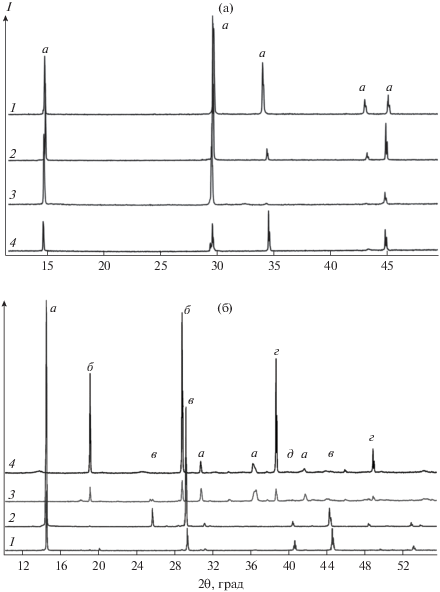
В случае ZrSe2 дифрактограмма свидетельствует об образовании ZrSe2 и отсутствии заметных примесей в высокотемпературной зоне, в то время как в низкотемпературной области происходит накопление ZrSe3 и других примесей, что подтверждает тезис о протекании химического транспорта в направлении более горячей зоны.
На микрофотографиях образцов вещества, извлеченного из высокотемпературной и низкотемпературной зон ростовых ампул, хорошо видна слоистая структура синтезированных кристаллов (рис. 4г и 4е). Наличие характерных углов, равных 120°, подтверждает, что в основе полученных кристаллов лежит гексагональная структура. На рис. 4ж можно видеть кристалл ZrSe3, относящийся к основной примесной фазе в этом образце.
ЗАКЛЮЧЕНИЕ
Рассмотрены процессы химического транспорта слоистых дихалькогенидов VSe2 и ZrSe2 c участием I2 и Cl2 в качестве транспортного агента.
Методом химического транспорта получены образцы VSe2 и ZrSe2 c I2 и Cl2 в качестве транспортных агентов.
Термодинамическая оценка направления и возможности протекания процесса при разных температурах предсказывает, что транспорт вещества должен протекать из низкотемпературной области ампулы в высокотемпературную область в случае VSe2/Cl2 и в случае ZrSe2 независимо от природы транспортного агента. В случае VSe2/I2 транспорт вещества должен протекать в направлении низкотемпературной области. Исследования фазового состава вещества, извлеченного из высоко- и низкотемпературных областей ростовых ампул, подтверждают это предположение. Проведена оценка термодинамических параметров процессов химического транспорта, но, учитывая допущения, принятые при расчетах, значения этих величин следует считать приближенными.
Список литературы
Wang Q.H., Kalantar-Zadeh K., Kis A. et al. // Nat. Nanotech. 2012. V. 7. P. 699. https://doi.org/10.1038/nnano.2012.193
Das S., Robinson J.A., Dubey M. et al. // Annu. Rev. Mater. Res. 2015. V. 45. P. 1. https://doi.org/10.1146/annurev-matsci-070214-021034
Rao C.N.R., Ramakrishna Matte H.S.S., Maitra U. // Angew. Chem. Int. Ed. 2013. V. 9. № 50. P. 13162. https://doi.org/10.1002/anie.201301548
Lee Y.Y., Park G.O., Choi Y.S. et al. // RSC Adv. 2016. V. 6. P. 14253. https://doi.org/10.1039/C5RA19799F
Onuki Y., Inada R., Tanuma S., Yamanaka S. et al. // Solid State Ionics. 1983. V. 8. № 2. P. 141. https://doi.org/10.1016/0167-2738(83)90075-9
Thompson A.H., Scanlon J.C., Symon C.R. // Solid State Ionics. 1980. V. 1. № 1–2. P. 47. https://doi.org/10.1016/0167-2738(80)90021-1
Li H., Jia X., Zhang Q., Wang X. // Chem. 2018. V. 7. № 12. P. 1510. https://doi.org/10.1016/j.chempr.2018.03.012
Roy T., Tosun M., Kang J.S. et al. // ACS Nano. 2014. V. 8. № 6. P. 6259. https://doi.org/10.1021/nn501723y
Rouxel J. // Physica B+C. 1980. V. 99. № 1–4. P. 3. https://doi.org/10.1016/0378-4363(80)90203-X
Zhang Zh., Yang P., Hong M. et al. // Nanotechnology. 2019. V. 30. P. 182002. https://doi.org/10.1088/1361-6528/aaff19
Buslaeva E.Yu., Kraevskii S.V., Groshkova Yu.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 1. P. 5. https://doi.org/10.1134/S0036023620010040
Ril’ I., Kochura A.V., Marenkin S.F. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 9. P. 1087. https://doi.org/10.1134/S0036023618090139
Tsukio O., Hideaki N., Mitsuoki N., Motohiko I. // J. Less Common Met. 1981. V. 77. № 2. P. 185. https://doi.org/10.1016/0022-5088(81)90169-7
Mleczko M.J., Zhang C., Lee H.R. et al. // Sci. Adv. 2017. V. 3. № 8. P. e1700481. https://doi.org/10.1126/sciadv.1700481
Шефер Г. Химические транспортные реакции / Пер. с нем. под ред. Лужной Н.П. М.: Мир, 1964. 194 с.
Ubaldini A., Jacimovic J., Ubrig N., Giannini E. // Cryst. Growth Des. 2013. V. 13. № 10. P. 4453. https://doi.org/10.1021/cg400953e
Nikonov K.S., Brekhovskikh M.N., Egorysheva A.V. et al. // Inorg. Mater. 2017. V. 53. № 11. P. 1126. https://doi.org/10.1134/S0020168517110061
Nikonov K.S., Brekhovskikh M.N., Menshchikova T.K., Fedorov V.A. // Inorg. Mater. 2019. V. 55. № 9. P. 898. https://doi.org/10.1134/S0020168519090097
Babanly M.B., Mashadiyeva L.F., Babanly D.M. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 13. P. 1649. https://doi.org/10.1134/S0036023619130035
Blinder A.V., Bolgar A.S., Trofimova Zh.A. // Powder Metall. Met. Ceram. 1993. V. 32. № 3. P. 234. https://doi.org/10.1007/BF00559756
Mills K.C. Thermodynamic data for inorganic sulphides, selenides and tellurides. L.: Butterworths, 1974. 845 p.
Термические константы веществ: Вып. 1–10 / Под ред. Глушко В.П. М.: ВИНИТИ, 1965–1982.
McTaggart F.K., Wadsley A.D. // Aust. J. Chem. 1958. V. 11. № 4. P. 445. https://doi.org/10.1071/CH9580445
Hooley J.G. Preparation and Crystal Growth of Materials with Layered Structures / Ed. Lieth R.M.A. Dordrecht: Springer, 1977. 285 p. https://doi.org/10.1007/978-94-017-2750-1
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии