Журнал неорганической химии, 2020, T. 65, № 9, стр. 1208-1215
Особенности образования моно- и биядерных комплексов меди(II) с 2,2'-бипиридилом и клозо-декаборатным анионом
Е. А. Малинина a, В. В. Авдеева a, С. Е. Короленко a, *, С. Е. Нефедов a, Л. В. Гоева a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: korolencko0110@yandex.ru
Поступила в редакцию 19.03.2020
После доработки 09.04.2020
Принята к публикации 12.04.2020
Аннотация
Изучена реакция комплексообразования меди(I) с 2,2'-бипиридилом в присутствии солей клозо-декаборатного аниона на воздухе в органических растворителях (1,2-дихлорэтане и ДМФА). Установлено, что в результате окислительно-восстановительной реакции из образующегося in situ комплекса меди(I) [${\text{Cu}}_{2}^{{\text{I}}}$(Bipy)2[B10H10]] известного строения образуются координационные соединения Cu(II) с анионом [В10Н10]2– и 2,2'-бипиридилом. Показано, что условия проведения реакции (температура процесса, природа растворителя) оказывают существенное влияние на ее протекание и, соответственно, на состав и строение образующихся комплексных соединений. Выделены и охарактеризованы моно- и биядерные комплексы Cu(II) состава [CuII(Bipy)2Cl]2[B10H10] и {[${\text{Cu}}_{2}^{{{\text{II}}}}$(Bipy)2(μ-OH)2][B10H10]}. Согласно РСА, в комплексе {[${\text{Cu}}_{2}^{{{\text{II}}}}$(Bipy)2(μ-OH)2][B10H10]} присутствуют дальние контакты Cu…H(B) между клозо-декаборатным анионом и атомом металла.
ВВЕДЕНИЕ
При комплексообразовании меди с кластерными анионами бора [BnHn]2– (n = 10, 12) в присутствии азагетероциклических лигандов L (L = = 2,2'-бипиридил (Bipy), 1,10-фенантролин (Phen), 2,2'-бипиридиламин (BPA)) в зависимости от условий проведения процесса (растворителя, температуры, наличия/отсутствия кислорода воздуха, соотношения реагентов, порядка приливания реагентов) могут образовываться различные комплексы. Так, установлена возможность селективного получения моно-, би-, три-, тетраядерных и полимерных комплексов меди(II), моно- и биядерных комплексов меди(I), а также смешановалентных комплексов меди(I)/меди(II) [1–10].
Проведенные нами ранее исследования реакций комплексообразования меди(I) с клозо-декаборатным анионом и 2,2'-бипиридилом (Bipy) в ацетонитриле показали, что в зависимости от условий реакции образуется комплекс меди(I) [${\text{Cu}}_{2}^{{\text{I}}}$(Bipy)2[B10H10]] [10] или смешановалентный комплекс меди(I)/меди(II) {[${\text{Cu}}_{4}^{{{\text{II}}}}$(Bipy)4(OH)4][CuI2[B10H10]3]} ∙ nCH3CN [11], образование которого обусловлено частичным окислением Cu(I) до Cu(II) при кипячении раствора [Cu2[B10H10]] с Bipy в ацетонитриле на воздухе. Позднее были определены условия образования комплексов Cu(II) с Bipy и анионом [B10H10]2– (система [Cu2[B10H10]]/Bipy/(DMSO + CH3CN)). В работе [12] описан синтез, рентгеноструктурные и магнитные исследования тетраядерного комплекса Cu(II) состава [${\text{Cu}}_{4}^{{{\text{II}}}}$(Bipy)4(OH)4[B10H10]2(DMSO)2], приведены ЭПР-спектры и температурная зависимость магнитной восприимчивости в диапазоне температур от комнатной до температуры кипения жидкого азота. Анализ полученных результатов показал, что на состав и строение конечных продуктов реакции комплексообразования в системе Cu(I)/[B10H10]2–/Bipy существенным образом влияют условия реакции, а именно природа растворителя и температура.
Среди возможных областей применения соединений с кластерными анионами бора можно отметить борнейтронозахватную терапию [13–16], получение термостабильных полимерных соединений [17], радионуклидную диагностику и катализ [18–21]. Уникальные свойства кластеров бора позволяют использовать их в качестве фармакофоров, каркасов в молекулярном дизайне и модуляторов биоактивных соединений [22].
В настоящей работе изучено комплексообразование Cu(I)/Cu(II) c Bipy в органических растворителях и бинарных системах в присутствии различных источников аниона [B10H10]2– и катионов меди(I) или меди(II). Проанализированы окислительно-восстановительные процессы и закономерности образования комплексов, а также особенности их строения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Декагидро-клозо-декаборатодимедь(I) [Cu2[B10H10]] синтезировали по методике [23] из декагидро-клозо-декабората триэтиламмония (Et3NH)2[B10H10], который, в свою очередь, получали в результате многостадийного синтеза из декаборана-14 через стадию образования 1,6-бис(триэтиламин)декаборана [24]. Растворители 1,2-дихлорэтан, ацетонитрил, DMF фирмы Aldrich (HPLC) использовали без дополнительной очистки.
Синтез [CuII(Bipy)2Cl]2[B10H10] ∙ 2C2H4Cl2 (1 ∙ 2C2H4Cl2). К раствору [Cu2[B10H10]] (0.24 г, 1 ммоль) в 1,2-дихлорэтане (10 мл) приливали 2,2'‑бипиридил (0.31 г, 2 ммоль), растворенный в горячем дихлорэтане (15 мл). Наблюдали мгновенное появление ярко-красной окраски реакционного раствора. Полученный реакционный раствор кипятили в течение 10 мин, охлаждали до комнатной температуры и оставляли под тягой. Изотермическое упаривание раствора на воздухе в течение 48 ч приводило к выделению кристаллов зеленого цвета. Кристаллы отфильтровывали и высушивали на воздухе. Выход ~60%. ИК-спектр (NaCl, см–1): ν(BH) 2468; δ(BBH) 995; ν(Bipy) 1600, 1594, 1573, 1557, 1491, 1472, 1352, 1315, 1246, 1171, 1159, 1102, 1062, 971, 737, 652; π(CH) 778.
| С | Н | N | Cu | B | |
|---|---|---|---|---|---|
| Для 1 найдено, %: | 54.67; | 4.78; | 12.72; | 7.15; | 11.8. |
| Для C40H42N8B10CuCl2 | |||||
| вычислено, %: | 54.76; | 4.82; | 12.77; | 7.24; | 12.3. |
Синтез {[CuII2(Bipy)2(μ-OH)2][B10H10]}n (2). К раствору [Cu2[B10H10]] (0.24 г, 1 ммоль) в ацетонитриле (10 мл), нагретом на воздухе до температуры кипения, приливали раствор 2,2'-бипиридила (0.31 г, 2 ммоль) в горячем ацетонитриле (10 мл). Наблюдали мгновенное появление ярко-красной окраски реакционного раствора. Полученный реакционный раствор кипятили в течение 10 мин. Изотермическое упаривание реакционного раствора на воздухе в течение 72 ч с добавлением в систему диметилформамида в соотношении CH3CN : DMF = 1 : 1 приводило к выделению кристаллов темно-зеленого цвета. Кристаллы отфильтровывали и высушивали на воздухе. Выход ~50%. ИК-спектр (NaCl), см–1: ν(OH) 3495; ν(BH) 2501, 2472, 2425; δ(BBH) 1020; ν(Bipy) 1609, 1601, 1495, 1472, 1447, 1370, 1311, 1253, 1175, 1158, 1126, 1033, 900, 856, 732; π(CH) 766.
| С | Н | N | Cu | B | |
|---|---|---|---|---|---|
| Для 2 найдено, %: | 39.85; | 6.29; | 9.23; | 20.97; | 17.3. |
| Для C20H38N4B10Cu2O2 | |||||
| вычислено, %: | 39.92; | 6.36; | 9.31; | 21.12; | 17.9. |
Элементный анализ на углерод, водород и азот осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Перед проведением анализа образцы высушивали до постоянной массы. Бор определяли методом атомно-абсорбционной спектроскопии на спектрофотометрах Perkin–Elmer (CША) модель 2100 с электротермическим атомизатором HGA-700, определение Cu проводили на ААS-303 в пламени ацетилен-воздух.
ИК-спектры записывали на ИК-Фурье-спектрометре Инфралюм ФТ-02 (НПФ АП Люмекс) в области 4000–400 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензии исследуемого вещества в вазелиновом масле (Aldrich); при проведении исследования использовали пластинки NaCl.
PCA. Наборы интенсивностей дифракционных отражений для кристаллов 1 ∙ 2C2H4Cl2 и 2 получены в ЦКП ИОНХ РАН на автоматическом дифрактометре Bruker SMART APEX2 (λMoKα, графитовый монохроматор). Структуры 1 ∙ 2C2H4Cl2 и 2 расшифрованы прямым методом. В структуре 1 ∙ 2C2H4Cl2 содержатся две молекулы дихлорэтана, одна из которых разупорядочена по двум положениям: Cl(3)C(41)C(42)Cl(4) и Cl(3А)C(41А)C(42А)Cl(4А) с соотношением заселенностей 0.43(2) : 0.57(2), другая (Cl(5)C(43)C(44)Cl(6)) упорядочена. Атомы углерода разупорядоченной молекулы растворителя уточнены в изотропном приближении, остальные неводородные атомы структуры – в анизотропном приближении при стремлении связей С–Cl и C–C молекул дихлорэтана к 1.78 и 1.50 Å соответственно. Атомы водорода полиэдрического аниона и молекул бипиридила локализованы в разностных синтезах. Положения атомов Н молекул дихлорэтана рассчитаны. Все атомы Н уточнены по модели наездника в идеализированных позициях с изотропными тепловыми параметрами, превышающими Uэкв или Uизо соответствующего неводородного атома в 1.2 раза. Основные кристаллографические данные, параметры эксперимента и уточнения структур 1 ∙ 2C2H4Cl2 и 2 приведены в табл. 1, некоторые длины связей и валентные углы в структурах 1 ∙ 2C2H4Cl2 и 2 – в табл. 2 и 3 соответственно. При сборе и обработке массива 1 ∙ 2C2H4Cl2 использовали программы APEX2, SAINT и SADABS [25]. Расчеты проведены по комплексу программ SHELX97 [26].
Таблица 1.
Основные кристаллографические данные, параметры эксперимента и уточнения структур 1 ∙ 2C2H4Cl2 и 2
| Параметр | Соединение | |
|---|---|---|
| 1 ∙ 2C2H4Cl2 | 2 | |
| Брутто-формула | C44H50B10N8Cl6Cu2 | C20H28B10Cu2N4O2 |
| М | 1138.80 | 591.64 |
| T, K | 296(2) | 173(2) |
| Сингония | Триклинная | Моноклинная |
| Пр. гр. | P1 | С2/c |
| a, Å | 9.3076(6) | 19.647(16) |
| b, Å | 14.0989(10) | 8.975(7) |
| c, Å | 21.0875(15) | 17.151(14) |
| α, град | 98.6360(10) | 90 |
| β, град | 94.5250(10) | 120.237(12) |
| γ, град | 101.2510(10) | 90 |
| V, Å3 | 2666.5(3) | 2613(4) |
| Z | 2 | 4 |
| ρрасч, г/см3 | 1.418 | 1.504 |
| μ, мм–1 | 1.139 | 1.656 |
| F(000) | 1160 | 1200 |
| Размеры кристалла, мм | 0.220 × 0.060 × 0.020 | 0.20 × 0.08 × 0.03 |
| Излучение, λ, Å | 0.71073 | 0.71073 |
| Интервал углов 2θ, град | 1.966–23.255 | 2.40 –21.99 |
| Число отражений: | ||
| измеренных независимых (N) [Rint] |
18 754 7655 [0.0670] |
4272 1547 [0.0776] |
| R1, wR2 по N0 | 0.0590, 0.1323 | 0.0422, 0.0908 |
| R1, wR2 по N | 0.1203, 0.1579 | 0.0681, 0.0987 |
| Δρmax/Δρmin, е/Å3 | 0.662/–0.372 | 0.427/–0.425 |
Таблица 2.
Длины связей и валентные углы в соединении 1 ∙ 2C2H4Cl2
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Cu(1)–N(2) | 2.000(5) | Cu(2)–N(5) | 1.991(6) |
| Cu(1)–N(4) | 2.015(5) | Cu(2)–N(8) | 1.991(5) |
| Cu(1)–N(1) | 2.033(5) | Cu(2)–N(7) | 2.079(5) |
| Cu(1)–N(3) | 2.209(5) | Cu(2)–N(6) | 2.140(5) |
| Cu(1)–Cl(1) | 2.2602(17) | Cu(2)–Cl(2) | 2.2735(18) |
| Угол | ω, град | Угол | ω, град |
| N(2)Cu(1)N(4) | 173.24(19) | N(5)Cu(2)N(8) | 172.2(2) |
| N(2)Cu(1)N(1) | 81.4(2) | N(5)Cu(2)N(7) | 94.1(2) |
| N(4)Cu(1)N(1) | 92.6(2) | N(8)Cu(2)N(7) | 80.5(2) |
| N(2)Cu(1)N(3) | 99.53(19) | N(5)Cu(2)N(6) | 79.1(2) |
| N(4)Cu(1)N(3) | 78.1(2) | N(8)Cu(2)N(6) | 96.9(2) |
| N(1)Cu(1)N(3) | 99.41(19) | N(7)Cu(2)N(6) | 105.8(2) |
| N(2)Cu(1)Cl(1) | 95.24(15) | N(5)Cu(2)Cl(2) | 92.19(16) |
| N(4)Cu(1)Cl(1) | 91.34(14) | N(8)Cu(2)Cl(2) | 95.60(16) |
| N(1)Cu(1)Cl(1) | 163.88(14) | N(7)Cu(2)Cl(2) | 135.10(15) |
| N(3)Cu(1)Cl(1) | 96.69(14) | N(6)Cu(2)Cl(2) | 119.02(15) |
Таблица 3.
Длины связей и валентные углы в соединении 2
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Cu(1)–O(1)#1 | 1.937(4) | Cu(1)–O(1) | 1.938(4) |
| Cu(1)–N(2) | 1.987(4) | Cu(1)–N(1) | 2.003(4) |
| Cu(1)–Cu(1)#1 | 2.848(2) | O(1)–Cu(1)#1 | 1.937(4) |
| Угол | ω, град | Угол | ω, град |
|---|---|---|---|
| O(1)#1Cu(1)O(1) | 85.40(15) | O(1)#1Cu(1)N(2) | 177.74(18) |
| O(1)Cu(1)N(2) | 95.77(16) | O(1)#1Cu(1)N(1) | 97.74(16) |
| O(1)Cu(1)N(1) | 176.22(16) | N(2)Cu(1)N(1) | 81.16(17) |
| O(1)#1Cu(1)Cu(1)#1 | 42.72(11) | O(1)Cu(1)Cu(1)#1 | 42.69(10) |
| N(2)Cu(1)Cu(1)#1 | 138.43(13) | N(1)Cu(1)Cu(1)#1 | 140.42(13) |
| Cu(1)#1O(1)Cu(1) | 94.60(15) | C(1)N(1)C(5) | 119.0(5) |
| C(1)N(1)Cu(1) | 126.4(4) | C(5)N(1)Cu(1) | 114.5(3) |
| C(10)N(2)C(6) | 119.2(5) | C(10)N(2)Cu(1) | 125.9(4) |
| C(6)N(2)Cu(1) | 115.0(3) | B(3)B(1)B(3)#2 | 100.3(6) |
Кристаллографические данные для соединений 1 ∙ 2C2H4Cl2 и 2 депонированы в Кембриджском банке структурных данных (№ 1989968 и 1978901 соответственно).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Систематическое исследование реакций комплексообразования в системах Cu(I)/[B10H10]2–/L (L = Bipy, BPA или Phen) показало, что образование комплексов Cu(II) наблюдается в результате окисления меди(I) до меди(II) на воздухе и зависит от природы азагетероциклического лиганда L. Так, для BPA этот процесс протекает в ацетонитриле при комнатной температуре [6]; для Phen комплексы Cu(II) получали окислением меди(I) до меди(II) при температуре кипения растворителя с последующим добавлением в реакционный раствор DMF или DMSO в соотношении 1 : 1 [7].
В настоящей работе для получения комплексов Cu(II) с Bipy и [B10H10]2– реакции комплексообразования проводили в C2H4Cl2 и в системе CH3CN/DMF с использованием методики, описанной в [7]. Предварительное нагревание на воздухе раствора, содержащего [Cu2[B10H10]] и Bipy в ацетонитриле или дихлорэтане, до температуры кипения растворителя приводит к получению реакционного раствора, содержащего комплекс меди(I) с Bipy in situ оранжевого цвета [6].
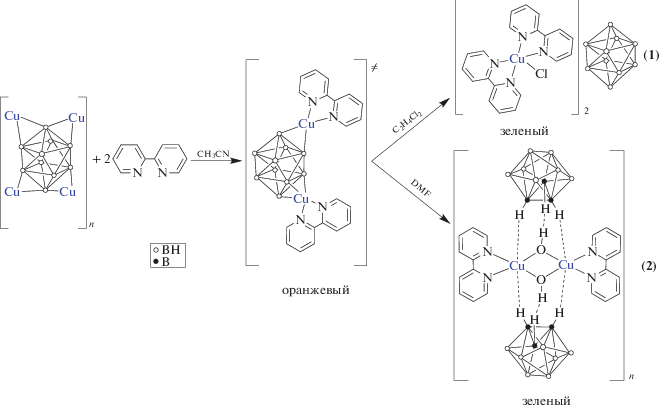
Как оказалось, природа используемого в реакции комплексообразования растворителя существенно влияет на скорость процесса окисления Cu(I) → Cu(II) под действием кислорода воздуха. Так, для 1,2-дихлорэтана образование моноядерного комплекса меди(II) [CuII(Bipy)2Cl]2[B10H10] ∙ ∙ 2C2H4Cl2 (1 ∙ 2C2H4Cl2) происходило при длительном изотермическом упаривании на воздухе. В ацетонитриле окисление Cu(I) удавалось провести только при добавлении в реакционный раствор DMF, при этом происходило образование биядерного комплекса состава {[CuII2(Bipy)2(μ-OH)2][B10H10]} (2) (схема 1 ). В отсутствие DMF в ацетонитриле реакция окисления Cu(I) протекает частично, и из реакционного раствора выделяется вышеописанный смешановалентный комплекс {[${\text{Cu}}_{4}^{{{\text{II}}}}$(Bipy)4(OH)4][${\text{Cu}}_{2}^{{\text{I}}}$[B10H10]3]} ∙ 4СН3СN [11].
Схема 1 . Синтез комплексов 1, 2.
В ИК-спектре комплекса 1 присутствует интенсивная уширенная полоса ν(BH) свободных ВН-групп при 2468 см–1. Отсутствие в спектре полос ν(BH)MHB в интервале 2350–2100 см–1 свидетельствует о нахождении аниона [B10H10]2– во внешней сфере комплекса. Окружение центрального атома металла составляют молекулы Bipy, об этом свидетельствует незначительное повышение полосы ν(C–H) c одновременным перераспределением интенсивностей полос колебаний гетероцикла в интервале 1600–700 см–1.
Пригодные для РСА монокристаллы 1 ∙ 2C2H4Cl2 получены в результате изотермического упаривания реакционного раствора. Кристалл 1 ∙ 2C2H4Cl2 построен из комплексных катионов [CuII(Bipy)2Cl]+, анионов [B10H10]2– и разупорядоченных молекул C2H4Cl2 (рис. 1). В структуре содержатся два независимых комплексных катиона с близким, но не идентичным строением. Пятикоординационное окружение атомов Cu(1) и Cu(2) образуют четыре атома N двух молекул Bipy и атом Cl. В комплексах Cu(1) и Cu(2) уплощенные молекулы Bipy образуют двугранные углы 80.2° и 75.4° соответственно. Атомы Cl(1) и Cl(2) расположены по-разному относительно атомов N в координационном полиэдре. Как видно из табл. 2, позицию атома Cl(1) можно описать как транс относительно атома N(1) (угол N(1)Cu(1)Cl(1) 163.9°) и цис относительно остальных атомов N (N(2,3,4)Cu(1)Cl(1) 91.3°–96.7°). Полиэдр атома Cu(1) наилучшим образом аппроксимируется тетрагональной пирамидой с атомом N(3) в апикальной вершине. Атомы N(1), N(2), N(4) и Cl(1), образующие основание пирамиды, копланарны в пределах ±0.18 Å (Δср = 0.166 Å). В окружении атома Cu(2) положение атома Cl(2) относительно атомов N(8) и N(6) характеризуется углами 135.0° и 119.0° соответственно. Кроме того, угол N(6)Cu(2)N(8) (105.9°) заметно увеличен по сравнению с соответствующим углом N(1)Cu(1)N(3) (99.4°). Таким образом, форма полиэдра атома Cu(2) наиболее близка к тригональной бипирамиде, основание которой образуют атомы N(6), N(8) и Cl(2), а апикальные вершины занимают атомы N(5) и N(7). В структуре комплексы Cu(1) и Cu(2) попарно связаны слабыми взаимодействиями Cl(2)…Cu(1) (3.181(2) Å). Атом Cl(2) достраивает полиэдр Cu(1) до асимметрично вытянутой бипирамиды (угол N(3)Cu(1)Cl(2) 174.13(14)°). В кристалле димерные катионы упакованы в диагональные слои [11], стабилизированные слабыми Н-связями С–Н…Cl и π–π-взаимодействиями между молекулами Bipy. Анионы [B10H10]2– расположены в пустотах между слоями в окружении атомов Н молекул Bipy (Н…Н 2.28–2.43 Å). Молекулы дихлорэтана также расположены между слоями.
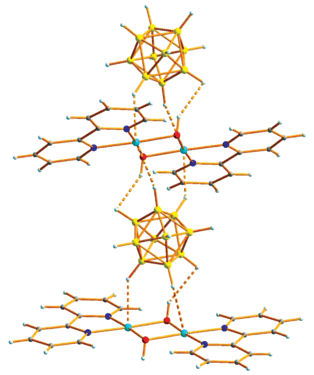
Рис. 1.
Фрагмент структуры комплекса 1 ∙ 2C2H4Cl2, молекулы растворителя не показаны. Тепловые эллипсоиды атомов приведены с вероятностью 30%.
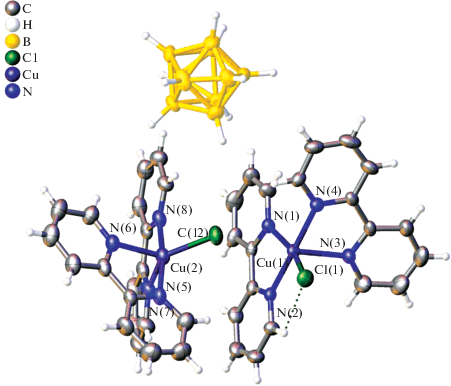
Источником атома хлора, присутствующего в структуре комплекса 1 ∙ 2C2H4Cl2, является используемый в реакции растворитель 1,2-дихлорэтан. Это не единственный пример участия дихлорэтана в реакциях с кластерными анионами бора в качестве реагента. Так, при изучении взаимодействия солей Cat2[B10H10] или Cat2[B12H12] с галогеноводородами (HCl, HBr и HI) в дихлорэтане [27, 28] установлено образование моно- и дихлорзамещенных производных [B10H10 –nCln]2– или [B12H12 –nCln]2– (n = 1, 2), при этом источником атомов хлора в составе продуктов реакции служил именно дихлорэтан, который первоначально использовали в реакциях в качестве растворителя.
По данным РСА, комплекс 2 построен из димерных катионов [CuII(μ-OH)(Bipy)]22+ и анионов [В10Н10]2–. Фрагмент структуры 2 показан на рис. 2. Комплексный катион имеет уплощенное центросимметричное строение. Окружение атома Cu2+ в форме искаженного квадрата образуют два атома N молекулы Bipy и атомы О двух групп (ОН)–. Анионы [B10H10]2– участвуют во взаимодействиях с ионами Cu2+ через атомы водорода BH-групп полиэдра с образованием удлиненных связей Cu2+…Н(B). ВН-группы двух полиэдрических анионов достраивают квадрат атома Cu (2N + + 2O) до вытянутой тетрагональной бипирамиды (Cu…Н 2.37 и 2.63 Å). В структуре 2 за счет этих взаимодействий катионы и анионы объединены в полимерные цепочки, в которых наблюдаются контакты ОН…НВ (Н…Н 2.26, Н…В 2.61 Å, ОНН 143°, ОНВ 120°). Строение комплекса 2 аналогично строению соединения [Cu2(BPA)2(μ-OH)2][B10H10] [6], однако в отсутствие NH-группы в лиганде цепочки не связаны в слои.
В ИК-спектре 2 присутствует интенсивная полоса валентных колебаний “свободных” ВН-групп ν(BH) с максимумами при 2486 и 2434 см–1. Кроме того, в спектре 2 проявляются полосы, соответствующие колебаниям координированных молекул Bipy, чему соответствует незначительное повышение полос валентно-деформационных колебаний ν(CN) c одновременным перераспределением интенсивностей полос колебаний гетероцикла в интервале 1605–700 см–1; также в спектре проявляется узкая полоса валентных колебаний ν(OH) гидроксогрупп средней интенсивности с максимумом при 3495 см–1.
В настоящей работе изучено комплексообразование меди(I) с азагетероциклическим лигандом Bipy на воздухе в присутствии солей кластерного аниона бора [B10H10]2–. Кластерные анионы бора отличаются большим разнообразием структур. В состав борного остова могут входить не только атомы бора, но и гетероатомы: азот, углерод, а также атомы металлов (карбораны, металлобораны, металлокарбораны [29–35]). При этом их химическое поведение существенно отличается от поведения родственных структур. В частности, известны комплексы меди(II) с другими кластерными анионами бора, которые содержат катионный комплекс [CuIIL2Cl]+ (L = Bipy, Phen), обнаруженный в 1 ∙ 2C2H4Cl2: [CuII(Phen)2Cl]2[B12H12] [4], [CuII(Phen)2Cl]2[транс-B20H18] [36], [CuII(Bi py)2Cl]2[B10Cl10] [37], [CuII(Phen)2Cl]2[B10Cl10] [37]. Перечисленные соединения были получены при взаимодействии хлорида меди(I) с Bipy в присутствии солей соответствующего кластерного аниона бора. В этом случае источником атома хлора в катионной части соединений являлся исходный реагент CuCl. Видно, что перечисленные кластерные анионы бора не стабилизируют медь(I) в реакционном растворе в присутствии азагетероциклов, и происходит быстрое окисление меди(I) до меди(II) на воздухе.
Химическое поведение другого представителя кластерных анионов бора – аниона [B11H14]– [38] в присутствии меди(I) или меди(II) существенно отличается – образуется сэндвичевый комплекс меди [1,1'-Cu(B11H11)2]3–, который может быть выделен в виде тетраметиламмониевой или тетрабутиламмониевой соли [39].
ЗАКЛЮЧЕНИЕ
Изучена реакция комплексообразования меди(I) с Bipy на воздухе в присутствии солей кластерного аниона бора [B10H10]2– в дихлорэтане и в системе ацетонитрил/DMF. Установлено, что окисление комплекса меди(I) состава [CuI2(Bipy)2[B10H10]], образованного in situ, приводит к получению координационных соединений Cu(II) с анионом [B10H10]2– и Bipy с достаточно высоким выходом. Обнаружено, что существенное влияние на состав и строение конечных продуктов оказывают условия проведения реакции комплексообразования, которая сопровождается окислительно-восстановительной реакцией (температура процесса, природа растворителя, наличие кислорода воздуха, выступающего в роли окислителя). Реакция комплексообразования в системе ацетонитрил/DMF привела к получению комплекса меди(II) {[CuII2(Bipy)2(μ-OH)2][B10H10]}n, тогда как проведение реакции комплексообразования в дихлорэтане показало возможность его участия в качестве реагента – источника атомов хлора. Большее сродство атомов меди(II) к образованию связи с ионами Cl– по сравнению с клозо-декаборатным анионом привело к образованию комплексного катиона [CuII(Bipy)2Cl]+ и его выделению в составе соединения [CuII(Bipy)2Cl]2[B10H10] с клозо-декаборатным анионом в качестве противоиона. Полученный результат можно объяснить с позиций принципа ЖМКО: анион [В10Н10]2–, будучи “мягким” основанием, охотнее координируется к “мягким” кислотам, чем к “жестким” кислотам или кислотам, находящимся в промежуточной группе. В частности, в литературе нет ни одного примера комплекса меди(I) с кластерными анионами бора [BnHn]2–, которые выступали бы в качестве противоионов (в таких соединениях всегда присутствует связь металла с борным кластером), как нет примеров комплексов металлов, относящихся к “жестким” кислотам, с кластерными анионами [BnHn]2– во внутренней сфере.
Список литературы
Avdeeva V.V., Malinina E.A., Churakov A.V. et al. // Polyhedron. 2019. V. 169. P. 144. https://doi.org/10.1016/j.poly.2019.05.018
Kochneva I.K., Avdeeva V.V., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 5. P. 591. [Кочнева И.К., Авдеева В.В., Гоева Л.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 5. С. 559.]https://doi.org/10.1134/S0036023618050066
Malinina E.A., Kochneva I.K., Polyakova I.N. et al. // Inorg. Chim. Acta. 2018. V. 479. P. 249. https://doi.org/10.1016/j.ica.2018.04.059
Malinina E.A., Kochneva I.K., Polyakova I.N. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 284. https://doi.org/10.1016/j.ica.2018.03.024
Malinina E.A., Kochneva I.K., Avdeeva V.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1210. [Малинина Е.А., Кочнева И.К., Авдеева В.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 10. С. 1031.]https://doi.org/10.1134/S0036023619100085
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 440. P. 253. [Дзиова А.Э., Авдеева В.В., Полякова И.Н. и др. // Докл. АН. 2011. Т. 440. № 3. С. 351.]https://doi.org/10.1134/S0012500811090035
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 6. P. 657. [Авдеева В.В., Дзиова А.Э., Полякова И.Н. и др. // Журн. неорган. химии. 2013. Т. 58. № 6. С. 746.]https://doi.org/10.1134/S003602361306003X
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 514. [Авдеева В.В., Малинина Е.А., Жижин К.Ю. и др. // Журн. неорган. химии. 2020. Т. 65. № 4. С. 495.]https://doi.org/10.1134/S0036023620040026
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 335. [Авдеева В.В., Малинина Е.А., Кузнецов Н.Т. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 334.]https://doi.org/10.1134/S003602362003002X
Vologzhanina A.V., Korlyukov A.A., Avdeeva V.V. et al. // J. Phys. Chem. Part A. 2013. V. 117. № 49. P. 13138. https://doi.org/10.1021/jp405270u
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 437. Part 2. P. 79. [Авдеева В.В., Дзиова А.Э., Полякова И.Н. и др. // Докл. АН. 2011. Т. 437. № 4. С. 488.]https://doi.org/10.1134/S001250081104001X
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2012. V. 442. № 1. P. 1. [Дзиова А.Э., Авдеева В.В., Полякова И.Н. и др. // Докл. АН. 2012. Т. 442. № 1. С. 57.]https://doi.org/10.1134/S0012500812010016
Boron Science: New Technologies and Applications / Ed. Hosmane N.S. CRC Press, 2011.
Mi P., Yanagie H., Dewi N. et al. // J. Control. Release. 2017. V. 254. P. 1. https://doi.org/10.1016/j.jconrel.2017.03.036
Hawthorne M.F., Lee M.W. // J. Neuro-Oncol. 2003. V. 62. P. 33.
Barth R.F., Coderre J.A., Vicente M.G. et al. // Clin. Cancer Res. 2005. V. 11. P. 3987. https://doi.org/10.1158/1078-0432
Plešek J. // Chem. Rev. 1992 V. 92. P. 269.
Reed C.A. // Chem. Commun. 2005. P. 1669. https://doi.org/10.1039/B415425H
Teixidor F., Viñas C., Demonceau A. et al. // Pure Appl. Chem. 2003. V. 75. P. 1305.
Sivaev I.B., Bregadze V.I. // Organomet. Chem. Research Perspectives / Ed. Irwin R.P. Nova Publ., 2007.
Sivaev I.B., Bregadze V.I. // Eur. J. Inorg. Chem. 2009. V. 11. P. 1433. https://doi.org/10.1002/ejic.200900003
Leśnikowski Z.J. // J. Med. Chem. 2016. V. 59. P. 7738. https://doi.org/10.1021/acs.jmedchem.5b01932
Malinina E.A., Zhizhin K.Yu., Mustyatsa V.N. et al. // Russ. J. Inorg. Chem. 2003. V. 48. № 7. P. 993. [Малинина Е.А., Жижин К.Ю., Мустяца В.Н. и др. // Журн. неорган. химии. 2003. Т. 48. № 7. С. 1102.]
Miller H.C., Miller N.E., Muetterties E.L. // J. Am. Chem. Soc. 1963. V. 85. № 23. P. 3885.
APEX2 (V. 2008, 6-1), SAINT (V7.60A), SADABS (2008/1). Bruker AXS Inc., Madison, Wisconsin, USA, 2008–2009.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Drozdova V.V., Malinina E.A., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2007. V. 52. № 1. P. 52. [Дроздова В.В., Малинина Е.А., Полякова И.Н. и др. // Журн. неорган. химии. 2007. Т. 52. № 1. С. 57.]https://doi.org/10.1134/S003602360701010X
Drozdova V.V., Zhizhin K.Yu., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2007. V. 52. № 7. P. 996. [Дроздова В.В., Жижин К.Ю., Малинина Е.А. и др. // Журн. неорган. химии. 2007. Т. 52. № 7. С. 1072.]https://doi.org/10.1134/S0036023607070042
Cotton F.A., Wilkinson G., Murillo C.A., Bochmann M. // Adv. Inorg. Chem. New York: Wiley-Interscience, 1999.
Muetterties E.L., Knoth W.H. Polyhedral Boranes. New York: Dekker, 1968.
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth-Heinemann, 1997.
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. P. 679. https://doi.org/10.1135/cccc20020679
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. P. 1149. https://doi.org/10.1135/cccc2010054
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1726. https://doi.org/10.1134/S0036023619140067
Avdeeva V.V., Buzin M.I., Dmitrienko A.O. et al. // Chem. Eur. J. 2017. V. 23. № 66. P. 16819. https://doi.org/10.1002/chem.201703285
Avdeeva V.V., Kravchenko E.A., Malinina E.A. et al. // Polyhedron. 2017. V. 127. P. 238. https://doi.org/10.1016/j.poly.2017.02.015
Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. № 8. P. 955. https://doi.org/10.1134/S003602362003002X
Kester J.C., Keller D., Huffman J.C. et al. // Inorg. Chem. 1994. V. 33. P. 5438. https://doi.org/10.1021/ic00102a015
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии