Журнал неорганической химии, 2020, T. 65, № 9, стр. 1241-1247
Состояние воды в продуктах гидротермальной обработки гидраргиллита и γ-Al2O3
И. В. Козерожец a, *, Г. П. Панасюк a, Е. А. Семенов a, Т. Л. Симоненко a, Г. Е. Никифорова a, Л. А. Азарова a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: irina135714@yandex.ru
Поступила в редакцию 01.04.2020
После доработки 04.05.2020
Принята к публикации 06.05.2020
Аннотация
Исследована термодинамика образования бемита при разном времени гидротермальной обработки микронных частиц гидраргиллита и γ-Al2O3 в различных средах. Выявлено наличие поверхностно-связанной воды с низким значением энтальпии испарения на начальных этапах гидротермальной обработки прекурсора. Показано, что независимо от прекурсора и среды, в которой осуществлялась гидротермальная обработка, синтезированный бемит обладает схожими свойствами.
ВВЕДЕНИЕ
Исследованию термодинамики превращения оксидов и гидроксидов посвящено большое число работ [1–13]. Среди термогравиметрических методов исследования дифференциальная сканирующая калориметрия (ДСК) является простым и широко распространенным способом, позволяющим определить этапы превращений оксидов и гидроксидов алюминия при различных видах обработки [3–5, 8, 9, 14–16].
В работе [17] методом ДСК исследовано превращение наноразмерного порошка γ-Al2O3 в наноразмерный порошок бемита (АlООН) при термопаровой обработке в среде HCl с изотермической выдержкой при 150°С. В этой работе [17] определена энтальпия дегидратации бемита, синтезированного на разных этапах обработки γ-Al2O3 в среде HCl в течение 8, 12 и 16 ч. Полученные величины, равные соответственно 6.2, 9.4 и 10.6 кДж/моль AlOOH, ниже расчетных значений энтальпии дегидратации бемита (26.1 кДж/моль AlOOH) [18], по-видимому, из-за несовершенства его структуры. После завершения процесса синтеза наноразмерного порошка бемита энтальпия дегидратации составила 19.4 кДж/моль AlOOH. Авторы работ [17, 19–21] отмечают, что снижение энтальпии дегидратации бемита коррелирует со смещением температурного максимума пика дегидратации в область 517°С и связывают это с размером частиц синтезированного бемита (20 нм). Также в работе [17] авторы обращают внимание на изменение состояния воды в синтезированных образцах на начальных этапах обработки наноразмерного порошка γ-Al2O3. Так, энтальпия испарения воды из системы наноразмерный порошок γ-Al2O3/AlOOH при обработке в течение 8, 12 и 16 ч равна 8, 16 и 22 кДж/моль Н2О соответственно, что позволяет классифицировать данную воду как поверхностно-связанную, существующую на начальных этапах превращения γ-Al2O3. После завершения синтеза наноразмерного порошка бемита (обработка γ-Al2O3 в течение 96 ч) на кривых ДТА и ТГ отсутствует тепловой эффект, указывающий на наличие поверхностно-связанной воды в образце, и присутствует только эндотермический эффект дегидратации бемита при 517°С.
В работе [22] представлены результаты исследования изменения состояния воды в кремнеземе при его термической и термопаровой обработке. Термогравиметрические исследования гидратированного кремнезема показали, что дегидратация образцов происходит в трех температурных интервалах: 50–120, 250–500, 500–1000°С и соответствует удалению из частиц кремнезема жидкой, связанной и молекулярно-дисперсной воды. При этом интегральная теплота испарения воды в температурном интервале 50–120°С составляет ~42 кДж/моль, что позволяет классифицировать данную воду как жидкую. Теплота испарения связанной воды в температурном диапазоне 250–500°С колеблется в пределах 4.2–25 кДж/моль. Для температурного диапазона 500–1000°С характерно отсутствие фиксированного теплового эффекта, однако потеря массы наблюдается, что позволяет авторам работы высказать предположение об удалении в данном температурном диапазоне молекулярно-дисперсной воды.
В работе [23] для образцов гидраргиллита, подвергнутых центробежной термоактивации, на кривых ДТА и ТГ фиксируются четыре эндотермических эффекта при температурах 43, 165, 310 и 525°С. По утверждению авторов работы [24], эффект при 165°С связан с удалением хемосорбированной воды, при 310°С соответствует разложению гидраргиллита, при 525°С разложению бемита, слабовыраженный экзотермический эффект при 760°С относится к кристаллизации аморфного γ-Al2O3. В этой работе приведены также кривые ДТА и ТГ образцов, состоящих из двух и более фаз, подвергнутых различным обработкам. На кривых ДТА и ТГ всех образцов хорошо выражен эндотермический эффект потери химически сорбированной воды, который сопровождается изменениями на кривой ТГ [23].
Таким образом, классификация форм воды на начальных этапах обработки поликристаллических гидроксидов и оксидов различными методами, а также определение роли воды в механизме формирования конечных продуктов обработки являются актуальной фундаментальной и научно-практической задачей [25–28].
Цель настоящей работы – определение методами калориметрии состояния воды в промежуточных и конечных продуктах гидротермальной обработки при 200°С гидраргиллита и γ-Al2O3 в нейтральной, кислой и щелочной средах, а также выявление роли поверхностно-связанной воды при формировании частиц бемита на начальных этапах обработки прекурсоров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования термодинамики синтеза микронных частиц бемита в качестве прекурсора использовали гидраргиллит марки МДГА производства ООО “Пикалево” и γ-Al2O3, полученный в результате прогрева гидраргиллита при 800°C в течение 4 ч. Обработку гидраргиллита и γ-Al2O3 осуществляли в автоклавах объемом 25 см3 в тефлоновом вкладыше при температуре 200°C в различных средах (вода, 1.5 мас. % раствор НСl, 1.5 мас. % раствор NaOH). Коэффициент заполнения автоклава составлял 15%. Автоклавы охлаждали проточной водой, синтезированные образцы бемита (AlOOH) извлекали из вкладышей, промывали дистиллированной водой и высушивали при 100°С. Использование тефлонового вкладыша позволяет избежать загрязнения синтезированного бемита примесями, возникающими за счет коррозии стенок контейнера [29]. Синтезированный бемит исследовали методами: РФА на дифрактометре Bruker D8 Advance; СЭМ на приборе Самscan-S2; ДСК на SDT Q600, скорость нагрева 10 град/мин в температурном интервале 20–1000°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
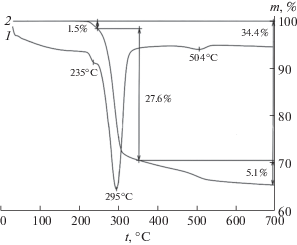
Согласно результатам РФА, гидраргиллит представляет собой монофазный образец со средним размером частиц 3 мкм, определенным по данным СЭМ (рис. 1а). На термограммах гидраргиллита в температурном интервале 20–1000°С присутствуют следующие эндотермические эффекты (рис. 2): при 235°С с потерей массы 1.95% и энтальпией образования бемита 26.9 кДж/моль Аl(OH)3; при 295°С с потерей массы 29.5% и энтальпией разложения гидраргиллита до χ-фазы оксида алюминия [30–32] 71 кДж/моль Аl(OH)3; при 504°С с потерей массы 1.94% и энтальпией дегидратации бемита при образовании γ-Al2O3 [17] 9.1 кДж/моль АlООН. Следует отметить, что снижение значений энтальпии при 235 и 504°С по сравнению с табличными значениями (55.2 кДж/моль Аl(OH)3 и 26.1 кДж/моль АlООН [18]) указывает на слабую упорядоченность структуры бемита.
Рис. 1.
СЭМ-изображения гидраргиллита марки МДГА (а); бемита (б), полученного после гидротермальной обработки гидраргиллита в воде при 200°С (τ = 4 ч); бемита (в), полученного после гидротермальной обработки γ-Al2O3 в 1.5 мас. % растворе НСl при 200°С (τ = 15 ч); бемита (г), полученного после гидротермальной обработки γ-Al2O3 в 1.5 мас. % растворе NaOH при 200°С (τ = 7 ч).

Согласно результатам исследования гидраргиллита методами ДСК и РФА, наличие теплового эффекта при 295°С указывает на то, что переход гидраргиллита в оксид алюминия при термообработке осуществляется двумя параллельными путями: непосредственно в оксид алюминия и через фазу бемита. В подтверждение данного заключения гидраргиллит прогревали на воздухе при 250°С в течение 22 ч. Результаты РФА показали наличие в образце смеси бемита и гидраргиллита [32].
Обработка гидраргиллита в автоклаве в воде при 200°С в течение 1 ч приводит к появлению, согласно результатам РФА, смеси фаз гидраргиллита и бемита, что находит отражение на термограммах. Так, для образовавшейся смеси фаз гидраргиллита и бемита на термограммах имеются эндотермические эффекты с максимумом при 241°С и энтальпией образования бемита 28.7 кДж/моль Al(OH)3; с двойным максимумом разложения гидраргиллита при 283 и 291°С и соответствующей суммарной энтальпией 73 кДж/моль Al(OH)3 и наконец с максимумом при 499°С и энтальпией разложения образовавшегося бемита 10.2 кДж/моль АlООН.
Обработка гидраргиллита в автоклаве в течении 4 ч при 200°С в воде позволяет завершить процесс синтеза изометрического бемита (рис. 1б). На дифрактограммах этого образца присутствуют только узкие рефлексы бемита. На термограммах присутствует один эндотермический эффект при 529°С с потерей массы 12.7% в температурном диапазоне 447–572°С и энтальпией дегидратации бемита 26.4 кДж/моль АlООН, соответствующей табличному значению (26.1 кДж/моль АlООН) [18].
Для выявления возможной зависимости механизма автоклавного синтеза бемита от используемого прекурсора была проведена гидротермальная обработка порошка γ-Al2O3 в 1.5 мас. % растворе НСl и в 1.5 мас. % растворе NaOH.
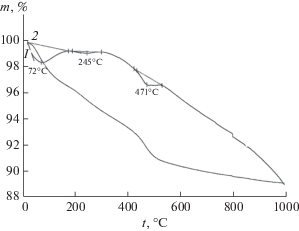
Образец, полученный в результате обработки γ-Al2O3 в течение 7 ч при 200°С в 1.5 мас. % растворе НСl, представляет собой смесь фаз γ-Al2O3 и бемита. На термограммах образца (рис. 3) присутствуют три эндотермических эффекта с максимумами: при 72°С в температурном интервале 28–182°С, соответствующий испарению поверхностно-связанной воды с энтальпией 28.2 кДж/моль Н2О; при 244°С с энтальпией образования бемита 6.5 кДж/моль Н2О и при 471°С с энтальпией дегидратации бемита 13.5 кДж/моль АlООН. Наличие на термограмме эндотермического эффекта испарения поверхностно-связанной воды и низкое значение энтальпии дегидратации бемита свидетельствуют о незавершенности синтеза бемита.
Рис. 3.
Кривые ДТА (1) и ТГ (2) образца, полученного при гидротермальной обработке γ-Al2O3 в 1.5 мас. % растворе НСl при 200°С в течение 7 ч.
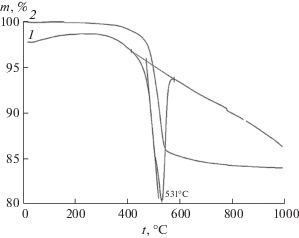
Обработка γ-Al2O3 в течение 15 ч в автоклаве при 200°С в 1.5 мас. % растворе НСl позволяет получить бемит игольчатого габитуса со средним размером частиц 300 нм (рис. 1в). На термограммах этого образца (рис. 4.) присутствует эндотермический эффект с максимумом при 531°С и потерей массы 13% при дегидратации бемита с энтальпией 27.2 кДж/моль АlООН, которая соответствует расчетному табличному значению.
Рис. 4.
Кривые ДТА (1) и ТГ (2) бемита, полученного при гидротермальной обработке γ-Al2O3 в 1.5 мас. % растворе НСl при 200°С, τ = 15 ч.
Для образца, полученного при обработке γ-Al2O3 в автоклаве при 200°С в течение 0.5 ч в 1.5 мас. % растворе NaOH, характерна незавершенность процесса синтеза бемита, и на дифрактограммах наблюдаются только рефлексы γ-Al2O3. На термограммах присутствуют эндотермические эффекты: при 77°С, соответствующий испарению поверхностной воды с энтальпией, численно сравнимой с энтальпией испарения жидкой воды и равной 40.08 кДж/моль Н2О; при 251°С с энтальпией образования бемита 26.9 кДж/моль Н2О и при 509°С с энтальпией дегидратации образовавшегося бемита 21.4 кДж/моль АlООН, которая ниже расчетного табличного значения.
Обработка в автоклаве в 1.5 мас. % растворе NaOH при 200°С в течение 7 ч γ-Al2O3, позволяет синтезировать бемит пластинчатого габитуса, со средним размером частиц 1 мкм (рис. 1г). На термограммах этого образца присутствует один эндотермический эффект с максимумом при 528°С и потерей массы 13.7%. Величина энтальпии дегидратации синтезированного бемита равна 26.9 кДж/моль АlООН и соответствует табличному значению.
Таким образом, исследование термодинамики синтеза микронных частиц бемита при термопаровой обработке различных прекурсоров (гидраргиллит, γ-Al2O3) путем фиксирования процесса в определенном промежутке времени позволило выявить наличие на начальных этапах обработки, независимо от рН среды и используемого прекурсора, поверхностно-связанной воды, которая участвует в процессе синтеза бемита. При наличии в образце поверхностно-связанной воды энтальпия дегидратации бемита ниже расчетного теоретического значения, что указывает на несовершенство структуры синтезированного бемита и незавершенность процесса его образования. Полученные значения энтальпии процессов, происходящих при термическом анализе, представлены в табл. 1.
Таблица 1.
Результаты термогравиметрии продуктов гидротермальной обработки гидраргиллита и γ-Al2O3 в различных средах при 200°С
| Образец | Обработка | Температурный интервал пика (максимум), °С | Потеря массы, % | Энтальпия | Характеристика теплового эффекта | Фазовый состав образца | ||
|---|---|---|---|---|---|---|---|---|
| τ, ч | среда | КДж/моль | вещество | |||||
| Гидраргиллит МГДА | – | – | 175–251 (235) | 1.95 | 26.9 | Аl(OH)3 | ОБ | Гидраргиллит |
| 251–320 (289) | 29.50 | 71.0 | Аl(OH)3 | РГ | ||||
| 460–520 (500) | 1.94 | 9.1 | АlОOH | ДБ | ||||
| 1 | Вода | 224–247 (241) | 1.60 | 28.7 | Аl(OH)3 | ОБ | Смесь гидраргиллита и бемита | |
| 247–350 (283, 291) | 27.30 | 73.0 | Аl(OH)3 | РГ | ||||
| 450–541 (499) | 2.50 | 10.2 | АlОOH | ДБ | ||||
| 4 | Вода | 447–572 (529) | 12.70 | 26.4 | АlООН | ДБ | Бемит | |
| γ-Al2O3 | 0.5 | NаОН | 39–83 (77) | 1.90 | 40.1 | Н2О | ИПСВ | γ-Al2O3 |
| 231–280 (251) | 1.00 | 26.9 | Н2О | ОБ | ||||
| 475–549 (509) | 2.90 | 21.4 | АlООН | ДБ | ||||
| 7 | NаОН | 476–595 (528) | 13.70 | 26.9 | АlООН | ДБ | Бемит | |
| 7 | НСl | 28–182 (72) | 3.50 | 28.2 | Н2О | ИПСВ | Смесь γ-Al2O3 и бемита | |
| 203–312 (244) | 2.10 | 6.5 | Н2О | ОБ | ||||
| 431–546 (471) | 2.60 | 13.5 | АlООН | ДБ | ||||
| 15 | НСl | 473–591 (531) | 13.00 | 27.2 | АlООН | ДБ | Бемит | |
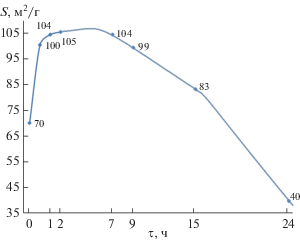
Синтез игольчатых частиц бемита при обработке в кислой среде γ-Al2O3 протекает более длительное время по сравнению с обработкой гидраргиллита в воде и γ-Al2O3 в щелочной среде, что позволяет использовать данную систему как модельную для описания роли поверхностно-связанной воды при синтезе бемита. Поверхностная энергия для полиморфного кристалла γ-Аl2O3 равна ~747 мДж/м2 [33], а максимальное значение поверхностного натяжения на границе твердое/жидкость при 200°С равно 218.58 мДж/м2 [34]. При гидротермальной обработке γ-Al2O3 в 1.5 мас. % растворе НСl формируются частицы бемита игольчатой формы, так как эта форма является термодинамически стабильной в данных условиях. При появлении первых рефлексов бемита значение удельной поверхности становится максимальным для двухфазной системы и значительно снижается с увеличением структурированности и доли бемита в образце (рис. 5). Бемит, образующийся на ранних этапах гидротермальной обработки, характеризуется низким значением тепловых эффектов образования и дегидратации с образованием γ-Al2O3, что коррелирует с высокими величинами удельной поверхности и указывает на несовершенную структуру бемита. При увеличении времени гидротермальной обработки значения тепловых эффектов дегидратации бемита увеличиваются, а значения удельной поверхности уменьшаются, что указывает на формирование более совершенной структуры бемита.
Рис. 5.
Изменение удельной поверхности образцов, полученных при гидротермальной обработке γ-Al2O3 при 200°С в 1.5 мас. % растворе НСl.
При обработке гидраргиллита в воде при 200°С в течение 1 ч на кривых ДТА и ТГ эндотермический эффект испарения поверхностно-связанной воды прямо не фиксируется, однако значения тепловых эффектов образования и дегидратации бемита оказываются выше по сравнению со значениями этих тепловых эффектов для исходного гидраргиллита, не подвергнутого обработке в автоклаве. Это указывает на образование более совершенного бемита по первому пути разложения гидраргиллита.
Обработка γ-Al2O3 в 1.5 мас. % растворах NaOH или HCl в течение короткого времени указывает на активное взаимодействие поверхности γ-Al2O3 с водой гидротермального раствора. Пониженная температура разложения бемита и низкое значение энтальпии разложения (табл. 1) свидетельствуют о сохранении в продукте синтеза оксида алюминия, т.е. незавершенности синтеза бемита. Причем образование бемита в ходе термического анализа (как и при разложении гидраргиллита по первому пути, табл. 1) приводит к выводу о присутствии в продукте разупорядоченного гидроксилированного оксида алюминия, аналогичного псевдобемиту, т.е. содержащего увеличенное количество связанной воды по сравнению с бемитом.
Синтезированный однофазный бемит независимо от прекурсора (гидраргиллит, γ-Al2O3) и рН среды синтеза обладает близкими значениями теплового эффекта дегидратации бемита, которые колеблются в пределах погрешности измерительного оборудования. При этом поверхностно-связанная вода отсутствует. Для всех образцов синтезированного однофазного бемита температура дегидратации составляет 530°С, это косвенно указывает на то, что размер частиц бемита находится в пределах 1 мкм [19] и обладает совершенной структурой.
Таким образом, полученные результаты позволяют сделать вывод о том, что роль поверхностно-связанной воды заключается в стабилизации структуры бемита, возникающей в разупорядоченном состоянии на начальном этапе синтеза в водной среде.
ЗАКЛЮЧЕНИЕ
Определены термодинамические параметры процесса синтеза микронных частиц бемита из различных прекурсоров при термопаровой обработке в различных средах. Методом ДСК показано, что независимо от прекурсора и гидротермальной среды для образцов, полученных на начальных этапах автоклавной обработки, присутствует поверхностно-связанная вода со значением энтальпии испарения значительно ниже табличных значений испарения жидкой воды. Величина энтальпии дегидратации бемита зависит от его структурного совершенства и на начальных этапах термопаровой обработки ниже табличных значений. Для образцов однофазного бемита отсутствует тепловой эффект испарения поверхностно-связанной воды, и энтальпия дегидратации бемита соответствует табличным значениям. Сделан вывод о том, что роль поверхностно-связанной воды заключается в стабилизации структуры бемита, возникающей в разупорядоченном состоянии на начальном этапе синтеза в водной среде.
Список литературы
Nangoi I.M., Faro A.C., Souza W.F. et al. // Appl. Clay Sci. 2018. V. 151. № 1. P. 194. https://doi.org/10.1016/j.clay.2017.10.011
Zhang L., Li Y.H., Gu Y.Q. et al. // Sci. Rep. 2019. V. 9. № 16 889. https://doi.org/10.1038/s41598-019-53088-3
Chen F., Chen W., Guo Y.F. et al. // Int. J. Min. Met. Mater. 2018. V. 25. № 12. P. 1373. https://doi.org/10.1007/s12613-018-1691-7
Zhou Y.L., Zhu Y.L., Zhu Y.F. et al. // J. Alloys. Compd. 2015. V. 628. P. 257. https://doi.org/10.1016/j.jallcom.2014.12.191
Zhang X., Cui W.W., Hu J.Z. et al. // Cryst. Growth Des. 2019. V. 19. № 10. P. 5557. https://doi.org/10.1021/acs.cgd.9b00468
Zhong Y.W., Gao J.T., Meng L. et al. // J. Alloys Compd. 2017. V. 710. P. 182. https://doi.org/10.1016/j.jallcom.2017.03.248
Bloch L., Kauffmann Y., Pokroy B. // Cryst. Growth Des. 2014. V. 14. № 8. P. 3983. https://doi.org/10.1021/cg500580c
Chen S.S., Navrotsky A. // Am. Mineral. 2010. V. 95. № 1. P. 112. https://doi.org/10.2138/am.2010.3339
Yang R.J., Yu P.C., Chen C.C. et al. // Cryst. Growth Des. 2009. V. 9. № 4. P. 1692. https://doi.org/10.1021/cg800351d
Wang X.D., Du S.C., Li W.C. et al. // Metall. Mater. Trans. B. 2002. V. 33. № 2. P. 201. https://doi.org/10.1007/s11663-002-0005-6
Bazhin P.M., Kostitsyna E.V., Stolin A.M. et al. // Ceram. Int. 2019. V. 45. № 7. P. 9297. https://doi.org/10.1016/j.ceramint.2019.01.188
Stolin A.M., Bazhin P.M., Konstantinov A.S. et al. // Ceram. Int. 2018. V. 44. № 12. P. 13815. https://doi.org/10.1016/j.ceramint.2018.04.225
Ivakin Yu.D., Danchevskaya M.N., Kholodkova A.A. et al. // J. Supercrit. Fluids. 2020 V. 159. P. 104771. https://doi.org/10.1016/j.supflu.2020.104771
Simonenko T.L., Kalinina M.V., Simonenko N.P. et al. // Glass Phys. Chem. 2018. V. 44. № 4. P. 314. https://doi.org/10.1134/S1087659618040144
Simonenko T.L., Simonenko N.P., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 12. P. 1475. https://doi.org/10.1134/S0036023619120167
Simonenko T.L., Ivanova V.M., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1753. https://doi.org/10.1134/S0036023619140080
Panasyuk G.P., Kozerozhets I.V., Semenov E.A. et al. // Inorg. Mater. 2019. V. 55. № 9. P. 920. https://doi.org/10.1134/S0020168519090127
Panasyuk G.P., Kozerozhets I.V., Voroshilov I.L. et al. // Russ. J. Phys. Chem. A 2015. V. 89. № 4. P. 592. https://doi.org/10.1134/S0036024415040196
Bokhimi X., Toledo-Antonio J.A., Guzman-Castillo M.L. et al. //J. Solid State Chem. 2001. V. 161. P. 319. https://doi.org/10.1006/jssc.2001.9320
Panasyuk G.P., Belan V.N., Voroshilov I.L. et al. // Inorg. Mater. 2010. V. 46. № 7. P. 747. https://doi.org/10.1134/S0020168510070113
Panasyuk G.P., Belan V.N., Voroshilov I.L. et al. // Theor. Found. Chem. Eng. 2013. V. 47. № 4. P. 415. https://doi.org/10.1134/S0040579513040143
Панасюк Г.П., Будова Г.П., Ворошилов И.Л. Состояние воды в кремнеземе. Теоретическая и прикладная неорганическая химия. М.: Наука, 1999. С. 221.
Матвеева А. Н., Пахомов Н.А. // Известия СПбГТИ(ТУ). 2015. № 31. С. 18.
Харина И.В., Исупова Л.А., Литвак Г.С. и др. // Кинетика и катализ. 2007. Т. 48. № 2. С. 343.
Ivakin Yu.D., Smirnov A.V., Tarasovskii V.P. et al. // Glass Ceram. 2019. V. 76. № 6. P. 210. https://doi.org/10.1007/s10717-019-00167-6
Kholodkova A.A., Danchevskaya M.N., Ivakin Yu.D. et al. // Ceram. Int. 2019. V. 45. № 17 B. P. 23050. https://doi.org/10.1016/j.ceramint.2019.07.353
Kholodkova A.A., Danchevskaya M.N., Ivakin Yu.D. et al. // Russ. J. Phys. Chem. B. 2018. V. 12. № 8. P. 1261. https://doi.org/10.1134/S1990793118080079
Kholodkova A., Danchevskaya M., Popova N. et al. // Materiali in Tehnologije. 2015. V. 49. № 3. P. 447. https://doi.org/10.17222/mit.2013.276
Panasyuk G.P., Semenov E.A., Kozerozhets I.V. et al. // Dokl. Chem. 2018. V. 483. P. 272. https://doi.org/10.1134/S0012500818110022
Panasyuk G.P., Kozerozhets I.V., Semenov E.A. et al. // Inorg. Mater. 2019. V. 55. № 9. P. 929. https://doi.org/10.1134/S0020168519090139
Суходуб Л.Ф., Тележенко Ю.В., Шелковский В.С., Лисняк Ю.В. Энтальпия малых кластеров воды. Харьков: Физико-технический институт низких температур АН УССР, 1984. 24 с.
Danchevskaya M.N., Ivakin Yu.D., Martynova L.F et al. // J. Therm. Anal. 1996. V. 46 № 5. P. 1215. https://doi.org/10.1007/bf01979236
Стромберг А. Г. Физическая химия. М.: Высшая школа, 2001. 527 с.
Козерожец И.В. Разработка метода получения и исследование субмикронных и наноразмерных частиц оксидов алюминия с низким содержанием примесей. Дис. … канд хим. наук. 2011. 128 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии