Журнал неорганической химии, 2020, T. 65, № 9, стр. 1265-1273
Биологическая активность протонных ионных жидкостей на основе трис(2-гидроксиэтил)аммониевых солей и кристаллическая структура малата трис(2-гидроксиэтил)аммония
Ю. А. Кондратенко a, *, В. В. Гуржий b, Г. Г. Панова c, Л. М. Аникина c, О. Р. Удалова c, В. И. Крутиков d, В. Л. Уголков a, Т. А. Кочина a
a Институт химии силикатов им. И.В. Гребенщикова
199034 Санкт-Петербург, наб. Макарова, 2, Россия
b Институт наук о Земле, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
c Агрофизический научно-исследовательский институт
195220 Санкт-Петербург, Гражданский пр-т, 14, Россия
d Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский пр-т, 26, Россия
* E-mail: kondratencko.iulia@yandex.ru
Поступила в редакцию 18.03.2020
После доработки 16.04.2020
Принята к публикации 27.04.2020
Аннотация
Впервые изучена противомикробная и ростостимулирующая активность девяти протонных ионных жидкостей (ПИЖ) – трис(2-гидроксиэтил)аммониевых солей (протатранов) коричной, бензойной, салициловой, щавелевой, малоновой, янтарной, яблочной и лимонной кислот. Обнаружено, что трис(2-гидроксиэтил)аммониевые соли коричной, бензойной и малоновой кислот оказывают положительное влияние на прорастание семян и ростовые характеристики проростков кресс-салата (Lepidium sativum L.). Все исследуемые ПИЖ проявляют селективную активность к бактерии Staphylococcus aureus. ПИЖ на основе малата трис(2-гидроксиэтил)аммония с температурой плавления 41°C была выделена в виде кристаллов для сравнительного изучения кристаллической структуры методом монокристальной рентгеновской дифракции. В отличие от катионов в сукцинате трис(2-гидроксиэтил)аммония, катионы в соли яблочной кислоты характеризуются трициклической эндо-конформацией, которая является наиболее характерной для трис(2-гидроксиэтил)аммониевых солей.
ВВЕДЕНИЕ
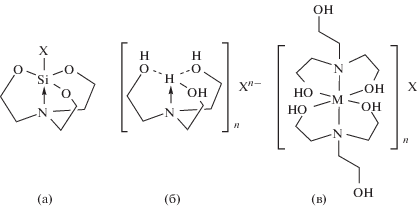
Потребность в экологически безопасных биодеградируемых препаратах комплексного положительного действия на растения делает актуальным поиск и разработку их новых форм, обеспечивающих направленную регуляцию процессов роста и развития, транспортировку в растения макро- и микроэлементов и физиологически активных соединений, обладающих свойствами адаптогенов и протекторов растений. В России и в мире существует острая потребность в разработке подобных препаратов, обусловленная глобальным снижением плодородия почв и загрязнением пахотных земель пестицидами, что в совокупности негативным образом влияет на урожайность агрофитоценозов, их устойчивость к стрессовым факторам, качество и безопасность получаемой растительной продукции [1–3]. Перспективными источниками получения препаратов комплексного положительного действия на растения могут служить внутрикомплексные соединения трис(2-гидроксиэтил)амина (ТЕА) – атраны. Атраны, к которым относятся силатраны (рис. 1а), протатраны (рис. 1б) и гидрометаллатраны (рис. 1в), зарекомендовали себя как биологически активные соединения широкого спектра действия, находящие применение в медицине, косметологии, сельском хозяйстве и других областях [4–6].
Рис. 1.
Строение атранов: силатраны (X = Hal, Alk, OAlk и др.) (а); протатраны (X – анионы протонных кислот) (б); гидрометаллатраны (M = Cu, Co, Zn и др., X – анионы протонных кислот) (в).
Многолетние исследования биологической активности силатранов показали, что они способны повышать всхожесть растений, устойчивость к водному дефициту, заболеваниям и вредителям, морозостойкость, засухоустойчивость, улучшать регенерацию тканей, повышать урожайность и качество плодов [7, 8].
Превращение биологически активных кислот в их трис(2-гидроксиэтил)аммониевые соли существенно повышает эффективность и расширяет спектр действия исходной кислоты. Трис(2-гидроксиэтил)аммониевая соль 2-метилфеноксиуксусной кислоты, известная как крезацин, относится к экологически безопасным биостимуляторам для сельского хозяйства и является значительно более активным росторегулирующим средством, чем исходная кислота. Крезацин внесен в государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории РФ в 2009 г. [9]. В растениях препарат способствует усилению биосинтеза белков и нуклеиновых кислот, повышает активность ферментов. Крезацин рекомендован для предпосевной, корневой и внекорневой обработки зерновых и овощных культур, плодовых и декоративных деревьев и кустарников с целью повышения всхожести семян и корнеобразования, устойчивости к грибковым и инфекционным заболеваниям, повышения холодостойкости, ускорения роста и накопления биомассы [10]. Растворы (10–4–10–6 моль/л) гидрометаллатрана на основе ТЕА комплекса с ацетатом цинка(II) статистически достоверно стимулируют рост клеток суспензионной культуры сахарного тростника (сорт POJ2878) [11].
В работах [12–14] исследовано влияние трис(2-гидроксиэтил)аммониевых солей на рост и жизнедеятельность микроорганизмов и показано, что протатраны эффективно стимулируют рост спиртовых дрожжей Saccharomyces cerevisiae [12], увеличивают прирост биомассы гриба Rhizopus oryzae F-814, который является продуцентом биополимера хитозана [14].
Кроме того, трис(2-гидроксиэтил)аммониевые соли относятся к классу протонных ионных жидкостей, которые в последнее время вызывают научный и практический интерес [15, 16]. Как известно [17], ионные жидкости представляют собой органические соли с температурой плавления <100°C и характеризуются комплексом ценных физико-химических свойств, таких как низкая температура плавления и практически отсутствие давления насыщенных паров, высокая термостойкость, широкий диапазон значений плотности и вязкости, способность растворять большое количество различных органических соединений и солей металлов, высокая полярность и ионная проводимость и др. Ранее нами была получена серия протонных ионных жидкостей на основе трис(2-гидроксиэтил)аммониевых солей биологически активных карбоновых кислот и исследована конформация трис(2-гидроксиэтил)аммониевого катиона в солях щавелевой, малоновой, янтарной и салициловой кислот методом монокристальной рентгеновской дифракции [18, 19].
Таким образом, анализ литературных данных наглядно показывает, что биологически активные внутрикомплексные соединения ТЕА могут служить основой для создания эффективных препаратов комплексного действия для растениеводства, микробиологии и медицины. В связи с этим в данной работе была оценена противомикробная и ростостимулирующая активность синтезированных ранее трис(2-гидроксиэтил)аммониевых солей биологически активных карбоновых кислот (коричной, бензойной, салициловой, щавелевой, малоновой, янтарной, яблочной и лимонной) и исследована кристаллическая структура и термическая устойчивость малата трис(2-гидроксиэтил)аммония.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез трис(2-гидроксиэтил)аммониевых солей. Трис(2-гидроксиэтил)аммониевые соли 1–9 (рис. 2) были получены взаимодействием ТЕА с соответствующей карбоновой кислотой в спирте при молярном соотношении реагентов 1 : 1 (соли 1–5, 7) или 2 : 1 (соли 6, 8, 9) по методике [20]. Соль 8 была выделена из реакционной среды в виде вязкой маслянистой жидкости с выходом 94%. Кристаллы соединения 8, пригодные для рентгеноструктурного эксперимента, были впервые выделены из жидкой фазы (процесс длился несколько недель), промыты ацетоном и высушены в вакууме, tпл = 41°С. Данные элементного анализа представлены ниже:
Данные ИК-спектроскопии для соединения 8 (3600–600 см–1): 3350 (уш., с.), 3150 (с.), 2930 (ср.), 2900 (сл.), 2830 (сл.), 1590 (уш., с.), 1490 (ср.), 1460 (ср.), 1410 (с.), 1320 (ср.), 1290 (сл.), 1260 (сл.), 1190 (сл.), 1090 (ср.), 1030 (ср.), 1000 (ср.), 917 (ср.), 672 (уш., сл.).
Данные ЯМР-спектроскопии для 8. 1Н ЯМР (ДМСО-d6, δ, м.д., J, Гц): 2.33 дд (1H, 4.7, 17.4, ‒O2CCH2CH(OH)C${\text{O}}_{2}^{ - }$), 2.59–2.57 м (1H, ‒O2CCH2CH(OH)C${\text{O}}_{2}^{ - }$), 3.05 т (12H, 5.6, 5.6, HN+CH2), 3.55 т (12H, 5.6, 5.6, CH2OH), 3.94 дд (1H, 4.7, 8.7, –O2CCH2CH(OH)C${\text{O}}_{2}^{ - }$), 4.2–5.2 уш. с. (9Н, HN+C2H4OH, –O2CСH(OH)CH2C${\text{O}}_{2}^{ - }$). 13С ЯМР (ДМСО-d6, δ, м.д.): 41.8 (‒O2CСH(OH)CH2C${\text{O}}_{2}^{ - }$), 56.8 (HN+CH2), 58.0 (CH2OH), 66.9 (‒O2CСH(OH)CH2C${\text{O}}_{2}^{ - }$), 172.9 (‒O2CСH(OH)CH2C${\text{O}}_{2}^{ - }$), 177.0 (‒O2CСH(OH)CH2C${\text{O}}_{2}^{ - }$).
Методы исследования. ИК-спектр в области 4000–500 см–1 для образца 8 в виде таблетки с бромидом калия был записан на ИК-Фурье-спектрометре Nicolet 8700 (Thermo Scientific). 1H и 13C ЯМР-спектры соли 8 сняты в растворах ДМСО-d6 2–5% на спектрометре Bruker Avance III (400.13 MГц (1Н), 100.613 MГц (13С)). Химические сдвиги измерены относительно остаточных сигналов диметилсульфоксида (2.50 м.д. для 1Н и 39.52 м.д. для 13С) [21]. Элементный анализ выполнен на CHN-анализаторе Euro EA3028-НТ.
Термическая устойчивость протатрана 8 изучена на установке синхронного термического анализа STA 429 СD (Netzsch) с использованием Pt-Pt/Rh-держателя для образцов. Для анализа продуктов разложения использован квадрупольный масс-спектрометр QMS 403 C (Netzsch), позволяющий анализировать продукты термического разложения в интервале от 1 до 121 атомно-зарядной единицы. Температура плавления протатрана 8 была дополнительно определена на приборе для определения точки плавления SMP10.
Рентгеноструктурный анализ выполнен на монокристальном дифрактометре Rigaku Oxford Diffraction XtaLab SuperNova HyPix-3000 при 100 K. Съемка проведена с использованием микрофокусного CuKα-излучения (λ = 1.54184 Å). Кристаллографические данные: C16H36N2O11, M = = 432.47; моноклинная сингония, пр. гр. Pn; a = 5.3684(3), b = 15.0088(6) и c = 13.0636(5) Å; β = 94.105(4)°; V = 1049.88(8) Å3; Z = 2; μ = 0.981 мм–1; T = 100 K; измерено 8363 рефлекса, 2512 независимых рефлексов (Rint = 0.0361); R[F 2 > 2σ(F 2)] = 0.0576; wR(F2) = 0.1578; GOF = 1.162. Экспериментальные данные собраны с помощью программы CrysAlisPro [22]. Структура решена прямыми методами и уточнена с использованием программы Shelx [23, 24], интегрированной в комплекс Olex2 [25]. Конечные модели включают координаты и анизотропные тепловые параметры для всех неводородных атомов. Позиции атомов водорода, связанных с углеродом, были рассчитаны и уточнены с помощью модели “наездника”, где Uiso(H) установлено как 1.2Ueq(C) и C–H 0.97 Å для CH2-групп, Uiso(H) установлено как 1.2Ueq(C) и C–H 0.98 Å для CH-групп. Атомы водорода NH- и OH–-групп были определены из разностного синтеза и сдерживались в процессе уточнения методом МНК. Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDC 1941239) (http://www.ccdc.cam.ac.uk/deposit).
Биологическая активность. Оценка биологической активности заключалась в определении влияния растворов исследуемых соединений 1–9 на всхожесть семян кресс-салата сорта “Ажур” (Lepidium sativum L.), а также на рост корней и проростков в течение 7 сут после замачивания семян. Растворы исследуемых трис(2-гидроксиэтил)аммониевых солей 1–9 приготовили в концентрациях 0.03, 0.003 и 0.0003 мг/л. Семена кресс-салата проращивали в чашках Петри в растворах исследуемых солей (10 мл). Контрольные образцы выращивали в чистой воде. Через 3 сут определяли энергию прорастания семян, а через 7 сут рассчитывали всхожесть семян и измеряли длину корней и ростков. Исследования проводили в соответствии с правилами Международной ассоциации по контролю качества семян (ISTA) и общепринятыми методами [26–29]. Опыты повторяли три раза. Данные статистически обрабатывали и определяли средние значения.
Противомикробную активность исследуемых соединений 1–9 изучали по отношению к стандартным штаммам микроорганизмов из коллекции кафедры микробиологии, вирусологии и иммунологии ПСПбГМУ им. И.П. Павлова. Минимальную ингибирующую концентрацию определяли как наименьшую концентрацию антимикробного агента, при которой визуально не наблюдался рост микроорганизмов, по методу серийных разведений (NCCLS, 1997).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
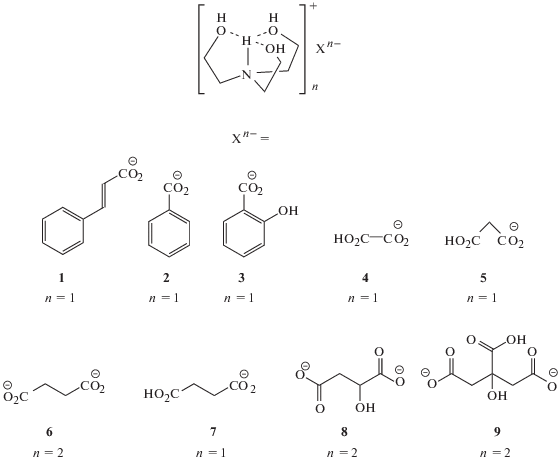
Трис(2-гидроксиэтил)аммониевые соли (рис. 2) коричной (1), бензойной (2), салициловой (3), щавелевой (4), малоновой (5), янтарной (6 и 7), яблочной (8) и лимонной (9) кислот были синтезированы с высоким выходом взаимодействием ТЕА с соответствующей кислотой в спиртовой среде [20]. В данном исследовании трис(2-гидроксиэтил)аммониевая соль яблочной кислоты [NH(CH2CH2OH)3]2(O2CCH(OH)CH2CO2) впервые была выделена в виде кристаллов для изучения конформации катиона методом монокристальной рентгеновской дифракции. Ранее нами впервые установлена редкая эндо-экзо-конформация катиона в соли сукцината трис(2-гидроксиэтил)аммония (6) и эндо-конформация (трициклическая) катиона в солях гидрооксалата, гидромалоната и гидросукцината трис(2-гидроксиэтил)аммония (4, 5 и 7) [18]. Малат трис(2-гидроксиэтил)аммония (8) является ближайшим структурным аналогом солей 6 и 7, поэтому представляет определенный фундаментальный научный интерес – исследовать влияние заместителя (OH-группа) на образование эндо-экзо-конформации трис(2-гидроксиэтил)аммониевого катиона. Следует отметить, что в отличие от соли 6, протатран 8 имеет более низкую температуру плавления (41°С), что значительно осложняет процесс выращивания кристаллов.
Рис. 2.
Протонные ионные жидкости 1–9 на основе трис(2-гидроксиэтил)аммониевых солей карбоновых кислот.
Структура 8 содержит два кристаллографически неэквивалентных катиона трис(2-гидроксиэтил)аммония и один анион яблочной кислоты (рис. 3а). Следует отметить, что каждая группа СН2, связанная с атомом N в катионах, неупорядочена по двум кристаллографически неэквивалентным позициям с общим фактором заселенности атомных позиций (SOF), равным 1. Разупорядоченность малат-аниона вызвана вращением молекулы вокруг псевдооси второго порядка и приводит к наличию двух неэквивалентных позиций для OH-группы с суммарным SOF, равным 1. Повышение симметрии показывает возможную пр. гр. P21/n, но она не может быть реализована из-за неравномерной неупорядоченности различных групп молекулы. Уточнение структуры 8 в пр. гр. P21 или P21/n приводит к значительному увеличению значений R и других параметров.
Рис. 3.
Молекулярная структура протатрана 8 со схемой нумерации атомов (а) и кристаллическая структура 8 вдоль оси а (б). Пунктирные линии указывают на водородные связи.
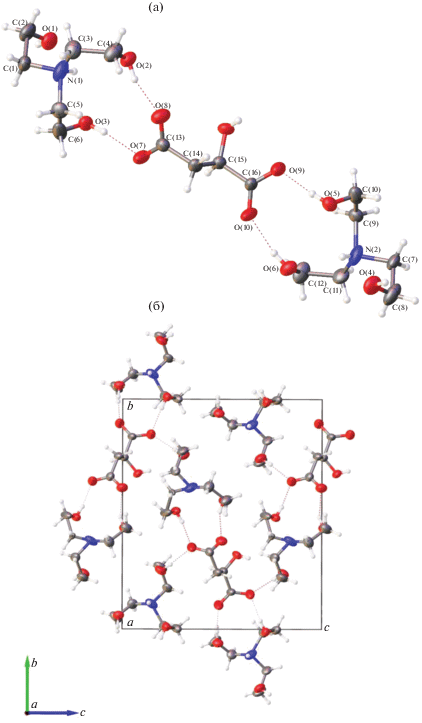
В отличие от сукцината трис(2-гидроксиэтил)аммония (соль 6), катионы в соли 8 характеризуются трициклической эндо-конформацией: три атома кислорода гидроксиэтильных групп окружают аммонийный атом водорода HN с образованием трех внутримолекулярных водородных связей. На рис. 4 представлены две возможные конформации трис(2-гидроксиэтил)аммониевого катиона − трициклическая эндо- (соль 8) и бициклическая эндо-экзо-конформации (соль 6). Геометрические параметры (длина связей, валентные и торсионные углы) в трис(2-гидроксиэтил)аммониевых катионах соли 8 очень близки к соответствующим значениям в других трис(2-гидроксиэтил)аммониевых солях с эндо-конформацией катиона. В сукцинате трис(2-гидроксиэтил)аммония (рис. S1 ) катионы формируют колонки, внутри которых катионы выстроены в цепи, образуя водородные связи между NH-группой одного катиона и OH-группой экзо-ветви соседнего катиона [18]. В случае соли 8 образование катионных цепей внутри колонок не наблюдается (рис. 3б). Катионы выстроены в колонки вдоль оси а, которые связаны с соседними катионными колонками только через водородные связи с атомами кислорода СOO-групп малат-аниона. Атомы кислорода O(7) и O(9) карбоксилатных групп аниона образуют две водородные связи с гидроксильными группами двух разных катионов (O(7)···O(3)–H, O(7)···O(4)–H и O(9)···O(1)–H, O(9)···O(5)–H). При этом атомы кислорода O(8) и O(10) двух COO-групп образуют единственную водородную связь с OH-группой катиона (O(8)···O(2)–H и O(10)···O(6)–H). Геометрические параметры водородных связей в структурах 6 и 8 представлены в табл. 1.
Рис. 4.
Трициклическая (эндо-) и бициклическая (эндо-экзо-) конформации катионов трис(2-гидроксиэтил)аммония в солях 8 (а) и 6 (б).
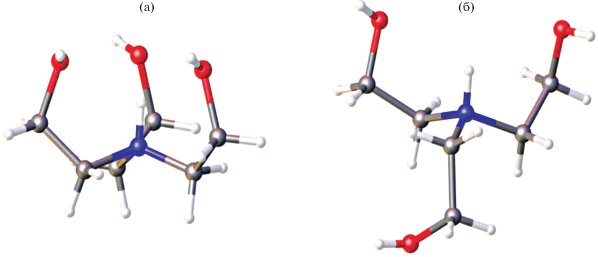
Таблица 1.
Геометрические параметры водородных связей в солях 6 и 8
| D–H···A | D–H, Å | H···A, Å | D···A, Å | ∠D–H···A, град |
|---|---|---|---|---|
| 6 [18] (нумерация атомов указана на рис. S1 ) |
||||
| O(1)–H···O(4) | 0.84 | 1.81 | 2.644(2) | 171.7 |
| O(2)–H···O(5) | 0.84 | 1.87 | 2.698(1) | 168.1 |
| O(3)–H···O(7) | 0.84 | 1.80 | 2.641(2) | 175.8 |
| O(6)–H···O(10) | 0.84 | 1.79 | 2.627(2) | 177.5 |
| O(8)–H···O(7) | 0.84 | 1.85 | 2.688(2) | 174.3 |
| O(9)–H···O(4) | 0.93 | 1.86 | 2.692(1) | 174.5 |
| N(11)–H···O(2) | 0.93 | 2.08 | 2.882(2) | 143.9 |
| N(12)–H···O(6) | 0.84 | 1.99 | 2.818(2) | 146.7 |
| 8 | ||||
| O(2)–H···O(8) | 0.82 | 1.92 | 2.668(5) | 151.0 |
| O(3)–H···O(7) | 0.82 | 1.85 | 2.661(6) | 172.1 |
| O(4)–H···O(7) | 0.82 | 1.86 | 2.670(7) | 169.3 |
| O(6)–H···O(10) | 0.82 | 1.83 | 2.633(6) | 167.2 |
| O(5)–H···O(9) | 0.82 | 1.87 | 2.674(5) | 167.3 |
| O(1)–H···O(9) | 0.82 | 1.93 | 2.738(7) | 167.5 |
Методом комплексного термического анализа в температурном интервале 40–650°С исследована термическая устойчивость протатрана 8. Плавление образца наступает после 40°С, на кривой ДСК проявляется небольшой эндотермический эффект с максимумом при 41°С. Начало термической деструкции соли 8 наступает после 124°С. В температурном интервале 124–258°С на кривых ионного тока наблюдаются пики выделения воды и углекислого газа, потери массы составляют 51.89%. В интервале температур 258–555°С на кривой ДСК наблюдается небольшой экзотермический эффект с максимумом при 376°С и более заметный при 455°С, продолжается активное выделение воды и углекислого газа. Потери массы на данном температурном интервале составляют 45.08%. В интервале температур 555–590°С заметен небольшой экзотермический эффект с максимумом при 579°С, наблюдаются пики выделения углекислого газа без заметных пиков выделения воды. После 590°С на кривой ТГ происходит увеличение массы на 7.58%, что, вероятно, связано с процессом окисления образца кислородом воздуха.
Таким образом, протатран 8 с температурой плавления 41°С и температурой начала деструкции 124°С можно отнести к классу протонных ионных жидкостей. Если сравнить термическую устойчивость соли 8 с другими трис(2-гидроксиэтил)аммониевыми солями двухосновных кислот [14], то процесс плавления соли 8 наступает значительно раньше солей щавелевой, малоновой и янтарной кислот 4–7 (tпл = 70–85°С). При этом температура начала деструкции солей 4–8 изменяется незначительно и варьируется в интервале 122–151°С.
Для изучения влияния протатранов 1–9 на ростовые характеристики семян кресс-салата сорта “Ажур” (Lepidium sativum L.) были приготовлены растворы солей 1–9 в концентрациях 0.03, 0.003 и 0.0003 мг/л. Исследования были проведены в трех сериях, результаты представлены в табл. S1 . Полученные результаты свидетельствуют, что соединения 3, 4, 6–9 во всех исследуемых концентрациях не оказывают достоверного влияния на посевные характеристики семян кресс-салата, за исключением значимого ингибирующего действия вещества 3 (0.03 мг/л) на длину корней проростков и вещества 9 (0.0003 мг/л) на длину их ростков. При воздействии протатрана 7 можно отметить слабую тенденцию к стимуляции роста проростков при концентрациях 0.003 и 0.0003 мг/л и роста корней, но только при концентрации 0.03 мг/л. Слабое положительное влияние на рост корней наблюдалось также в варианте с обработкой семян протатраном 9. Под влиянием соли 4 отмечалась тенденция к увеличению энергии прорастания и всхожести семян кресс-салата.
Положительное влияние на показатели прорастания семян и роста проростков было обнаружено в случае протатранов 1, 2 и 5. При этом достоверные изменения значений показателей при 5%-ном уровне значимости отмечаются преимущественно только в отношении длины корней под воздействием указанных соединений, а также энергии прорастания только в варианте обработки семян растворами протатрана коричной кислоты 1 в концентрациях 0.03 и 0.003 мг/л (табл. S1 ). Следует отметить слабую тенденцию усиления роста ростков под влиянием растворов протатранов 1 (0.03 и 0.003 мг/л), 2 (0.003 мг/л) и 5 (0.03 мг/л).
Таким образом, среди исследованных протатанов 1–9 выявлены соединения (1, 2 и 5), оказывающие положительное влияние на прорастание семян и ростовые характеристики проростков кресс-салата. Наибольшее комплексное положительное влияние на оцениваемые показатели прорастания семян и роста проростков оказал протатран коричной кислоты (1) в концентрациях 0.03 и 0.003 мг/л. Протатраны салициловой 3 (0.03 мг/л) и лимонной 9 (0.0003 мг/л) кислот проявили значимое ингибирующее действие на длину корней и ростков проростков соответственно. Следует отметить, что корни проростков сильнее реагировали на обработку растворами протатранов. Стимуляция роста корней как результат воздействия исследуемых соединений благоприятно влияет на развитие растений, так как хорошая корневая система на ранних стадиях развития организма способствует повышению его конкурентоспособности и выживаемости в среде обитания.
Противомикробную активность протатранов 1–9 исследовали по отношению к бактериям Escherichia coli, Staphylococcus aureus, Mycobacterium smegmatis, грибам Candida albicans и Aspergillus niger, результаты исследований представлены в табл. 2. Практически все исследованные соединения проявили заметную активность по отношению к бактерии Staphylococcus aureus (золотистый стафилококк). Наиболее высокую активность показал протатран 9 (МИК = 12.5 мкг/мл). Эффективность синтезированных протатранов 1, 5, 7–9 с МИК < 25 мкг/мл по отношению к Staphylococcus aureus сравнима с активностью комплексов 2-(1'/2'-гидроксинафтил)бензоксазола [30], антибиотика цефалексина и его координационных соединений [31]. Соли 6 и 9 также проявили активность к бактерии Mycobacterium smegmatis. Однако все исследованные соединения показали низкое антифунгицидное действие по отношению к штаммам грибов Candida albicans и Aspergillus niger.
Таблица 2.
Результаты биологического тестирования протатранов 1–9
| Соединение | Минимальная ингибирующая концентрация (МИК), мкг/мл | ||||
|---|---|---|---|---|---|
| E. coli | S. aureus | M. smegmatis | C. albicans | A. niger | |
| 1 | >100 | 25 | >100 | >100 | >100 |
| 2 | >100 | 50 | >100 | >100 | 100 |
| 3 | >100 | 50 | 100 | >100 | >100 |
| 4 | 100 | 100 | >100 | >100 | >100 |
| 5 | >100 | 25 | >100 | >100 | >100 |
| 6 | >100 | 100 | 25 | 100 | 100 |
| 7 | >100 | 25 | >100 | >100 | >100 |
| 8 | >100 | 25 | >100 | >100 | >100 |
| 9 | >100 | 12.5 | 12.5 | 100 | >100 |
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что природа аниона оказывает существенное влияние на конформацию трис(2-гидроксиэтил)аммониевого катиона, а также на физико-химические свойства трис(2-гидроксиэтил)аммониевых солей. В частности, трис(2-гидроксиэтил)аммониевые катионы в солях близких по структуре кислот – янтарной (6) и яблочной (8) ‒ характеризуются двумя различными конформациями: бициклической (эндо-экзо-конформация, соль 6) и трициклической (эндо-конформация, соль 8). Вероятно, такое различие связано с разным характером водородных связей в данных солях, а именно с отсутствием межмолекулярных взаимодействий между аммонийной группой и OH-группой гидроксиэтильной ветви соседних катионов в соли 8 по сравнению с солью 6. Результаты исследования биологической активности синтезированных протонных ионных жидкостей 1–9 отражают перспективы для более широкого изучения спектра противомикробного действия внутрикомплексных соединений гидроксиалкиламинов, а также возможности их эффективного использования в сельском хозяйстве для регуляции процессов роста и развития основных сельскохозяйственных культур.
Список литературы
Welch R.M., Graham R.D. // J. Exp. Bot. 2004. V. 55(396). P. 353. https://doi.org/10.1093/jxb/erh064
Simoglou K.B., Dordas C. // Crop Protection. 2006. V. 25. P. 657. https://doi.org/10.1016/j.cropro.2005.09.007
Деградация сельскохозяйственных земель России и меры по ее предотвращению // Современное сельскохозяйственное землепользование в России: состояние, проблемы и перспективы / Под ред. Романенко Г.А. М., 2007. С. 87.
Voronkov M.G., Rasulov M.M. // Pharm. Chem. J. 2007. V. 41. P. 1. [Воронков М.Г., Расулов М.М. // ХФЖ. 2007. Т. 41. № 1. С. 3.] https://doi.org/10.1007/s11094-007-0001-x
Voronkov M.G., Sofronov G.A., Starchenko D.A. et al. // Dokl. Biol. Sci. 2009. V. 428. P. 398. [Воронков М.Г., Софронов Г.А., Старченко Д.А. и др. // Докл. АН. 2009. Т. 428. С. 125.] https://doi.org/10.1134/S0012496609050020
Voronkov M.G., Baryshok V.P. // Pharm. Chem. J. 2004. V. 38. P. 3. [Воронков М.Г., Барышок В.П. // ХФЖ. 2004. Т. 38. С. 5.]
Воронков М.Г., Барышок В.П. Силатраны в медицине и сельском хозяйстве. Новосибирск: СО РАН, 2005. 257 с.
Voronkov M.G., Baryshok V.P. // Herald Russ. Acad. Sci. 2010. V. 80. P. 514. [Воронков М.Г., Барышок В.П. // Вестн. РАН. 2010. Т. 80. С. 985.] https://doi.org/10.1134/S1019331610060079
Список пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. М., 2004. 575 с.
Острошенко В.В., Острошенко Л.Ю., Острошенко В.Ю. // Вестник КрасГАУ. 2015. Т. 5. С. 184.
Shmakov V.N., Konstantinov Y.M., Kuznetsova G.A., Voronkov M.G. // Dokl. Biol. Sci. 2006. V. 410. P. 414. [Шмаков В.Н., Константинов Ю.М., Кузнецова Г.А., Воронков М.Г. // Докл. АН. 2006. Т. 410. С. 716.] https://doi.org/10.1134/S0012496606050206
Привалова Е.А., Тигунцева Н.П., Адамович С.Н. и др. // Вестник ИрГТУ. 2015. Т. 11(106). С. 136.
Petrovic Z.D., Comic L., Stefanovic O. et al. // J. Mol. Liq. 2012. V. 170. P. 61. https://doi.org/10.1016/j.molliq.2012.03.009
Kondratenko Yu.A., Nyanikova G.G., Molchanova K.V., Kochina T.A. // Glass Phys. Chem. 2017. V. 43. P. 445. [Кондратенко Ю.А., Няникова Г.Г., Молчанова К.В., Кочина Т.А. // Физ. и хим. стекла. 2017. Т. 43. С. 496.] https://doi.org/10.1134/S108765961705008X
Gruzdev M.S., Shmukler L.E., Kudryakova N.O. et al. // J. Mol. Liq. 2018. V. 249. P. 825. https://doi.org/10.1016/j.molliq.2017.11.127
Gruzdev M.S., Shmukler L.E., Kudryakova N.O. et al. // J. Mol. Liq. 2017. V. 242. P. 838. https://doi.org/10.1016/j.molliq.2017.07.078
Agafonov A.V., Grishina E.P. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1641. https://doi.org/10.1134/S0036023619130023
Fundamensky V.S., Kochina T.A., Kondratenko Y.A. et al. // J. Mol. Liq. 2017. V. 230. P. 113. https://doi.org/10.1016/j.molliq.2016.12.111
Kondratenko Y., Kochina T., Fundamensky V. et al. // J. Mol. Liq. 2016. V. 221. P. 1218. https://doi.org/10.1016/j.molliq.2016.06.085
Kondratenko Yu.A., Kochina T.A., Fundamensky V.S., Vlasov Yu.G. // Russ. J. Gen. Chem. 2015. V. 85. P. 2710. [Кондратенко Ю.А., Кочина Т.А., Фундаменский В.С., Власов Ю.Г. // ЖОХ. 2015. Т. 85. С. 1978.]. https://doi.org/10.1134/S1070363215120075
Gottlieb H.E., Kotlyar V., Nudelman A. // J. Org. Chem. 1997. V. 62 (21). P. 7512. https://doi.org/10.1021/jo971176v
CrysAlisPro, Rigaku Oxford Diffraction, 2015. Version 1.171.38.46.
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Crystallogr. 2015. V. A71. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 2015. V. C71. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. М., 1985. 58 с.
Hartmann H.T., Kester D.E., Davies F.T., Geneve R.L. Plant propagation: Principles and Practices. Prentice-Hall, Englewood Cliffs NJ, 1997.
Методические рекомендации 2.1.7.2297-07, Обоснование класса опасности отходов производства и потребления по фитотоксичности. М., 2007.
ISTA, International Rules for Seed Testing, 2016. https://doi.org/10.15258/istarules.2016
Kumar A., Kumar D. // Arkivoc. 2007. V. 7. P. 117. https://doi.org/10.3998/ark.5550190.0008.e12
Anacona J., Pineda Y., Bravo A., Camus J. // Med. Chem. (Los Angeles). 2016. V. 6. P. 467. https://doi.org/10.4172/2161-0444.1000385
Дополнительные материалы
- скачать EMS.docx
- Рис. S1. Молекулярная структура протатрана 6 со схемой нумерации атомов (а) и кристаллическая структура 6 вдоль оси b (б) Пунктирные линии указывают на водородные связи
Таблица S1. Влияние протатранов 1-9 на посевные свойства семян кресс-салата сорта Ажур (Lepidium sativum L.) и ростовые характеристики его проростков.
Инструменты
Журнал неорганической химии


