Журнал неорганической химии, 2020, T. 65, № 9, стр. 1248-1255
Особенности исследования фазовых равновесий в системе NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–NH4Cl–H2O при 25°C оптимизированным методом сечений
Н. С. Кистанова a, *, С. А. Мазунин a
a Пермский государственный национальный исследовательский университет
614990 Пермь, ул. Букирева, 15, Россия
* E-mail: natalya.kistanova@gmail.com
Поступила в редакцию 13.02.2020
После доработки 07.04.2020
Принята к публикации 27.04.2020
Аннотация
Исследованы фазовые равновесия в пятикомпонентной водно-солевой системе NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–NH4Cl–H2O и ограняющих ее системах при 25°С оптимизированным методом сечений. Показана эффективность алгоритма прогнозирования составов эвтонических растворов в системе. Описана методология планирования и экспериментального исследования нон-, моно-, ди- и тривариантных равновесий оптимизированным методом сечений. Исследованная система относится к простому эвтоническому типу, эвтонический раствор в ней насыщен исходными солевыми компонентами. Изучены линии моновариантного равновесия и поверхности совместной кристаллизации солей. По экспериментальным данным построена фазовая диаграмма системы и ее проекция на солевое основание. На солевой проекции системы обозначены границы областей кристаллизации одной, двух, трех и четырех солей.
ВВЕДЕНИЕ
Интерес к исследованию фазовых равновесий в водно-солевых системах связан с необходимостью решения различных прикладных задач. Фазовая диаграмма многокомпонентной системы является основой для комплексной переработки высокоминерализованных рассолов природного [1–3] и техногенного происхождения [4–6], разработки способов получения формиатов щелочных, щелочноземельных [7–9], переходных и редкоземельных металлов [10], производства неорганических солей и удобрений с использованием аминов [11], определения основных технологических параметров проведения процесса карбонизации [12].
Экспериментальные данные, лежащие в основе построения диаграмм состояния четырех- и более компонентных систем, могут быть получены аналитическим методом. В этом случае состав жидких и твердых фаз определяют методами аналитической химии, графоаналитическим методом сечений [13–18] и комбинированным способом [19]. Особенность метода сечений заключается в возможности установления состава равновесных твердых фаз без их изоляции от жидкой фазы на всех границах фазовых областей. Исследование сечений определенных направлений (оптимизированный метод сечений) позволяет определять составы на границах фазовых областей без потери точности в системах любой компонентности [20, 21]. С увеличением числа компонентов в системе возрастает и ее сложность. Предложен ряд приемов, методов планирования и прогнозирования составов равновесных фаз, позволяющих значительно уменьшить трудоемкость и время исследования фазовых равновесий в пяти- и более компонентных системах [22].
Апробацию оптимизированного метода сечений проводили при исследовании системы NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–NH4Cl–H2O при 25°C. Все соли, составляющие систему, широко применяются в качестве компонентов жидких удобрений и могут быть интересны для определения условий их совместной кристаллизации. В литературе приведены данные по растворимости в трехкомпонентных системах [23–25], в ограняющих четырехкомпонентных системах (NH4)2HPO4–NH4Cl–(NH4)2SO4–H2O [20], NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–H2O [25] и NH4H2PO4–(NH4)2HPO4–NH4Cl–H2O [19] и установлены составы эвтонических растворов. Пятикомпонентная система изучена авторами впервые.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
По данным о растворимости в ограняющих четырех- и трехкомпонентных системах рассчитана предполагаемая структура фазовой диаграммы системы NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–NH4Cl–H2O. Алгоритм прогнозирования состава четырехкратно насыщенного раствора в системе NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–NH4Cl–H2O при 25°C описан в работе [22]. Состав жидкой фазы, находящейся в нонвариантном равновесии с твердыми фазами, в ограняющей системе NH4H2 PO4–(NH4)2SO4–NH4Cl–H2O вычисляли по методике, описанной в работе [20]. Геометрическим образом пятикомпонентной системы является пентатоп, в вершинах которого располагаются исходные компоненты. Для визуализации методики изучения и представления экспериментальных данных использовали проекцию системы на солевое основание и ее изображение в произвольных координатах.
В работе применяли гидрофосфат, дигидрофосфат и хлорид аммония квалификации “х. ч.”, сульфат аммония квалификации “ч.” (дополнительно очищали перекристаллизацией из воды), дистиллированную воду ($n_{D}^{{25}}$ = 1.3325). Смеси компонентов готовили на аналитических весах ВСЛ-200/0.1А с точностью ±0.001 г. Температуру поддерживали при помощи ультратермостата с погрешностью ±0.2°C. Установление равновесия в исходной смеси компонентов контролировали по показателю преломления жидкой фазы с погрешностью ±2 × 10−4 единиц на рефрактометре ИРФ-454 Б2М. Растворимость солей в воде и содержание солей в растворе определяли с точностью 0.5 мас. %.
Исследование фазовых равновесий в пятикомпонентной водно-солевой системе NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–NH4Cl–H2O при 25°C проводили оптимизированным методом сечений. Сечения были выбраны таким образом, чтобы на функциональной зависимости показателя преломления жидкой фазы от состава исходной смеси компонентов одна из ветвей проходила параллельно оси состава. В этом случае точка излома на функциональной зависимости, отвечающая составу на границе фазовых областей, определяется наиболее точно. Составы смесей в сечениях получали двумя или тремя взвешиваниями, время установления равновесия в гетерогенных смесях не превышало 1–2 сут.
Составы жидкой и твердых фаз, находящихся в нонвариантном равновесии, устанавливали оптимизированным методом сечений без их выделения и анализа физико-химическими методами. Для этого с помощью сечений оптимальных направлений на каждой границе нонвариантной области экспериментально определяли по два–три состава. В каждой точке состава qi рассчитывали отношение соли, отсутствующей в донной фазе на этой грани, к воде. Равенство коэффициентов ci в точках составов qi на рассматриваемой грани нонвариантной области служило критерием наличия компонента в составе равновесных эвтоническому раствору твердых фаз (табл. 1). Отличие в третьем знаке коэффициентов ci обусловлено погрешностью определения состава qi на границе фазовой области и положением точки состава qi на предельной ноде относительно состава эвтоники. Оптимальным значением по времени установления равновесия и отбору жидкой фазы для анализа является содержание твердой фазы в исходных смесях компонентов 10–30 мас. %.
Таблица 1.
Экспериментальные составы (qi) на гранях нонвариантной области системы NH4H2PO4 (A)–(NH4)2HPO4 (B)–NH4Cl (C)–(NH4)2SO4 (D)–H2O и вычисленный по ним состав нонвариантного раствора EABCD
| Состав исходных смесей, мас. % | Граница | $\frac{{\{ {\text{A}}\} }}{{\{ {{{\text{H}}}_{{\text{2}}}}{\text{O}}\} }}$ | $\frac{{\{ {\text{B}}\} }}{{\{ {{{\text{H}}}_{{\text{2}}}}{\text{O}}\} }}$ | $\frac{{\{ {\text{C}}\} }}{{\{ {{{\text{H}}}_{{\text{2}}}}{\text{O}}\} }}$ | $\frac{{\{ {\text{D}}\} }}{{\{ {{{\text{H}}}_{{\text{2}}}}{\text{O}}\} }}$ | ||||
|---|---|---|---|---|---|---|---|---|---|
| A | B | C | D | H2O | |||||
| 11.32 | 21.65 | 8.83 | 18.20 | 40.00 | bdcEABCD | 0.283 | |||
| 11.33 | 22.77 | 9.38 | 16.52 | 40.00 | То же | 0.283 | |||
| 17.59 | 15.38 | 8.83 | 18.20 | 40.00 | adcEABCD | 0.385 | |||
| 18.55 | 15.55 | 9.38 | 16.52 | 40.00 | То же | 0.389 | |||
| 16.34 | 19.67 | 6.77 | 17.87 | 39.34 | abdEABCD | 0.172 | |||
| 15.79 | 19.99 | 6.72 | 17.50 | 40.00 | То же | 0.168 | |||
| 13.90 | 18.39 | 9.13 | 15.65 | 42.93 | abcEABCD | 0.365 | |||
| 15.79 | 19.99 | 9.70 | 14.52 | 40.00 | То же | 0.363 | |||
| Среднее значение ci | |||||||||
| 12.85 | 17.55 | 7.72 | 16.51 | 45.38 | $E_{{{\text{ABCD}}}}^{*}$ | 0.283 | 0.387 | 0.170 | 0.364 |
Составы на гранях нонвариантной области устанавливали экспериментально с помощью разрезов двух типов: изогидрического с постоянным содержанием воды и разреза раствор + соль, направленного из вершины фигуры состава в точку состава раствора.
Изогидрические разрезы, предложенные Н.Б. Воскобойниковым [26] для установления границ нонвариантной области, применимы к системам любой сложности и компонентности. В пятикомпонентной системе границами нонвариантной области являются гиперплоскости. В трехмерном пространстве в сечении изогидрического разреза ABCD нонвариантной области находится тетраэдр abcd (рис. 1a). Составы qi на границах нонвариантной области определяли с помощью трех изогидрических разрезов и двух разрезов раствор + соль. На рис. 1б показаны два изогидрических разреза (I и II) и разрез раствор Р + соль, направленный в вершину хлорида аммония.
Рис. 1.
Перспективная проекция сечения ABCD изогидрического разреза (40 мас. %) на солевое основание системы NH4H2PO4 (А)–(NH4)2HPO4 (B)–NH4Cl(C)–(NH4)2SO4 (D)–H2O (a, b, c, d — вершины нонвариантной области разреза): a – структура сечения; б – составы на гранях нонвариантной области abc, abd (сечение P направлено в вершину сульфата аммония, сечение I с постоянным содержанием солей NH4H2PO4 и (NH4)2HPO4) и acd, bcd (сечение II с постоянным содержанием солей (NH4)2SO4 и NH4Cl).
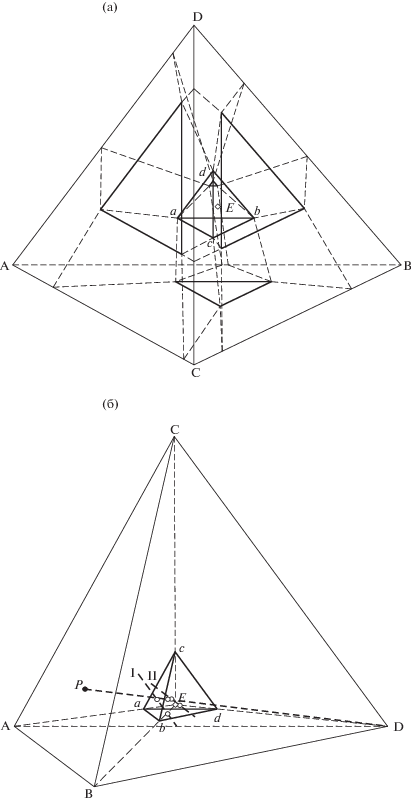
Направления изогидрических разрезов характеризуются постоянством содержания в них двух солей. Исходные смеси компонентов в сечении I готовили добавлением к раствору солей гидро- и дигидрофосфата аммония (20.84% NH4H2PO4, 26.38% (NH4)2HPO4, 59.68% H2O) твердых солей хлорида и сульфата аммония. В сечениях II и III составы исходных смесей компонентов готовили, добавляя к раствору хлорида и сульфата аммония (раствор II: 13.17% NH4Cl, 27.15% (NH4)2SO4, 59.68% H2O, раствор III: 14.23% NH4Cl, 25.07% (NH4)2SO4, 60.70% H2O) твердые гидро- и дигидрофосфаты аммония.
Определение точки состава на границе нонвариантной области с помощью разреза раствор + + соль возможно в том случае, если проекция состава эвтонического раствора из вершины солевого компонента на противолежащую грань фигуры состава находится в гомогенной части системы. С помощью разреза, направленного в вершину хлорида аммония из точки состава P, отвечающего раствору трех солей (17.53% NH4H2PO4, 21.10% (NH4)2HPO4, 19.17% (NH4)2SO4, 42.20% H2O), получен состав на границе нонвариантной области EABCD–NH4H2PO4 (A)–(NH4)2HPO4 (B)–(NH4)2SO4 (D). Изучение разреза, направленного в вершину сульфата аммония из точки состава раствора (16.47% NH4H2PO4, 21.81% (NH4)2HPO4, 10.83% (NH4)2SO4, 50.89% H2O), позволило установить состав на границе EABCD–NH4H2PO4 (A)–(NH4)2HPO4 (B)–NH4Cl (C).
Составы жидких фаз, находящихся в моновариантном равновесии с соответствующими твердыми фазами, планировали следующим образом. На линии, соединяющей составы четырехкратно насыщенного раствора и эвтонического раствора ограняющей четырехкомпонентной системы, рассчитывали желаемое количество точек. Через каждую вычисленную точку состава проводили разрез, в сечении которого находится тетраэдр, образованный тремя солевыми компонентами, насыщающими предполагаемый состав жидкой фазы, и раствором четвертой соли в воде. Нонвариантные точки в сечениях-тетраэдрах соответствуют составам на линиях моновариантного равновесия (e' и e", табл. 2) в пятикомпонентной системе. Состав жидкой фазы, находящейся в нонвариантном равновесии с твердыми фазами, в сечении-тетраэдре определяли оптимизированным методом сечений аналогично четырехкомпонентным системам.
Таблица 2.
Экспериментальные составы (qi) на гранях нонвариантной области в сечениях-тетраэдрах системы NH4H2PO4 (A)–(NH4)2HPO4 (B)–NH4Cl (C)–(NH4)2SO4 (D)–H2O
| Состав исходных смесей, мас. % | Граница | ||||
|---|---|---|---|---|---|
| A | B | C | D | H2O | |
| Разрез NH4H2PO4–(NH4)2HPO4–NH4Cl–$S_{{\text{D}}}^{'}$ (19.38%-ный раствор (NH4)2SO4) | |||||
| 15.55 | 20.77 | 8.51 | 10.69 | 44.48 | A–$e_{{{\text{ABC}}}}^{'}$–B |
| 19.10 | 18.01 | 11.96 | 9.87 | 41.06 | A–$e_{{{\text{ABC}}}}^{'}$–C |
| 21.10 | 17.90 | 10.00 | 9.88 | 41.12 | То же |
| 12.94 | 26.06 | 10.00 | 9.88 | 41.12 | B–$e_{{{\text{ABC}}}}^{'}$–C |
| 13.13 | 23.98 | 11.96 | 9.87 | 41.06 | То же |
| Разрез NH4H2PO4–(NH4)2HPO4–NH4Cl–$S_{{\text{D}}}^{{''}}$ (10.63%-ный раствор (NH4)2SO4) | |||||
| 18.48 | 23.89 | 10.60 | 5.00 | 42.03 | A–$e_{{{\text{ABC}}}}^{{''}}$–B |
| 19.76 | 24.98 | 10.03 | 4.80 | 40.43 | То же |
| 23.71 | 18.29 | 13.00 | 4.78 | 40.22 | A–$e_{{{\text{ABC}}}}^{{''}}$–C |
| 25.63 | 18.37 | 11.00 | 4.78 | 40.22 | То же |
| 13.23 | 28.77 | 13.00 | 4.78 | 40.22 | B–$e_{{{\text{ABC}}}}^{{''}}$–C |
| 13.40 | 30.60 | 11.00 | 4.78 | 40.22 | То же |
| Разрез NH4H2PO4 (A)–NH4Cl (C)–(NH4)2SO4 (D)–$S_{{\text{B}}}^{'}$ (15.36%-ный раствор (NH4)2HPO4) | |||||
| 11.13 | 8.70 | 10.75 | 21.46 | 47.96 | A–$e_{{{\text{ACD}}}}^{'}$–D |
| 14.24 | 8.62 | 10.41 | 19.24 | 47.49 | A–$e_{{{\text{ACD}}}}^{'}$–C |
| 17.36 | 7.99 | 12.50 | 18.14 | 44.01 | То же |
| 9.97 | 8.62 | 10.41 | 23.51 | 47.49 | C–$e_{{{\text{ACD}}}}^{'}$–D |
| 9.08 | 7.99 | 12.50 | 26.42 | 44.01 | То же |
| Разрез NH4H2PO4 (A)–NH4Cl (C)–(NH4)2SO4 (D)–$S_{{\text{B}}}^{{''}}$ (9.18%-ный раствор (NH4)2HPO4) | |||||
| 10.64 | 4.90 | 11,47 | 24.47 | 48.52 | A–$e_{{{\text{ACD}}}}^{{''}}$–D |
| 8.81 | 5.26 | 12,33 | 21.57 | 52.03 | То же |
| 6.47 | 4.41 | 13,00 | 32.53 | 43.59 | C–$e_{{{\text{ACD}}}}^{{''}}$–D |
| 6.44 | 4.41 | 19,76 | 25.80 | 43.59 | То же |
| 19.00 | 4.41 | 13,00 | 20.00 | 43.59 | A–$e_{{{\text{ACD}}}}^{{''}}$–C |
| 12.00 | 4.41 | 20,18 | 19.82 | 43.59 | То же |
| Разрез (NH4)2HPO4 (B)–NH4Cl (C)–(NH4)2SO4 (D)–$S_{{\text{A}}}^{'}$ (11.16%-ный раствор NH4H2PO4) | |||||
| 5.92 | 15.84 | 11.68 | 19.42 | 47.14 | B–$e_{{{\text{BCD}}}}^{'}$–C |
| 5.69 | 12.45 | 15.55 | 21.00 | 45.31 | С–$e_{{{\text{BCD}}}}^{'}$–D |
| 5.92 | 15.84 | 9.17 | 21.95 | 47.12 | B–$e_{{{\text{BCD}}}}^{'}$–D |
| 5.69 | 19.51 | 8.49 | 21.00 | 45.31 | То же |
| Разрез (NH4)2HPO4 (B)–NH4Cl (C)–(NH4)2SO4 (D)–$S_{{\text{A}}}^{{''}}$ (5.85%-ный раствор NH4H2PO4) | |||||
| 3.03 | 13.95 | 13.08 | 21.22 | 48.72 | B–$e_{{{\text{BCD}}}}^{{''}}$–C |
| 3.01 | 13.89 | 11.16 | 23.45 | 48.49 | B–$e_{{{\text{BCD}}}}^{{''}}$–D |
| 2.91 | 15.25 | 10.61 | 24.47 | 46.76 | То же |
| 2.81 | 10.49 | 18.43 | 23.03 | 45.24 | C–$e_{{{\text{BCD}}}}^{{''}}$–D |
| 2.69 | 9.98 | 16.27 | 27.74 | 43.32 | То же |
| Разрез NH4H2PO4 (A)–(NH4)2HPO4 (B)–(NH4)2SO4 (D)–$S_{{\text{C}}}^{'}$ (8.94%-ный раствор NH4Cl) | |||||
| 16.09 | 19.96 | 4.01 | 19.04 | 40.90 | A–$e_{{{\text{ABD}}}}^{'}$–B |
| 15.60 | 18.32 | 3.85 | 23.00 | 39.23 | A–$e_{{{\text{ABD}}}}^{'}$–D |
| 19.99 | 18.22 | 3.83 | 18.93 | 39.03 | То же |
| 13.99 | 19.93 | 3.85 | 23.00 | 39.23 | B–$e_{{{\text{ABD}}}}^{'}$–D |
| 13.99 | 24.22 | 3.83 | 18.93 | 39.03 | То же |
Составы, отвечающие дивариантному равновесию в пятикомпонентной системе NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–NH4Cl–H2O, образуют поверхность совместной кристаллизации двух солей. В сечениях-тетраэдрах эти составы располагаются на линиях двойного насыщения и изучены с помощью разреза, проходящего через точку на ребре тетраэдра и две вершины, отвечающие исходным солевым компонентам. Точки составов на поверхностях кристаллизации компонентов в сечении-тетраэдре образуют гиперповерхности кристаллизации компонентов в исходной пятикомпонентной системе. Составы, отвечающие тривариантному равновесию, изучены в сечении-тетраэдре с помощью разрезов раствор + соль, направленных из вершины соли, поверхность которой изучается, на противолежащую грань тетраэдра.
Границы нонвариантной области определяют структуру фазовых областей системы, число и характер взаимодействия всех твердых фаз, образующихся в системе. В исследовании моно-, ди- и тривариантных равновесий составы твердых фаз, находящихся в нонвариантном равновесии с жидкой фазой, в первичных и вторичных разрезах системы дополнительно не подтверждали.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оптимизированным методом сечений изучены ограняющие трех- и четырехкомпонентные системы. В каждой трехкомпонентной системе составы твердых фаз, находящихся в нонвариантном равновесии с жидкой фазой, подтверждены комбинированным методом. Получены дополнительные данные о составах на линиях моновариантного равновесия в системах NH4H2PO4–(NH4)2HPO4–H2O и (NH4)2SO4–NH4Cl–H2O. Оптимизированным методом сечений уточнены составы эвтонических растворов в системах NH4H2PO4–(NH4)2SO4–H2O и (NH4)2SO4–NH4Cl–H2O. Все системы простого эвтонического типа, в которых эвтонический раствор насыщен исходными солевыми компонентами.
Установлены составы жидкой и твердых фаз, находящихся в нонвариантном равновесии, в системах NH4H2PO4–(NH4)2HPO4–NH4Cl–H2O и NH4H2PO4–(NH4)2SO4–NH4Cl–H2O оптимизированным методом сечений, в системе NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–H2O состав эвтонического раствора подтвержден комбинированным способом (табл. 3).
Таблица 3.
Экспериментальные составы насыщенных растворов при 25°C в системе NH4H2PO4 (A)–(NH4)2HPO4 (B)–NH4Cl (C)–(NH4)2SO4 (D)–H2O
| Точка | Состав насыщенного раствора, мас. % | Донная фаза | ||||
|---|---|---|---|---|---|---|
| A | B | C | D | H2O | ||
| RA | 29.14 | ‒ | ‒ | ‒ | 70.86 | A |
| 28.88 | 6.53 | ‒ | ‒ | 64.59 | » | |
| 28.13 | 14.79 | ‒ | ‒ | 57.08 | » | |
| 27.31 | 23.09 | ‒ | ‒ | 49.60 | » | |
| EAB | 26.95 | 32.67 | ‒ | ‒ | 40.38 | A + B |
| 13.07 | 36.48 | ‒ | ‒ | 50.45 | B | |
| 5.42 | 38.87 | ‒ | ‒ | 55.71 | » | |
| RB | ‒ | 40.85 | ‒ | ‒ | 59.15 | » |
| 24.46 | ‒ | ‒ | 6.34 | 69.20 | A | |
| 19.78 | ‒ | ‒ | 13.32 | 66.90 | » | |
| 16.12 | ‒ | ‒ | 21.25 | 62.63 | » | |
| 12.47 | ‒ | ‒ | 29.49 | 58.04 | » | |
| EAD | 9.15 | ‒ | ‒ | 38.46 | 52.39 | A + D |
| 6.97 | ‒ | ‒ | 39.19 | 53.84 | D | |
| 2.88 | ‒ | ‒ | 41.32 | 55.80 | » | |
| RD | ‒ | ‒ | ‒ | 43.21 | 56.79 | » |
| RC | ‒ | ‒ | 28.44 | ‒ | 71.56 | C |
| ‒ | ‒ | 27.20 | 2.88 | 69.92 | » | |
| ‒ | ‒ | 24.16 | 9.12 | 66.72 | » | |
| ‒ | ‒ | 21.03 | 15.88 | 63.09 | » | |
| ‒ | ‒ | 17.98 | 22.60 | 59.42 | » | |
| ECD | ‒ | ‒ | 16.15 | 26.27 | 57.58 | C + D |
| ‒ | ‒ | 10.62 | 32.19 | 57.19 | D | |
| ‒ | ‒ | 4.43 | 38.50 | 57.07 | » | |
| EABD | 18.05 | 21.43 | ‒ | 20.01 | 40.51 | A + B + D |
| EABC | 17.24 | 24.03 | 11.79 | ‒ | 46.95 | A + B + C |
| EACD | 5.54 | ‒ | 14.67 | 25.08 | 54.71 | A + C + D |
| EABCD | 12.85 | 17.55 | 7.72 | 16.51 | 45.38 | A + B + C + D |
| $e_{{{\text{BCD}}}}^{'}$ | 6.27 | 13.72 | 9.53 | 20.56 | 49.92 | B + C + D |
| $e_{{{\text{BCD}}}}^{{''}}$ | 3.17 | 11.81 | 11.68 | 22.25 | 51.09 | » |
| $e_{{{\text{ABC}}}}^{'}$ | 14.51 | 19.99 | 8.75 | 11.00 | 45.75 | A + B + C |
| $e_{{{\text{ABC}}}}^{{''}}$ | 15.36 | 21.14 | 11.60 | 5.52 | 46.38 | » |
| $e_{{{\text{ACD}}}}^{'}$ | 10.29 | 8.97 | 11.08 | 20.21 | 49.45 | A + C + D |
| $e_{{{\text{ACD}}}}^{{''}}$ | 7.62 | 5.20 | 12.18 | 23.51 | 51.48 | » |
| $e_{{{\text{ABD}}}}^{'}$ | 14.97 | 19.55 | 4.11 | 19.50 | 41.87 | A + B + D |
| $e_{{{\text{AD}}}}^{'}$ | 8.30 | ‒ | 5.20 | 33.54 | 52.96 | A + D |
| $e_{{{\text{AD}}}}^{{''}}$ | 11.53 | 9.81 | 4.67 | 26.38 | 47.61 | » |
| $e_{{{\text{AB}}}}^{'}$ | 22.95 | 30.25 | 4.18 | ‒ | 42.62 | A + B |
| $e_{{{\text{AB}}}}^{{''}}$ | 18.86 | 24.66 | 4.17 | 9.82 | 42.49 | » |
| $e_{{{\text{BD}}}}^{'}$ | ‒ | 12.89 | 5.11 | 29.98 | 52.02 | B + D |
| $e_{{{\text{BD}}}}^{{''}}$ | 7.43 | 16.01 | 4.64 | 24.62 | 47.30 | » |
| 20.63 | 8.89 | 6.30 | ‒ | 64.18 | A | |
| 22.46 | 17.73 | 5.35 | ‒ | 54.46 | » | |
| 14.41 | ‒ | 6.75 | 10.09 | 68.75 | » | |
| 11.61 | ‒ | 6.09 | 20.21 | 62.08 | » | |
| 10.37 | 30.84 | 5.26 | ‒ | 53.53 | B | |
| ‒ | 21.17 | 5.70 | 15.13 | 58.01 | » | |
| ‒ | 7.50 | 5.31 | 33.08 | 54.11 | D | |
| 4.21 | ‒ | 5.42 | 35.14 | 55.23 | » | |
В пятикомпонентной системе границами нонвариантной области являются гиперплоскости, задаваемые точками составов эвтонического раствора EABCD и безводных солевых компонентов. С помощью изогидрического разреза и разрезов раствор + соли определены составы на каждой грани нонвариантной области. Содержание воды (40.00 мас. %) в изогидрическом разрезе рассчитывали по составу спрогнозированного эвтонического раствора (мас. %): 14.66 NH4H2PO4, 18.69 (NH4)2HPO4, 5.68 NH4Cl, 16.18 (NH4)2SO4, 44.79 H2O [22]. С помощью разрезов раствор + + соли определены составы на гранях NH4H2 PO4–(NH4)2HPO4–NH4Cl–EABCD и NH4H2PO4–(NH4)2HPO4–(NH4)2SO4–EABCD, так как проекции эвтоники EABCD из вершин сульфата и хлорида аммония соответственно на грани NH4H2PO4–(NH4)2HPO4–NH4Cl–H2O и NH4H2 PO4–(NH4)2HPO4–(NH4)2SO4–H2O при 25°C находятся в гомогенной области системы.
Составы трехкратно насыщенных растворов (e' и e") установлены оптимизированным методом сечений. Для этого в каждом разрезе-тетраэдре, в одной из вершин которого находится раствор соли, определены составы (qi) на границах нонвариантной области (табл. 2). Изучено семь разрезов-тетраэдров. В каждом разрезе определены составы на линиях двойного насыщения и на поверхностях кристаллизации сульфата, гидрофосфата и дигидрофосфата аммония. Экспериментальные данные по фазовым равновесиям в пятикомпонентной системе приведены в табл. 3.
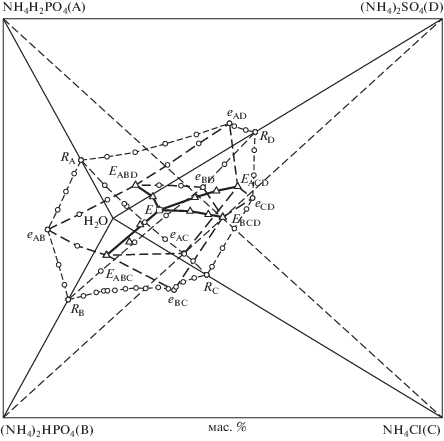
Пятикомпонентная водно-солевая система NH4H2PO4 (A)–(NH4)2HPO4 (B)–NH4Cl (C)–(NH4)2SO4 (D)–H2O при 25°C относится к простому эвтоническому типу. На перспективной проекции изогидрического разреза системы (40 мас. %) обозначены нонвариантная область, поля совместной кристаллизации трех солей, области совместной кристаллизации двух солей и объемы кристаллизации индивидуальных солевых компонентов (рис. 1a). На рис. 2 представлена проекция пятикомпонентной системы в виде произвольной фигуры на плоскости. Составы точек соответствуют: Ri – растворимости i-компонента; eij – составам двух-, Eijk – трех- и E – четырехкратно насыщенных растворов. Изображение системы в виде произвольной проекции позволяет увидеть “дерево” линий моновариантных равновесий, образующих контуры поверхностей начала кристаллизации одной, двух, трех и четырех солей.
Рис. 2.
Фазовая диаграмма системы NH4H2PO4 (A)–(NH4)2HPO4 (B)–NH4Cl(C)–(NH4)2SO4 (D)–H2O при 25°С. Составы точек соответствуют: Ri – растворимости i-компонента; eij – составам двух-, Eijk – трех- и E – четырехкратно насыщенных растворов.
Исследование фазовых равновесий в пятикомпонентной системе NH4H2PO4–(NH4)2HPO4–NH4Cl–(NH4)2SO4–H2O при 25°C подтвердило эффективность разработанных методов прогнозирования составов нонвариантных растворов, планирования и экспериментального исследования нон-, моно-, ди- и тривариантных равновесий. В системах с бóльшим числом компонентов и более сложным процессом фазообразования предложенные методы будут особенно эффективны.
Список литературы
Gao Y.-Y., Li X.-P., He X.-F., Sang S.-H. // J. Chem. Eng. Data. 2018. V. 63. № 12. P. 4497. https://doi.org/10.1021/acs.jced.8b00596
Yu X., Zeng Y., Guo S. et al. // J. Chem. Eng. Data. 2016. V. 61. № 3. P. 1246. https://doi.org/10.1021/acs.jced.5b00888
Wang R., Zeng Y. // J. Chem. Eng. Data. 2014. V. 59. № 3. P. 903. https://doi.org/10.1021/je4010867
Cao J., Ren Y., Zhu Q. et al. // J. Chem. Eng. Data. 2019. V. 64. № 3. P. 1209. https://doi.org/10.1021/acs.jced.8b01110
Ren M., Dang Y., Fei D. et al. // J. Chem. Eng. Data. 2018. V. 63. № 5. P. 1435. https://doi.org/10.1021/acs.jced.7b01015
Zhang Y., Xu H., Zhang Y. et al. // J. Chem. Eng. Data. 2013. V. 58. № 4. P. 1050. https://doi.org/10.1021/je400049m
Gordenchuk A.D., Kudryashova O.S. // Russ. J. Inorg. Chem. 2017. V. 62. № 8. P. 1099. https://doi.org/10.7868/S0044457X17080128
Кудряшова О.С., Матвеева К.Р., Бабченко Н.А., Глушанкова И.С. // Башкирский хим. журнал. 2012. Т. 19. № 3. С. 29.
Елохов А.М., Лукманова Л.М., Кудряшова О.С. // Журн. физ. химии. 2019. Т. 93. № 3. С. 358.
Elokhov A.M., Subbotina Y.R., Kudryashova O.S. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1092. https://doi.org/10.1134/S0044457X18080056
Mazunin S.A., Chechulin V.L. // Russ. J. Appl. Chem. 2010. V. 83. № 9. P. 1690. https://doi.org/10.1134/S1070427210090375
Мазунин С.А., Панасенко В.А., Зубарев М.П. // Вестн. Пермск. ун-та. Сер. Химия. 2011. Т. 2. № 2. С. 19.
Журавлев Е.Ф., Шевелева А.Д. // Журн. неорган. химии. 1960. Т. 5. № 11. С. 2630.
Кудряшова О.С., Елохов А.М. // Вестн. Пермск. ун-та. Сер. Химия. 2019. Т. 9. № 4. С. 320. https://doi.org/10.17072/2223-1838-2019-4-320-330
Ильин К.К., Черкасов Д.Г. // Изв. Сарат. ун-та. Сер. Химия. Биология. Экология. 2008. Т. 8. № 1. С. 20.
Kudryashova O.S., Kataev A.V., Malinina L.N. // Russ. J. Inorg. Chem. 2015. V. 60. № 3. P. 355. https://doi.org/10.7868/S0044457X15030125
Станкова А.Д., Елохов А.М., Катаева Д.А. // Вестн. Южно-Уральск. ун-та. Сер. Химия. 2018. Т. 10. № 3. https://doi.org/10.14529/chem180304
Елохов А.М., Леснов А.Е., Кудряшова О.С., Денисова С.А. // Вестн. Пермск. ун-та. Сер. Химия. 2014. Т. 14. № 2. С. 130.
Кистанова Н.С., Мазунин С.А., Фролова С.И., Блинов А.С. // Вестн. Тамбовск. техн. ун-та. 2010. Т. 16. № 4. С. 863.
Чеснокова С.А., Кистанова Н.С. // Вестн. Пермск. ун-та. Сер. Химия. 2012. Т. 6. № 2. С. 55.
Елсуков А.В., Мазунин С.А., Колясникова О.И. // Вестн. Пермск. ун-та. Сер. Химия. 2015. Т. 18. № 2. С. 39.
Mazunin S.A., Noskov M.N., Elsukov A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 539. https://doi.org/10.1134/S0036023617050163
Коган В.Б., Огородников С.К., Кафаров В.В. Справочник по растворимости. Т. 3. Кн. 2. М.-Л.: Изд-во АН СССР, 1962.
Справочник по растворимости солевых систем: в 4 т. Т. 1. Трехкомпонентные системы / Под ред. Здановского А.Б. и др. Л.-М.: ГХИ, 1953.
Вольфкович С.И., Берлин Л.Е., Манцев Б.М. // Журн. прикл. химии. 1932. Т. 5. № 1. С. 1.
Воскобойников Н.Б. // Журн. неорган. химии. 1982. Т. 27. № 10. С. 2634.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


