Журнал неорганической химии, 2020, T. 65, № 8, стр. 1019-1026
Влияние методов синтеза на фотокаталитические и сорбционные свойства полититанатов калия, допированных ионами двух- и трехвалентных металлов
Н. А. Морозов a, *, О. Ю. Синельщикова a, Н. В. Беспрозванных a, Т. П. Масленникова a
a Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
* E-mail: nikita.andreevich.morozov@yandex.ru
Поступила в редакцию 03.02.2020
После доработки 19.03.2020
Принята к публикации 27.03.2020
Аннотация
Изложены результаты физико-химического исследования материалов, полученных в системах K2O–MO(M2O3)–TiO2 (M = Ni, Mg, Al, Fe, Cr) методами пиролиза цитратно-нитратных композиций и соосаждения с последующей гидротермальной обработкой. Показано, что в гидротермальных условиях формируются наночастицы, обладающие высокой сорбционной емкостью в отношении модельного красителя (метиленового голубого), но при этом не проявляющие заметной фотокаталитической активности. Применение цитратно-нитратного метода для синтеза нанопорошков позволяет получить материалы со значительно меньшей сорбционной емкостью, но с большей фотокаталитической активностью. Выполнены спектральные исследования для оценки ширины запрещенной зоны синтезированных образцов. На основании проведенного исследования определены оптимальные составы для получения сорбентов и фотокатализаторов в указанных системах.
ВВЕДЕНИЕ
В последние несколько десятилетий исследованию различных форм титанатных наноматериалов посвящено большое количество работ. Эти материалы в зависимости от состава и структуры могут применяться в различных областях: энергетической, где предложено их использовать в литий-ионных и солнечных батареях; экологической для очистки воды и воздуха с применением сорбционных, фильтрационных и фотокаталитических процессов, в специальных покрытиях – фотохромных, обладающих контролируемой смачиваемостью, и фрикционных материалах [1–3]. Непосредственно оксид титана является наиболее изученным и востребованным фотокатализатором разложения органических загрязнителей. Ширина запрещенной зоны TiO2 такова (3 эВ – рутила, 3.2 эВ – анатаза и 3.3 эВ – брукита), что в результате облучения ультрафиолетовым светом в нем происходит возбуждение электронно-дырочных пар. Этот процесс используется в солнечных элементах и различных фотокаталитических реакциях [4–8]. Однако поглощаемое оксидом титана излучение составляет всего 4–5% спектра солнечного света, поэтому основной задачей проводимых в настоящее время исследований является обеспечение поглощения в его видимой области. Этого можно достичь либо путем соответствующего смещения края поглощения, что характерно для сложных оксидов титана, либо путем сенсибилизации TiO2 поверхностными добавками [9–12]. Одним из ключевых критериев, влияющих на каталитическую, фотокаталитическую и сорбционную активность материалов в гетерогенных процессах является размер и морфология частиц. Получение соединений в наноразмерном состоянии позволяет в десятки раз увеличить их удельную поверхность [13–15], а также в фотокаталитических реакциях снизить вероятность электрон-дырочной рекомбинации [1, 5, 16].
Проведенные авторами [17–20] исследования показали, что сложные слоистые полититанаты калия (ПТК) с общей формулой K2TinO2n+ 1 проявляют высокие сорбционные и фотокаталитические свойства. Данные соединения благодаря своей структуре, представленной титан-кислородными полианионами и компенсирующими заряд катионами, расположенными в межслойном пространстве, обладают способностью к ионному обмену как с неорганическими, так и с органическими ионами. При этом, изменяя условия получения и модифицируя состав, можно получать наночастицы ПТК различной морфологии. Установлено, что атомы в плотноупакованных материалах, таких как нанопроволока, образуют трехмерную сеть октаэдров TiO6. В то время как полые материалы, например нанотрубки, образуют свитки из гофрированных слоев октаэдров TiO6, расположенных друг относительно друга на расстоянии ~10 Å [21, 22]. Это явление приводит к существенному различию сорбционных свойств наноматериалов на основе ПТК различной морфологии и состава [1, 23, 24]. Авторами [20, 25] было показано, что аморфный ПТК с разной степенью протонирования, подвергнутый модифицированию путем интеркаляции ионами переходных металлов, проявляет сорбционную емкость по отношению к метиленовому голубому (МГ) от 16.7 до 51.1 мг/г. Поскольку в разных литературных источниках используется разная начальная концентрация, а также сорбционная емкость различных наноматериалов на основе ПТК изменяется в достаточно больших пределах, эффективность фотокаталитической активности можно сравнить по скорости деградации с кинетической моделью псевдопервого порядка, описываемой следующим уравнением:
где С0 – концентрация красителя в растворе после достижения адсорбционного равновесия в темноте, мг/л; Сτ – концентрация красителя в растворе после экспонирования его на свету в присутствии фотокатализатора в течение отрезка времени τ, мг/л; k – константа скорости фотораспада молекул красителя, адсорбированных на поверхности частиц фотокатализатора, мин–1.Значение k при облучении светом видимого диапазона для различных материалов на основе ПТК варьируется в интервале от 2.5 × 10–3 до 15.9 × 10–3 мин–1, максимальное значение получено при модифицировании в растворе солей никеля [17, 25, 26]. При этом авторами [26] была отмечена меньшая эффективность фотокатализа допированных никелем наноматериалов в случае возбуждения ультрафиолетовым излучением.
В связи с этим интерес вызывает исследование сорбционных и фотокаталитических свойств наночастиц полититанатов калия, допированных различными катионами, в отношении органических красителей.
Получать наночастицы титанатов щелочных металлов можно различными способами: реакцией в расплаве солей [17, 24, 25], с использованием гидротермальной обработки [19, 27, 28], золь-гель методом, из алкоксидов металлов [18]. Одним из наиболее эффективных методов получения является гидротермальный метод синтеза, который выполняют в автоклавах, заполненных концентрированным раствором щелочи. В подавляющем количестве работ в качестве гидротермальной среды используется раствор NaOH [16]. При этом есть данные о том, что применение KOH в качестве щелочной среды может увеличить выход получаемых нанопорошков к исходной шихте практически до 100% [29].
Еще одним перспективным подходом к синтезу титанатов щелочных металлов, не применявшимся ранее для получения слоистых полититанатов калия, является метод пиролиза органосолевых композиций, позволяющий в ряде случаев за счет подбора соотношения восстановителя и окислителя в исходной композиции получaть хорошо закристаллизованные продукты, с достаточно развитой удельной поверхностью [30].
Задачей настоящего исследования являлось получение наноматериалов на основе полититанатов калия, допированных ионами двух- и трехвалентных металлов с использованием гидротермального и цитратно-нитратного методов синтеза, а также изучение сорбционных и фотокаталитических свойств этих наноматериалов по отношению к метиленовому голубому.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов осуществляли двумя способами: соосаждением из водных растворов солей с последующей гидротермальной обработкой (ГТО) и методом пиролиза цитратно-нитратных композиций (ЦНС).
В качестве реактивов для приготовления исходных растворов использовали: TiCl4 (“ос. ч.”), KNO3 (“ос. ч.”), Al(NO3)3 ⋅ 9H2O (“ос. ч.”), MgO (“ос. ч.”), MgSO4 ⋅ 7H2O (“х. ч.”), NiCl2 ⋅ 6H2O (“х. ч.”), Ni3(OH)4CO3 ⋅ 4H2O (“ч. д. а.”), Cr(NO3)3 ⋅ 9H2O (“ос. ч.”), Fe(NO3)3 ⋅ 9H2O (“ч. д. а.”), TiCl4 (“ос. ч.”). Раствор нитрата магния получали реакцией MgO с разбавленной HNO3 (“ос. ч.”), а никель при ЦНС вводили в виде раствора цитрата, полученного реакцией карбоната никеля основного с лимонной кислотой (C6H8O7 ⋅ H2O, “ос. ч.”).
Для получения исходных прекурсоров для ГТО проводили осаждение гидроксидов с помощью NH4OH (марки 23-5 “ос. ч.”) из смесей водных растворов тетрахлорида титана и солей допирующих элементов. Соотношения солей выбирали таким образом, чтобы содержание допирующего компонента составляло 2.5 мол. % в пересчете на соответствующие оксиды. В зависимости от модифицирующего металла полученные образцы обозначали ГТО-Al, ГТО-Fe, ГТО-Cr, ГТО-Mg и ГТО-Ni. Допирующие элементы были выбраны на основе ранее проведенных исследований, показавших изменение размеров и морфологии наночастиц при их введении [23]. Помимо этого модифицирование ПТК ионами железа, никеля и хрома способствует смещению края спектра поглощения в область видимого света [20, 25, 31]. Осаждение проводили при pH 9, после чего полученные осадки тщательно промывали от растворимых примесей дистиллированной водой и фильтровали до достижения отрицательной реакции на ионы хлора. Перед гидротермальной обработкой полученные составы высушивали при температуре 80°C в течение 3 ч и измельчали вручную в ступке. Соотношение воздушно-сухого порошка и 10 М водного раствора KOH составляло 1 г на 20 мл раствора, объем полученной суспензии выбирался таким образом, чтобы степень заполнения автоклава была равна 80% от его внутреннего объема. Образцы, полученные данным способом, подвергали гидротермальной обработке в течение 24 ч при температуре 180°C, давление в автоклаве составляло 10 МПа. После извлечения составы тщательно отмывали от остатков непрореагировавшей щелочи в дистиллированной воде до отрицательной реакции на фенолфталеин, затем сушили в термостате при температуре 100°C до полного высыхания.
Исходные смеси при использовании метода пиролиза цитратно-нитратных композиций получали по схеме, описанной в [30].
Соотношения металлов рассчитывали согласно стехиометрии K2M0.2Ti3.85O9 (M = Al, Fe, Cr) и K2M0.2Ti3.95O9 (M = Mg, Ni), что соответствовало соотношению оксидов 0.05 MO(M2O3) : 0.95 TiO2. В дальнейшем составы образцов в зависимости от допирующего металла обозначали ЦНС-Al, ЦНС-Fe, ЦНС-Cr, ЦНС-Mg, ЦНС-Ni. Необходимый объем лимонной кислоты определяли исходя из количества ионов азота в азотнокислых солях, входящих в состав смеси компонентов. Для полного восстановления азота, входящего в состав нитратов, необходимо чтобы выполнялось следующее соотношение:
где n – количество молей восстановителя на 1 моль продукта, а m – число окисляемых связей в одной молекуле органического вещества (для лимонной кислоты m = 20). Были приготовлены составы с количеством восстановителя, соответствующим расчетному, т.е. с условным соотношением восстановителя и окислителя – φ = 1.0.После растворения смеси в лимонной кислоте pH раствора доводили до 6.5 сильно разбавленным водным раствором аммиака, что приводило к образованию золя, который в процессе сушки при 80°C превращался в ксерогель. Порошки исследуемых титанатов были получены сжиганием и последующей термообработкой в муфельной печи в атмосфере воздуха при температуре 650°C в течение 1 ч.
Фазовый анализ образцов на различных стадиях синтеза проводили методом рентгенофазового анализа (РФА), который осуществляли на дифрактометре ДРОН-3М с использованием CuKα-излучения. Удельную площадь поверхности (Sуд) рассчитывали по методу Бранауэра–Эммета–Теллера (БЭТ) на основании изотерм низкотемпературной сорбции–десорбции азота (Quantachrome NOVA 1200e, США). Дегазацию осуществляли при температуре 300°С в течение 3 ч.
Исследования микроструктуры порошков выполняли с помощью сканирующей электронной микроскопии (СЭМ), совмещенной с микрорентгеноспектральным анализом (МРСА) (Tescan MIRA 3).
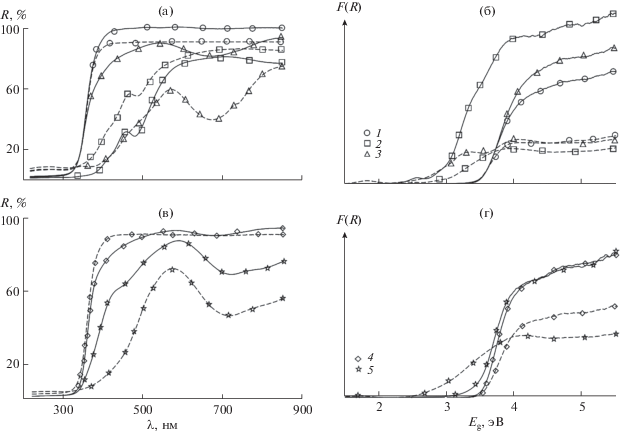
Определение ширины запрещенной зоны (Eg) синтезированных образцов проводили на основании спектров диффузного отражения, полученных с использованием УФ-спектрометра с интегрирующей сферой Shimadzu UV2600 в интервале длин волн 220–850 нм, а также рассчитанных на их основе спектров функции Кубелки–Мунка. Измерения осуществляли c использованием порошковых образцов и BaSO4 (“ч. д. а.”) в качестве эталона сравнения. Ширину запрещенной зоны Eg определяли экстраполяцией прямолинейных участков функции Кубелки–Мунка F(R) до пересечения с осью Е (энергия кванта света в эВ, E = = hc/λ):
где R – коэффициент диффузного отражения.Для изучения сорбционной и фотокаталитической активности полученных материалов в отношении органических красителей использовали MГ в качестве модельного. Исходный раствор красителя готовили, учитывая минимальное значение светопропускания, регистрируемого спектрофотометром ПЭ-5400 УФ. Для МГ концентрация исходного раствора была выбрана равной 210 мг/л.
Исходный раствор красителя отбирали пипеткой в объеме 5 мл и приливали в кварцевую кювету спектрофотометра, в которую предварительно насыпали 0.015 г исследуемого состава. Сразу после добавления исходного раствора кювету помещали в спектрофотометр и выполняли два экспериментальных измерения. В первом случае кювету оставляли в приборе, где проводилось измерение светопропускания конечного раствора каждые 2 с в течение 60 мин. Во втором случае конечный раствор облучали УФ-лампой ближнего УФ-спектра (тип 3, мощность 20 Вт) и выполняли серию измерений: 10 измерений каждые 30 с, 10 измерений каждую минуту и 10 измерений каждые 5 мин. Затем полученные данные по светопропусканию обрабатывали с учетом заранее построенных градуировочных графиков, при этом величина относительной погрешности ΔС/С0 составляла 0.15%.
Исходя из полученных данных рассчитывали сорбционную емкость (q, мг/г) по формуле:
где C0 – концентрация красителя в исходном растворе, мг/л; C – концентрация красителя после сорбции, мг/л; V – объем раствора красителя, в который помещен сорбент, л; m – масса сорбента, г. Итоговые данные представлены в табл. 1. Погрешность расчетов составляла от 1 до 3%.Таблица 1.
Текстурные и некоторые физико-химические свойства полученных материалов
| Состав образца | Количество метиленового синего, удаленного из водного раствора, в зависимости от массы образца, мг/г | Ширина запрещенной зоны, эВ | Удельная поверхность, м2/г |
Средний диаметр пор, нм | |
|---|---|---|---|---|---|
| за счет сорбции | за счет фотокатализа | ||||
| ГТО-TiO2 | 62.18 ± 0.43 | 63.34 ± 0.43 | 3.55 ± 0.06 | 278.99 ± 5.58 | 17.37 |
| ГТО-Al | 64.55 ± 0.45 | 65.49 ± 0.45 | 3.53 ± 0.06 | 272.49 ± 5.45 | 13.68 |
| ГТО-Fe | 63.50 ± 0.43 | 62.97 ± 0.43 | 2.72 ± 0.06 2.97 ± 0.06 |
278.79 ± 5.58 | 13.63 |
| ГТО-Cr | 40.83 ± 0.33 | 43.12 ± 0.30 | 3.56 ± 0.06 | 298.87 ± 5.98 | 3.52 |
| ГТО-Mg | 63.48 ± 0.44 | 62.86 ± 0.43 | 3.53 ± 0.06 | 284.18 ± 5.68 | 13.66 |
| ГТО-Ni | 63.89 ± 0.43 | 60.80 ± 0.42 | 3.46 ± 0.06 | 304.07 ± 6.08 | 11.26 |
| ЦНС-Al | 9.16 ± 0.19 | 16.40 ± 0.20 | 3.46 ± 0.06 | 6.30 ± 1.19 | – |
| ЦНС-Fe | 31.38 ± 0.27 | 36.91 ± 0.28 | 2.94 ± 0.06 | 13.21 ± 3.84 | – |
| ЦНС-Cr | 15.28 ± 0.20 | 20.78 ± 0.21 | 2.59 ± 0.06 3.00 ± 0.06 |
10.75 ± 2.04 | – |
| ЦНС-Mg | 13.32 ± 0.20 | 20.55 ± 0.22 | 3.56 ± 0.06 | 10.98 ± 2.06 | – |
| ЦНС-Ni | 5.27 ± 0.15 | 9.08 ± 0.18 | 2.78 ± 0.06 | 5.80 ± 1.10 | – |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
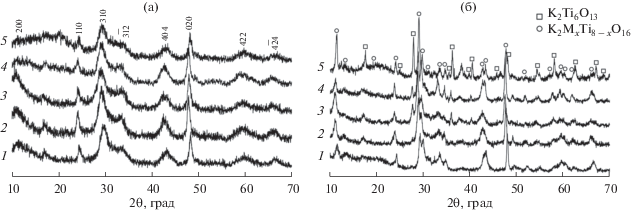
Порошки, полученные гидротермальной обработкой, согласно данным РФА и СЭМ, представляли собой наночастицы ПТК (рис. 1а, 2) [26]. При получении образцов цитратно-нитратным методом формировались двухфазные керамические материалы, содержащие кристаллические фазы со структурой типа голландита (K2MxTi8 –xO16) в смеси с K2Ti6O13 (рис. 1б).
Рис. 1.
Дифрактограммы образцов: ГТО-M (а), ЦНС-M (б), где M = Al (1), Fe (2), Cr (3), Mg (4) и Ni (5).
Одним из ключевых факторов, влияющих на эффективность использования материалов в сорбционных и каталитических процессах, является их удельная поверхность. Использование гидротермальной обработки позволило получить наночастицы различных размеров и морфологии (рис. 2) с высокоразвитой удельной поверхностью (Sуд ≈ 270–304 м2/г (табл. 1 и рис. S1 )). При этом в большинстве полученных составов после гидротермальной обработки формировались квазиодномерные наночастицы с внешним диаметром ~10–20 нм и средней длиной >700 нм (трубки, вискеры, проволоки), в то время как в образцах, содержащих хром, наблюдались плотноупакованные агломераты наночастиц пластинчатой формы. На основании микрорентгеноспектрального анализа установлено, что мольное соотношение образцов данной серии составило: [TiO2]/[K2O] ≈ 6.4–7.
Рис. 2.
Микрофотографии образцов ГТО-M, где M = Al (1), Fe (2), Cr (3), Mg (4), Ni (5) и TiO(OH)2 (6), синтезированных методом соосаждения с последующей гидротермальной обработкой в 10 М растворе KOH.

Применение пиролиза цитратно-нитратных композиций при синтезе приводило к формированию образцов со значительно меньшей удельной поверхностью, которая находилась в пределах от 5.8 до 13.2 м2/г.
Для всех составов, синтезированных гидротермальным методом, наблюдалось высокое значение сорбционной емкости МГ. При этом допирование наночастиц рассматриваемыми металлами, за исключением хрома, приводило к ее увеличению по сравнению с образцами, полученными из чистого осадка TiO(OH)2 (рис. 3). Данный факт связан с различием в их морфологии.
Рис. 3.
Кинетические кривые сорбции метиленового голубого образцами состава ГТО-M, где M = Al (1), Fe (2), Cr (3), Mg (4) и Ni (5) (сплошная линия), и гидроксида титана при гидротермальной обработке (пунктирная линия).
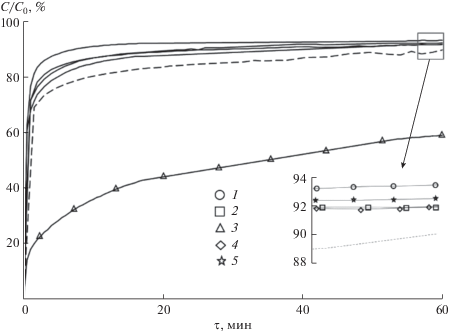
Следует отметить, что при облучении ультрафиолетовой лампой всех образцов, синтезированных с использованием гидротермальной обработки, не происходило существенного изменения концентрации красителя во времени по сравнению с кривыми, полученными без облучения. Данный эффект, возможно, проявлялся из-за большой адсорбции красителя на поверхности наночастиц, что препятствовало процессу облучения и образованию электрон-дырочных пар на поверхности. Поэтому можно говорить о сорбции как о лимитирующей стадии при использовании данных наночастиц и незначительной роли фотокатализа в обесцвечивании рассматриваемого раствора.
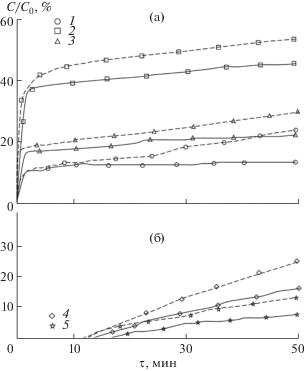
Для образцов, синтезированных цитратно-нитратным методом, наблюдались значительно меньшие величины сорбции красителя из раствора, что, вероятно, связано с большим размером частиц получившихся материалов и различием в их фазовом составе. Однако при облучении данных образцов УФ-лампой во всех случаях происходило уменьшение концентрации красителя в растворе по сравнению со значениями концентрации, полученными без облучения (рис. 4).
Рис. 4.
Кинетические кривые сорбции метиленового голубого образцами состава: а – ЦНС-Al (1), ЦНС-Fe (2) и ЦНС-Cr (3), б – ЦНС-Mg (4) и ЦНС-Ni (5), сплошная линия – необлученные растворы, пунктирная – облученные УФ-лампой.
Для составов, полученных гидротермальной обработкой, значение функции Кубелки–Мунка существенно больше, чем для синтезированных цитратно-нитратным методом, что объясняется меньшим размером получаемых частиц и, как следствие, уменьшением их рассеивающей способности (рис. 5). Следует отметить, что образование в электронной структуре получаемых соединений различных вариантов электронных переходов, смещенных в область видимого спектра, характерно для образцов с добавлением Fe (Eg = = 2.96 эВ), полученных обоими методами, и при введении Ni и Cr при цитратно-нитратном синтезе (Eg = 2.78 и 2.59 эВ соответственно). Для всех остальных составов значение ширины запрещенной зоны Eg ≈ 3.45 эВ, что характерно для недопированных наночастиц ПТК.
ЗАКЛЮЧЕНИЕ
Гидротермальной обработкой соосажденных гидроксидов получены наночастицы различной морфологии, допированные рядом двух- и трехвалентных металлов. Показано, что введение всех рассмотренных металлов, кроме хрома, приводит к небольшому, примерно на 1.5–2%, увеличению сорбционной емкости по сравнению с наночастицами, полученными из чистого осадка TiO(OH)2. Наибольшее значение q = 64.55 ± 0.45 мг/г продемонстрировал образец ГТО-Al. Показано, что применение цитратно-нитратного метода синтеза для получения порошков исследуемых систем приводит к формированию смеси полититанатов со структурой типа голландита и K2Ti6O13, которые проявляют фотокаталитическую активность в реакции разложения модельного красителя при облучении светом, включающим ближний ультрафиолет. В зависимости от состава образца фотовозбуждение вызывает увеличение значения ΔС/С0 на 5.5–10.5% за 1 ч экспонирования, что соответствует k ≈ 1.2–3.2 × 10–3 мин–1. Наибольшую фотокаталитическую активность проявил образец ЦНС-Fe, что может быть связано с его зонным строением (Eg = 2.96 эВ) и наибольшей величиной удельной поверхности среди составов данной серии.
Список литературы
Zhang Y., Jiang Z., Huang J. et al. // RSC Adv. 2015. V. 97. P. 79479. https://doi.org/10.1039/C5RA11298B
Opra D.P., Gnedenkov S.V., Sinebryukhov S.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 5. P. 680. [Опра Д.П., Гнеденков С.В., Синебрюхов С.Л. и др. // Журн. неорган. химии. 2019. Т. 64. № 5. С. 553. https://doi.org/10.1134/S0036023619050140]
Feng X., Diao X., Shi Y. et al. // Wear. 2006. V. 261. P. 1208. https://doi.org/10.1016/j.wear.2006.03.005
Banfield J.F., Veblen D.R., Smith J. // Am. Mineral. 1991. V. 76. № 3. P. 343. https://doi.org/0003-O04X/9 l/03044343$02.00
Chen X., Mao S.S. // Chem. Rev. 2007. V. 107. № 7. P. 2891. https://doi.org/10.1021/cr0500535
Bach U., Tachibana Y., Moser J.E. et al. // J. Am. Chem. Soc. 1999. V. 121. № 32. P. 7445. https://doi.org/10.1021/ja9915403
Park N.G., van de Lagemaat J., Frank A.J. // J. Phys. Chem. B. 2000. V. 104. P. 8989. https://doi.org/10.1021/jp994365l
Carp O., Huisman C.L., Reller A.W. // Prog. Solid State Chem. 2004. V. 32. № 1–2. P. 33. https://doi.org/10.1016/j.progsolidstchem.2004.08.001
Liu C., Sun T., Wu L. et al. // Appl. Catal., B. 2015. V. 170. P. 17. https://doi.org/10.1016/j.apcatb.2015.01.026
Wang X., Tang Y., Leiw M.Y. et al. // Appl. Catal., A. 2011. V. 409-410. P. 257. https://doi.org/10.1016/j.apcata.2011.10.011
Xu X.G., Ding X., Chen Q. et al. // Phys. Rev. B: Condens. Matter. 2006. V. 73. № 16. P. 165403. https://doi.org/10.1103/PhysRevB.73.165403
Здравков А.В., Горбунова М.А., Волкова А.В. и др. // ЖОХ. 2018. Т. 88. № 3. С. 502. [Zdravkov A.V., Gorbunova V.A., Volkova A.V. et al. // Russ. J. Gen. Chem. 2018. V. 88. N 3. P. 528. https://doi.org/10.1134/S1070363218030210]
Zlobin V.V., Krasilin A.A., Almjasheva O.V. // Nanosystems: Phys. Chem. Math. 2019. V. 10. № 6. P. 733. https://doi.org/10.17586/2220-8054-2019-10-6-733-739
Zherebtsov D.A., Kulikovskikh S.A., Viktorov V.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 165. [Жеребцов Д.А., Куликовских С.А., Викторов В.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 132.] https://doi.org/10.1134/S0036023619020220
Zakharova G.S., Fattakhova Z.A., Andreikov E.I. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 3. P. 283. [Захарова Г.С., Фаттахова З.А., Андрейков Е.И. и др. // Журн. неорган. химии. 2019. Т. 64. № 3. С. 229.]https://doi.org/10.1134/S0036023619030227
Bavykin V., Walsh F.C. // Eur. J. Inorg. Chem. 2009. V. 2009. № 8. P. 977. https://doi.org/10.1002/ejic.200801122
Wang Q., Zhang B., Lu X. et al. // Catal. Sci. Technol. 2018. V. 8. P. 6180. https://doi.org/10.1039/C8CY01684D
Garay-Rodríguez L.F., Torres-Martínez L.M. // J. Sol-Gel Sci. Technol. 2019. V. 91. P. 1. https://doi.org/10.1007/s10971-019-05138-5
Abdul Rahman N.R., Muniandy L., Adam F. et al. // J. Photochem. Photobiol., A. 2019. V. 375. P. 219. https://doi.org/10.1016/j.jphotochem.2019.02.020
Gorokhovsky A.V., Tretyachenko E.V., Vikulova M.A. et al. // Theor. Exp. Chem. 2013. V. 49. № 4. P. 224. [Гороховский А.В., Третьяченко Е.В., Викулова М.А. и др. // Теорет. и эксперим. химия. 2013. Т. 49. № 4. С. 211.]https://doi.org/10.1007/s11237-013-9319-5
Sasaki T., Kooli F., Iida M. et al. // Chem. Mater. 1998. V. 10. № 12. P. 4123. https://doi.org/10.1021/cm980535f
Pradhan S.K., Mao Y., Wong S.S. et al. // Chem. Mater. 2007. V. 19. № 25. P. 6180. https://doi.org/10.1021/cm7019069
Sinelshchikova O.Yu., Petrov S.A., Besprozvan-nykh N.V. et al. // J. Sol-Gel Sci. Technol. 2013. V. 68. № 3. P. 495. https://doi.org/10.1007/s10971-013-2988-7
Escobedo Bretado M.A., González Lozanoa M.A., Collins Martínez V. et al. // Int. J. Hydrogen Energy. 2019. V. 44. № 24. P. 12470. https://doi.org/10.1016/j.ijhydene.2018.06.085
Gorokhovsky A.V., Kosobudskii I.D., Tret’yachenko E.V. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 11. P. 1693. [Гороховский А.В., Кособудский И.Д., Третьяченко Е.В. и др. // Журн. неорган. химии. 2011. Т. 56. № 11. С. 1775.]https://doi.org/10.1134/S0036023611110088
Gorokhovsky A.V., Tret’yachenko E.V., Vikulova M.A. // Russ. J. Appl. Chem. 2013. V. 86. № 3. P. 343. [Гороховский А.В., Третьяченко Е.В., Викулова Д.С. и др. // ЖПХ 2013. Т. 86. № 3. P. 371.]https://doi.org/10.1134/S1070427213030099
Wang B.L., Chen Q., Wang R.H. et al. // Chem. Phys. Lett. 2003. V. 376. P. 726. https://doi.org/10.1016/S0009-2614(03)01068-6
Conceição D.S., Ferreira D.P., Graça C.A.L. et al. // Appl. Surf. Sci. 2017. V. 392. P. 418. https://doi.org/10.1016/j.apsusc.2016.09.067
Bavykin D.V., Cressey B., Light M. et al. // Nanotechnology. 2008. V. 19. № 27. P. 275604. https://doi.org/10.1088/0957-4484/19/27/275604
Sinelshchikova O.Y., Maslennikova T.P., Besprozvannykh N.V. et al. // Russ. J. Appl. Chem. 2019. V. 92. № 4. P. 549. [Синельщикова О.Ю., Масленникова Т.П., Беспрозванных Н.В. и др. // ЖПХ. 2019. Т. 92. № 4. С. 510.]https://doi.org/10.1134/S1070427219040116
Ковалева Д.С., Третьяченко Е.В., Гороховский А.В. и др. // Перспективные материалы. 2011. № 11. С. 462.
Дополнительные материалы
- скачать EMS_1.docx
- Рис. S1. (а) Изотерма сорбции/десорбции азота и (б) распределение пор по размерам для образцов, ГТО-Me, где Me = Al(1), Fe(2), Cr(3), Mg(4), Ni(5) и TiO(OH)2 (6).
Инструменты
Журнал неорганической химии