Журнал неорганической химии, 2020, T. 65, № 8, стр. 1105-1113
Соединения кобальта(II) и никеля(II) с 2-тиобарбитуровой кислотой
А. П. Лакеев a, *, Н. М. Коротченко a
a Национальный исследовательский Томский государственный университет
634050 Томск, пр-т Ленина, 36, Россия
* E-mail: lakeevs@mail.ru
Поступила в редакцию 03.02.2020
После доработки 05.04.2020
Принята к публикации 06.04.2020
Аннотация
Методами спектрофотометрии и pH-метрии при pH < 4, I = 0.1 (NaCl) и t = 20°C изучено комплексообразование в системах, содержащих хлориды кобальта(II) или никеля(II) и 2-тиобарбитуровую кислоту (C4H4N2O2S, H2L). Установлен состав протонированных комплексных частиц, определены их общие константы устойчивости (lg β11): [CoHL]+ (3.69 ± 0.04), [NiHL]+ (3.68 ± 0.08) и [M(HL)2]. Состав выделенных из исследуемых систем солей Co(C4H3N2O2S)2 · 4H2O и Ni(C4H3N2O2S)2 · 5H2O подтвержден различными физико-химическими методами; при I = 0.1 (NaCl) и t = 20°C рассчитаны их константы растворимости (lgKS): –12.82 ± 0.22 и –12.30 ± 0.10 соответственно. Разработанная спектрофотометрическая методика определения тиобарбитурат-иона в водных растворах, основанная на поглощении комплекса железа(III) [FeL]+, может быть рекомендована к использованию химиками-аналитиками и фармацевтами.
ВВЕДЕНИЕ
Тиобарбитуровая кислота (C4H4N2O2S, H2thioBar, H2L, 2-тиобарбитуровая кислота, малонилтиомочевина – производное барбитуровой кислоты) является родоначальником целого класса лекарственных препаратов – тиобарбитуратов, проявляющих выраженные седативные, анестезирующие, противосудорожные, антисклеротические и бактериостатические свойства. Наиболее известными из них являются тиопентал натрия, тиобарбитал, тиобутабарбитал, тиалбарбитал и метитурал [1, 2]. В практике экспериментальной и клинической фармакологии кислота находит широкое применение при определении малонового диальдегида [3], являющегося продуктом перекисного окисления липидов. Сотрудниками лаборатории биохимии и иммунологии больничного комплекса Сальпетриер (Париж, Франция) предложена методика колориметрического определения фосфогексозоизомеразы с тиобарбитуровой кислотой для оценки содержания фруктозы, образующейся в результате ферментативных процессов [4]. Специфические цветные реакции, которые дает тиобарбитуровая кислота, обусловливают ее использование в качестве аналитического реагента для обнаружения ионов металлов p- и d-семейства (Bi3+, Cu2+, Pd2+, Fe3+, Ru3+ и др.) [5]. Известно также применение тиобарбитуратных комплексов редкоземельных элементов в качестве прекурсоров при получении соответствующих оксидов, сульфидов, оксисульфидов и оксисульфатов [6–8], находящих широкое применение в электротехнической промышленности и материаловедении. Помимо этого комплексные соединения, содержащие анионы кислоты в качестве лигандов, обладают биологическими и фармакологическими свойствами. Установлено, что ее комплекс с оловом(IV) проявляет антибактериальную и противораковую активность [9], а смешанолигандные соли тиобарбитуровой и производных арилиденантраниловой кислот с кобальтом(II), никелем(II), медью(II) обладают антимикробной активностью [10].
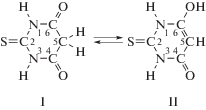
Для малонилтиомочевины возможно существование большого числа таутомерных структур, являющихся результатом кето-енольной или лактим-лактамной таутомерии. Такое разнообразие изомерных форм обусловлено наличием в ее молекуле трех подвижных атомов водорода (один метиленовой группы >CH2 и два имидных групп >NH) и трех потенциально способных к енолизации групп (две карбонильные >C=O и одна тионная >C=S). Однако в водных растворах преимущественно устанавливается равновесие между тионди- (I) и тионмонокарбонильным (II) таутомерами [5]:
Наличие электронодонорных атомов азота, кислорода и серы, входящих в состав вышеперечисленных функциональных групп, определяет способность кислоты выступать в роли моно- или бидентатного лиганда в процессах комплексообразования. Кислотные же свойства, выраженные сильнее, чем у барбитуровой и виолуровой кислот (по первой ступени диссоциации) [11–13], обусловлены атомами водорода гидроксильной –OH (с учетом возможной енолизации группы >C=O) и имидной >NH групп [5, 14] (формы I и II, положения 1 и 6).
В работе [15] методом pH-метрии при постоянной ионной силе I = 0.1 (NaClO4) и температурах 18, 31 и 42°C изучена термодинамика ступенчатого комплексообразования тиобарбитуровой кислоты с ионами Cu2+, Fe2+, Zn2+, Co2+, Ni2+ с образованием частиц [ML]0 и [ML2]2–. Анализ приведенных термодинамических характеристик (ΔG°, ΔH° и ΔS°; 31°C) указывает на определяющий вклад энтальпийного фактора. При этом отрицательные значения ΔG° свидетельствуют о самопроизвольном протекании реакций, а относительно невысокие величины ΔS° в совокупности с рядом рассуждений привели авторов к выводу, что в данном случае M2+ и H2thioBar выступают в роли мягких акцепторов и доноров соответственно. Это косвенно подтверждает участие в координации лиганда “мягкого” донорного атома серы [5]. Значения логарифмов ступенчатых констант устойчивости (æi) для Co2+ и Ni2+ (18°C) составляют 6.82 и 5.30; 6.22 и 4.45 соответственно. Авторами [16] приведены данные по общим константам устойчивости (β2) комплексов ионов Cu2+, Zn2+, Co2+, Ni2+ с малонилтиомочевиной, полученные методом спектрофотометрического титрования при pH 6, ионной силе 0.2% (г NaCl/100 мл раствора) и температуре 25°C. В случае Co2+ и Ni2+ логарифмы их значений равны 4.69 и 4.47 соответственно. При этом в работе [5] отмечается, что полученные константы относятся к эффективным, поскольку не учитывают возможное протонирование лиганда. Методами полярографии, амперометрического титрования и спектрофотометрии получены данные о составе комплексных частиц в системах M2+–H2thioBar (M = Cu, Ni) в интервале pH 3–10 [17]. Для никеля(II) установлено образование комплексов состава (M : L) 1 : 1, 1 : 2, 1 : 6 и 2 : 1 (значения констант устойчивости не приводятся). Комплексообразование между H2thioBar и ионами Co2+, Zn2+, Cd2+, Pb2+ полярографическим методом не зафиксировано.
Значительная часть работ посвящена синтезу, установлению строения и изучению свойств координационных соединений с малонилтиомочевиной; отмечается, что по структуре они являются супрамолекулярными [5]. Так, из водного раствора выделен [Co(HL)2] [18]; из этанольного – [Ni(H2L)2(HL)]Cl и [Co(H2L)2(HL)]Cl · H2O [19], а также [Co(H2O)2(H2L)4](CH3COO)2 · 2H2O [20]. Авторами [5, 21] на основании данных рентгеноструктурного анализа (РСА) и ИК-спектроскопии подробно описываются структуры внутрисферных комплексных солей кобальта(II), никеля(II), железа(II), кадмия состава M(H2O)2(HL)2, имеющих полимерное строение с октаэдрическим окружением M2+. Координация HL– осуществляется посредством донорных атомов кислорода и серы. Известен также внешнесферный тиобарбитурат никеля(II) – [Ni(H2O)6](HL)2 · 2H2O, который при извлечении из раствора быстро превращается во внутрисферную комплексную соль указанного выше состава [21].
Цель настоящей работы – определение условий образования протонированных комплексных частиц между 2-тиобарбитуровой кислотой и катионами Co2+ (d7, 0.089 нм) или Ni2+ (d8, 0.083 нм) в водном растворе с последующим установлением их состава и устойчивости, выделение из соответствующих систем солей и их физико-химический анализ. Выбор объектов исследования обусловлен биологической значимостью как рассматриваемых катионов-биометаллов, относящихся к важным микроэлементам, так и тиобарбитуровой кислоты, являющейся биолигандом экзогенного происхождения. Кроме того, указанные ионы имеют близкие электростатические характеристики, обусловливающие подобие химических свойств образуемых ими соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и оборудование. В качестве исходных реактивов без дополнительной очистки использовали 2-тиобарбитуровую кислоту марки “ч. д. а.” отечественного производства, гексагидраты хлоридов кобальта(II) и никеля(II) квалификации “х. ч.”. В рабочих растворах заданной концентрации поддерживали постоянную ионную силу I = = 0.1, создаваемую хлоридом натрия марки “х. ч.”, и температуру 20°C. Концентрацию кислоты уточняли потенциометрическим титрованием раствором щелочи, а солей соответствующих металлов – прямым трилонометрическим титрованием по известным методикам [22].
Спектрофотометрические измерения в УФ- и видимой областях проводили с применением спектрофотометра ПЭ-5400УФ компании “Экрос” в кварцевых кюветах толщиной 10 мм. Измерение pH – с использованием pH-метра-673 в концентрационной шкале, для чего стеклянный электрод предварительно калибровали по растворам (H, Na)Cl с различной концентрацией соляной кислоты при постоянной ионной силе I = 0.1. Синхронный термический анализ (СТА) малонилтиомочевины и ее солей проводили на приборе NETZSCH STA 449 F1 в токе воздуха при неизотермическом нагреве от 30 до 600°C со скоростью 10 град/мин в предварительно прокаленных тиглях из оксида алюминия. Масса навесок составляла ~5 мг. ИК-спектры в диапазоне 4000–400 см–1 записывали для твердых образцов в таблетках из KBr в режиме пропускания с применением ИК-Фурье-спектрометра Nicolet 6700 c алмазным анализатором. Расчет констант растворимости (KS) синтезированных солей, а также констант устойчивости комплексов (β11) осуществляли с учетом возможных процессов протонирования анионов лиганда и гидролиза катионов металла по первой ступени с использованием программ [23]. Подробные методики проведения экспериментов и расчетов представлены в [24].
Определение состава и устойчивости комплексных частиц. По данным спектрофотометрии и потенциометрического титрования раствором гидроксида натрия раствора тиобарбитуровой кислоты предварительно была установлена константа протонизации (I = 0.1, 20°C) ее однозарядного аниона (æ2): lg æ2 = 2.37 ± 0.06 и lg æ2 = 2.30 ± 0.01 соответственно [14]. При дальнейших расчетах использовали величину, определенную по результатам pH-метрии. Общие константы протонизации двухзарядного тиобарбитурат-аниона были взяты из [15] для 18°С (lgB1 = 10.55, lgB2 = = 12.85). Разница температур не учитывалась, поскольку была незначительной. При этом значение B2 включает в себя найденную нами экспериментально величину æ2 (lg B2 = lg B1 + lg æ2).
Состав комплексных частиц, образующихся в исследуемых двойных системах, устанавливали спектрофотометрическим методом молярных отношений, а также на основании анализа результатов расчета по pH-метрическим данным. Ход зависимости оптической плотности А от соотношения CL/CM (рис. 1, кривая насыщения в системе Ni2+–H2thioBar) указывает на присутствие в растворе (pH 2.7) комплексов состава 1 : 2 – [M(HthioBar)2]0 (аналогично для системы Co2+–H2thioBar). Вхождение протонированной формы лиганда в состав внутренней координационной сферы рассматриваемых комплексов представляется наиболее вероятным, поскольку, согласно диаграмме выхода равновесных частиц кислоты в зависимости от pH (рис. 2) при указанном значении кислотности раствора, доминирующей является форма HthioBarˉ.
Рис. 1.
Зависимость изменения оптической плотности ΔA (ΔA = Aкомплекса – AM) от соотношения ${{{{C}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{C}_{{\text{L}}}}} {{{C}_{{{\text{N}}{{{\text{i}}}^{{2 + }}}}}}}}} \right. \kern-0em} {{{C}_{{{\text{N}}{{{\text{i}}}^{{2 + }}}}}}}}$ (λэф = 395 нм, pH 2.7, I = 0.1 (NaCl), t = = 20°C).
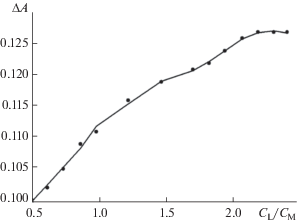
Рис. 2.
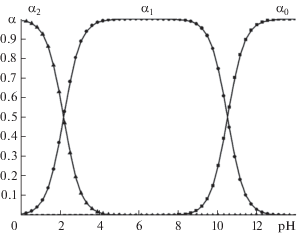
Диаграмма выхода равновесных частиц малонилтиомочевины в зависимости от pH водного раствора: α2 – H2thioBar, α1 – HthioBar–, α0 – thioBar2– (CL = 0.01 М, lgB1 = 10.55, lgB2 = 12.85; программа “Выход кислоты” [23]).
Общие константы устойчивости тиобарбитуратных комплексов определяли методом pH-метрии титрованием смеси соли кобальта(II) или никеля(II) с известной свободной кислотностью и тиобарбитуровой кислоты раствором предварительно стандартизированной бескарбонатной щелочи, содержащей фоновый электролит, при перемешивании очищенным азотом. Так, в интервале pH 2.3–3.3 по данным pH-метрии с использованием программы “Бьеррум 1” [23] рассчитаны константы устойчивости протонированных комплексов [MHthioBar]+. Значения β11, представленные в логарифмической форме, составляют 3.69 ± 0.04 и 3.68 ± 0.08 для кобальта(II) и никеля(II) соответственно. Необходимые экспериментальные данные, а также результаты расчета величин lgβ11 представлены в табл. 1 и 2.
Таблица 1.
Результаты расчета константы устойчивости комплекса [CoHthioBar]+ по данным pH-метрии ($V_{{\text{M}}}^{^\circ }$ = = $V_{{\text{L}}}^{^\circ }$ = 5.00 мл, $C_{{\text{L}}}^{^\circ }$ = 3.92 × 10–3 М, $С_{{\text{M}}}^{^\circ }$ = 5.67 × 10–3 М c СНCl = 0.01 М, CNaOH = 1.07 × 10–2 М, lgKh1 = –9.76, lg æ2 = 2.30, I = 0.1, t = 20°C); $\overline {\lg {{\beta }_{{11}}}} $ = 3.69 ± 0.04
| Vщ, мл | pH | lg β11 | Vщ, мл | pH | lg β11 | Vщ, мл | рH | lg β11 |
|---|---|---|---|---|---|---|---|---|
| 0.60 | 2.30 | 3.68 | 2.00 | 2.47 | 3.75 | 3.80 | 2.76 | 3.72 |
| 0.80 | 2.33 | 3.60 | 2.20 | 2.50 | 3.72 | 4.00 | 2.81 | 3.64 |
| 1.00 | 2.36 | 3.52 | 2.40 | 2.52 | 3.81 | 4.40 | 2.89 | 3.72 |
| 1.20 | 2.38 | 3.58 | 2.60 | 2.55 | 3.70 | 4.60 | 2.94 | 3.72 |
| 1.40 | 2.41 | 3.52 | 2.80 | 2.58 | 3.70 | 4.80 | 3.00 | 3.68 |
| 1.60 | 2.43 | 3.60 | 3.00 | 2.61 | 3.82 | 5.00 | 3.06 | 3.68 |
| 1.80 | 2.45 | 3.68 | 3.40 | 2.68 | 3.78 | 5.40 | 3.18 | 3.90 |
Таблица 2.
Результаты расчета константы устойчивости комплекса [NiHthioBar]+ по данным pH-метрии ($V_{{\text{M}}}^{^\circ }$ = = $V_{{\text{L}}}^{^\circ }$ = 5.00 мл, $C_{{\text{L}}}^{^\circ }$ = 3.92 × 10–3 М, $С_{{\text{M}}}^{^\circ }$ = 6.03 × 10–3 М c СНCl = 0.01 М, CNaOH = 1.07 × 10–2 М, lgKh1 = –9.70, lg æ2 = = 2.30, I = 0.1, t = 20°C); $\overline {\lg {{\beta }_{{11}}}} $ = 3.68 ± 0.08
| Vщ, мл | pH | lgβ11 | Vщ, мл | pH | lgβ11 | Vщ, мл | рH | lg β11 |
|---|---|---|---|---|---|---|---|---|
| 2.00 | 2.46 | 3.87 | 3.00 | 2.61 | 3.81 | 4.00 | 2.81 | 3.64 |
| 2.20 | 2.50 | 3.72 | 3.20 | 2.65 | 3.74 | 4.20 | 2.86 | 3.59 |
| 2.40 | 2.52 | 3.81 | 3.40 | 2.69 | 3.69 | 4.40 | 2.91 | 3.56 |
| 2.60 | 2.55 | 3.80 | 3.60 | 2.73 | 3.71 | 4.60 | 2.98 | 3.43 |
| 2.80 | 2.58 | 3.80 | 3.80 | 2.77 | 3.65 | 4.80 | 3.04 | 3.40 |
Синтез и анализ выделенных солей Co(C4H3N2O2S)2 · 4H2O и Ni(C4H3N2O2S)2 · 5H2O. Синтез тиобарбитуратов кобальта(II) и никеля(II) осуществляли при pH 3.5–4.0 путем взаимодействия охлажденных насыщенных водных растворов хлоридов соответствующих металлов с малонилтиомочевиной, раствор которой был частично нейтрализован гидроксидом натрия, в мольном соотношении компонентов M2+ : H2thioBar : NaOH = 1 : 2 : 1.2. Выпавшие кристаллы отфильтровывали, промывали этиловым спиртом с последующим их высушиванием в сушильном шкафу при 45°C до постоянной массы.
Выделенные тиобарбитураты представляли собой мелкокристаллические вещества розового и желтого цвета. Анализ синтезированных солей на содержание металла проводили гравиметрическим методом по остаткам соответствующих оксидов – Co3O4 и NiO, полученных после прокаливания образцов при 800°C в течение 3 ч в муфельной печи, а также прямым трилонометрическим титрованием [22], предварительно растворив соли в растворах (H, Na)Cl. Концентрацию трилона Б устанавливали по растворам с известным содержанием металла(II) в присутствии тиобарбитуровой кислоты. Определение тиобарбитурат-иона в солях осуществляли по разработанной нами спектрофотометрической методике, аналогичной приведенной ранее для барбитурат-иона [11] и основанной на поглощении тиобарбитуратного комплекса железа(III) [FethioBar]+ (λэф = 490 или 540 нм, ${{C}_{{{\text{F}}{{{\text{e}}}^{{3 + }}}}}}$ = 0.01 М, CHCl = 0.1 М, Vобщ = 25.0 мл, pH 2.3) при условиях, близких к его максимальному выходу (~76%, рис. 3). Закон Бугера–Ламберта–Бэра выполняется в интервале концентраций тиобарбитурат-аниона (0.5–2.5) × 10–3 М. Полученные градуировочные характеристики при 490 и 540 нм имеют хорошие коэффициенты детерминации (0.9885 и 0.9919 соответственно). Их обработка методом наименьших квадратов (tα = 2.57) приводит к следующим значениям параметров уравнения прямой:
(коэффициент a в данном случае незначим, поэтому принимаем его равным нулю):Рис. 3.
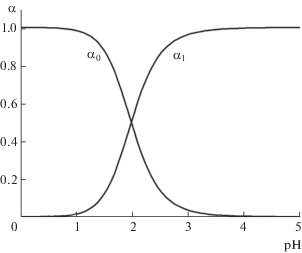
Диаграмма выхода частиц Fe3+ (α0) и FethioBar+ (α1) в зависимости от pH водного раствора (CL = 0.01 M, lg β1 = 11.05, lg B1 = 10.55, lg B2 = 12.85; программа “Выход комплекса” [23]).
b = (130.0 ± 18.0) при λэф = 490 нм; b = (100.9 ± 12.9) при λэф = 540 нм.
Состав и устойчивость комплекса [FethioBar]+ определяли предварительно методами спектрофотометрии и потенциометрии.
Содержание кристаллизационной воды и металла (в составе оксидов Co3O4 и NiO) оценивали по данным термогравиметрического анализа. Результаты химического анализа тиобарбитуратов кобальта(II) и никеля(II) представлены ниже (для металла приведены усредненные значения по данным гравиметрии, термогравиметрии и титриметрии).
| Co2+ | C4H3N2O2S– | H2O | |
|---|---|---|---|
| Найдено, %: | 14.74; | 65.13; | 19.59. |
| Для Co(C4H3N2O2S)2 · 4H2O | |||
| вычислено, %: | 14.12; | 68.61; | 17.27. |
| Ni2+ | C4H3N2O2S– | H2O | |
| Найдено, %: | 13.53; | 62.70; | 18.62. |
| Для Ni(C4H3N2O2S)2 · 5H2O | |||
| вычислено, %: | 13.49; | 65.81; | 20.70. |
Наличие кристаллизационной воды в солях также качественно подтверждено с помощью ИК-спектров, основные наблюдаемые частоты в которых представлены ниже:
ИК-спектр Co(C4H3N2O2S)2 · 4H2O (ν, см–1): 3353 сл., 3106 сл., 3055 сл., 2662 сл., 1585 ос., 1551 ос., 1474 сл., 1392 ос., 1287 ос., 1230 с., 1190 ос., 1010 с., 944 ср., 886 ос., 811 ос., 731 сл., 697 ср., 627 ср., 606 с., 538 ос., 488 ос., 414 сл.
ИК-спектр Ni(C4H3N2O2S)2 · 5H2O (ν, см–1): 3392 сл., 3104 сл., 3065 сл., 2890 сл., 2668 сл., 1605 ос., 1540 ос., 1443 сл., 1406 с., 1295 с., 1250 сл., 1203 ос., 967 сл., 869 сл., 814 ср., 792 ос., 632 ср., 604 ср., 526 ос., 471 сл., 416 сл.
Определение растворимости синтезированных солей. Для синтезированных солей были определены величины их констант растворимости KS = = [M2+][HthioBarˉ]2 в интервалах pH 2.5–5.3 для Co(C4H3N2O2S)2 · 4H2O и 2.5–2.8 для Ni(C4H3N2O2S)2 · 5H2O при 20°C. Небольшое количество тиобарбитуратов кобальта(II) и никеля(II) помещали в 0.1 М растворы (H, Na)Cl. Суспензии периодически встряхивали в сосудах с притертыми пробками и несколько дней выдерживали до установления гетерогенного равновесия (постоянство значения pH). Насыщенные растворы отфильтровывали, измеряли в них величины pH и определяли трилонометрическим титрованием концентрацию ионов M2+. Равновесия, устанавливающиеся в насыщенных водных растворах солей без учета комплексообразования, и соответствующие им константы можно представить в виде:
(1)
$\begin{gathered} {\text{M}}{{({\text{HthioBar}})}_{{{\text{2}}\left( т \right)}}} \leftrightarrow {\text{M}}{{({\text{HthioBar}})}_{{{\text{2}}\left( р \right)}}} \leftrightarrow \\ \leftrightarrow {\text{M}}_{{\left( р \right)}}^{{{\text{2}} + }} + {\text{2HthioBar}}_{{(р)}}^{ - }, \\ \end{gathered} $KS = [M2+][HthioBar–]2;
(2)
${\text{HthioBa}}{{{\text{r}}}^{--}} + {{{\text{H}}}^{ + }} \leftrightarrow {{{\text{H}}}_{{\text{2}}}}{\text{thioBar}},$æ2 = [H2thioBar]/([HthioBar–][H+]);
(3)
${{{\text{M}}}^{{2 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{MO}}{{{\text{H}}}^{{\text{ + }}}} + {{{\text{H}}}^{ + }},$Kh1 = ([MOH+][H+])/[M2+].
Из равновесия (1) видно, что в насыщенном растворе CM = Cсоли (Cсоли – растворимость соли, моль/л). Тогда уравнение материального баланса по иону металла примет вид:
(4)
$\begin{gathered} {{C}_{{\text{M}}}} = {{C}_{{{\text{соли}}}}} = {\text{[}}{{{\text{M}}}^{{2 + }}}{\text{]}} + [{\text{MO}}{{{\text{H}}}^{ + }}] = \\ = [{{{\text{M}}}^{{2 + }}}](1 + {{K}_{{{\text{h}}1}}}/[{{{\text{H}}}^{ + }}]) = [{{{\text{M}}}^{{2 + }}}]\omega . \\ \end{gathered} $Величина [MOH+] = [M2+]Kh1/[H+] найдена из выражения (3) для Kh1; ω = 1 + Kh1/[H+] – функция гидролиза, Kh1 – константа гидролиза ионов M2+ по первой ступени. Из уравнения (4) получаем, что [M2+] = Cсоли/ω. Из уравнения (5) материального баланса по лиганду с учетом равновесия (1):
(5)
$\begin{gathered} {{C}_{{{\text{HthioBar}}}}} = [{\text{HthioBa}}{{{\text{r}}}^{--}}] + [{{{\text{H}}}_{{\text{2}}}}{\text{thioBar}}] = \\ = [{\text{HthioBa}}{{{\text{r}}}^{--}}]\left( {1 + {{{\unicode{230} }}_{2}}[{{{\text{H}}}^{ + }}]} \right) = [{\text{HthioBa}}{{{\text{r}}}^{--}}]f = 2{{C}_{{{\text{соли}}}}}, \\ \end{gathered} $(6)
${{K}_{{\text{S}}}} = ({{{{C}_{{{\text{соли}}}}}} \mathord{\left/ {\vphantom {{{{C}_{{{\text{соли}}}}}} \omega }} \right. \kern-0em} \omega }){{({{{\text{2}}{{C}_{{{\text{соли}}}}}} \mathord{\left/ {\vphantom {{{\text{2}}{{C}_{{{\text{соли}}}}}} f}} \right. \kern-0em} f})}^{{\text{2}}}} = {{{\text{4}}C_{{{\text{соли}}}}^{{\text{3}}}} \mathord{\left/ {\vphantom {{{\text{4}}C_{{{\text{соли}}}}^{{\text{3}}}} {(\omega ~{{f}^{{\text{2}}}})}}} \right. \kern-0em} {(\omega ~{{f}^{{\text{2}}}})}}.$В табл. 3 приведены данные по определению растворимости тиобарбитуратов кобальта(II) и никеля(II) в 0.1 М растворах (H, Na)Cl, а также результаты расчета их констант растворимости без учета комплексообразования. Расчет констант растворимости солей с учетом возможного комплексообразования по программе “Растворимость” [23] приводит к следующим результатам: pKS = 12.82 ± 0.22 для Co(C4H3N2O2S)2 · 4H2O и pKS = 12.30 ± 0.10 для Ni(C4H3N2O2S)2 · 5H2O.
Таблица 3.
Результаты расчета констант растворимости синтезированных солей по данным их растворимости в растворах (H, Na)Cl (lg Kh1(Co2+) = –9.76, lg Kh1(Ni2+) = –9.70, lg æ2 = 2.30, I = 0.1, t = 20°C
| №* | pH | CCо × 103, M | pKS | pH | CNi × 103, M | pKS |
|---|---|---|---|---|---|---|
| Co(C4H3N2O2S)2 · 4H2O, $\overline {{\text{p}}{{K}_{{\text{S}}}}} $ = 8.27 ± 0.31 | Ni(C4H3N2O2S)2 · 5H2O, $\overline {{\text{p}}{{K}_{{\text{S}}}}} $ = 7.58 ± 0.15 | |||||
| 1 | 4.25 | 0.74 | 8.81 | 2.81 | 2.31 | 7.54 |
| 2 | 4.14 | 1.07 | 8.32 | 2.78 | 2.12 | 7.67 |
| 3 | 3.63 | 0.81 | 8.74 | 2.78 | 2.65 | 7.38 |
| 4 | 3.58 | 0.83 | 8.66 | 2.65 | 2.16 | 7.72 |
| 5 | 3.10 | 1.18 | 8.33 | 2.65 | 2.51 | 7.52 |
| 6 | 2.86 | 1.78 | 7.86 | 2.62 | 2.98 | 7.32 |
| 7 | 2.73 | 1.65 | 8.02 | 2.61 | 1.82 | 7.96 |
| 8 | 2.56 | 1.96 | 7.91 | 2.59 | 2.31 | 7.67 |
| 9 | 2.53 | 2.17 | 7.79 | 2.54 | 2.77 | 7.47 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для катионов двухвалентных металлов M2+ с H2thioBar описаны комплексы состава [MthioBar]0 и [M(thioBar)2]2–, доминирующие в водных растворах при pH > 6 [15, 16]. Известно, что протонированные комплексные частицы характерны, как правило, для азотсодержащих лигандов [25]. Поэтому в кислой области следует ожидать образования различных протонированных тиобарбитуратов, поскольку электростатические характеристики ионов Co2+ и Ni2+ не позволяют им вытеснить второй протон из доминирующего в широком интервале pH однозарядного тиобарбитурат-аниона (pKa2 = 10.55).
Метод кривых насыщения (рис. 1) в системах M2+–H2thioBar указывает на образование в них комплексов состава 1 : 2 при pH 2.7, что исключает координацию депротонированной формы лиганда при указанном значении pH. Полученные кривые титрования (рис. 4) щелочью растворов тиобарбитуровой кислоты и ее смесей с предварительно подкисленными (CHCl = 0.01 М) растворами хлоридов кобальта(II) или никеля(II) имеют различный ход, что свидетельствует о вытеснении протона катионами указанных металлов и служит косвенным доказательством протекающих процессов комплексообразования в исследуемых системах. Экспериментальные значения эквивалентных объемов щелочи (Vэксп), составляющие 6.53 (Co2+) и 6.41 мл (Ni2+), удовлетворительно согласуются с теоретически ожидаемой величиной (Vтеор = 6.50 мл), вычисленной с учетом нейтрализации одного высвобождающегося в результате взаимодействия протона. Согласно распределительной диаграмме (рис. 2), выход частиц кислоты в интервале pH 2.3–3.3 изменяется в диапазоне 46.6–92.0% для HthioBar– и 53.4–8.0% для H2thioBar. С учетом этого образование протонированных тиобарбитуратных комплексов кобальта(II) и никеля(II) можно представить в виде ионных равновесий:
(7)
${{{\text{M}}}^{{{\text{2}} + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{L}}\overset {{{K}_{1}}} \longleftrightarrow \,{{[{\text{MHL}}]}^{ + }} + {{{\text{H}}}^{ + }},$(8)
${{{\text{M}}}^{{{\text{2}} + }}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{L}}\overset {{{K}_{2}}} \longleftrightarrow \,{{[{\text{M}}{{\left( {{\text{HL}}} \right)}_{{\text{2}}}}]}^{0}} + {\text{2}}{{{\text{H}}}^{ + }},$(9)
${{{\text{M}}}^{{{\text{2}} + }}} + {\text{H}}{{{\text{L}}}^{ - }}\overset {{{{\beta }}_{{11}}}} \longleftrightarrow \,{{[{\text{MHL}}]}^{ + }},$(10)
${{{\text{M}}}^{{{\text{2}} + }}} + {\text{2H}}{{{\text{L}}}^{ - }}\overset {{{{\beta }}_{{12}}}} \longleftrightarrow \,{{[{\text{M}}{{\left( {{\text{HL}}} \right)}_{{\text{2}}}}]}^{0}}.$Рис. 4.
Кривые титрования 10.00 мл раствора кислоты и ее смесей с растворами солей металлов щелочью (CNaOH = 1.07 × 10–2 М): 1 – 1.96 × 10–3 М H2thioBar; 2 – 1.96 × 10–3 М H2thioBar и 3.02 × 10–3 М NiCl2 (CHCl = 0.01 М); 3 – 1.96 × 10–3 М H2thioBar и 2.84 × × 10–3 М CoCl2 (CHCl = 0.01 М).
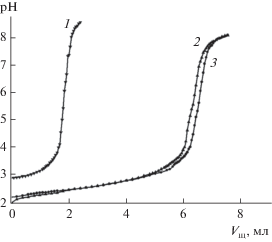
Практически идентичное расположение кривых титрования систем M2+–H2thioBar, обусловленное близостью электростатических характеристик исследуемых ионов, позволяет предположить близкую устойчивость образующихся комплексов, что подтверждается рассчитанными по данным pH-метрии значениями их констант устойчивости (lgβ11), равными 3.69 ± 0.04 и 3.68 ± 0.08 для [CoHthioBar]+ и [NiHthioBar]+ соответственно. В целом предложенная модель взаимодействия подтверждается экспериментально кривыми титрования, данными спектрофотометрических измерений и постоянством значений рассчитываемых констант устойчивости. При этом расчет с использованием программы “Бьеррум 2” [23] указывает на отсутствие одновременного доминирования в растворе комплексов [MHthioBar]+ и [M(HthioBar)2]0 в интервале pH 2.3–3.3, поскольку не выполняется условие CL > CM. В связи с этим наличие билигандных протонированных частиц при расчете величин β11 не учитывали.
Диаграмма выхода частиц кислоты (рис. 2) указывает на преобладание анионов HthioBar– (94.1–98.3%) в интервале кислотности 3.5–4.0, в котором проводился синтез солей кобальта(II) и никеля(II). Поскольку первым в молекуле кислоты диссоциирует протон –OH-группы (pKa1 = = 2.30), следует ожидать прежде всего O-координацию. Имидная группировка подвергается депротонированию в сильнощелочной среде (pKa2 = 10.55). В связи с этим можно исключить N-координацию ввиду того, что в HthioBar– атом азота группы –NH– блокирован протоном. Неспособность исследуемых ионов при данных условиях вытеснить второй протон приводит к выпадению из насыщенных растворов тиобарбитуратов, содержащих протонированную форму лиганда. Согласно данным ИК-спектроскопии и [5, 21], в синтезированных Co(C4H3N2O2S)2 · 4H2O и Ni(C4H3N2O2S)2 · 5H2O наблюдается O,S-координация. В спектрах исследуемых солей в области 3400–3300 см–1 присутствуют полосы низкой интенсивности, относящиеся к ν(O–H) связанных молекул воды. Наблюдающиеся смещения характеристических полос ν(>C=O) по сравнению с таковыми в H2thioBar, лежащими в диапазоне 1720–1640 см–1, в область более низких частот подтверждают участие атомов кислорода в координации лиганда. Исчезновение пика в интервале 1165–1145 см–1, отнесенного к ν(>C=S), указывает на S-координацию [5], что также согласуется с наличием полос слабой интенсивности при 1551 см–1 в случае соли кобальта(II) и при 1540 см–1 для никеля(II), имеющих более низкие частоты валентных колебаний по сравнению с аналогичными в самой кислоте, которые наблюдаются при 1561 см–1. Указанные сигналы принадлежат циклической тиоамидной структуре –NH–(–C=S) и свидетельствуют о том, что координированный лиганд находится в тионной форме. Незначительные отличия (~10 см–1) в области колебаний ν(>N–H) связаны с участием этих групп в образовании водородных связей. По данным СТА, отщепление двух молекул воды в солях наблюдается в высокотемпературной области (t > 200°C), что может указывать на их внутрисферный характер (в случае тетрагидрата тиобарбитурата кобальта(II) и пентагидрата тиобарбитурата никеля(II) две и три молекулы воды соответственно теряются при более низких температурах). Совпадение основных частот ИК-спектров, а также близкие интервалы термической деструкции синтезированных нами солей с приведенными авторами [5, 21] позволяют утверждать об их аналогичном составе.
Авторы [20] указывают на отсутствие в области 3200–3000 см–1 полосы, отвечающей колебаниям ν(>N–H), в комплексных солях цинка и кадмия подобного строения, что может указывать на участие атома азота имидной группы в связывании с ионами M2+ либо на таутомерное превращение лиганда перед координацией в енол-тиольную форму. Последний вариант является наиболее вероятным, поскольку, по их мнению, переход кето-формы кислоты в енол-тиольную форму путем таутомеризации служит непременным условием связывания лиганда. В работе также предложена O,S-координация. При этом на наличие связи M–S указывают слабые колебания в области 430–410 см–1, принадлежащие ν(M–S). В полученных нами солях также наблюдаются сигналы в указанном диапазоне: при 414 см–1 для соли кобальта(II) и при 416 см–1 для соли никеля(II). Очевидно, что связь между металлом и кислотным остатком в синтезированных тиобарбитуратах характеризуется значительной долей ковалентности ввиду поляризующего действия катионов d-металлов, с одной стороны, и высокой поляризуемости кислотного остатка – с другой, что подтверждается их низкими значениями KS: 5.40 × 10–9 и 2.63 × 10–8 без учета комплексообразования; 1.51 × 10–13 и 5.01 × × 10–13 с учетом комплексообразования для солей кобальта(II) и никеля(II) соответственно. Кроме того, указанные структуры дополнительно стабилизированы внутри- и межмолекулярными водородными связями типа N−H···O и O−H···O, а также π–π-взаимодействиями между лигандами HthioBar– [5, 21], что также обусловливает их низкую растворимость.
Список литературы
Машковский М.Д. Лекарственные средства. М.: Новая волна, 2012. 1216 с.
Досон Р., Элиот Д., Элиот У., Джонс К.М. Справочник биохимика. Пер. с англ. Мир, 1991. 544 с.
Oldham K.M., Bowen P.E. // J. Am. Diet. Assoc. 1998. V. 98. № 9. P. 1001. https://doi.org/10.1016/S0002-8223(98)00230-2
German A., Galli A., Maison C. et al. // Clin. Chim. Acta. 1968. V. 22. № 4. P. 551. https://doi.org/10.1016/0009-8981(68)90103-4
Головнев Н.Н., Молокеев М.С. 2-Тиобарбитуровая кислота и ее комплексы с металлами: синтез, структура и свойства. Красноярск: Сиб. федер. ун-т, 2014. 252 с.
Golovnev N.N., Molokeev M.S. // Russ. J. Coord. Chem. 2014. V. 40. № 9. P. 648. [Головнев Н.Н., Молокеев М.С. // Журн. коорд. химии. 2014. Т. 40. № 9. С. 564.]https://doi.org/10.7868/S0132344X14090035
Golovnev N.N., Molokeev M.S., Vereshchagin S.N. et al. // J. Coord. Chem. 2015. V. 68. № 11. P. 1865. https://doi.org/10.1080/00958972.2015.1031119
Golovnev N.N., Molokeev M.S., Sterkhova I.V. et al. // Russ. J. Stuct. Chem. 2017. V. 58. № 3. P. 539. [Головнев Н.Н., Молокеев М.С., Стерхова И.В. и др. // Журн. структур. химии. 2017. Т. 58. № 3. С. 567.]https://doi.org/10.15372/JSC20170315
Balas V.I., Verginadis I.I., Geromichalos G.D. et al. // Eur. J. Med. Chem. 2011. V. 46. P. 2835. https://doi.org/10.1016/j.ejmech.2011.04.005
El-Gahami M.A., Ibrahim S.A., Salman H.M.A. // Synth. React. Inorg. Met.-Org. Chem. 1991. V. 21. № 10. P. 1497. https://doi.org/10.1080/15533179108020625
Korotchenko N.M., Skorik N.A. // Russ. J. Inorg. Chem. 2000. V. 45. № 12. P. 2099. [Коротченко Н.М., Скорик Н.А. // Журн. неорган. химии. 2000. Т. 45. № 12. С. 2099.]
Korotchenko N.M., Skorik N.A. // Russ. J. Inorg. Chem. 2002. V. 47. № 5. P. 790. [Коротченко Н.М., Скорик Н.А. // Журн. неорган. химии. 2002. Т. 47. № 5. С. 790.]
Korotchenko N.M., Skorik N.A. // Russ. J. Inorg. Chem. 2012. V. 57. № 1. P. 133. [Коротченко Н.М., Скорик Н.А. // Журн. неорган. химии. 2012. Т. 57. № 1. С. 141.]https://doi.org/10.1134/S0036023612010135
Lakeev A.P., Korotchenko N.M., Sayfulin E.R. // J. Sib. Fed. Univ. Chem. 2019. V. 12. № 1. P. 6. [Лакеев А.П., Коротченко Н.М., Сайфулин Э.Р. // Журн. Сиб. Фед. ун-та. Химия. 2019. Т. 12. № 1. С. 6.]https://doi.org/10.17516/1998-2836-0104
Singh B.R., Jain R.K., Jain M.K. et al. // Thermochim. Acta. 1984. V. 78. № 1–3. P. 175. https://doi.org/10.1016/0040-6031(84)87144-0
Ahmadi F., Sarrafi A.H.M., Ghashghaee M.M. // Eur. J. Chem. 2009. V. 6. № 1. P. 47. https://doi.org/10.1155/2009/965619
Murphy R.J., Svehla G. // Anal. Chim. Acta. 1978. V. 99. № 1. P. 115. https://doi.org/10.1016/S0003-2670(01)84503-7
Siddiqi K.S., Khan P., Khan S. et al. // Synth. React. Inorg. Met.-Org. Chem. 1982. V. 12. № 6. P. 681. https://doi.org/10.1080/00945718208082685
Masoud M.S., Heiba A.M., Ashmawy F.M. // Transition Met. Chem. 1983. V. 8. P. 124. https://doi.org/10.1007/BF01036097
Zaki Z.M., Mohamed G.G. // Spectrochim. Acta, Part A. 2000. V. 56. P. 1245. https://doi.org/10.1016/S1386-1425(99)00225-5
Golovnev N.N., Molokeev M.S., Vereshchagin S.N. et al. // Polyhedron. 2014. V. 70. P. 71. https://doi.org/10.1016/j.poly.2013.12.021
Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия, 1970. 360 с.
Скорик Н.А., Чернов Е.Б. Расчеты с использованием персональных компьютеров в курсе химии комплексных соединений. Томск: Изд-во ТГУ, 2009. 90 с.
Кумок В.Н., Скорик Н.А. Лабораторные работы по химии комплексных соединений. Томск: Изд-во ТГУ, 1983. 140 с.
Smith R.M., Martell A.E. Critical Stability Constants. V. 2. N.Y.-L.: Plenum Press, 1976.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии