Журнал неорганической химии, 2020, T. 65, № 8, стр. 1055-1060
Синтез и кристаллическая структура разнолигандных комплексных соединений кобальта(II) и никеля(II) с N,N-диэтилпиридин-3-карбоксамидом
Т. Г. Черкасова a, *, Н. В. Первухина b, c, Н. В. Куратьева b, c, Е. В. Черкасова a, И. В. Исакова a, Ю. А. Мизинкина a, Э. С. Татаринова a
a Кузбасский государственный технический университет им. Т.Ф. Горбачева
650000 Кемерово, ул. Весенняя, 28, Россия
b Институт неорганической химии им. А.В. Николаева СО РАН
630092 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
c Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: ctg.htnv@kuzstu.ru
Поступила в редакцию 23.12.2019
После доработки 10.03.2020
Принята к публикации 27.03.2020
Аннотация
Синтезированы и изучены методами химического и рентгеноструктурного анализа, а также ИК-спектроскопии новые комплексные соединения [M(NKA)2(NCS)2(H2O)2], где M2+ = Co2+ (I), Ni2+ (II); NKA = C10H14N2O (N,N-диэтилпиридин-3-карбоксамид, диэтиламид никотиновой кислоты, никетамид). РСА монокристаллов комплексов показал, что соединения кристаллизуются в триклинной сингонии, пр. гр. $P\bar {1}.$ Несмотря на схожее молекулярное строение, ориентация молекул в кристаллической ячейке двух соединений различная. Координационный полиэдр атома металла – искаженный октаэдр, построенный из атомов О двух координированных молекул воды, двух атомов N пиридиновых колец двух молекул NKА и двух атомов N роданидных групп. При упаковке молекул возникают дополнительные стекинговые взаимодействия, в структурах комплексов формируется разветвленная сеть водородных связей между координированными молекулами воды и карбонильными группами NKA.
ВВЕДЕНИЕ
Производные никотиновой кислоты, к которым относится никетамид (N,N-диэтилпиридин-3-карбоксамид, диэтиламид никотиновой кислоты), используются в качестве N,O-содержащих лигандов в координационных соединениях 3d-металлов. Опубликованные работы посвящены синтезу, спектроскопическому и структурному исследованию, изучению магнитных характеристик аддуктов органических комплексов меди(II) с NKА [1–7]. Получены и методом РСА охарактеризованы моноядерные разнолигандные комплексы кобальта(II) [8–14] и никеля(II) [15–19], цинка [20], полимерные тиоцианатные комплексы железа(II) [21] и кадмия [22] с NKА. Тиоцианат-ион являясь амбидентатным, позволяет получать соединения с разнообразной структурой. Так, в соединении [Fe(NCS)2(NKA)2]n тиоцианатные группы не принимают участия в образовании цепочечной структуры, образующейся за счет молекул NKА, в то время как в комплексе кадмия ионы металла связаны бидентатно-мостиковыми тиоцианатными группами. Данная работа является продолжением исследований тиоцианатных комплексов металлов с нейтральными органическими лигандами – никотиновой кислотой и ее производными.
Цель настоящей работы – синтез, ИК-спектроскопическое исследование и изучение структурных характеристик новых комплексных соединений [M(NKA)2(NCS)2(H2O)2], где M2+ = Co2+ (I), Ni2+ (II); NKA = C10H14N2O (N,N-диэтилпиридин-3-карбоксамид, диэтиламид никотиновой кислоты, никетамид) методом РСА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений. В качестве исходных веществ использовали CoCl2 · 6H2O (х. ч.), NiCl2 · 6H2O (х. ч.), KNCS (х. ч.) и 30%-ный водный раствор NKA (ч. д. а.).
Этанольные растворы 5 мл CoCl2 · 6H2O (0.595 г, 2.5 ммоль) и NiCl2 · 6H2O (0.594 г, 2.5 ммоль) смешивали с этанольным раствором 5 мл KNCS (0.486 г, 5.0 ммоль), отфильтровывали осадок KCl и к каждому фильтрату добавляли по 3.0 мл водного раствора NKA (0.95 г, 5.4 ммоль). Из полученных растворов в течение 1 ч при комнатной температуре выпадал осадок, который промывали этанолом и сушили в эксикаторе над CaCl2. Выход 54% (I), 53% (II). Схема получения комплексов представлена на рис. S1 .
Химический анализ на содержание ионов Co2+ и Ni2+ выполняли гравиметрическим методом в виде сульфатов, полученных после прокаливания при 500°С обработанных 9 н серной кислотой комплексов [23]. Элементный C,H,N,O,S-анализ проводили на приборе ThermoFlash 2000. Полученные результаты представлены в табл. 1.
Таблица 1.
Результаты химического анализа комплексов I, II, %
| Элемент | [Co(NKA)2(NCS)2(H2O)2] | [Ni(NKA)2(NCS)2(H2O)2] | ||
|---|---|---|---|---|
| найдено | вычислено | найдено | вычислено | |
| M | 10.33 | 10.38 | 10.31 | 10.35 |
| C | 46.50 | 46.55 | 46.53 | 46.57 |
| H | 5.64 | 5.68 | 5.65 | 5.69 |
| N | 14.78 | 14.81 | 14.76 | 14.81 |
| O | 11.24 | 11.28 | 11.25 | 11.28 |
| S | 11.26 | 11.30 | 11.27 | 11.30 |
ИК-спектры соединений I и II регистрировали на ИК-Фурье-спектрометре Cary 630 FTIR фирмы Agilent в интервале 4000–400 см–1 в матрице KBr. Основные частоты полос поглощения соединений (ν, см–1): I – 3359 (ср.), 3158 (сл.), 2979 (сл.), 2103 (оч. с.), 2979 (ср.), 2940 (сл.), 2879 (сл.), 1662 (сл.), 1600 (оч. с.), 1517 (сл.), 1455 (ср.), 1383 (сл.), 1299 (ср.), 1226 (сл.), 1120 (ср.), 886 (сл.), 735 (сл.), 707 (оч. с.); II – 3381 (ср.), 3174 (ср.), 2979 (сл.), 2108 (оч. с.), 2979 (ср.), 2940 (сл.), 2879 (сл.), 1667 (сл.), 1600 (оч. с.), 1517 (сл.), 1461 (ср.), 1383 (сл.), 1299 (ср.), 1226 (сл.), 1121 (сл.), 885 (сл.), 740 (сл.), 706 (оч. с.). ИК-спектры представлены на рис. S2, S3 .
РСА. Рентгеноструктурный эксперимент для соединений I и II выполнен на дифрактометре Bruker APEX DUO с 4K CCD-детектором с использованием φ- и ω-сканирования при 150(2) K. Поправки на поглощение введены с помощью программы SADABS [24]. Структуры расшифрованы прямым методом и уточнены полноматричным МНК по F 2 в анизотропном приближении для неводородных атомов с использованием комплекса программ SHELXTL [25]. Атомы водорода органических лигандов локализованы из карт разностной электронной плотности и уточнены в приближении жесткого тела. Атомы водорода молекул воды уточнены свободно в изотропном приближении с ограничением длины связи О–Н 0.96 Å. Кристаллографические данные и детали дифракционного эксперимента приведены в табл. 2, основные длины связей и величины валентных углов для I и II – в табл. 3. Структурные данные для I и II депонированы в КБСД (ССDС № 1 973 635, 1 973 636) и могут быть свободно получены по запросу на сайте www.ccdc.cam.ac.uk/data_reguest/cif.
Таблица 2.
Кристаллографические данные и условия дифракционного эксперимента комплексов I, II
| Стехиометрическая формула | C22H32CoN6O4S2 | C22H32N6NiO4S2 |
| М, г/моль | 567.58 | 567.37 |
| Температура, K | 150(2) | 150(2) |
| Сингония | Триклинная | |
| Пр. гр., Z | P$\bar {1}$, 1 | |
| a, Å | 7.5648(3) | 8.0227(5) |
| b, Å | 8.1521(3) | 8.1571(5) |
| c, Å | 11.8920(5) | 11.2085(6) |
| α, град | 73.407(1) | 70.712(2) |
| β, град | 82.850(1) | 83.146(2) |
| γ, град | 74.005(1) | 76.357(2) |
| V, Å3 | 674.78(5) | 672.11(7) |
| ρвыч, г/см3 | 1.397 | 1.402 |
| μ, мм–1 | 0.829 | 0.916 |
| F(000) | 297 | 298 |
| Размер кристалла, мм | 0.27 × 0.22 × 0.10 | 0.14 × 0.12 × 0.08 |
| Диапазон сбора данных по θ, град | 1.789–28.487 | 1.93–28.42 |
| Диапазон h, k, l | –10 ≤ h ≤ 9 –10 ≤ k ≤ 10 –15 ≤ l ≤ 15 |
–10 ≤ h ≤ 10 –10 ≤ k ≤ 9 –14 ≤ l ≤ 14 |
| Число измеренных Ihkl | 6112 | 6192 |
| Число Ihkl > 2σI | 3357 (Rint = 0.0185) | 3305 (Rint = 0.0202) |
| Число параметров | 170 | 170 |
| GOOF для $F_{{hkl}}^{2}$ | 1.072 | 1.058 |
| R (Ihkl > 2σI) | R1 = 0.0232, wR2 = 0.0638 |
R1 = 0.0275, wR2 = 0.0683 |
| R (все отражения) | R1 = 0.0245, wR2 = 0.0646 |
R1 = 0.0326, wR2 = 0.0703 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.337/0.436 | –0.364/0.455 |
Таблица 3.
Основные межатомные расстояния и углы в комплексах I и II
| Комплекс I | Комплекс II | ||
|---|---|---|---|
| связь | d, Å | cвязь | d, Å |
| Co(1)–N(1) | 2.0974(10) | Ni(1)–N(1) | 2.0544(12) |
| Co(1)–N(2) | 2.1698(9) | Ni(1)–N(2) | 2.1147(11) |
| Co(1)–O(1w) | 2.0721(8) | Ni(1)–O(1w) | 2.0757(10) |
| Угол | φ, град | Угол | φ, град |
| O(1w)Co(1)N(1) | 88.02(4) | O(1w)Ni(1) N(1) | 89.56(4) |
| O(1w)Co(1)N(2) | 92.80(3) | O(1w)Ni(1)N(2) | 94.07(4) |
| N(1)Co(1)N(2) | 89.15(4) | N(1)Ni(1)N(2) | 89.63(5) |
| O(1w)Co(1)O(1w)#1 | 180 | O(1w)Ni(1)O(1w)#1 | 180 |
| N(1)Co(1)N(1)#1 | 180 | N(1) Ni(1)N(1)#1 | 180 |
| N(2)Co(1)N(2) #1 | 180 | N(2)Ni(1)N(2)#1 | 180 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные вещества представляют собой устойчивые на воздухе мелкокристаллические порошки. Соединение I имеет голубую окраску, комплекс II зеленого цвета. Вещества разлагаются в концентрированных растворах серной и азотной кислот, не растворяются в ацетоне, толуоле, н-углеводородах, плохо растворимы в воде.
Отнесение полос поглощения в ИК-спектрах веществ выполнено в соответствии с работами [26, 27] и сопоставлено со снятым спектром NKA (рис. S4 ). По концепции “жестких–мягких кислот и оснований” (ЖМКО), ионы Co2+ относятся к “мягким” кислотам Льюиса, а ионы Ni2+ являются кислотой, занимающей промежуточное положение между “мягкими” и “жесткими” кислотами Льюиса. Для таких акцепторов электронных пар характерно как “мягкое” S-связывание, так и “жесткое” N-связывание с тиоцианатной группой [28, 29]. Значения ν(CN), ν(CS) и δ(NCS) характеризуют тип координации NCS-группы. Незначительное смещение полосы валентных колебаний группы CN (от 2100 см–1 до 2103 и 2108 см–1 для комплексов I и II соответственно) не свидетельствует однозначно о наличии тиоцианатных мостиков. Полосы ν(CS) при 735 (I) и 740 см–1 (II) являются малоинтенсивными и не могут быть определяющими для вывода об S- или N-координации. Полосы валентных колебаний ν(NH) регистрируются для комплекса I при 3359 и 3158 см–1, для комплекса II при 3381 и 3174 см–1, что практически соответствует значениям для никетамида в работе [27] и в ИК-спектре, полученном нами для NKA. Очень интенсивная полоса ν(CO)NKA при 1600 см–1 в комплексах I, II не претерпевает никаких изменений. Полученные данные характеризуют неучастие группы СО в координации. Смещение в ИК-спектрах комплексов νкольца в интервале 1600–1030 см–1 по сравнению со спектром “свободного” NKA свидетельствует, согласно данным [30–33], о координации ионов металлов с органическими амидами через атом азота пиридинового кольца.
Таким образом, как и во всех известных координационных соединениях металлов, связь NKA с комплексообразователями осуществляется через атом азота пиридинового кольца, а Co2+ и Ni2+ связаны с группами NCS через атомы азота.
Монокристаллы комплексов I и II выделены при изотермической кристаллизации из этанольных растворов веществ.
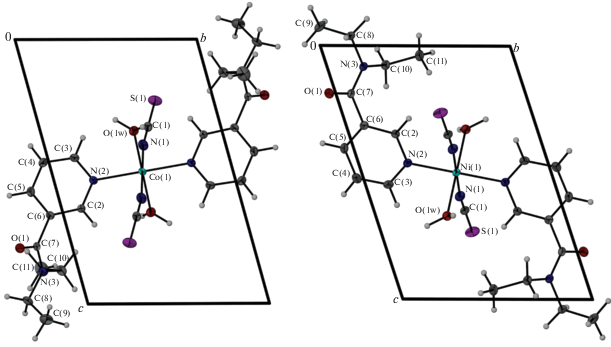
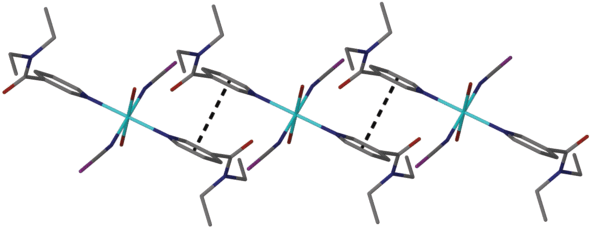
Структуры соединений I и II молекулярные. Катион металла имеет искаженное октаэдрическое координационное окружение, состоящее из двух атомов O двух координированных молекул воды и четырех атомов N двух роданид-ионов и двух молекул NKA (табл. 3). Строение центросимметричной молекулы комплексов приведено на рис. 1. Атомы металла занимают систему центров инверсии. При упаковке молекул возникают дополнительные стекинговые взаимодействия между пиридильными кольцами NKA соседних молекул с расстоянием между центрами гетероциклов 3.679(1) (I) и 3.825(1) Å (II) (рис. 2). Кроме того, в структурах комплексов формируется разветвленная сеть водородных связей между координированными молекулами воды и карбонильными группами NKA (d(D…A) = 2.668(1) (I) и 2.672(1) Å (II)) и атомами S роданид-ионов (d(D…A) = 3.213(1) (I) и 3.226(1) Å (II)). Структуры отличаются ориентацией молекулярного фрагмента внутри ячейки и разворотом терминальных этильных радикалов NKA внутри молекулярного фрагмента, поэтому их нельзя назвать изоструктурными несмотря на схожее строение молекул (рис. 1).
ЗАКЛЮЧЕНИЕ
Впервые синтезированы комплексные соединения состава [M(NKA)2(NCS)2(H2O)2], где M2+ = Co2+ (I), Ni2+ (II); NKA = C10H14N2O (N,N-диэтилпиридин-3-карбоксамид), установлены их состав и строение. В известных ранее [22, 34] и изученных нами координационных соединениях, содержащих нейтральный органический и тиоцианатный лиганды, в частности в биметаллических комплексах [NiHg(ДМСО)2(SCN)4]n [35] и [MHg(C6H6N2O)2(SCN)4] [36], роданидные группы являются бидентатно мостиковыми. Co2+ и Ni2+ связаны с группой NCS– через атомы азота в биметаллических соединениях, Cd2+ и Mn2+ в однометаллических веществах связаны как с азотом, так и с серой тиоцианатных групп. Во всех известных соединениях связь NKA с комплексообразователями осуществляется через азот пиридинового кольца. Ранее сделанные выводы подтверждаются и на примере соединений I и II. Отмечена неизоструктурность комплексов Co2+ и Ni2+ с одинаковым стехиометрическим составом и схожим строением молекул.
Список литературы
Kumar S., Sharma R.P., Venugopalan P. et al. // Inorg. Chim. Acta. 2018. V. 469. P. 288. https://doi.org/10.1016/j.ica.2017.09.032
Petricek S., Kozlevcar B. // Termochim. Acta. 2002. V. 386. P. 59.
Moncol J., Mudra M., Lonnecke P. et al. // Inorg. Chim. Acta. 2007. V. 360. P. 3213. https://doi.org/10.1016/j.ica.2007.01.027
Puchonova M., Mazur M., Ruzickova Z. et al. // J. Mol. Struct. 2019. V. 1181. P. 373. https://doi.org/10.1016/j.molstruc.2018.12.066
Szabo-Planka T., Moncol J., Toth E. et al. // Polyhedron. 2011. V. 30. P. 2421. https://doi.org/10.1016/j.poly.06.030
Husarikova L., Repicka Z., Valigura D. et al. // J. Mol. Struct. 2013. V. 1049. P. 41. https://doi.org/10.1016/j.molstruc.2013.06.029
Kavalirova J., Korabik M., Stachova P. et al. // Polyhedron. 2008. V. 27. P. 1333. https://doi.org/10.1016/j.poly.2007.12.030
Sahin O., Buyukgungor O., Kose D.A. et al. // Anal. Sci. X-Ray Struct. Anal. Online. 2008. V. 24. P. 253. https://doi.org/10.1016/j.poly.2011.02.047
Sertcelik M., Tercan B., Sahin E. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2009. V. 65. P. m389. https://doi.org/10.1107/S1600536809030980
Necefoglu H., Cimen E., Tercan B. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2010. V. 66. P. m556. https://doi.org/10.1107/S1600536810013954
Askin G.S., Necefoglu H., Ozkaya S. et al. // Acta Crystallogr., Sect. E: Cryst. Commun. 2016. V. 72. P. 498. https://doi.org/10.1107/S2056989016004059
Hokelek T., Saka G., Tercan B. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2010. V. 66. P. m1132. https://doi.org/10.1107/S1600536810032630
Hokelek T., Necefoglu H. // Acta Crystallogr., Sect.C: Cryst. Struct. Commun. 1997. V. 53. P. 187. https://doi.org/10.1107/S0108270196013170
Necefoglu N., Maraci A., Ozbek F.E. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2011. V. 67. P. m619. https://doi.org/10.1107/S1600536811014188
Hokelek T., Suzen Y., Tercan B. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2009. V. 65. P. m1015. https://doi.org/10.1107/S1600536809030098
Sertcelik M., Tercan B., Sahin E. et al. // Acta Crystallogr., Sect.E: Struct. Rep. Online. 2009. V. 65. P. m326. https://doi.org/10.1107/S1600536809006345
Hokelek T., Dal H., Tercan B. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2009. V. 65. P. m1051. https://doi.org/10.1107/S1600536809008265
Hokelek T., Dal H., Tercan B. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2009. V. 65. P. m545. https://doi.org/10.1107/S1600536809014226
Hokelek H., Yilmaz F., Tercan B. et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2009. V. 65. P. m766. https://doi.org/10.1107/S1600536809021795
Bigoli F., Braibanti A., Pellinghelli M.A. et al. // Acta Crystallogr., Sect. B: Struct. Crystallogr. Cryst. Chem. V. 29. P. 2344.
Ondrejkovicova I., Galkova S., Mrozinski J. et al. // Inorg. Chim. Acta. 2008. V. 361. P. 2483. https://doi.org/10.1016/j.ica.2008.01.009
Bigoli F., Braibanti A., Pellinghelli M.A. et al. // Acta Crystallogr., Sect. B: Struct. Crystallogr. Cryst. Chem. 1972. V. 28. P. 962.
Шарло Г. Методы аналитической химии. М.: Химия, 1965. 976 с.
Bruker AXS Inc. (2000-2012). APEX2 (Version 2012.2-0), SAINT (Version 8.18c), and SADABS (Version 2008/1). Bruker Advanced X-ray Solutions, Madison, Wisconsin, USA.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71. P. 3.
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных. М.: Мир; БИНОМ. Лаборатория знаний, 2006. 438 с.
Садиков Г.Г., Анцышкина А.С., Кокшарова Т.В. и др. // Кристаллография. 2007. Т. 52. № 5. С. 847. https://doi.org/10.1134/S1063774507050112
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Киселев Ю.М. Химия координационных соединений. М.: Юрайт, 2014. 657 с.
Baig R.B.N., Vaddula B.R., Nadagoida M.N. et al. // J. Royal Soc. Chem. 2015. V. 17. P. 1243.
Li C., Cui F., Zhang H. et al. // Spectrochim. Acta, Part A: Mol. and Biomol. Spectr. 2015. V. 134. P. 367. https://doi.org/10.1016/j.saa.2014.06.080
Arici M., Yesilel O.Z., Acar E., Dede N. // Polyhedron. 2017. V. 127. P. 293. https://doi.org/10.1016/j.poly.2017.02.013
Dziewulska-Kulaczkoska A., Mazur L., Ferenc W. // J. Therm. Anal. Calorim. 2009. V. 96. № 1. P. 255.
Begoli F., Braibanti A., Pellinghelli M.A. et al. // Acta Crystallogr., Sect. B: Struct. Crystallogr. Cryst. Chem. 1973. V. 29 P. 39. https://doi.org/10.1107/S0567740873001949
Черкасова Т.Г., Золотухина Н.А. // Журн. неорган. химии. 2002. Т. 47. № 3. С. 433.
Черкасова Т.Г., Первухина Н.В., Куратьева Н.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 4. С. 365. https://doi.org/10.1134/ S0036023619040077
Дополнительные материалы
- скачать EMS.docx
- Рис. S1. - Рис. S4.
Инструменты
Журнал неорганической химии